World Journal of Cancer Research
Vol.2 No.1(2012), Article ID:430,8 pages DOI:10.12677/wjcr.2012.21001
Advances in Studies on Oleanolic Acid and Derivatives
Faculty of Pharmaceutical Engineering, Shenyang University of Chemical Technology, Shenyang
Email: *mengyanqiu@hotmail.com
Received: Oct. 17th, 2011; revised: Nov. 2nd, 2011; accepted: Nov. 21st, 2011.
ABSTRACT:
Oleanolic acid belongs to pentacyclic triterpenes which has diverse biological activities. Its pharmacological effects continue to be found, and the studies of clinical application and structure modification are developed increasingly, showing a wide respect of applications. In this regard, gives a summary of the studies on pharmacological effects and structure modification of Oleanolic acid.
Keywords: Oleanolic Acid; Pentacyclic Triterpenes; Pharmacological Effects; Structure Modification
齐墩果酸及其衍生物的研究进展
孟艳秋*,赵 娜,聂慧慧,邹 超
沈阳化工大学制药工程教研室,沈阳
Email: *mengyanqiu@hotmail.com
摘 要:
齐墩果酸属于五环三萜类化合物,具有多种生物学活性。其药理作用不断被发现,且临床应用及结构改造逐渐深入,展现出广泛的应用前景。因此,现将齐墩果酸的药理作用及其结构修饰研究进展进行综述。
收稿日期:2011年10月17日;修回日期:2011年11月2日;录用日期:2011年11月21日
关键词:齐墩果酸;五环三萜;药理作用;结构修饰
1. 引言
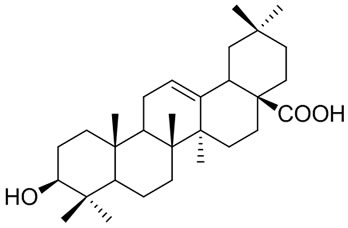
齐墩果酸(Oleanolic acid,OA)又名庆四素,属于五环三萜类化合物,是从女贞子和青叶胆等植物中分离得到的有效成份,以游离体或糖苷的形式广泛存在于多种植物中,具有多样的生物活性和药理作用,如保肝[1,2]、降糖降脂[3]、抗肿瘤[4-6]、抗高血压[7]、消炎[8]和抗HIV[9,10]。现将 OA及其衍生物的研究新进展进行综述。OA的结构式如下图所示。
2. 齐墩果酸的药理作用
2.1. 护肝、解毒作用
齐墩果酸对肝脏的保护作用主要归因于它的抗氧化、抗炎作用以及对药物代谢酶的影响。20世纪70年代人们便已开始了对OA保肝作用的研究,发现经OA(Sc)治疗后的四氯化碳中毒大鼠血清中谷丙转氨酶明显下降。80年代人们又通过组织病理学的检查进一步证实了OA的肝保护作用。研究报道把OA作为对照药物研究绞股蓝总皂苷的保肝作用时,发现在绞股蓝总皂苷和OA作用下残留的肝脏其核分裂相数目明显增多(P < 0.01),再生度高于对照组,说明二者对于肝细胞均有促进再生的作用。
宫新江等[11]发现,OA对环磷酰胺(CP)所致的大鼠肝损伤细胞具有保护作用。CP可使大鼠肝细胞上清液中丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)及乳酸脱氢酶(DH)活力升高,肝细胞MTT的光密度值减小。OA能抑制上述变化,促进肝细胞再生,使坏死区迅速修复,从而抑制胶原纤维增生,防止肝硬化。张杰等[12]研究表明,OA对肝脏缺血–再灌注损伤具有一定保护作用,其抗肝脏缺血–再灌注损伤作用与抑制自由基的生成和释放有关。
2.2. 降糖、降脂作用
Ortiz-Andrade等[13]通过做口服葡萄糖耐量实验发现,齐墩果酸可以明显抑制血浆葡萄糖浓度的增高。在OA降低血糖的同时,肝糖原和血清胰岛素均有明显升高(P < 0.01);它通过抑制糖从胃到小肠的转运和糖在小肠绒毛的转运而表现降低血糖的作用,具体作用机制有待研究。
Buus NH等[14],对OA是否能够影响载脂蛋白E基因敲除(ApoE-/-)小鼠的动脉粥样硬化发展和血管功能进行了研究。结果发现,与野生组、氟伐他汀组和盐水对照比较,被喂食含有OA的高胆固醇组ApoE-/-小鼠的体重没有增加。OA和氟伐他汀没有显著降低血浆总胆固醇和甘油三脂的浓度。与野生组相比,盐水组的血小板斑块面积为25%,但OA组只有14%,氟伐他汀组有19%。OA组的诱导型一氧化氮合酶的表达也有减弱。OA具有显著的抗动脉粥样硬化作用,不受脂质水平的影响,而且在一氧化氮合成酶介导的乙酰胆碱扩张中没有较多的变化。但OA降低一氧化氮合成酶表达可能改变血管对肾上素的反应。
殷峻等[15]对OA的降糖机制进行研究,通过采用与人肝细胞表型相似的人肝癌细胞(HepG2)检测24 h培养液中葡萄糖的消耗量发现OA可使糖耗轻度增加,但同时使胰岛βTC3细胞的胰岛素分泌量减少25%~29% (P < 0.01),故认为OA主要不是通过肝细胞发挥降糖作用,而是存在其他作用机制。
2.3. 抗肿瘤作用
OA能作用于肿瘤发生的不同阶段,包括抑制肿瘤的形成,阻碍肿瘤诱发和肿瘤细胞分化。OA还能有效地抑制血管发生,进而抑制肿瘤细胞的侵袭和转移[16]。
黄炜等[17]进行了齐墩果酸对人类肺癌细胞(PGCL3)增殖抑制实验,结果表明OA毒性较低,可降低PGCL3细胞增殖能力并呈明显的剂量依赖性,半抑制浓度(IC50)为40.71 μmol/L;同时可以抑制PGCL3细胞的穿膜侵袭能力(P < 0.01),其机理不是对侵袭某一环节的阻断,而是对各个基本环节(粘附、运动和降解)都有抑制作用,可能是通过诱导细胞恶性表型逆转即诱导细胞分化而实现的。
卫小红等[18]研究发现,用不同浓度OA干预人肺癌细胞(A549) 24 h,细胞凋亡率均明显高于正常对照组(OA浓度为0 μmol/L),且凋亡率随着药物浓度的增加而增高(P < 0.01);研究中还发现经OA干预组A549细胞内钙离子荧光强度均明显高于正常对照组,荧光强度随OA浓度的升高而增加(P < 0.01),而且细胞凋亡率和细胞内钙离子浓度之间有明显相关性(P < 0.01)。因此认为,OA具有浓度依赖诱导人肺腺癌细胞(A549)凋亡的作用,该作用可能与其导致细胞内钙超载有关。
张鹏霞等[19]报道,齐墩果酸对人白血病HL-60细胞生长具有明显的抑制作用,诱导细胞凋亡呈明显的时间和剂量依赖性,并使细胞阻滞于G1期。
黄炜等[20]研究表明,OA具有诱导人乳腺癌细胞(MCF-7)凋亡而抑制其增殖的作用,半抑制浓度(IC50)为88.36 μmol/L,凋亡率略低于细胞增殖抑制率,但无显著性差异(P > 0.05);其诱导凋亡可能依赖于细胞内Ca+水平上调。
吴勃岩等[21]通过观察荷瘤小鼠抑瘤率,生命延长率,肝/体比脾脏指数及用药前后体重的变化等指标,对OA体内抗肿瘤作用进行了研究,结果表明,女贞子有效成分齐墩果酸对S180荷瘤小鼠具有良好的抑瘤作用,在保护机体重要器官方面作用显著。
李鸿梅等[22]研究发现OA在体外能够抑制人胃癌顺铂耐药细胞株(SGC-7901/CDDP)的细胞增殖,并使促凋亡基因Bax表达升高,抗凋亡基因Bcl-2表达降低,上调Bax和下调Bcl-2mRNA的表达可能是其作用机制之一。
Fujiwara Y等[23]研究发现,OA可以显著地抑制M2型巨噬细胞的表型标记物CD163的表达,以及抑制由M2型巨噬细胞优先产生的抗炎细胞因子IL-10的分泌,从而表明,OA能抑制M2型巨噬细胞极化。Furthermore, OA inhibited the proliferation of U373 human glioblastoma cells, and the activation of signal transducer and activator of transcription-3 (STAT3) in both human macrophages and glioblastoma cells.此外,OA抑制U373人脑胶质瘤细胞的增殖以及信号转导和活化转录-3(STAT3)在人类巨噬细胞和胶质母细胞的激活。These results indicate that OA suppresses the M2 polarization of macrophages and tumor cell proliferation by inhibiting STAT3 activation.这些结果表明,OA通过抑制STAT3的激活,从而抑制M2型巨噬细胞极化和肿瘤细胞增殖。Therefore, OA may be a potentially new agent that can be used for the prevention and treatment of various malignant tumors, including glioma.因此,OA可能是一个潜在的新药,用于预防和治疗各种恶性肿瘤,包括胶质瘤。
2.4. 抗高血压作用
Rosalia等[24]研究发现长期食用齐墩果酸含量高食物的大鼠可以通过增强烯醇酶表达来增强内皮组织NO介导的主动脉环的舒张。Bachhav SS[25]等研究表明,OA可以显著地降低大鼠由糖皮质激素(地塞米松)诱导的高血压(P < 0.01,P < 0.05),而且对大鼠的体重和胸腺重量没有任何影响,硝酸盐/亚硝酸盐血浆浓度的降低是由于OA对地塞米松的显著抑制(P < 0.05)。其作用机制可能是归因于OA的抗氧化和NO释放的作用。
2.5. 抗炎、抗病毒作用
Steele[26]等指出OA具有一定的抗疟性。范玉玲等[27]通过不同给药途径、给药次数和给药剂量研究了齐墩果酸对二甲苯引起的小鼠耳肿胀抑制作用,以证实齐墩果酸的抗炎作用。Giner-Larza等[28]研究了齐墩果酸对二肽基肽酶引起的耳肿胀、佛波酯引起的皮炎、缓激肽引起的爪水肿的抑制作用,并研究了可能的抗炎机制。OA的糖苷化合物抑制疱疹性口炎病毒斑形成,对被膜化的病毒有杀灭作用[29]。
2.6. 抗骨质疏松作用
Bian Q[30]等研究表明,OA对卵巢切除诱导的骨质疏松大鼠具有骨保护作用,体内可以增加成骨细胞数量,增加骨钙蛋白和成骨蛋白2的蛋白水平,体外可以诱导骨髓间质干细胞向成骨细胞分化。此分子作用机制可能与Norch信号传导通路有关,需要进一步的研究。
3. 齐墩果酸的结构改造
3.1. 齐墩果酸骨架结构的改造
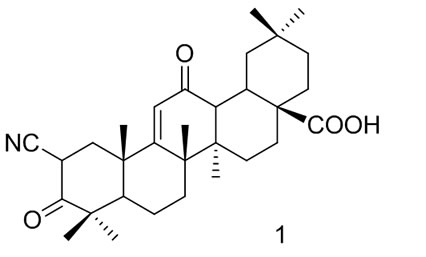
Honda等[30,32]研究齐墩果酸对小鼠巨噬细胞中一氧化氮产生的抑制作用时,发现能够抑制巨噬细胞中一氧化氮产生的化合物也是潜在的抗炎药物和癌症的化学预防药物。合成的衍生物2-氰基-3, l2-二羰基齐墩果烷-1, 9-二烯-28-羧酸(1)具有很好的活性,其抑制活性IC50值为0.1 μmol/L,这是一个多活性化合物,具有抗增殖和抗炎的作用。为了进一步提高齐墩果酸的生物利用度,降低药物对其他组织的毒副作用,提高对肿瘤细胞的选择性能,靶向特异性的衍生物也在不断的研究,Honda等[33]通过齐墩果酸二次先导化合物2-氰基-3, l2-二羰基齐墩果烷-1, 9-二烯-28-羧酸设计合成了C-17、C-23位偶联生物素的系列衍生物,作为蛋白质靶向药物,肿瘤抑制实验表明,衍生物对乳腺癌细胞抑制均有一定的抑制作用,其中衍生物2对乳腺癌细胞抑制活性优于其他衍生物,而与二次先导化合物相比,活性下降,但是潜在的蛋白质靶向作用,可能成为新型抗肿瘤靶向的目标分子。

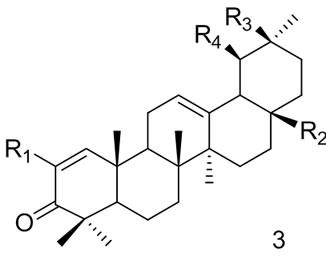
Gribble等[34]人合成了一系列齐墩果酸和熊果酸的衍生物(3),用于大鼠巨噬细胞干扰素-γ (interferon-γ)诱导的NO产生抑制剂。
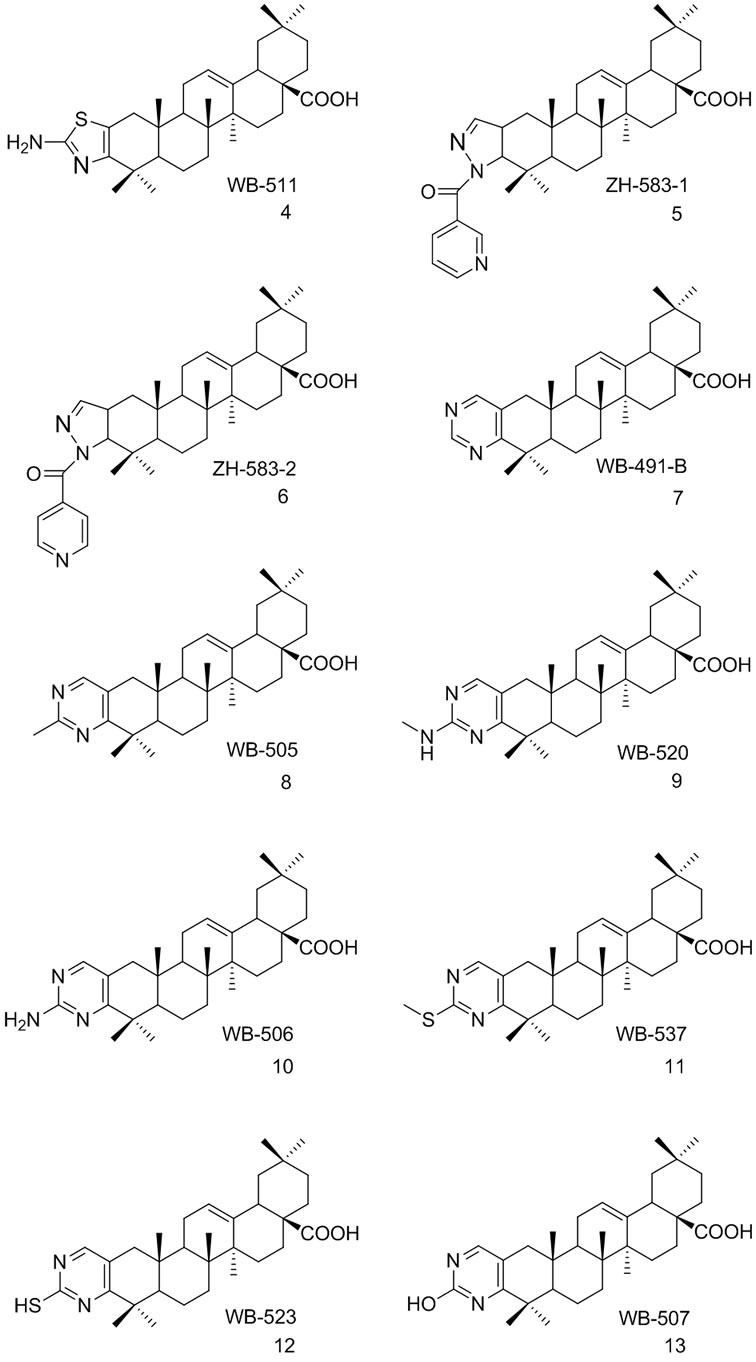
汤杰等[35]以齐墩果酸为先导化合物,先经氧化得到相应的C3位羰基衍生物,再在C2位卤代或甲酰化或成烯胺,最后通过系列缩合反应得到10个相应的C2,C3位并杂环的齐墩果酸衍生物(4-13),研究表明,它们可作为胰岛素增敏剂,对蛋白酪氨酸磷酸酯酶1B(PTP1B)的抑制活性明显增强。
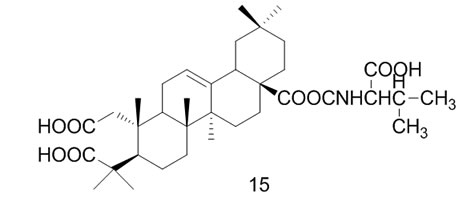
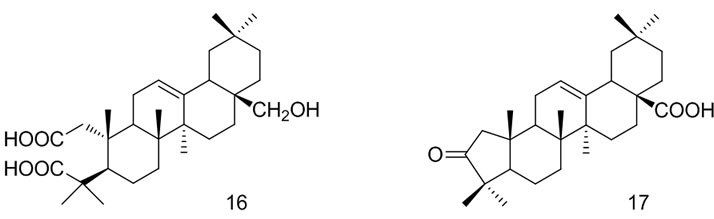
Ying Wei等[36]以OA为原料通过逐步氧化反应,成功地合成了一系列A环改造的齐墩果酸衍生物,并进行了抗HIV-1蛋白酶活性的测试,其中化合物14,15, 16,17的IC50值分别为3.9 μmol/L,88.1 μmol/L,30.4 μmol/L,28.6 μmol/L,化合物14的抑制活性显著,而化合物15,16,17与14相比抑制活性较弱,说明A环经改造后C28位羧酸对HIV-1蛋白酶具有高度的选择性。

张奕华等[37]以齐墩果酸和熊果酸为先导化合物,合成了一系列五环三萜-13,28-内酯化合物,并进行体外抗人肝癌细胞HepG2、SMMC-7221、BEL-7402,人宫颈癌细胞HeLa,人乳腺癌细胞MCF-7,人肺癌细胞H460和人黑色素瘤细胞A-375的活性测试。结果表明,齐墩果酸衍生物12-氰基-3,12-二氧代齐墩果烷-1,9(11)-二烯-13,28-内酯,即化合物18具有广谱的抗肿瘤活性,其IC50值据处于低微摩尔级别。其中,化合物18对HepG2、BEL-7402、MCF-7和A-375细胞的作用尤为突出,与阳性对照药CDDO-Me活性相当。同时,化合物18对人正常肝细胞LO2的毒性则低于CDDO-Me。

3.2. 齐墩果酸C3-羟基和C28-羧基的改造
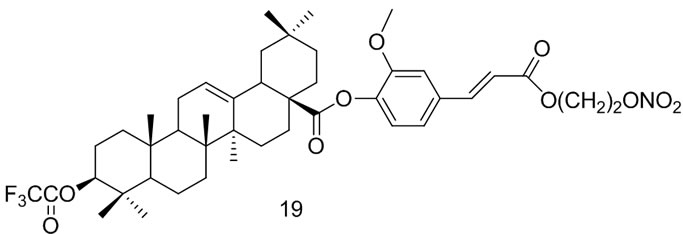
研究发现,NO在细胞凋亡过程中具有双向调节作用,体内持续低浓度的NO(无论是内源性的还是外源性的)可抑制细胞凋亡,对细胞具有保护和促其生长的作用;体内高浓度的NO可产生细胞毒性,诱导肿瘤细胞凋亡,阻止肿瘤细胞的扩散和转移[38,39]。因此,Chen等[40-42]以OA为先导化合物,设计、合成了系列硝酸酯类NO供体/OA杂合物,初步生物活性研究显示,此类衍生物可释放母体药物OA及低浓度的NO,抑制肝细胞凋亡,发挥两者的协同保肝活性,其中化合物ZCII2 (19)的活性最强。
在OA的3位羟基和/或28位羧基,通过连接呋咱氮氧化物类一氧化氮(NO)供体,合成了一系列的NO-OA杂合物。初步生物活性研究显示,此类衍生物能选择性地在肝肿瘤细胞内释放NO,诱导肝肿瘤细胞凋亡而不伤害正常肝细胞,显示了特异性的肝肿瘤细胞毒性作用,其中OA的C3-OH通过琥珀酰基偶联呋咱氮氧化物所得ZCVI4 (20)的活性最强。

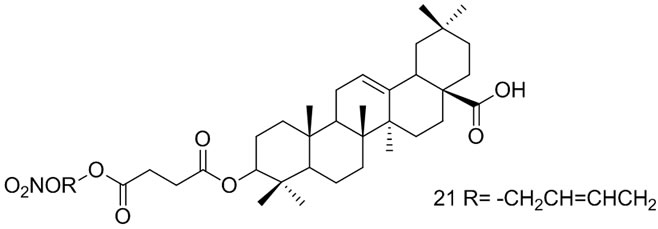
在前期研究基础上,以直链烷烃、烯烃、取代芳环或芳杂环及抗氧基(阿魏酸)片断为连接基团,将硝酸酯类NO供体与OA的C3-OH偶联,设计、合成了10个目标化合物,并对其进行体外抗人肝癌细胞SMMC-7721和BEL-7402,人肺癌细胞A549及人结肠癌细胞HT-29的活性筛选,以考察C3-OH连接不同类型的NO供体对活性的影晌,结果表明化合物21表现出较强细胞毒性,对上述三种癌细胞的作用均强于阳性对照药阿霉素和化合物ZCVI4 (20)。
陈秀英等[43]进行了一氧化氮供体型齐墩果酸衍生物ZCII2(19)对早期实验性肝纤维化的保护作用的实验,研究表明,ZCII2高剂量能显著降低谷丙转氨酶、谷草转氨酶含量,增加白蛋白含量,提高白/球比例,显著降低血清透明质酸、层粘蛋白和Ⅲ型前胶原含量,明显改善肝组织病理损伤,因此,认为一氧化氮供体型齐墩果酸衍生物ZCII2对大鼠早期实验性肝纤维化具有一定的保护作用。
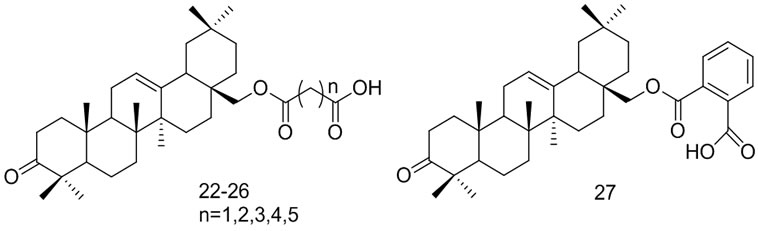
Shan Qian[44]等以OA为先导化合物通过氧化,酯化等反应合成了一系列齐墩果酸衍生物,并进行了对PTP1B抑制活性测试,其中化合物22,23,24显示出较好的抑制活性(IC50值分别为4.11 μmol/L,4.61 μmol/L,6.39 μmol/L),分析还表明,与齐墩果烯相连的酸链的长度决定了化合物抑制活性的大小(22 > 23 > 24 > 25 > 26),芳香化合物27的抑制活性是母体OA的7.6倍,IC50值仅为3.12 μmol/L。
研究结果表明齐墩果酸皂苷具有与齐墩果酸不同的生物活性。为了获得高活性的齐墩果酸皂苷药物,郭甜甜[45]以齐墩果酸衍生物28和29为母体,在母体3位羟基处引入不同糖链,合成了12个齐墩果酸皂昔。并对合成的系列化合物进行了初步的蛋白质酪氨酸磷酸酯酶(PTPIB)、α-糖苷酶以及α-淀粉酶的抑制活性的测试,确定了该系列化合物初步的构效关系。发现了化合物30对蛋白质酪氨酸磷酸酯酶IB (PTPIB)具有良好的抑制活性,IC50值为19.1 nmol/mL,齐墩果酸28位羧基连接的6-氨基己酸甲酯,以及3位羟基处连接的甘露糖醛酸共同为蛋白质酪氨酸磷酸酯酶IB (PTPIB)抑制活性必需部分。

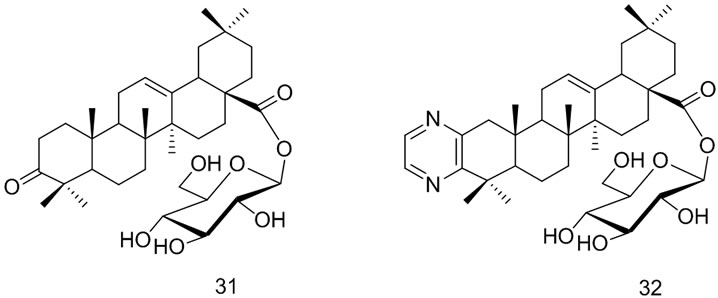
Yingqi Hua等[46]将A环连有含N杂环的OA和C3位羟基氧化的OA上的C28羧基与上述四种糖连接,反应得到15种齐墩果酸皂苷衍生物,并进行了对骨肉瘤细胞的影响实验,体内和体外实验结果显示葡萄糖-齐墩果酸皂苷衍生物(31~33)对抑制骨肉瘤细胞的增殖和诱导骨肉瘤细胞凋亡作用是所合成衍生物中最强的。说明不同的糖基对抗肿瘤活性的影响不同,糖链结构对活性的影响规律研究正在进行中。
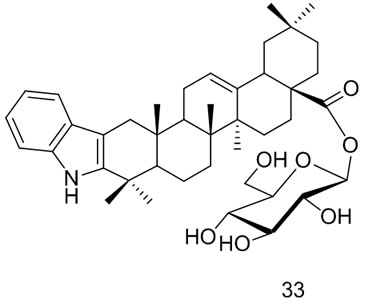
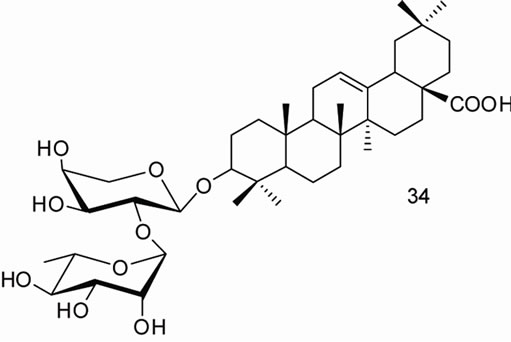
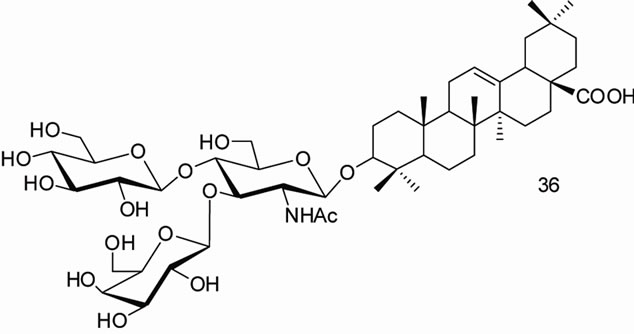
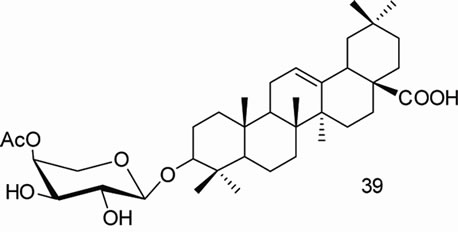
闫茂才[47]合成的齐墩果酸皂苷类衍生物,齐墩果酸3-O-α-L-吡喃鼠李糖-(l→2)-a-L-吡喃阿拉伯糖苷(β-hederin, 34),齐墩果酸3-O-α-L-吡喃鼠李糖-(l→2)-[β-D-吡喃葡萄糖-(1→4)]-吡喃阿拉伯糖苷(hederacolchiside A1,35),齐墩果酸3-O–β-D-吡喃半乳糖基-(l→3)-[β-D-吡喃葡萄糖基-(1→4)]-2-乙酰氨基-2-脱氧吡喃葡萄糖苷(lotoidoside D,36),齐墩果酸3-O-β-D-吡喃半乳糖基-(1→3)-2-乙酰氨基-2-脱氧吡喃葡萄糖苷(lotoidoside E,37),齐墩果酸3-O-α-L-吡喃鼠李糖基-(1→2)-β-D-吡喃木糖苷(giganteaside D,38)和齐墩果酸3-O-(4-O-乙酰基-α-L-吡喃阿拉伯糖苷) (39),体外初步药理实验表明这些化合物对人卵巢癌细胞(SKOV3)和人子宫颈癌细胞(HeLa)大都具有较强的抑制作用。



Huang等[48] 研究发现,3-氧代齐墩果酸的抗肿瘤活性比OA有明显的提高,对人口腔鳞癌细胞(KB)具有较高的选择性,并且对正常细胞毒性较小。但是3-氧代齐墩果酸水溶性差,影响生物利用度,因此孙华等[49] 利用氨基酸改善其水溶性,设计合成了9个3-氧代齐墩果酸氨基酸衍生物,并测试其水溶性和体外抗肿瘤活性,其中部分衍生物的水溶性与3-氧代齐墩果酸相比有不同的程度的改善。初步体外抗肿瘤活性结果表明,水溶性较高的衍生物40,41,42仍保持抗肿瘤活性。具有羧基和羟基取代的衍生物40,41,42保持抗肿瘤活性,这说明具有极性取代基的衍生物能改善化合物的水溶性和抗肿瘤活性。

4. 结语
综上所述,OA广泛存在于多种植物中,毒性很低,具有多种生物活性,如护肝、解毒作用,降糖、降脂作用,抗肿瘤作用,抗高血压作用和抗炎、抗病毒作用,药理作用被逐渐深入研究。OA由于分子结构中含有羧基、羟基和双键等特征性官能团,因此,对其结构修饰和化学改造也主要在这三个部位展开,还有是针对分子中固有的环进行的,获得了结构新颖的开环化合物。在OA及其衍生物的各种活性评价实验中,一些衍生物表现出较母体更高的药理活性,这表明以OA作为先导化合物,具有进一步结构优化的潜力;此外,部分衍生物活性还相当高,可以作为二次先导化合物,进一步设计优化,可望开发出新的化学治疗剂,成为新型的抗肿瘤药物,在药学大放异彩。尽管合成出了大量的衍生物或类似物,但有些结构与药理活性的构效关系尚不明确,显然需要加强此方面的研究。
参考文献 (References)
[1] Y. J. Chen, J. Liu, X. L.Yang, et al. Oleanolic acid nanosus preparation, in vitro characterization and enhanced hep-at protective effect. Journal of Pharmacy and Pharmacology, 2005, 57(2): 259- 264.
[2] H. G. Jeong. Inhibition of cytochrome P450 2E1 expression by Oleanolic acid: Hepatoprotective effects against carbon tetrachloride-induced hepatic injury. Toxicology Letters, 1999, 105(3): 215-222.
[3] M. Yoshikawa and H. Matsuda. Antidiabetogenic activity of Oleanolic acid glycosides from medicinal foodstuffs. Biofactors, 2000, 13(1-4): 231-237.
[4] Z. Ovesna, A. Vachalkova, K. Horvathova, et a1. Pentacyclic triterpenoic acids: New chemoprotective compounds. Neoplasma, 2004, 51(5): 327-333.
[5] B. B. Aggarwal, Y. Takada, O. V. Oommen. From chemoprevention to chemotherapy: common targets and common goals. Expert Opinion on Investigational Drugs, 2004, 13(10): 1327-1338.
[6] F. A. Resende, C. A. M. de An-drade Barcala, M. C. da Silva Faria, et a1. Antimutagenicity of ursolicacid and Oleanolic acid against doxorubicin induced clastogenesis in Balb/c mice. Life Sciences, 2006, 79(13): 1268-1273.
[7] 杜瑜, 李焕德. 齐墩果酸的研究进展[J]. 中国药房, 2006, 17(4): 304-306.
[8] S. Marquina, N. Maldonado, M. L. Garduño-Ramírez, et al. Bioactive Oleanolic acid saponins and other constituents from the roots of Viguiera decurrens. Phytochemistry, 2001, 56(1): 93-97.
[9] Y. Kashiwada, H. K. Wang, T. Nagao, et al. Anti-AIDS agents 30 anti-HIV activity of Oleanolic acid, pomolic acid, and structurally related triterpenoids. Journal of Natural Products, 1998, 61(9): 1090-1095.
[10] C. M. Ma, N. Nakamura, M. Hattori, et al. Inhibitory effects on HIV-1 protease of constituents from the wood of Xanthoceras sorbifolia. Journal of Natural Products, 2000, 63(2): 238-242.
[11] 宫新江, 丁虹, 邱银生等. 齐墩果酸抗环磷酰胺所致大鼠肝细胞损伤作用[J]. 医药导报, 2006, 25(11): 1114-1116.
[12] 张杰, 许仄平, 孙宏斌等. 大鼠肝脏缺血–再灌注损伤时齐墩果酸对氧自由基的影响[J]. 临床麻醉学杂志, 2009, 25(5): 428-430.
[13] R. R. Ortiz-Andrade, S. García-Jiménez, P. Castillo-España, et al. α-Glucosidase inhibitory activity of the methanolic extract from Tournefortia hartwegiana: An anti-hyperglycemic agent. Journal of Ethnopharmcology, 2007, 109(1): 48-53.
[14] N. H. Buus, N. C. Hansson, R. Rodriguez-Rodriguez, et al. Antiatherogenic effects of Oleanolic acid in apolipoprotein E knockout mice. European Journal of Pharmacology, 2011, 670 (2-3): 519-526.
[15] 殷峻, 胡仁明, 陈名道等. 小檗碱、齐墩果酸和大蒜新素对糖代谢作用的体外研究[J]. 北京中医药大学学报, 2003, 26(2): 36-39.
[16] Z. Ovesna, A. Vachalkova, K. Horvatova, et a1. Pentacyclic triterpenoic acids: New chemoprotective compounds. Minireview Neoplasma, 2004, 51(5): 327-333.
[17] 黄炜, 黄济群, 张东方等. 甘草酸、18β-甘草次酸、熊果酸和齐墩果酸抗人癌细胞侵袭作用及其机理的研究. 中国中医药科技, 2003, 10(6): 349-350.
[18] 卫小红, 邵杰, 王军辉, A. Thaku. 齐墩果酸诱导人肺腺癌细胞A54凋亡及其与细胞内钙离子的关系[J]. 同济大学学报(医学版), 2009, 30(5): 19-23.
[19] 张红霞, 李鸿梅, 陈东等. 齐墩果酸诱导人白血病HL-60细胞凋亡及细胞周期阻滞[J]. 中国病理生理杂志, 2008, 24(10): 1909-1911.
[20] 黄炜, 吴其年, 黄敏珊等. 五环三萜类单体诱导人乳腺癌细胞凋亡的研究[J]. 中华中医药学刊, 2008, 26(7): 1566-1568.
[21] 吴勃岩, 高明, 徐绍娜. 女贞子有效成分齐墩果酸对S180荷瘤小鼠抑瘤作用及存活时间的影响[J]. 中医药信息, 2010, 21(1): 37-38.
[22] 李鸿梅, 李雪岩, 蔡德福等. 齐墩果酸对顺铂耐药胃癌SGC-7901细胞增殖的影响及其机制研究[J]. 中国药理学通报, 2009, 25(10): 1334-1337.
[23] Y. Fujiwara, Y. Komohara, R. Kudo, et al. Oleanolic acid inhibits macrophage differentiation into the M2 phenotype and glioblastoma cell proliferation by suppressing the activation of STAT3. Oncology Reports, 2011, 26(6): 1533-1537.
[24] R. Rodriguez-Rodriguez and M. D. Herrera. Pomace olive oil improves endothelial function in spontaneously hypertensive rats by increasing endothelial nitric oxide synthase expression. American Journal of Hypertension, 2007, 7(20): 728-734.
[25] S. S. Bachhav, S. D. Patil, M. S. Bhutada, et al. Oleanolic acid prevents glucocorticoid-induced hypertension in rats. Phytotherapy Research, 2011, 25(10): 1435-1439.
[26] J. C. Steele, D. C. Warhurst, G. C. Kirby, et a1. In Vitro and in Vivo evaluation of betulinic acid as an ant malaria1. Phytotherapy Research, 1999, 13(2): 115-119.
[27] 范玉玲, 崔福德, 杨明世等. 齐墩果酸和齐酞酸钠对二甲苯引起的小鼠耳肿胀抑制作用的研究[J]. 中西医结合心脑血管病, 2002, 18(6): 37-38.
[28] E. M. Giner-larza, S. Manez, M. C. Recio, et al. Oleanonic acid, a 3-oxotriterpene trom Pistacia, inhibits leukotriene synthesis and has anti-inflammatory activity. European Journal of Pharmacology, 2001, 428(1): 137-143.
[29] F. Mengoni, M. Lichtner and L. Battinelli. Anti-HIV activity of Oleanolic acid on infected human mononuclear cells. Planta Medica, 2002, 68(2): 111-114.
[30] Q. Bian, S. F. Liu, J. H. Huang, et al. Oleanolic acid exerts an osteoprotective effect in ovariectomy-induced osteoporotic rats and stimulates the osteoblastic differentiation of bone mesenchymal stem cells in vitro. Menopause, 2011.
[31] T. Honda, B. V. Rounds, G. W. Gribble, et al. Design and synthesis of 2-cyano-3, 12-dioxoolean-1, 9-dien-28-oic acid, a novel and highly active inhibitor of oxide production in mouse macrophages. Bioorganic & Medicinal Chemistry Letters, 1998, 8(19): 2711-2714.
[32] N. Suh, Y. Wang, T. Honda, et al. A novel synthetic oleanane triterpenoid, 2-cyano-3, 12-dioxooleana-1, 9-dien-28-oic-acid, with potent differentiating, anti-proliferative, and anti-inflammatory activity. Cancer Research, 1999, 59(2): 336-341.
[33] T. Honda, T. Janosik, Y. Honda, et al. Design, synthesis, and biological evaluation of biotin conjugates of 2-cyano-3, 12-dioxooleana-1, 9(11)-dien-28-oic acid for the isolation of the protein targets. Journal of Medicinal Chemistry, 2004, 47(20): 4923- 4932.
[34] T. Honda, Y. Honda, F. G. Favaloro, et al. A novel dicyanotriterpenoid, 2-cyano-3, 12-dioxooleana-1, 9(11)-dien-28-onitrile, active at picomolar concentrations for inhibition of nitric oxide production. Bioorganic & Medicinal Chemistry Letters, 2002, 12(7): 1027-1030.
[35] 汤杰, 李佳, 王博等. 山楂酸衍生物及其制备和应用[P]. 中国专利: 200910055852. X, 2010-01-06.
[36] Y. Wei, C. M. Ma and M. Hattori. Synthesis and evaluation of A-seco typetriterpenoids for anti-HIV-1 protease activity. European Journal of Medicinal Chemistry, 2009, 44(10), 4112-4120.
[37] 张奕华, 丁晔, 赖宜生等. 一类五环三萜-13,28-内酯化合物、其制备方法和用途[P]. 中国专利: 201010580457.8, 2011- 06-11.
[38] Y. Zhang, J. X. Li, J. W. Zhao, et al. Synthesis and activity of Oleanolic acid derivatives, a novel class of inhibitors of osteoclast formation. Bioorganic & Medicinal Chemistry Letters, 2005, 15(6): 1629-1632.
[39] W. Xu, L. Z. Liu, M. Loizidou, et al. The role of nitric oxide in cancer. Cell Research, 2002, 12(5-6): 311-320.
[40] L. Chen, Y. H. Zhang, X. W. Kong, et al. Synthesis and biological evaluation of nitric oxide-releasing derivatives of Oleanolic acid as inhibitors of HepG2 cell apoptosis. Bioorganic & Medicinal Chemistry Letters, 2007, 17(11): 2979-2982.
[41] L. Chen, Y. H. Zhang, X. W. Kong, et al. Design, synthesis and anti-hepatocellular carcinoma activity of nitric oxide-releasing derivatives of Oleanolic acid. Journal of Medicinal Chemistry, 2008, 51(15): 4834-4838.
[42] 陈莉, 孟飞, 王志凤等. 硝酸酯类NO供体型齐墩果酸衍生物的合成及抗肿瘤活性[J]. 中国药科大学学报, 2010, 41(6): 487-492.
[43] 陈秀英, 季晖, 张奕等. 一氧化氮供体型齐墩果酸衍生物ZCⅡ2对早期实验性肝纤维化的保护作用[J]. 中国临床药理学与治疗学, 2005, 10(11): 1261-1265.
[44] S. Qian, H. J. Li, Y. Chen, et al. Synthesis and Biological Evaluation of Oleanolic Acid Derivatives as Inhibitors of Protein Tyrosine Phosphatase 1B. Journal of Natural Products, 2010, 73(11): 1743-1750,
[45] 郭甜甜. 齐墩果酸皂苷的合成和生物活性评价以及羟基喜树碱缀合物的设计[D]. 中国海洋大学, 2010.
[46] Y. Q. Hua, Z. Y. Zhang, J. X. Li, et al. Oleanolic acid derivative Dex-OA has potent anti-tumor and anti-metastatic activity on osteosarcoma cells in vitro and in vivo. Investigational New Drugs, 2011, 29(2): 258-269.
[47] 闫茂才. 齐墩果酸衍生物的设计、合成与生物活性研究[D].沈阳药科大学, 2008.
[48] D. Huang, Y. Ding, Y. Li, et al. Antitumor activity of a 3-oxo derivative of Oleanolic acid. Cancer Letters, 2006, 23(2): 289- 296.
[49] 孙华, 胡春, 方唯硕. 3-氧代齐墩果酸氨基酸偶联物的合成、水溶性的测定及抗肿瘤活性研究[J]. 中国药物化学杂志, 2008, 18(11): 11-15.
NOTES
*通讯作者。