Asian Case Reports in Vascular Medicine
Vol.2 No.3(2013), Article ID:12260,3 pages DOI:10.12677/ACRVM.2013.23004
Differences of Myocardial Tissue Gene Expression of Diabetic Rats and the Effect of Melatonin
1Department of Endocrinology, Changzheng Hospital, Second Military Medical University, Shanghai
2International Joint Cancer Institute, Second Military Medical University, Shanghai
Email: zmliu_cz@hotmail.com
Received: Jul. 9th, 2013; revised: Jul. 20th, 2013; accepted: Jul. 27th, 2013
Copyright © 2013 Ming Liu et al. This is an open access article distributed under the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
ABSTRACT:
Aim: To investigate the pathogenesis of diabetic cardiomyopathy. The differences of myocardial tissue gene expressions among diabetic group, control group, and high dose melatonin group were compared by using rat genome-wide spectrum illumina beads chip. Methods: Divide 12 SD rats into 3 groups, control group, streptozotocin (STZ) induced diabetic group, and diabetic and melatonin group. Extract mRNA from the myocardial tissue, transcript it into cDNA, hybridize the cDNA with gene chips, and then statistically analyze the results of gene chip scanning. Results: Compared with the control group, the protein metabolism related gene expression significantly downregulated while apoptosis relevant gene expression upregulated in diabetic rats. Compared with the diabetic group, glucose and protein metabolism related genes expression in high dose melatonin group significantly increased while apoptosis and oxidative stress genes decreased in melatonin group. Conclusion: The results of gene chip analysis showed that glucose and protein metabolism, oxidative stress and apoptosis played important roles in the pathogenesis of diabetic cardiomyopathy.
Keywords: Diabetes; Rat; Gene Microarray; Melatonin; Apoptosis; Oxidative Stress
糖尿病大鼠心肌组织基因表达谱的改变及大剂量褪黑素的干预研究
刘 明1,石勇铨1,刘志民1,彭 玲2,邹俊杰1
1第二军医大学长征医院内分泌科,上海
2第二军医大学国际合作肿瘤研究所,上海
Email: zmliu_cz@hotmail.com
摘 要:
目的:比较糖尿病大鼠与正常对照组和大剂量褪黑素组心肌组织基因谱表达差异,探讨糖尿病心肌病变发病机制。方法:选用12只SD大鼠分3组,正常对照组,链脲佐菌素(Streptozocin, STZ)诱导糖尿病组,糖尿病 + 褪黑素组。从心肌组织抽提mRNA,逆转录为cDNA,与基因芯片杂交。扫描芯片结果统计分析。结果:与正常对照组相比,糖尿病组大鼠心肌蛋白代谢相关基因明显下调,凋亡相关基因明显上调;与糖尿病组相比,大剂量褪黑素组糖及蛋白代谢相关基因明显上调,氧化应激相关基因和凋亡相关基因明显下调。结论:物质代谢、氧化应激和凋亡在糖尿病心肌病变发病机制中可能起到重要作用。
收稿日期:2013年7月9日;修回日期:2013年7月20日;录用日期:2013年7月27日
关键词:糖尿病;大鼠;基因芯片;褪黑素;凋亡;氧化应激
1. 引言
基因表达谱芯片可以对来源于不同个体、不同生理病理状态、不同药物治疗手段或不同治疗阶段等的组织细胞基因表达mRNA水平进行检测,有助于理解基因及其编码蛋白质的生物学功能和阐明疾病的发病机制。本研究应用基因芯片技术研究链脲佐菌素诱导大鼠糖尿病心肌病变后心肌组织基因表达谱变化以及在药物干预下表达谱的改变。探讨糖尿病心肌病变的发病机制。
2. 材料与方法
2.1. 糖尿病心肌病变动物模型建立
SPF级健康雄性Sprague-Dawley大鼠:共12只,体重160~180克,6周龄,购进后普通饲料适应性喂养3天,随机分为二组:对照组(CN)4只,模型组8只。禁食12小时后模型组以65 mg/kg的剂量腹腔注射STZ (PH = 4.5的0.1 mol/L无菌柠檬酸盐缓冲液,用前新鲜配制),对照组同时腹腔注射等体积的上述缓冲液作为对照。于注射STZ后第3天,用罗氏优势型快速血糖仪检测大鼠尾尖血,以随机血糖持续≥16.7 mmol/L的大鼠确定为建模成功。建模成功大鼠随机分为2组:糖尿病组(DM)和大剂量褪黑素组(MEL):褪黑素10 mg/kg/d,每日一次灌胃。12周后麻醉放血处死所有大鼠,取心肌组织做电镜检查,DM组大鼠心肌细胞肌丝排列紊乱、扭曲;线粒体出现肿胀变形,原本平行排列的嵴成花环状排列,有些嵴断裂,基底空化,并可见部分线粒体内出现空泡化,表明已形成糖尿病心肌病变。
2.2. 芯片检测
Trizol试剂提取各组大鼠心肌组织总RNA,采用Ambion Illumina RNA Amplification试剂盒反转录合成cDNA。体外转录(IVT)合成cRNA,将样品与杂交试剂混合后加入芯片,杂交舱58℃孵育16~22 h,清洗芯片,离心干燥,用Illumina BeadChip Reader读取图像,用Illumina BeadStudio Application进行数据分析,两样本差异分值大于20为基因表达上调,小于−20为基因表达下调。
3. 结果
3.1. DM组与CN组比较
心肌组织差异表达862条,上调597条,下调265条。差异分值大于20及小于−20的基因共有41条。一部分基因功能与名称已明确,另一部分为表达序列标签,功能还未确定。表1列出部分已知名称和功能的基因及其序列号、差异分值。
与对照组相比,糖尿病组大鼠心肌组织中与蛋白质合成相关的基因表达,如核糖体蛋白L30及核糖体蛋白S9均明显下调,可能在糖尿病心肌组织中蛋白质合成受到抑制。同时,与凋亡相关基因泛素D表达较正常对照上调。
3.2. MEL组与DM组比较
心肌组织差异表达1263条,上调849条,下调414条。差异分值大于20及小于−20的基因共有145条。表2列出部分已知名称和功能的基因及其序列号、差异分值。
在大剂量褪黑素组大鼠心肌组织中,核糖体蛋白L30及核糖体蛋白S9基因表达较糖尿病组显著上升,可能存在蛋白质合成的修复。与氧化应激相关基因谷

Table 1. Dominant difference of gene chips expression in myocardial tissue between DM and CN group
表1. 糖尿病组和正常对照组大鼠心肌部分基因差异表达谱
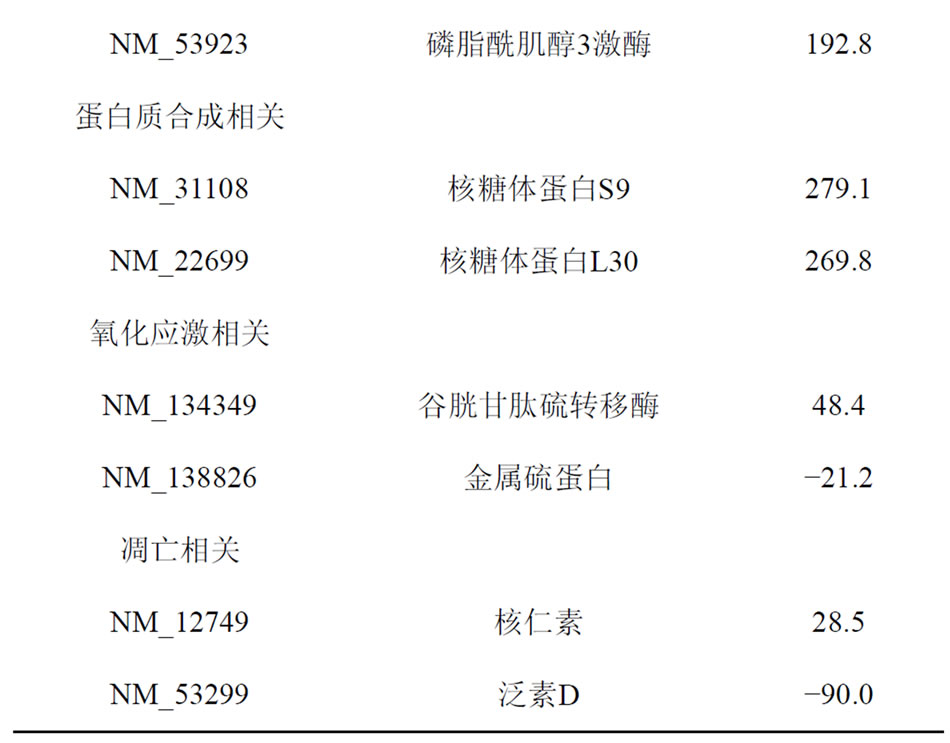
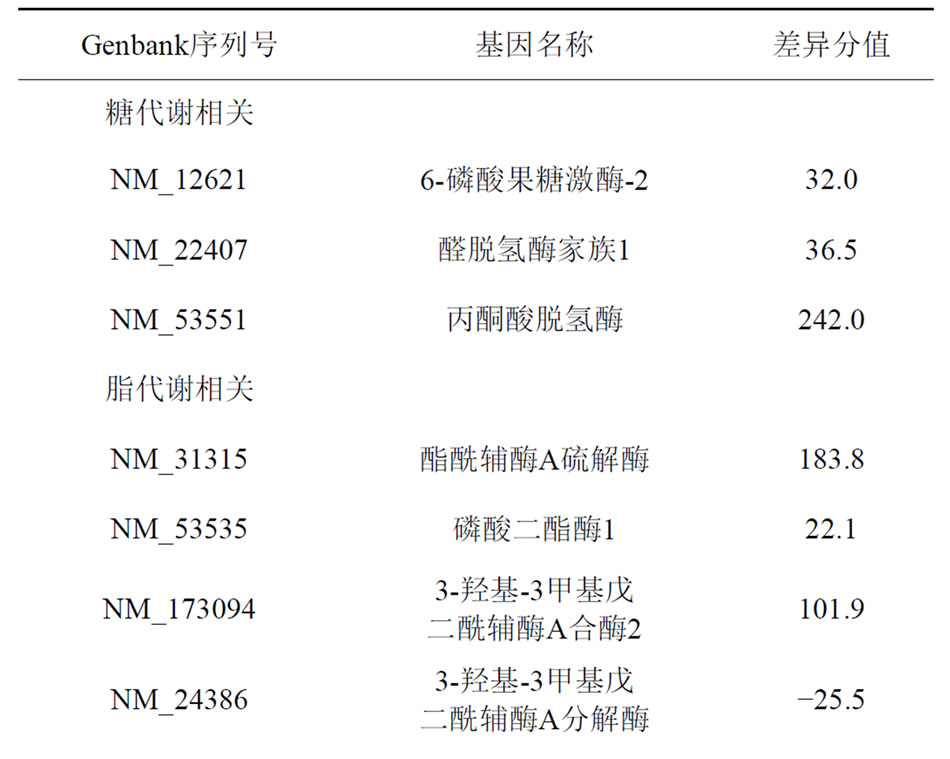
Table 2. Dominant difference of gene chips expression in myocardial tissue between DM and high dose melatonin group
表2. 大剂量褪黑素组与糖尿病组大鼠心肌部分基因差异表达谱
胱甘肽硫转移酶表达较糖尿病组明显上升。但金属硫蛋白基因表达下调。大剂量褪黑素干预后泛素D表达较糖尿病组明显下调。
4. 讨论
以往关于糖尿病并发症的研究汗牛充栋,但是大多数的研究工作仅仅从1个或几个基因、蛋白质入手,孤立地分析其与糖尿病并发症的关系,难以从基因的整体表达谱全面地观察2型糖尿病发病时基因的反应模式。基因芯片技术克服上述缺点,可以大规模、高通量、高效地进行成千上万基因在各种生理和病理状态下表达状况的研究以及分析大量的生物信息。
糖尿病心肌病变是由Rubler于1972年首先提出,研究证实,糖尿病心肌病变是一种独立的糖尿病慢性并发症,病理基础是心肌内微血管病变[1],它是一种特异性心肌病,其发生与冠状动脉供血障碍无关。高血糖是糖尿病最基础的特征,此基础上通过多元醇旁路、蛋白激酶C激活、糖基化终末产物增多及氧化应激作用增强和各类细胞因子产生而致全身广泛的微血管病变。目前认为这些机制均与糖尿病心肌病变发病有关。
与蛋白质合成相关基因核糖体蛋白L30及核糖体蛋白S9在糖尿病大鼠心肌组织表达均明显下调,说明在糖尿病时心肌组织存在负氮平衡[2]。在大剂量褪黑素组大鼠心肌组织中,核糖体蛋白L30及核糖体蛋白S9表达较糖尿病组明显上升。在大剂量褪黑素组和对照组之间,这两种基因表达差异不显著,说明药物干预后心肌组织的蛋白质代谢紊乱得到一定程度纠正。
氧化应激机制在糖尿病并发症中的地位越来越受到人们的关注[3]。心肌组织自身的抗氧化酶保护系统薄弱,同时代谢旺盛易受自由基攻击,这都给糖尿病心肌病变打下基础。此外,ROS还可直接攻击膜中的多价不饱和脂肪酸,引起脂质过氧化,形成过氧化产物,过氧化物可以氧化修饰糖基化的低密度脂蛋白(LDL),导致体内ox-LDL的含量明显增加,进一步加重心肌损害。谷胱甘肽硫转移酶(GST)是抗氧化防御机制中的重要的抗氧化酶,GST是谷胱甘肽(GSH)代谢中的重要酶,它可以催化氧化应激引起的脂质过氧化损伤产生的各种有毒代谢产物与GSH的巯基共价结合,防止脂质过氧化引起的损伤,具有清除体内过氧化物及解毒的双重功能[4]。本实验发现大剂量褪黑素组大鼠心肌组织中谷胱甘肽硫转移酶表达较糖尿病组明显上升,说明大剂量褪黑素可能通过GST发挥抗氧化应激作用,保护心肌组织。有趣的是,大剂量褪黑素干预下,金属硫蛋白的基因表达下调。褪黑素和金属硫蛋白均有抗氧化应激作用,可能在大剂量褪黑素的作用下,金属硫蛋白的基因表达受到抑制。本课题组发现金属硫蛋白通过抑制凋亡以及抗氧化应激,对糖尿病心肌病变有明确保护作用(未发表)。
泛素是一个由76个氨基酸组成的高度保守的多肽链,在蛋白质降解过程中,泛素的枢纽作用越来越得到研究者的重视[5]。Ub-26s蛋白酶体途径(ubiquitin- 26s proteasome pathway, UPP)是胞浆中一条重要的蛋白降解途径。近年来UPP在凋亡中的作用受到重视,可通过降解多种凋亡关键调控因子及调控细胞周期进程的调节因子、转录因子来影响凋亡。本研究中发现在糖尿病大鼠心肌组织中泛素的表达较正常对照组明显上调,大剂量褪黑素干预后泛素表达较糖尿病组明显下调,说明在糖尿病大鼠心肌组织中,凋亡明显增强,药物干预后凋亡受到抑制。
在整个糖尿病及糖尿病心肌病变的过程中,某些基因的表达可发生变化[6],我们仅从一个时间点进行研究,还是远远不够的。同时许多基因在功能上存在交叉,同一基因可通过多种功能参与作用。我们的工作为今后对糖尿病心肌病变发病机制的研究积累一些经验,在研究方向上作多方面的探讨,将在今后工作中继续努力,以期揭开糖尿病微血管病变的具体发病机制。
参考文献 (References)
[1] M. Hamblin, D. B. Friedman, S. Hills, et al. Alteration in the diabetic myocardial proteome coupled with increased myocardial oxidative stress underlies diabetic cardiomyopathy. Journal of Molecular and Cellular Cardiology, 2007, 42(4): 884-895.
[2] Y. Weng, F. Shen, J. Li, et al., Expression changes of mitogenactivated protein kinase phosphatase-1 (MKP-1) in myocardium of streptozotocin-induced diabetic rats. Experimental and Clinical Endocrinology & Diabetes, 2007, 115(7): 455-460.
[3] H. Nie, J. L. Wu, M. Zhang, et al., Endothelial nitric oxide synthase-dependent tyrosine nitration of prostacyclin synthase in diabetes in vivo. Diabetes, 2006, 55(11): 3133-3141.
[4] J. W. Hartog, A. A. Voors, S. J. Bakker, et al., Advanced glycation end-products (AGEs) and heart failure: Pathophysiology and clinical implications. European Journal of Heart Failure, 2007, 9(12): 1146-1155.
[5] R. Marfella, C. Di Filippo, M. Portoghese, et al., The ubiquitinproteasome system contributes to the inflammatory injury in ischemic diabetic myocardium: The role of glycemic control. Cardiovascular Pathology, 2009, 18(6): 332-345.
[6] H. Miyazaki, N. Oka, A. Koga, et al., Comparison of gene expression profiling in pressure and volume overload-induced myocardial hypertrophies in rats. Hypertension Research, 2006, 29(12): 1029-1045.