Open Journal of Fisheries Research
Vol.04 No.03(2017), Article ID:21563,6
pages
10.12677/OJFR.2017.43011
Effects of Ammonia-N Stress on the Activities of Immune Enzymes of Tegillarca granosa
Chenghao Wang, Qifan Qian, Yaoyin Zhang, Xidan Wu, Jianyu Jin*
College of Teacher Education, Wenzhou University, Wenzhou Zhejiang

Received: Jul. 7th, 2017; accepted: Jul. 29th, 2017; published: Aug. 1st, 2017

ABSTRACT
In this paper, the effects of ammonia-N stress on the activities of immune enzyme of Tegillarca granosa were studied at different conditions with ecological method. The results were as follows: 1) Ammonia-N concentration was found to have no significant effect on the activity of catalase (CAT) of Tegillarca granosa (F6, 14 = 2.6074, P = 0.06545 > 0.05). As the concentration of ammonia-N increased, CAT generally demonstrated an “induction-suppression” activity. 2) Ammonia-N concentration had a highly significant impact on the activity of acid phosphatase (ACP) of Tegillarca granosa (F6, 14 = 13.693, P = 0.00004 < 0.01). As the concentration of ammonia-N increased, ACP generally demonstrated a “suppression-induction” activity. 3) Ammonia-N concentration had a highly significant impact on the activity of alkaline phosphatase (AKP) of Tegillarca granosa (F6, 14 = 13.696, P = 0.00004 < 0.01). As the concentration of ammonia-N increased, AKP generally demonstrated an “induction-suppression” activity. In conclusion, the stress of ammonia-N could influence these immuno-enzymes’ activities.
Keywords:Tegillarca granosa, Ammonia-N Stress, Catalase, Acid Phosphatase, Alkaline Phosphatase
氨氮胁迫对泥蚶免疫酶活性的影响
王程昊,钱琦凡,张耀尹,吴茜丹,金建钰*
温州大学教师教育学院,浙江 温州

收稿日期:2017年7月7日;录用日期:2017年7月29日;发布日期:2017年8月1日

摘 要
本实验以泥蚶为研究对象,研究了不同浓度下的氨氮胁迫对三种免疫酶活性的影响。实验结果发现:1) 氨氮浓度对泥蚶过氧化氢酶(CAT)活力的影响不显著(F6,14 = 2.6074, P = 0.06545 > 0.05),随着氨氮浓度的增加,总体上CAT活性表现出“诱导–抑制”的趋势。2) 氨氮浓度极显著影响泥蚶酸性磷酸酶(ACP)的活力(F6,14 = 13.693, P = 0.00004 < 0.01),随着氨氮浓度的增加,总体上ACP活性表现出“抑制–诱导”的趋势。3) 氨氮浓度极显著影响泥蚶碱性磷酸酶(AKP)的活力(F6,14 = 13.696, P = 0.00004 < 0.01),随着氨氮浓度的增加,总体上AKP活性表现出“诱导–抑制”的趋势。结果表明,氨氮胁迫影响泥蚶这三种免疫酶的活性。
关键词 :泥蚶,氨氮胁迫,过氧化氢酶,酸性磷酸酶,碱性磷酸酶

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
氨氮是集约化水产养殖系统中普遍存在的有毒物质,也是水产养殖中重要的水体环境指标,它已成为水产经济动物养殖中的常见胁迫因子。在养殖过程中,养殖水体中的残饵、排泄物、分泌物以及生物尸体等含氮有机物经微生物分解后均可产生大量氨氮、硫化氢以及亚硝酸氮等有毒物质,其中以氨氮量的增加尤为显著 [1] 。在国内,有关氨氮对鱼类、虾类等水生生物抗病力影响的研究已有不少报道 [2] [3] [4] ,而有关氨氮胁迫对双壳贝类抗病力影响的报道较少。陈昌生等研究发现氨氮对九孔鲍体内的抗氧化酶活性有明显的影响 [5] ,提出氨氮胁迫会提高九孔鲍对病原体的易感性,增加患病的可能性。樊甄姣等人研究了氨氮对栉孔扇贝血淋巴活性氧含量和抗氧化酶活性的影响,进一步揭示适当的氨氮刺激可增加胞内外活性氧的含量,从而增强扇贝的两种抗氧化酶活性 [6] 。王文琪等人研究了氨氮对菲律宾蛤仔免疫力的影响,发现氨氮影响菲律宾蛤仔血细胞数量和血淋巴溶菌能力 [7] 。栗志民等人发现,氨氮胁迫也影响马氏珠母贝的免疫活性 [8] 。
泥蚶(Tegillarca granosa)隶属于软体动物门(Mollusca)双壳纲(Bivalvia)蚶目(Arcoida)蚶科(Arcidae),我国沿海各地均有分布,为我国传统的经济养殖贝类。本文以泥蚶为研究对象,通过开展不同浓度条件下的氨氮胁迫实验,测定氨氮对泥蚶常见免疫酶活力的影响,以期更好地了解泥蚶的防御机制,为其病害防治提供一定的理论依据。
2. 材料与方法
2.1. 实验材料
泥蚶实验材料来自乐清市泥蚶养殖场,材料运回实验室,用二次砂滤暗沉淀海水(海水盐度为25.5~27.1,pH为8.1~8.3,水温为19.8˚C~20.8˚C)暂养3 d,每12 h投饵和吸污一次,每24 h换水1次,每次投喂适量的等鞭金藻(Isochrysis galbana)。选择大小均匀、健康和活力强的个体用于实验,从中随机选取泥蚶个体30个,测量其壳长、壳宽、壳高和体重,所有数据都以平均值±标准差表示(见表1)。
2.2. 实验方法
2.2.1. 方案设计
实验共设置7个浓度梯度,总氨浓度根据预实验结果分别设为0、5、10、20、40、80、160 mg/L,
Table 1. Descriptive statistics of morphological measure of Tegillarca granosa
表1. 泥蚶形态描述性统计值
各梯度用氯化氨溶液调配,每个梯度设置3个平行。实验在30 cm × 20 cm × 10 cm的塑料水槽中进行,每槽分别放置成贝35个,各加入2 L海水。各组每12 h投饵和吸污一次,每24 h换水1次,各组温度、盐度、pH值等养殖条件保持一致。实验周期为7 d。
2.2.2. 样品采集
1周后贝类各随机选取30只,每10只混合作为一个样本,共设三个平行。从闭壳肌抽取血淋巴200 μl,立即与等量预冷的TBS抗凝剂(0.05 mol/L Tris-HCl, pH 7.4; 2% glucose; 2% NaCl; 20 mmol/L EDTA)混匀,于冰水混合物中保存备用。从制得的血淋巴中,超低温离心(4˚C, 8000 rpm/min) 20 min,取上清,用于过氧化氢酶(Catalase, CAT)活力测定。
同时,在冰上剪取肝胰脏组织,切成小块置于玻璃匀浆管中,加入1:2 (质量/体积)的0.85%生理盐水,冰上匀浆,超低温离心(4˚C, 10,000 rpm/min) 20 min,取上清,用于组织中蛋白质含量、酸性磷酸酶(Acid phosphatase, ACP)和碱性磷酸酶(Alkaline phosphatase, AKP)活力的测定。上清液置于−80˚C超低温冰箱保存备用。
2.2.3. 免疫酶活性的测定
过氧化氢酶(CAT)、酸性磷酸酶(ACP)和碱性磷酸酶(AKP)等3种酶活与蛋白质含量的测定均采用南京建成科技有限公司生产的试剂盒。
过氧化氢酶(CAT)活性:CAT分解H2O2的反应可通过加入钼酸铵而迅速中止,剩余的H2O2与钼酸铵作用产生一种淡黄色的络合物,通过分光光度计在405 nm处测定其生成量,可计算出CAT的活力。
酸性磷酸酶(ACP)的测定:ACP分解磷酸苯二钠时,产生游离酚和磷酸,酚在碱性溶液中与4-氨基安替吡啉作用经铁氰化钾氧化生成红色醌衍生物,根据红色深浅可以测定酶活力的高低。
碱性磷酸酶(AKP)的测定:当AKP分解磷酸苯二钠时,会产生游离酚和磷酸,酚在碱性溶液中与4-氨基安替吡啉作用经铁氰化钾氧化生成红色醌衍生物,根据其红色深浅可以测定酶活力的高低。
蛋白质含量测定(考马斯亮兰法):蛋白质分子具有 基团,当棕红色的考马斯亮兰显色剂加入蛋白标准液或样品中时,考马斯亮兰染料上的阴离子与蛋白
基团,当棕红色的考马斯亮兰显色剂加入蛋白标准液或样品中时,考马斯亮兰染料上的阴离子与蛋白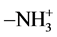 结合,使溶液变为蓝色,由此通过测定吸光度可计算出蛋白含量。
结合,使溶液变为蓝色,由此通过测定吸光度可计算出蛋白含量。
2.3. 数据处理
采用Statistica 6.0统计软件,所有数据在统计检验前分别检验其正态性和方差同质性。单因子方差分析(One-way ANOVA)及Tukey’s多重比较等处理相应数据,文中数据用平均值±标准差表示,显著性水平设置为a = 0.05。
3. 实验结果
3.1. 氨氮胁迫对泥蚶CAT活性的影响
单因素方差(ANOVA)分析显示,氨氮浓度对泥蚶CAT活力的影响不显著(F6,14 = 2.6074, P = 0.06545 > 0.05)。图1表明,在氨氮浓度为5 mg/L时,泥蚶血淋巴CAT的活性与对照相比有所增加,但是,随着

Figure 1. Changes of CAT activity of Tegillarca granosa at various ammonia-N concentrations
图1. 不同氨氮浓度下泥蚶CAT活性的变化
氨氮浓度的不断增加,CAT活性在总体上一直处于抑制状态。总体来看,CAT活性表现出“诱导–抑制”的趋势。
3.2. 氨氮胁迫对泥蚶ACP活性的影响
方差分析显示,氨氮浓度极显著影响泥蚶ACP的活力(F6,14 = 13.693, P = 0.00004 < 0.01)。图2表明,在氨氮浓度为5 mg/L时,泥蚶肝胰腺ACP的活性轻微下降,但是,随着氨氮浓度的不断增加,ACP活性呈现出增长趋势。与对照相比,当氨氮浓度为20、160 mg/L时,ACP活性升高明显,差异极显著(P < 0.01);当氨氮浓度为40、80 mg/L时,ACP活性升高明显,差异显著(P < 0.05)。同时,与10 mg/L实验组相比,当氨氮浓度继续增加为20、40、80、160 mg/L时,ACP活性都没有表现出显著差异(P > 0.05)。总体来看,ACP活性表现出“抑制–诱导”的趋势。
3.3. 氨氮胁迫对泥蚶AKP活性的影响
方差分析显示,氨氮浓度极显著影响泥蚶AKP的活力(F6,14 = 13.696, P = 0.00004 < 0.01)。图3表明,泥蚶肝胰腺AKP的活性随着氨氮浓度的不断增加,整体上保持增长趋势。当氨氮浓度为80 mg/L时,活性达到最高点,然后开始迅速降低。与对照相比,当氨氮浓度为40、80 mg/L时,AKP活性升高明显,差异极显著(P < 0.01)。总体来看,AKP活性表现出“诱导–抑制”的趋势。
4. 讨论
4.1. 氨氮胁迫对泥蚶过氧化氢酶活性的影响
氨氮在水体中以离子氨( )和非离子氨(NH3)两种形态存在,其中非离子氨不带电荷,具有较强的脂溶性,能够穿透贝体细胞膜而表现出毒性效应,使体内产生大量活性氧自由基,从而促使血细胞释放溶酶体酶等因子,并通过呼吸爆发产生细胞毒活性氧。在需氧生物体中,都必须具备抗氧化防御系统来防止内源代谢性活性氧自由基的过量产生,这个系统包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷肮甘肽过氧化物酶(GPx)等 [9] 。SOD可催化
)和非离子氨(NH3)两种形态存在,其中非离子氨不带电荷,具有较强的脂溶性,能够穿透贝体细胞膜而表现出毒性效应,使体内产生大量活性氧自由基,从而促使血细胞释放溶酶体酶等因子,并通过呼吸爆发产生细胞毒活性氧。在需氧生物体中,都必须具备抗氧化防御系统来防止内源代谢性活性氧自由基的过量产生,这个系统包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷肮甘肽过氧化物酶(GPx)等 [9] 。SOD可催化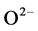 生成H2O2,从而清除
生成H2O2,从而清除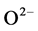 ,而CAT能催化H2O2生成水和氧气。因此,测定CAT酶活性的变化在一定程度上能反映出机体在环境胁迫下免疫机能的变化。
,而CAT能催化H2O2生成水和氧气。因此,测定CAT酶活性的变化在一定程度上能反映出机体在环境胁迫下免疫机能的变化。
研究结果表明,在较低的氨氮浓度(5 mg/L)条件下,CAT活性逐渐提高。这可能是贝类在氨氮胁迫环境下,活性氧自由基大量产生,机体处于过氧化状态,为保持抗氧化系统的动态平衡,抗氧化酶活力增加,才能消除机体产生的过量活性氧。但随着氨氮浓度继续增加,机体产生的大量活性氧已超过抗氧化系统的清除能力,进而对细胞结构造成氧化损伤,并使抗氧化酶CAT活性降低。这一发现也支持了其他贝类的研究结果 [5] [6] 。

Figure 2. Changes of ACP activity of Tegillarca granosa at various ammonia-N concentrations
图2. 不同氨氮浓度下泥蚶ACP活性的变化(*表示与对照组比较差异显著;**表示与对照组比较差异极显著)

Figure 3. Changes of AKP activity of Tegillarca granosa at various ammonia-N concentrations
图3. 不同氨氮浓度下泥蚶AKP活性的变化(**表示与对照组比较差异极显著)
4.2. 氨氮胁迫对泥蚶水解酶活性的影响
酸性磷酸酶(ACP)和碱性磷酸酶(AKP)都是存在于溶酶体的水解酶,作为软体动物体内两种重要的非特异性免疫因子,分别在酸性或碱性环境中参与对带磷酸脂基团异物的降解 [10] [11] 。一直以来,ACP 和AKP都被作为两种重要的免疫指标在动物免疫学中被广泛研究。
与CAT相反,ACP和AKP的活性在较低浓度时都出现“毒物兴奋效应” [12] :在氨氮浓度为10 mg/L时都开始升高,并在不断增加的氨氮浓度条件下保持较高的酶活水平。对AKP而言,在氨氮浓度为80 mg/L时,活性达到最高点,然后开始抑制性的下降。对ACP而言,从低浓度下的诱导升高并维持较高活性至160 mg/L,如果浓度继续增加,ACP活性很可能会发生抑制性下降。
本研究表明,低浓度的氨氮胁迫对贝体内的两种水解酶活性表现出的是激活效应,但随着浓度增加至一定程度后,水解酶活性将再度被抑制。这说明较低浓度的氨氮能有效地刺激贝体为维持自身酸碱平衡和离子平衡采取免疫反应,而在高浓度下免疫活性的抑制可能与高浓度条件下氨氮对贝体肝胰腺细胞造成的伤害有关 [3] 。同时,这也说明贝类溶酶体酶活力的提高可能也是一种防御反应外的被动的病理显示 [13] 。
综上所述,在氨氮胁迫下泥蚶体内三种免疫酶都受到不同的激活,显示贝体启动抗氧化防御系统来防止内源代谢性活性氧自由基的过量产生。但是,当氨氮浓度超过一定范围后,持续存在的离子氨、非离子氨和活性氧在体内累积,都会破坏抗氧化防御系统,从而最终降低免疫酶的活性。
基金项目
浙江省教育厅资助项目(Y201121032);温州大学2016年度实验室开放项目(16SK05A)。
文章引用
王程昊,钱琦凡,张耀尹,吴茜丹,金建钰. 氨氮胁迫对泥蚶免疫酶活性的影响
Effects of Ammonia-N Stress on the Activities of Immune Enzymes of Tegillarca granosa[J]. 水产研究, 2017, 04(03): 65-70. http://dx.doi.org/10.12677/OJFR.2017.43011
参考文献 (References)
- 1. 董乔仕. 养殖水体氨氮的危害与改良[J]. 齐鲁渔业, 2002(9): 10.
- 2. Colt, J. and Tchobanoglous, G. (1978) Chronic Exposure of Channel Catfish, Ictalurus punctatus, to Ammonia: Effects on Growth and Survival. Aquaculture, 15, 353-372. https://doi.org/10.1016/0044-8486(78)90081-9
- 3. 王贞杰, 陈四清, 曹栋正, 卢斌, 常青, 刘长琳, 燕敬平. 急性氨氮胁迫对圆斑星鲽(Verasper variegates)幼鱼鳃和肝组织结构及相关酶活性的影响[J]. 渔业科学进展, 2017, 38(2): 59-69.
- 4. 孙舰军, 丁美丽. 氨氮对中国对虾抗病力的影响[J]. 海洋与湖沼, 1999, 30(3): 267-272.
- 5. 陈昌生, 王淑红, 纪德华, 等. 氨氮对九孔鲍过氧化氢酶和超氧化物歧化酶活力的影响[J]. 上海水产大学学报, 2001, 10(3): 218-222.
- 6. 樊甄姣, 刘志鸿, 杨爱国. 氨氮对栉孔扇贝血淋巴活性氧含量和抗氧化酶活性的影响[J]. 海洋水产研究, 2005, 26(1): 23-27.
- 7. 王文琪, 姜令绪, 杨宁, 等. 氨氮对菲律宾蛤仔免疫力的影响[J]. 海洋科学, 2007, 31(1): 23-27.
- 8. 栗志民, 申玉春, 王淑敏, 李嘉威. 氨氮胁迫对马氏珠母贝免疫活性的影响[J]. 广东海洋大学学报, 2011, 31(4): 52-57.
- 9. 雷衍之. 养殖水环境化学[M]. 北京: 中国农业出版社, 2008, 191-202.
- 10. Cheng, T. C. (1978) The Role of Lysosomal Hydrolases in Molluscan Cellular Response to Immunologic Challenge. Comp Pathobio1, 4, 59-71. https://doi.org/10.1007/978-1-4757-1278-0_4
- 11. Pipe, R.K. (1990) Hydrolytic Enzymes Associated with the Granular Haemocytes of the Marine Mussel Mytilus edulis. European Journal of Histochemistry, 22, 595-603. https://doi.org/10.1007/BF01072941
- 12. Stebbing, A.R.D. (1982) Hormesis-the Stimulation of Growth by Low Levels of Inhibitors. Science of the Total Environment, 22, 213-234. https://doi.org/10.1016/0048-9697(82)90066-3
- 13. Feng, S.Y. (1988) Cellular Defense Mechanism of Oysters and Mussels. Management Of Asian Reservoir Fisheries, 18, 153-168.
