Material Sciences
Vol.2 No.4(2012), Article ID:5037,5 pages DOI:10.4236/MS.2012.24025
Vanadium Doped Mg1.03Mn0.97SiO4 Cathode Materials for Rechargeable Magnesium Batteries*
School of Chemistry and Engineering, Shanghai Jiao Tong University, Shanghai
Email: #nlyn@sjtu.edu.cn
Received: Jul. 17th, 2012; revised: Jul. 29th, 2012; accepted: Aug. 11th, 2012
ABSTRACT:
Vanadium doped Mg1.03–0.5xMn0.97–xVxSiO4 (x = 0, 0.034, 0.069 and 0.134) materials were synthesized by a high temperature solid-state method. The crystal structure and morphology were characterized by XRD and SEM measurements and the results demonstrated that V3+ ion dopant does not affect the structure of Mg1.03Mn0.97SiO4 and particle size decreases with increasing vanadium amount. Furthermore, the electrochemical performance of Mg1.03–0.5xMn0.97–xVxSiO4 materials as rechargeable magnesium battery cathodes was compared by cyclic voltammetry, AC impedance and direct current charge-discharge techniques. The vanadium doped materials exhibit improved electrochemical performance with lower polarization for magnesium de-intercalation and intercalation, larger discharge capacity and higher discharge flat plateau compared with that of pure Mg1.03Mn0.97SiO4. At a rate of 0.01 C (3.14 mA/g), 140 mAh/g discharge capacity and 1.65 V (vs. Mg) discharge voltage plateau can be reached for Mg1.03–0.5xMn0.97–xVxSiO4 with x = 0.069, compared with 40 mAh/g discharge capacity and 1.62 V (vs. Mg) discharge voltage plateau for pure Mg1.03Mn0.97SiO4.
Keywords: Rechargeable Magnesium Batteries; Cathode Materials; Electrochemical Performance; Metal Ion Doping
钒掺杂的可充镁电池正极材料Mg1.03Mn0.97SiO4*
伊丽奴尔·吐胡达洪,努丽燕娜#,陈 强,杨 军,王久林
上海交通大学化学化工学院,上海
Email: #nlyn@sjtu.edu.cn
摘 要:
采用高温固相方法制备了钒掺杂的可充镁电池正极材料Mg1.03–0.5xMn0.97–xVxSiO4(x = 0、0.034、0.069和0.134)。X射线衍射(XRD)表明掺杂V后Mg1.03Mn0.97SiO4的晶体结构未发生变化。扫描电镜(SEM)显示材料颗粒粒径随V掺杂量的增加而逐渐减小。通过循环伏安、交流阻抗、恒电流充放电测试比较了掺杂前后四种材料的电化学性能。电化学结果表明,掺杂V改善了Mg1.03Mn0.97SiO4脱嵌镁的可逆性、提高了其放电容量和放电电压平台。在0.01 C倍率下,x = 0.069的Mg1.03–0.5xMn0.97–xVxSiO4放电容量可达140 mAh/g,远大于未掺杂的Mg1.03Mn0.97SiO4 (40 mAh/g),并且1.62 V(vs. Mg)的放电平台可提高到1.65 V。
收稿日期:2012年7月17日;修回日期:2012年7月29日;录用日期:2012年8月11日
关键词:可充镁电池;正极材料;电化学性能;金属离子掺杂
1. 引言
可充镁电池作为高比能量的可充电池,与锂离子电池相比具有如下独特的特点:自然资源丰富,价格便宜,安全性s较高及对环境友好,使镁电池在安全和价格两点上有望取得突破,虽不能与应用于小尺度(如便携式电子仪器)的锂离子电池相竞争,但在大负荷用途方面有潜在优势,并被认为是有望适用于电动车的绿色蓄电池[1-3]。目前,可充镁电池的研究主要集中于可实现镁可逆沉积的非水电解液及能可逆脱嵌Mg2+的正极材料。在正极材料方面,相对于Li+来说,Mg2+的电荷密度大,溶剂化更为严重,因而Mg2+比Li+较难嵌入到一般的基质材料中;而且,Mg2+在嵌入材料中的移动也较困难[1]。对可充镁电池正极的研究主要集中于具有能嵌入/脱嵌Mg2+独特结构的材料,主要有[4,5]:1) 过渡金属硫化物:二硫化物和Chevrel相硫化物;2) 过渡金属氧化物:钒氧化物、MoO3、尖晶石型可插入氧化物、Todorokite型锰氧化合物等;3) 硼化物:MoB2、TiB2和ZrB2可插入材料;4) 聚阴离子型化合物:包括正交结构的硅酸盐系列化合物及Nasicon结构化合物如Mg0.5Ti2(PO4)3和Mg0.5+y(FeyTi1–y)2(PO4)3;5)其他化合物如MgV2O6、MgTi2O5、有机硫化物、有机硫聚合物等。其中,Aurbach小组报道的Cheverel相硫化物Mo3S4(理论比容量为122 mAh/g)是一种较好的Mg2+嵌/脱材料,Mg2+可在Mo6S8单元之间的通道中移动,实际放电比容量可达到100 mAh/g左右,放电电压平台在1.2 V和1.0 V(vs. Mg)左右;主要缺点是抗氧化性较差,容量有限且电压平台较低[6]。该小组又研究了Mo6S8–nSen(n = 0, 1, 2)和CuMo6S8(理论比容量为114 mAh/g),来减少Mo3S4中被俘获的Mg2+,提高速率性能[7-12]。国内陈军课题组[13]尝试将TiS2纳米管作为Mg嵌入材料,与TiS2微晶材料相比,储镁容量得到很大提升;最近他们采用溶剂热方法合成出类石墨烯结构的MoS2(G-MoS2),平均放电电压平台可达1.8 V[14]。袁华堂课题组借鉴开口式V2O5纳米管(VOx-NTs)在锂离子电池正极材料的应用,对其嵌脱镁的电化学行为进行了研究[15,16],结果表明少量Cu掺杂可使VOx层间距增加,提高材料导电性,有助于Mg2+的扩散和比容量的提高。本课题组提出将聚阴离子型Mg1.03Mn0.97SiO4材料作为可充镁电池的正极材料[17-21],利用SiO42–和Mn-O-Si键产生的大空间和稳定的三维框架结构,来完成Mg2+可逆地脱嵌,理论容量可高达314.6 mAh/g。如同聚阴离子型LiMPO4 (M = Fe、Mn、Co、Ni)锂离子电池正极材料一样,Mg1.03Mn0.97SiO4的电子电导率和离子扩散系数均较低,导致材料长期循环性能和倍率性能较差。为了改善Mg1.03Mn0.97SiO4材料的性能,我们前面的研究工作着重在:1) 减少颗粒粒径以缩短镁离子的扩散路径;2) 采用碳包覆以提高其表面电子电导率。3) 制备多孔材料增加与电解液的接触面积,提高材料的电化学活性。对LiMPO4锂离子电池正极来说,通过金属离子掺杂可造成晶格缺陷提高其本体电子电导率,改善材料的电化学性能[22-26]。本文采用高温固相方法制备钒掺杂的硅酸锰镁材料,并对其结构和电化学性能进行了探讨。
2. 实验
2.1. 材料制备
将MgO、MnCO3、纳米二氧化硅(15~20 nm)、V2O5及Super P(作为还原剂,将V2O5中的V5+还原为V3+)按Mg1.03–0.5xMn0.97–xVxSiO4 (x = 0、0.05、0.1和0.2)化学计量比称重,V2O5和乙炔黑的摩尔比为0.5:1,以无水乙醇作为分散剂球磨4 h混合均匀,将得到的粉末压片处理,放入刚玉舟中,在Ar + 5 wt% H2气氛下于500℃热处理4 h,继续升温至1250℃热处理24 h,待温度降至室温后取出,研磨得到四种硅酸锰镁材料Mg1.03–0.5xMn0.97–xVxSiO4。
所用电解液为0.25 mol/L的Mg(AlCl2EtBu)2/ THF[27],制备过程如下:在氩气手套箱(Mbraun, Unilab, Germany)中,以滴加的方式混合1:2摩尔比的MgBu2(1 mol/L的己烷溶液,Aldrich)和AlCl2Et(0.9 mol/L的庚烷溶液,Acros Organics),搅拌反应48小时。之后将反应瓶转移出手套箱,彻底蒸除混合物中存在的己烷和庚烷溶剂,得到白色固体。在手套箱中,加入适量的无水THF溶解即可得到无色透明的电解液。
2.2. 组成及结构测试分析
采用Riguku X射线衍射仪(CuKα辐射源)分析材料的物相组成和晶体结构。采用JEOL公司的JSM- 7401F场发射扫描电镜观察粉体的颗粒形貌。采用Iris Advangtage1000型电感耦合等离子体发射光谱仪(ICP)检测样品中Mg、Mn、V(Si不能被测出)的摩尔比例。使用Spectrum100红外光谱仪(Perkin Elmer, Inc., USA)对样品进行红外吸收光谱的测试。
2.3. 电化学性能测试
将上述制得的四种材料研细,加入15 wt%的乙炔黑导电剂,10 wt%的PVDF(聚偏氟乙烯,为配好的0.02 g/mL的PVDF/NMP溶液,NMP为N-甲基吡咯烷酮)粘结剂,经充分搅拌均匀后,用湿膜涂膜器涂覆在铜箔上,厚度为50 μm,放入60℃~80℃的烘箱中烘干后,冲成极片,压片后,放入120℃的真空烘箱中干燥,得到极片。将极片转移到氩气手套箱中,与金属镁条负极,Entek PE隔膜,0.25 mol/L Mg(AlCl2BuEt)2/ THF电解液,组装成CR2016扣式电池。充放电测试在LAND电池测试系统上进行,测试温度为室温,充放电截止电压为0.5~2.1 V(vs. Mg)。循环伏安扫描和交流阻抗测试在CHI650C电化学工作站上进行,循环伏安扫描速度为0.5 mV/s;循环伏安测试后的电池接着进行交流阻抗测试,交流电压信号的振幅为5 mV,频率范围为0.01~1 MHz。
3. 结果与讨论
Mg1.03–0.5xMn0.97–xVxSiO4材料的物相分析
Mg1.03Mn0.97SiO4属于橄榄石结构,正交晶系,Pbnm(62)空间群[28]。Mg2+和Mn2+以不同的占位分数占据了相同的八面体中心位点:M1(4a)位占有8%的Mn2+和92%的Mg2+,而M2(4c)位则占有89%的Mn2+和11%的Mg2+。也就是说,在这个结构中可供镁离子占据的位置有两种。图1为四种合成材料的XRD图谱及Mg1.03Mn0.97SiO4的标准谱图(JCPDS-ICDD 83- 1546)。由图可见,所有材料的衍射峰均尖锐,其中纯材料和掺杂量为0.05和0.1材料的谱图(分别为图1(a),1(b),1(c))中没有杂质峰,均与Mg1.03Mn0.97SiO4标准谱相吻合,说明这三种材料的晶体结构相同。这是由于V3+(0.074 nm)与Mn2+(0.080 nm)的半径相近,可以较容易地占据Mg1.03Mn0.97SiO4中Mn2+的位置,实现离子取代,掺杂离子以固熔的形式存在于晶体中。而掺杂量为0.2材料的谱图中则出现了一些未知的杂质峰(用#标出)。
根据XRD谱图计算得到的Mg1.03–0.5xMn0.97–xVxSiO4晶格参数如表1所示。从表中可知,掺杂V后的材料在a轴、b轴、c轴方向的晶胞参数均有所减小,晶格体积降低。这说明V掺杂后的材料与未掺杂材料相比,晶胞参数和晶胞体积有一定收缩,且收缩程度随着掺杂量的增加而增加。这主要是由于V3+的离子半径小于Mn2+,掺入后引起了晶胞参数和体积减小。表明钒已经掺入到Mg1.03Mn0.97SiO4的晶格中,形成了Mg1.03–0.5xMn0.97–xVxSiO4。一个异价V3+掺入Mg1.03Mn0.97SiO4的晶格替代Mn2+的位置,将产生一个带有一个单位的正电荷的缺陷,同时产生一个过剩电子,用来保证晶体整体的电中性,从而可形成过剩电子导电,提高其电导率。
通过ICP测试检测出四种材料中V元素的量x如表1所示。从表中可以看出刚开始反应原料中V的加入量分别为0.05、0.1、0.2,但通过测试可知产物中V的掺入量分别为0.034、0.069、0.134,掺入量明显减少了。原因可能是合成过程温度很高(1250℃),导致有一部分钒挥发损失所致。
图2是Mg1.03–0.5xMn0.97–xVxSiO4(x = 0、0.034、0.069和0.134)四种材料的红外光谱图,图中1640 cm–1和3450 cm–1附近出现的峰为水的吸收峰,这是由于样品吸附空气中少量水所致。在450~1200 cm–1范围中的峰是Mg1.03Mn0.97SiO4分子内 四种振动模式形成的峰[29]。比较掺杂V前后样品的红外吸收光谱图,可以发现,掺杂量为0.034和0.069样品的谱峰与Mg1.03Mn0.97SiO4的谱峰没有明显的变化,表明少量的V掺杂并不影响Mg1.03Mn0.97SiO4的结构。而当V的掺杂量增加到0.134时,900 cm–1附近的峰变得尖锐,说明V的掺入引起了分子中Si-O键的变化;且在2335 cm–1附近出现了一个新峰,结合XRD结果,这可能与存在的杂质相有关。
四种振动模式形成的峰[29]。比较掺杂V前后样品的红外吸收光谱图,可以发现,掺杂量为0.034和0.069样品的谱峰与Mg1.03Mn0.97SiO4的谱峰没有明显的变化,表明少量的V掺杂并不影响Mg1.03Mn0.97SiO4的结构。而当V的掺杂量增加到0.134时,900 cm–1附近的峰变得尖锐,说明V的掺入引起了分子中Si-O键的变化;且在2335 cm–1附近出现了一个新峰,结合XRD结果,这可能与存在的杂质相有关。
图3显示了Mg1.03–0.5xMn0.97–xVxSiO4(x = 0、0.034、0.069和0.134)四种材料的扫描电子显微镜图片(SEM)。很明显,通过高温固相法制得的材料形貌不规则,颗粒较大。其中未掺杂Mg1.03Mn0.97SiO4的颗粒粒径约为几个微米(图3(a))。加入钒后,材料的颗粒粒径减小(分别为图3(b),3(c),3(d))。而且,材料颗粒随钒掺入量的增加而减小,颗粒变得均匀。与锂离子电池正极材料聚阴离子型化合物LiMPO4相同,Mg1.03Mn0.97SiO4具有较低的电子和离子导电性,颗粒尺寸对材料的电化学
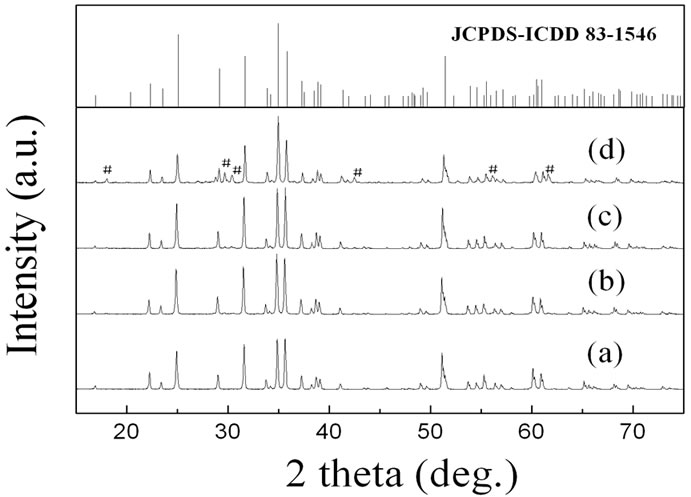
Figure 1. XRD patterns of Mg1.03–0.5xMn0.97–xVxSiO4, (a) x = 0, (b) x = 0.05, (c) x = 0.1, (d) x = 0.2, and Mg1.03Mn0.97SiO4 standard pattern JCPDS-ICDD 83-1546
图1. 制备得到Mg1.03–0.5xMn0.97–xVxSiO4的XRD图谱,其中(a) x = 0,(b) x = 0.05,(c) x = 0.1,(d) x = 0.2,以及Mg1.03Mn0.97SiO4的标准谱图(JCPDS-ICDD 83-1546)
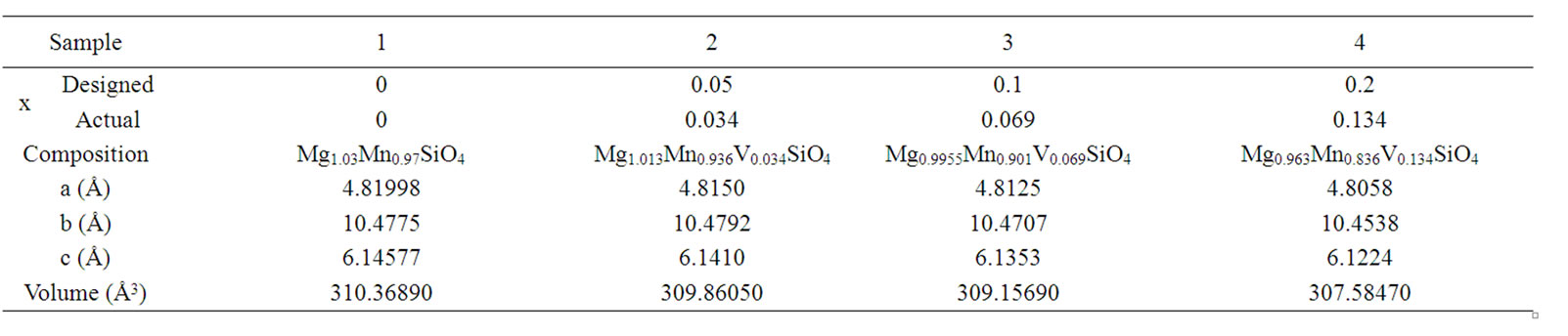
Table 1. Lattice parameters and compositions of Mg1.03–0.5xMn0.97–xVxSiO4
表1. Mg1.03–0.5xMn0.97–xVxSiO4的晶格参数和组成
性能具有重要影响。减小颗粒尺寸可缩短充放电过程中镁离子在Mg1.03Mn0.97SiO4颗粒中的扩散距离,从而提高材料的离子导电性,加快电化学反应速度,改善材料的充放电动力学特性。可以看到,加入钒不仅能够提高材料的电导率,而且起到了抑制材料颗粒长大的作用。
图4为Mg1.03–0.5xMn0.97–xVxSiO4(x = 0、0.034、0.069和0.134)材料的循环伏安曲线。4种材料的循环伏安曲线中均有两对氧化还原峰,分别标记为A、A’和B、B’,依次对应于镁离子在M1和M2不同位点上的脱出、嵌入过程[18,19]。由于掺杂的V进入了Mg1.03Mn0.97SiO4的晶格中,占据部分Mn的位置,可引起Mg1.03Mn0.97SiO4脱嵌镁性能的变化。如图可见,与纯Mg1.03Mn0.97SiO4相比,钒掺杂后的材料氧化还原峰型、两峰的相对强度发生了变化。特别是掺杂材料表现出较大的电流密度和较高的峰值电位,且峰间距降低。说明Mg1.03Mn0.97SiO4材料经V掺杂后,替换了部分Mn的位置,使镁离子脱出嵌入过程有些变化;镁离子电化学脱、嵌过程动力学速度加快,可逆性提高,且具有较大的容量和较高的平台电压。但除了A、A’和B、B’峰之外,没有出现新的氧化–还原峰,说明掺入的V3+没有电化学活性,可能是因为所在的电化学窗口范围较低的缘故。
循环伏安之后的Mg1.03–0.5xMn0.97–xVxSiO4(x = 0、0.034、0.069和0.134)材料的交流阻抗测试结果如图5所示。四种材料的曲线相似,均由高频区的半圆和低频区的斜率线组成。半圆代表电化学反应过程中的电荷转移阻抗,斜线代表Mg2+扩散控制的Warburg阻抗。与纯Mg1.03Mn0.97SiO4材料相比,掺杂V后材料对应的半圆直径明显减小。由此可见,掺杂V可提高材料的电导率,降低电化学反应阻抗,提高表面电荷传递速度,从而有利于提高材料的倍率性能和循环稳定性。
Mg1.03–0.5xMn0.97–xVxSiO4(x = 0、0.034、0.069和0.134)的充放电性能测试采用CR2016扣式模拟电池。
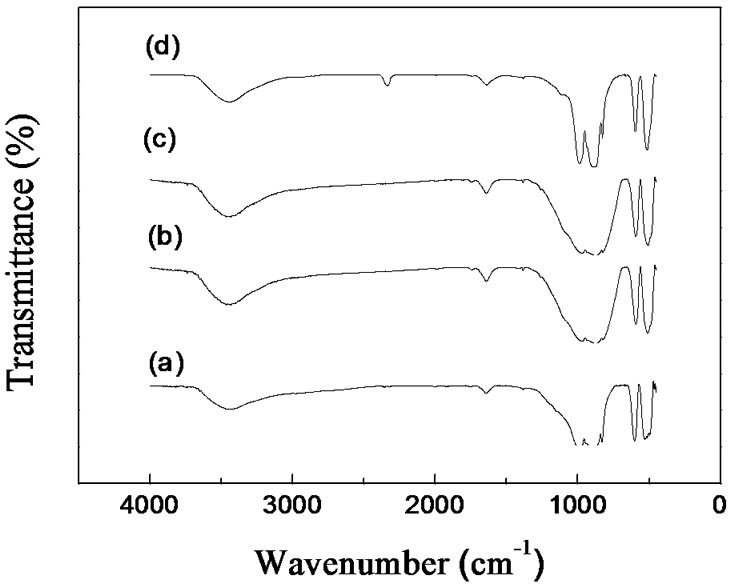
Figure 2. The FTIR spectra of Mg1.03Mn0.97SiO4 (a); Mg1.013Mn0.936V0.034SiO4 (b); Mg0.9955Mn0.901V0.069SiO4 (c); Mg0.963Mn0.836V0.134SiO4 (d)
图2. Mg1.03Mn0.97SiO4 (a);Mg1.013Mn0.936V0.034SiO4 (b);Mg0.9955Mn0.901V0.069SiO4 (c);Mg0.963Mn0.836V0.134SiO4 (d)的红外谱图

Figure 3. The SEM images of Mg1.03Mn0.97SiO4 (a); Mg1.013Mn0.936V0.034SiO4 (b); Mg0.9955Mn0.901V0.069SiO4 (c); Mg0.963Mn0.836V0.134SiO4 (d)
图3. Mg1.03Mn0.97SiO4 (a);Mg1.013Mn0.936V0.034SiO4 (b);Mg0.9955Mn0.901V0.069SiO4 (c);Mg0.963Mn0.836V0.134SiO4 (d)的SEM图

Figure 4. Cyclic voltammograms of Mg1.03–0.5xMn0.97–xVxSiO4 (x = 0, 0.034, 0.069 and 0.134) at a scan rate of 0.5 mV·s–1
图4. Mg1.03–0.5xMn0.97–xVxSiO4(x = 0、0.034、0.069和0.134)材料的循环伏安曲线,扫描速度为0.5 mV·s–1
由于电池在前几次充放电过程中,可能会发生与电解液相关的一些副反应,为了避免其影响电池的放电容量,实验测试几次循环,选择稳定容量作为判断依据。图6为0.01 C(3.14 mA/g)下四种材料的放电曲线。可以看到,由高温固相法制得的Mg1.03Mn0.97SiO4的放电比容量只有40.4 mAh/g,其放电电压平台分别在1.62 V和0.8 V左右,这两个放电平台与循环伏安测试中的两个峰相对应,分别为镁离子在M1和M2两个不同位点上的脱出过程。通过钒掺杂后放电容量分别可以达到122.6 mAh/g(x = 0.034)、139.8 mAh/g(x = 0.069)和97.2 mAh/g(x = 0.134),并且1.62 V的放电平台可提高到1.65V。可以看到,掺杂V后,Mg1.03Mn0.97SiO4材料的放电容量均有了明显的提高,其中,当掺杂量较小时,随V掺杂量的增加,放电容量依次增大;而当掺杂量为0.134时,材料中由于存在杂质影响了其电化学性能。
图7为纯Mg1.03Mn0.97SiO4 和掺钒量为0.069的Mg0.9955Mn0.901V0.069SiO4材料在0.02 C下的循环性能结果。从图中可以看出,由高温固相方法制备的Mg1.03Mn0.97SiO4材料在0.02 C下容量快速降低;而Mg0.9955Mn0.901V0.069SiO4的放电容量与Mg1.03Mn0.97SiO4材料相比提高不多,但容量随循环次数的衰减却改善很多。一般认为,掺杂离子的电负性是影响正极材料电化学性能的一个重要因素[30]。V3+与Mn2+具有相同的电负性(均为1.4),容易掺入Mg1.03Mn0.97SiO4晶格中。而且,V与Mn拥有不同的稳定化合价,容易在Mg1.03Mn0.97SiO4中形成缺陷,改变原来的能带结构,使载流子数量和迁移率的发生改变,提高电导率,
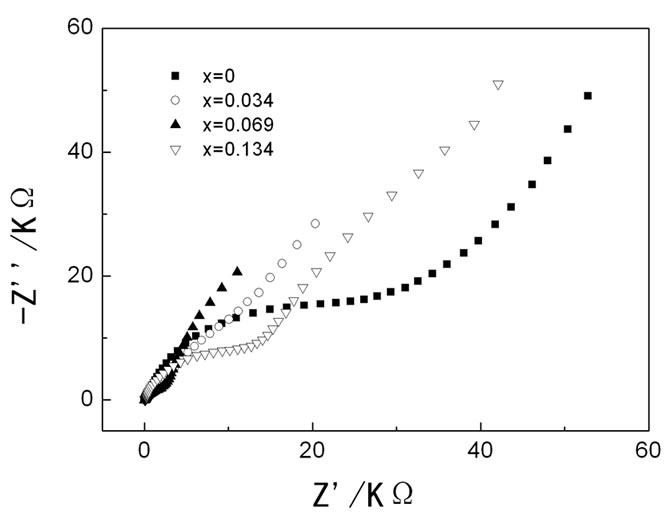
Figure 5. Impedance spectra of Mg1.03–0.5xMn0.97–xVxSiO4 (x = 0, 0.034, 0.069 and 0.134) after CV measurements
图5. 循环伏安后Mg1.03–0.5xMn0.97–xVxSiO4(x = 0、0.034、0.069和0.134)的交流阻抗结果
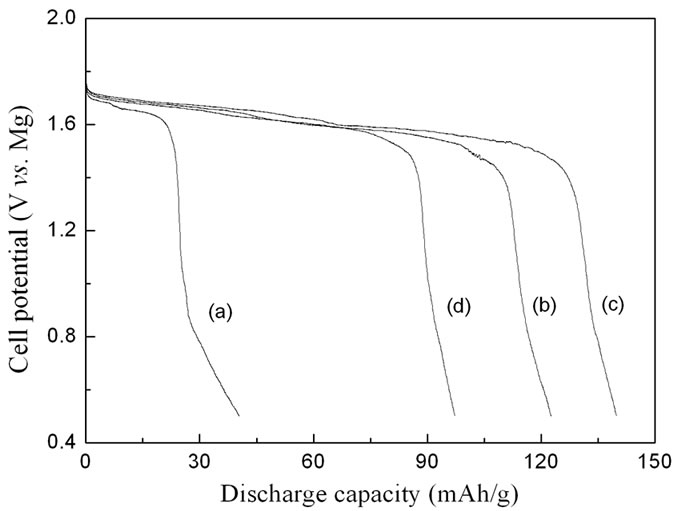
Figure 6. The typical discharge curves of Mg1.03Mn0.97SiO4 (a), Mg1.013Mn0.936V0.034SiO4 (b), Mg0.9955Mn0.901V0.069SiO4 (c), Mg0.963Mn0.836V0.134SiO4 (d) at a rate of 0.01 C
图6. Mg1.03Mn0.97SiO4 (a), Mg1.013Mn0.936V0.034SiO4 (b), Mg0.9955Mn0.901V0.069SiO4 (c), Mg0.963Mn0.836V0.134SiO4 (d)在0.01 C下的放电曲线
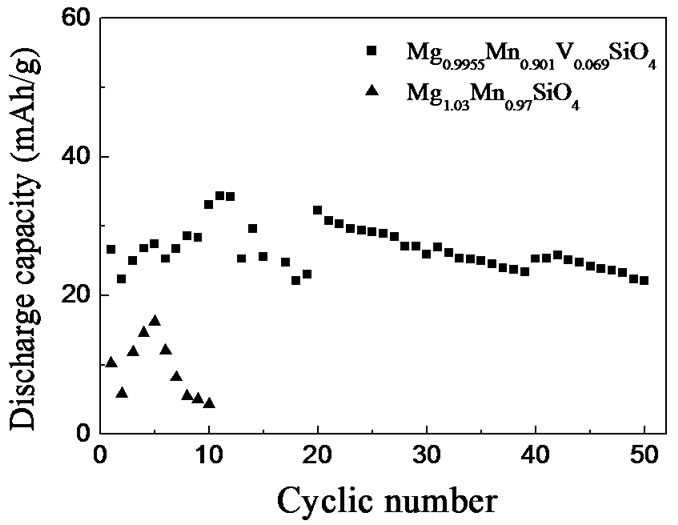
Figure 7. The discharge capacity versus cyclic number curves for Mg1.03Mn0.97SiO4 and Mg0.9955Mn0.901V0.069SiO4 at 0.02 C
图7. Mg1.03Mn0.97SiO4和Mg0.9955Mn0.901V0.069SiO4 在0.02 C下的循环性能
从而得到电化学性能提高的结果。但由于高温固相方法制备的钒掺杂材料颗粒形貌不规则,颗粒粒径较大、粒径不均匀,电化学性能可通过改变制备方法得到结晶性好、颗粒形貌规则、分散性好、粒度均匀的纳米材料来加以改善。另外,需要指出的是,硅酸锰镁正极材料的电化学性能还受制于Mg(AlCl2BuEt)2/THF电解液较低的抗氧化能力,研发与硅酸锰镁材料相匹配的具有更高阳极氧化分解电压的电解液体系也至关重要。
4. 结论
采用高温固相法成功制备了高结晶性的 Mg1.03–0.5xMn0.97–xVxSiO4(x = 0、0.034、0.069和0.134)可充镁电池正极材料。掺杂的V可进入Mg1.03Mn0.97SiO4晶格内部,降低材料颗粒尺寸,提高材料的导电性;从而不仅能够提高材料的放电容量和循环稳定性,而且可以提高放电电压平台并减小充放电极化。当x = 0.069时,0.01C充放电下,放电容量可达到为139.8 mAh/g,远大于未掺杂的Mg1.03Mn0.97SiO4(40.4 mAh/g),并且1.62 V的放电平台可提高到1.65 V。
5. 致谢
感谢国家自然科学基金(20603022, 20973112)的资助。
参考文献 (References)
[1] D. Aurbach, Z. Lu, A. Schechter, Y. Gofer, H. Gizbar, R. Turgeman, Y. Cohen, M. Moshkovich and E. Levi. Prototype systems for rechargeable magnesium batteries. Nature, 2000, 407: 724-727.
[2] 袁华堂, 吴峰, 武绪丽, 李强. 可充镁电池的研究和发展趋势[J]. 电池, 2002, 32(S1): 14-17.
[3] 冯真真, 努丽燕娜, 王久林, 杨军. 镁二次电池研究进展[J]. 化学与物理电源系统, 2007, 1: 73.
[4] P. Novák, R. Imhof and O. Haas. Magnesium insertion electrodes for rechargeable nonaqueous batteries: A competitive alternative to lithium. Electrochimica Acta, 1999, 45: 351-367.
[5] 郑育培, 努丽燕娜, 杨军, 陈强, 王久林. 可充镁电池正极材料研究进展[J]. 化工进展, 2011, 30(5): 1024-1032.
[6] M. D. Levi, E. Lancry, H. Gizbar, Z. Lu, E. Levi, Y. Gofer and D. Aurbach. Kinetic and thermodynamic studies of Mg2+ and Li+ ion insertion into the Mo6S8 Chevrel Phase. Journal of the Electrochemical Society, 2004, 151: A1044-A1051.
[7] M. D. Levi, E. Lancri, E. Levi, H. Gizbar, Y. Gofer and D. Aurbach. The effect of the anionic framework of Mo6X8 Chevrel phase (X = S, Se) on the thermodynamics and the kinetics of the electrochemical insertion of Mg2+ ions. Solid State Ionics, 2005, 176: 1695-1699.
[8] D. Aurbach, G. S. Suresh, E. Levi, A. Mitelman, O. Mizrahi, O. Chusid and M. Brunelli. Progress in rechargeable magnesium battery technology. Advanced Materials, 2007, 19: 4260-4267.
[9] G. Suresh, M. Levi and D. Aurbach. Effect of chalcogen substitution in mixed Mo6S8–nSen (n = 0, 1, 2) Chevrel phases on the thermodynamics and kinetics of reversible Mg ions insertion. Electrochimica Acta, 2008, 53: 3889-3896.
[10] N. Amir, Y. Vestfrid, O. Chusid, Y. Gofer and D. Aurbach. Progress in nonaqueous magnesium electrochemistry. Journal of Power Sources, 2007, 174: 1234-1240.
[11] A. Mitelman, M. D. Levi, E. Lancry, E. Levi and D. Aurbach. New cathode materials for rechargeable Mg batteries: Fast Mg ion transport and reversible copper extrusion in CuyMo6S8 compounds. Chemical Communications, 2007: 4212-4214.
[12] E. Levi, A. Mitelman, D. Aurbach and M. Brunelli. Structural mechanism of the phase transitions in the Mg-Cu-Mo6S8 system probed by ex situ synchrotron X-ray diffraction. Chemistry of Materials, 2007, 19: 5131-1542.
[13] Z. L. Tao, L. N. Xu, X. L. Gou, J. Chen and H. T. Yuan. TiS2 nanotubes as the cathode materials of Mg-ion batteries. Chemical Communications, 2004, 18: 2080-2081.
[14] Y. L. Liang, R. J. Feng, S. Q. Yang, H. Ma, J. Liang and J. Chen. Rechargeable Mg batteries with Graphene-like MoS2 cathode and ultrasmall Mg nanoparticle anode. Advanced Materials, 2011, 23: 640-643.
[15] L. F. Jiao, H. T. Yuan, Y. J. Wang, J. S. Cao and Y. M. Wang. Mg intercalation properties into open-ended vanadium oxide nanotubes. Electrochemistry Communications, 2005, 7: 431-436.
[16] L. F. Jiao, H. T. Yuan, Y. C. Si, Y. J. Wang and Y. M. Wang. Synthesis of Cu0.1-doped vanadium oxide nanotubes and their application as cathode materials for rechargeable magnesium batteries. Electrochemistry Communications, 2006, 8: 1041-1044.
[17] Z. Z. Feng, J. Yang, Y. N. Nuli and J. L. Wang. Sol-gel synthesis of Mg1.03Mn0.97SiO4 and its electrochemical intercalation behavior. Journal of Power Sources, 2008, 184: 604-609.
[18] Z. Z. Feng, J. Yang, Y. N. Nuli, J. L. Wang and X. J. Wang. Preparation and electrochemical study of a new magnesium intercalation material Mg1.03Mn0.97SiO4. Electrochemistry Communications, 2008, 10: 1291-1294.
[19] Y. N. Nuli, J. Yang, J. L. Wang and Y. L. Li. Electrochemical intercalation of Mg2+ in magnesium manganese silicate and its application as high-energy rechargeable magnesium battery cathode. Physical Chemistry C, 2009, 113: 12594-12597.
[20] Y. N. Nuli, J. Yang, Y. S. Li and J. L. Wang. Mesoporous magnesium manganese silicate as cathode materials for rechargeable magnesium batteries. Chemical Communications, 2010, 46: 3794-3796.
[21] Y. N. Nuli, Y. P. Zheng, F. Wang, J. Yang, A. I. Minett, J. L. Wang and J. Chen. MWNT/C/Mg1.03Mn0.97SiO4 hierarchical nanostructure for superior reversible magnesium ion storage. Electrochemistry Communications, 2011, 13: 1143-1146.
[22] S. Y. Chuang, Y. M. Chiang. Electronically conductive phosphoolivines as lithium storage electrodes. Nature Materials, 2002, 2: 123-128.
[23] C. S. Sun, Z. Zhou, Z. G. Xu, D. G. Wang, J. P. Wei, X. K. Bian and J. Yan. Improved high-rate charge/discharge performances of LiFePO4/C via V-doping. Journal of Power Sources, 2009, 193: 841-845.
[24] J. Hong, C. S. Wang, X. Chen, S. Upreti and M. S. Whittingham. Vanadium modified LiFePO4 cathode for Li-ion batteries. Electrochemical and Solid-State Letters, 2009, 12: A33-A38.
[25] J. Kim, Y. U. Park, D. H. Seo, J. Kim, S. W. Kim and K. Kang. Mg and Fe Co-doped Mn based olivine cathode material for high power capability. Journal of the Electrochemical Society, 2011, 158: A250-A254.
[26] F. Wang, J. Yang, Y. N. Nuli and J. L. Wang. Highly promoted electrochemical performance of 5V LiCoPO4 cathode material by addition of vanadium. Journal of Power Sources, 2010, 195: 6884-6887.
[27] D. Aurbach, A. Schechter, M. Moshkovich and Y. Cohen. On the mechanisms of reversible magnesium deposition processes. Journal of the Electrochemical Society, 2001, 148: A1004-A1014.
[28] C. A. Francis, P. H. Ribbe. The forsterite-tephroite series: I. Crystal structure refinements. American Mineralogist, 1980, 65, 1263-1269.
[29] A. M. Pires, M. R. Davolos. Luminescence of europium(III) and manganese(II) in barium and zinc orthosilicate. Chemistry of Materials, 2001, 13: 21-27.
[30] 刘芳凌, 韩绍昌, 陈晗, 于文志, 白咏梅. 掺杂离子价态对LiFePO4电化学性能的影响[J]. 电源技术, 2009, 33(5): 399-405.
NOTES
*资助信息:国家自然科学基金(20603022, 20973112),和教育部留学回国人员科研启动基金(第39批)。
#通讯作者。