Hans Journal of Biomedicine
Vol.2 No.1(2012), Article ID:484,5 pages DOI:10.12677/hjbm.2012.21001
Experimental Research on the Vitro Inactivation of HL60 Cells Based on CdTe and CdSe Quantum Dots
Laboratory of Quantum Information Technology, School of Physics and Telecommunication Engineering, South China Normal University, Guangzhou
Email: heyulu198707@126.com, *jwxiong@scnu.edu.cn
Received: Sep. 30th, 2011; revised: Nov. 6th, 2011; accepted: Nov. 9th, 2011.
ABSTRACT:
Quantum dots used to destruct the cancer cells through the photocatalytic reaction has caused great attention in recent years. In the paper, thiol-capped CdTe and CdSe QDs were used to destruct the HL60 cells. The results showed that the best light irradiation dose of CdTe and CdSe were 15 J/cm2 and 18 J/cm2. The best concentration of additive QDs were all 2.0 µmol/L. The inactivation efficiency were 62.7% and 83.0% under the best destruction parameters, respectively. Additionally, the destruction efficiency of CdSe is better than that of CdTe in the optimized conditions.
Keywords: CdSe; CdTe; Quantum Dots (QDs); Photodynamic Therapy (PDT); CCK-8
基于CdTe和CdSe量子点体外PDT灭活白血病 HL60细胞实验研究
贺宇路,黄康强,姜 飞,王 健,熊建文*
华南师范大学物理与电信工程学院,量子信息技术重点实验室,广州
Email: heyulu198707@126.com, *jwxiong@scnu.edu.cn
摘 要:
近年来,随着光动力疗法基础研究的不断深入,量子点作为潜在的光敏剂对癌细胞的灭活效应引起了人们的极大关注,实验利用羧基乙酸包覆的量子点CdTe和CdSe进行了QDs-PDT体外灭活HL60细胞的实验研究。实验结果表明:CdTe和CdSe的对HL60细胞灭活的最佳光照剂量分别为15 J/cm2和18 J/cm2,最佳作用浓度均为2.0 µmol/L;在最佳作用参数下两者的灭活效率分别为62.7%,83.0%,基于CdSe的QDs-PDT灭活效率优于CdTe。
收稿日期:2011年9月30日;修回日期:2011年11月6日;录用日期:2011年11月9日
关键词:CdSe;CdTe;量子点(QDs);光动力疗法(PDT);CCK-8
1. 引言
光动力疗法(photo dynamic therapy,PDT)是借助光敏剂进入患者体内后,动态浓集于生长异常的组织(如肿瘤、鲜红斑痣及黄斑病变),后者在一定波长光辐照下,因其所摄入光敏剂发生光动力敏化反应而产生活性氧物质,导致生物大分子光氧化失活,并由此造成细胞器损伤而破坏目标组织以达到治疗目的的方法[1-3]。在光动力疗法中,由于肿瘤等在人体中的深浅不一,使得传统光敏剂的应用受到限制,而量子点由于其尺寸效应,使其吸收光谱能够被调节去匹配深浅不同的肿瘤的需要[4,5]。量子点直接作为光敏剂或用于能量转移提高传统光敏剂的光动力疗效已初见成效[6,7]。
用于光动力疗法中的量子点必须具有亲水性,生物相容性[8,9]。研究证明量子点外包覆一层羧基乙酸或羧基丙酸,不仅可以使量子点具有水溶性,还可以在生物细胞内产生活性氧[10,11],这将会提高量子点在光动力疗法中的灭活效率。量子点CdTe因此本文主要利用巯基乙酸包覆的量子点CdSe和CdTe进行了QDs-PDT体外灭活HL60细胞的实验研究。
2. 实验材料
羧基乙酸做外包覆的CdSe量子点(CdSe/HSCH2-COOH,核半径为4.8 nm,包覆后约为10 nm),羧基乙酸做外包覆的CdTe量子点(核半径4 nm,包覆后约为9 nm)。HL60(中山大学实验动物中心细胞库提供),CCK-8试剂(日本同仁化学),PDT反应室(自行设计,以大功率LED作为光源),F-4500荧光分光光度仪(日本日立),DG5031型酶联免疫检测仪(南京华东电子),96孔培养板,细胞计数板及其他常规器皿。
3. 实验方法
3.1. 细胞培养
HL60细胞接种于装有1640培养液的培养瓶中,置于CO2体积分数为5%,空气湿度为95%,环境温度为37℃的培养箱中培养。取对数生长期(即生命力最旺盛时期)的细胞进行实验。
3.2. 细胞活性检测
采用与传统的细胞活性检测方法MTT法相比,操作方便、简洁、灵敏度高、重复性好的CCK-8(Cell Counting Kit-8)法[12,13]对细胞进行活性检测,降低实验误差。
3.3. 光谱分析
量子点CdTe和CdSe的吸收光谱如图1所示,两种量子点的吸收波长都集中在400~500 nm之间,而且在这一波段,CdSe量子点的吸收明显大于CdTe,同时,为了避免近紫外光对细胞本身的损伤,实验中采用中心波长在450 nm的蓝光LED作为PDT实验光源。自行设计的,发射波峰在450 nm附近的蓝光LED光反应室,很好的满足了实验中对PDT光源单色性好,光源面积大,光功率稳定,热效应变化不明显的要求[14]。
4. 实验设计
4.1. 基于CdTe和CdSe的QDs-PDT疗法对HL60细胞灭活的最佳参数研究
在96孔培养板上根据实验内容规划实验孔(包括调零孔、对照孔),同一实验条件设三个重复孔。取对数生长期的HL60细胞接种于96孔培养板上设定的实验孔,每孔接种100 µl(调零孔除外),并加适量体积的已配好的量子点溶液和培养液,确保每孔的总体积为200 µl,调零孔中只含200 µl培养液。放入培养箱中培养一定时间,需要PDT的实验孔在光反应室接受光辐照,然后继续培养一定时间后在每个实验孔加20 µl CCK-8试剂,培养四小时后,用酶联免疫检测仪测各孔OD值。
在实验中HL60细胞的终值浓度为1 × 105个/ml,羧基乙酸修饰的量子点CdTe和CdSe的终值浓度分别各设置为五组:1 µmol/L、1.5 µmol/L、2.0 µmol/L、2.5 µmol/L、3.0 µmol/L,辐照光功率为5 mW/cm2,光照剂量分别为12 J/cm2、15 J/cm2、18 J/cm2、21 J/cm2。
4.2. 最佳作用参数下CdTe和CdSe对HL60细胞灭活效率的比较
对比最佳光照剂量参数(CdTe为15 J/cm2,CdSe为18 J/cm2)下,四种量子点浓度情况时(1.0 µmol/L,1.5 µmol/L,2.0 µmol/L,2.5 µmol/L),量子点CdTe和
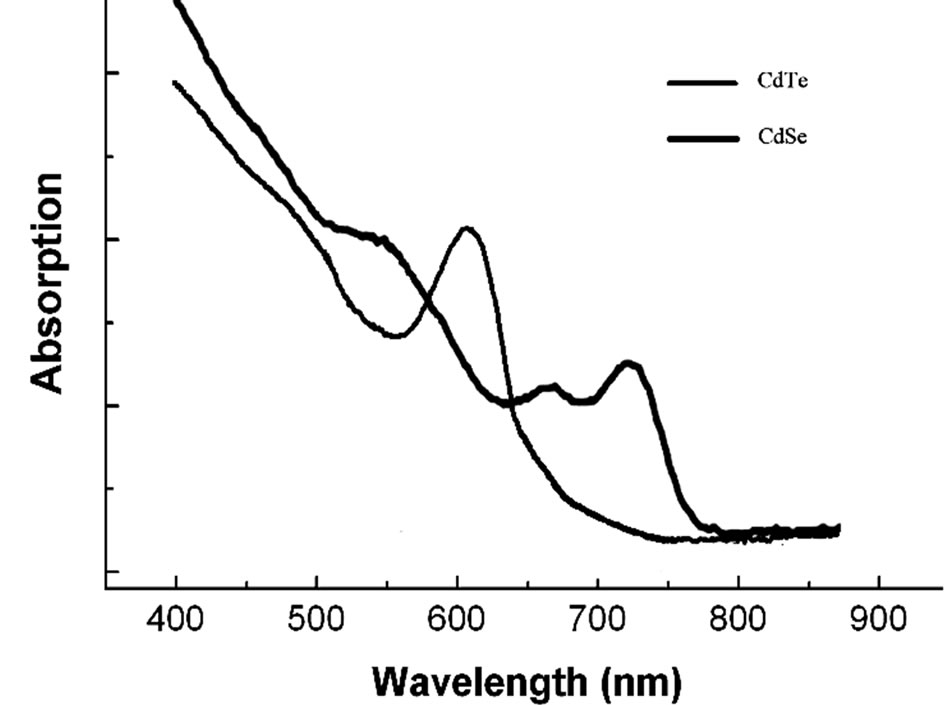
Figure 1. Absorption spectra of thiol-capped CdTe and CdSe QDs
图1. 羧基乙酸修饰的量子点CdTe和CdSe的吸收光谱
CdSe对HL60细胞的灭活效率。
对比量子点最佳作用浓度(CdTe和CdSe均为2.0µmol/L)下,光照剂量为12 J/cm2,15 J/cm2,18 J/cm2和21 J/cm2时CdTe和CdSe的灭活效率。
4.3. 统计学处理
n = 3,数值采用均数 ± 标准差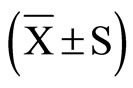 表示。SPSS11.5统计软件进行多样本均数两两比较的方差分析。P < 0.05为有统计学差异。
表示。SPSS11.5统计软件进行多样本均数两两比较的方差分析。P < 0.05为有统计学差异。
5. 实验结果与分析
5.1. 基于CdTe和CdSe的QDs-PDT疗法体外灭活HL60细胞的最佳参数
5.1.1. 基于CdTe的QDs-PDT疗法体外灭活HL60细胞的最佳参数
利用CCK-8法测量HL60细胞在添加不同浓度的量子点CdTe并光照不同时间后的OD值,测的实验数据如下表(表1)。
灭活HL60细胞的效率用Pe表示
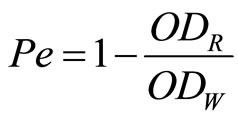
其中,ODR表示光照后细胞的OD值,ODW表示不光照时的细胞OD值。
图2表明,在相同量子点浓度条件下,随着光照剂量的增加,PDT效率越显著,但当光照剂量超过15 J/cm2,即光照时间为50 min时,PDT效率增加不明显,考虑到光剂量太大对正常细胞的灭杀也会增加[15],因此15 J/cm2 (P < 0.05)是本实验的最佳光照剂量参数。
图3表明,在光照剂量相同放入条件下,随着CdTe浓度的增加,PDT效应越显著,CdTe浓度超过2.0 µmol/L时,由于量子点浓度接近饱和,PDT效应增加不明显,因此浓度为2.0 µmol/L (P < 0.05)为本实验的最佳量子点作用浓度。
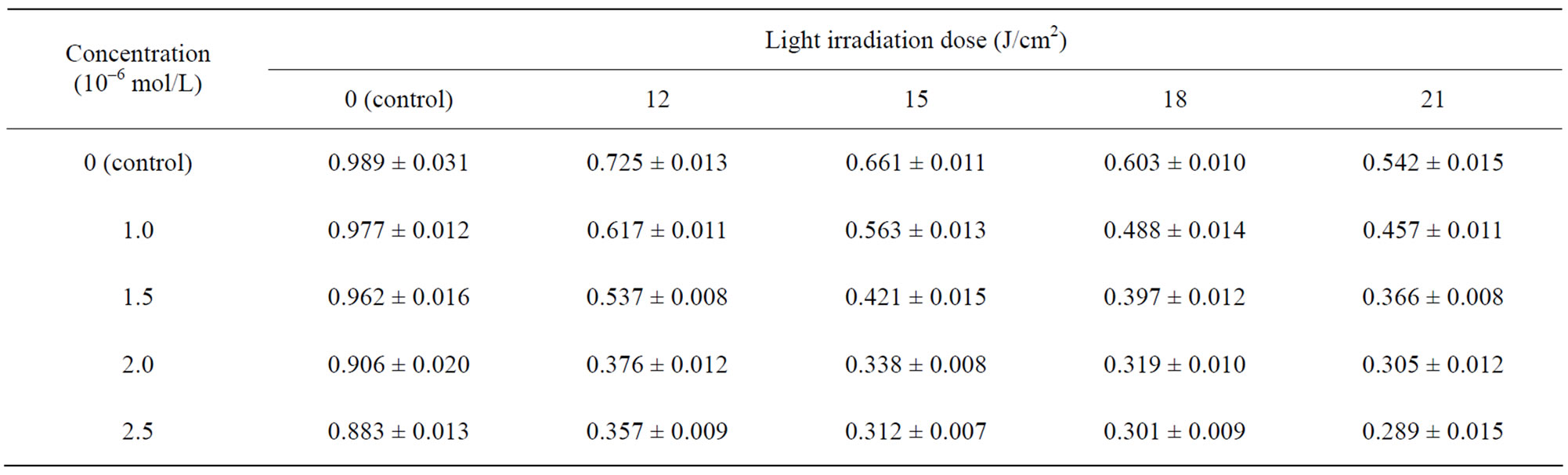
Table 1. The influence of CdTe concentration and light dosage to OD values of HL60 cells
表1. 不同CdTe浓度和不同光照剂量PDT对HL60细胞OD值的影响
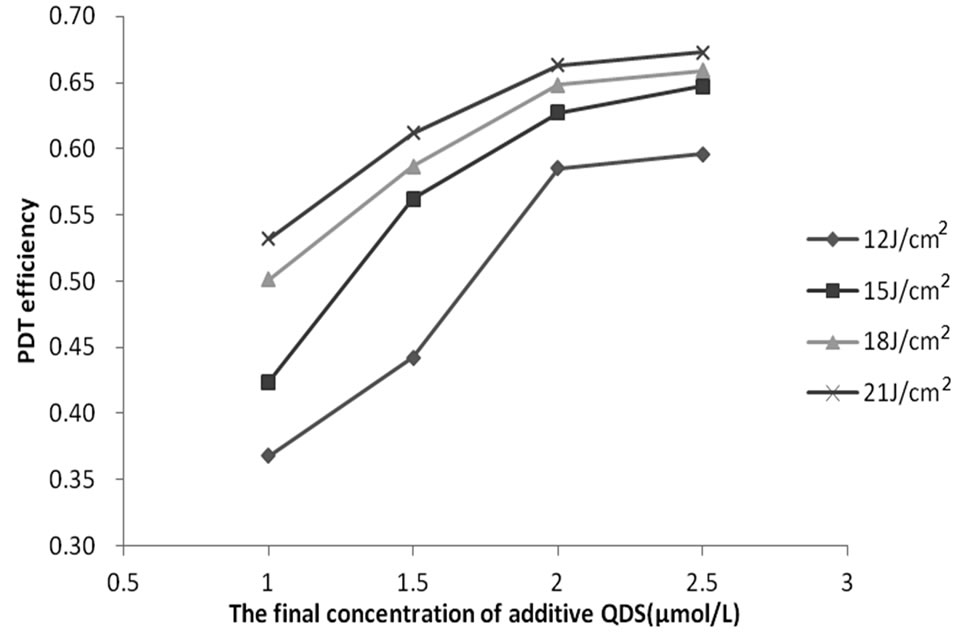
Figure 2. The influence of light dosage to CdTe-PDT efficiency
图2. 不同光照剂量下量子点CdTe的PDT效率
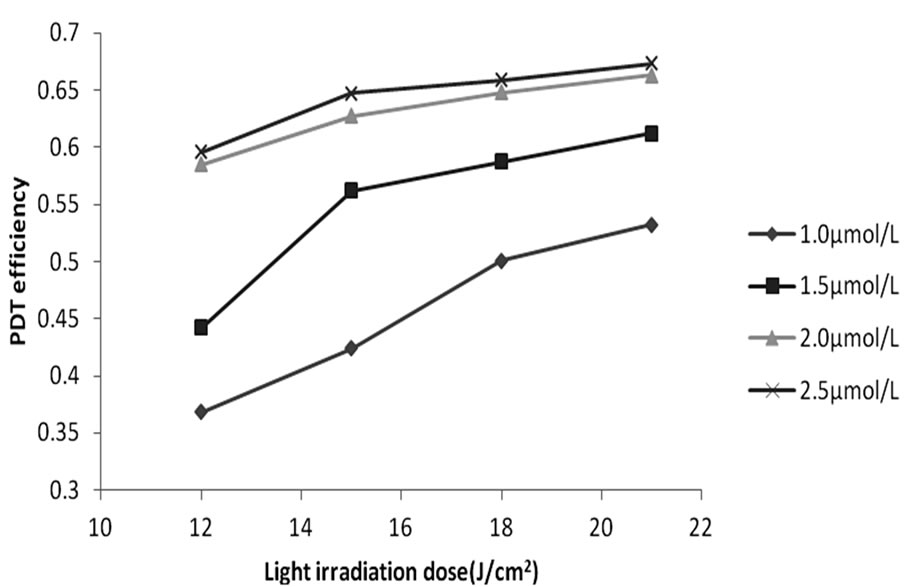
Figure 3. The influence of CdTe concentration to CdTe-PDT efficiency
图3. 不同浓度CdTe作用下的QDs-PDT效率
5.1.2. 基于CdSe的QDs-PDT疗法体外灭活HL60细胞的最佳参数
在相同的实验参数下,利用CCK-8法测量HL60细胞在添加不同浓度的量子点CdSe并光照不同时间后的OD值,测的实验数据如下表(表2):
同理,由图4和5知,基于CdSe的QDs-PDT灭活HL60细胞的最佳光照剂量参数为18 J/cm2 (P < 0.05);基于CdSe的QDs-PDT灭活HL60细胞的最佳量子点作用浓度为2.0 µmol/L (P < 0.05)。
在最佳作用参数(CdTe:光照剂量15 J/cm2,量子点浓度2.0 µmol/L;CdSe:光照剂量18 J/cm2,量子点浓度2.0 µmol/L)下,基于CdTe和CdSe的QDs-PDT对HL60细胞的灭活效率分别为62.7%和83.0%.
5.2. 最佳作用参数下CdTe和CdSe对HL60细胞灭活效率的比较
图6表明,在最佳光照剂量参数(CdTe为15 J/cm2,CdSe为18 J/cm2)下,四种量子点浓度情况(1.0 µmol/L,1.5 µmol/L,2.0 µmol/L,2.5 µmol/L)时,量子点CdSe的灭活效率均明显高于量子点CdTe的灭活效率。
图7表明在量子点最佳作用浓度(CdTe和CdSe均为2.0 µmol/L)下,在光照剂量为12 J/cm2和15 J/cm2时,量子点CdTe的灭活效率高于CdSe的灭活效率但两者的PDT效率相对较低,不超过65%。当光照剂量为18 J/cm2 和21 J/cm2时,CdSe的灭活效率显著提高,并且明显高于CdTe的灭活效率。
6. 结论
本文通过实验得出基于CdTe和CdSe的体外灭活HL60细胞的最佳光照剂量分别为15 J/cm2和18 J/cm2;最佳作用浓度均为2.0 µmol/L。在量子点最佳作用参数下,CdTe和CdSe对HL60细胞的灭活效率分别为62.7%和83.0%。在最佳光照剂量参数下,四种不同量子点浓度下,量子点CdSe的灭活效率均高于量子点CdTe的灭活效率。量子点最佳作用浓度下,光照剂量不同时,CdSe的灭活效率也明显高于CdTe。综上所述,量子点CdSe的QDs-PDT效率优于量子点CdTe。

Table 2. The influence of CdSe concentration and light dosage to OD values of HL60 cells
表2. 不同CdSe浓度和不同光照剂量PDT对HL60细胞OD值的影响

Figure 4. The influence of light dosage to CdSe-PDT efficiency
图4. 不同光照剂量下量子点CdSe的PDT效率

Figure 5. The influence of CdSe concentration to CdSe-PDT efficiency
图5. 不同浓度CdSe作用下的QDs-PDT效率
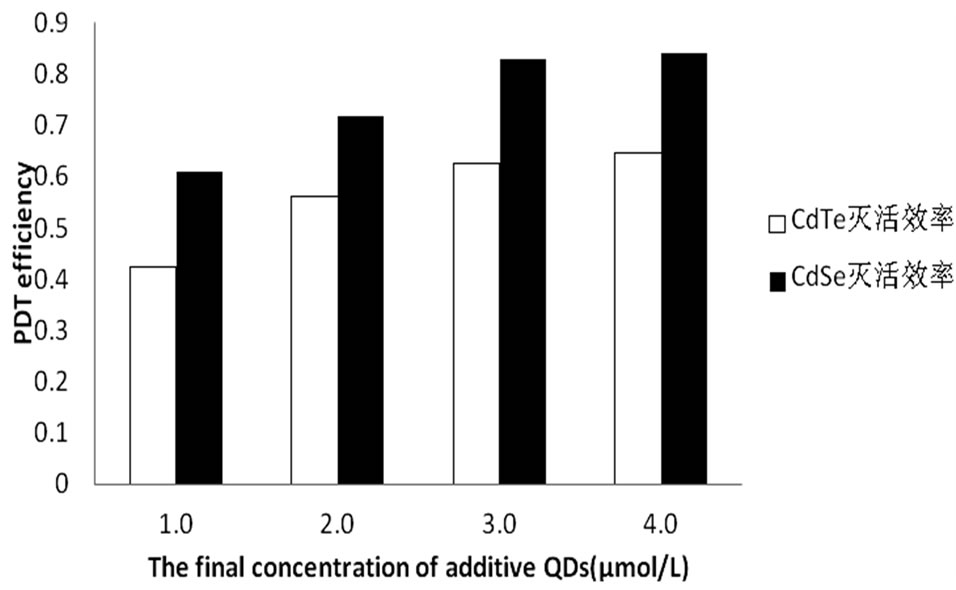
Figure 6. The inactivation efficiency of CdTe and CdSe under the best light dosage
图6. 最佳光照剂量参数下CdTe和CdSe量子点对HL60细胞灭活效率的比较
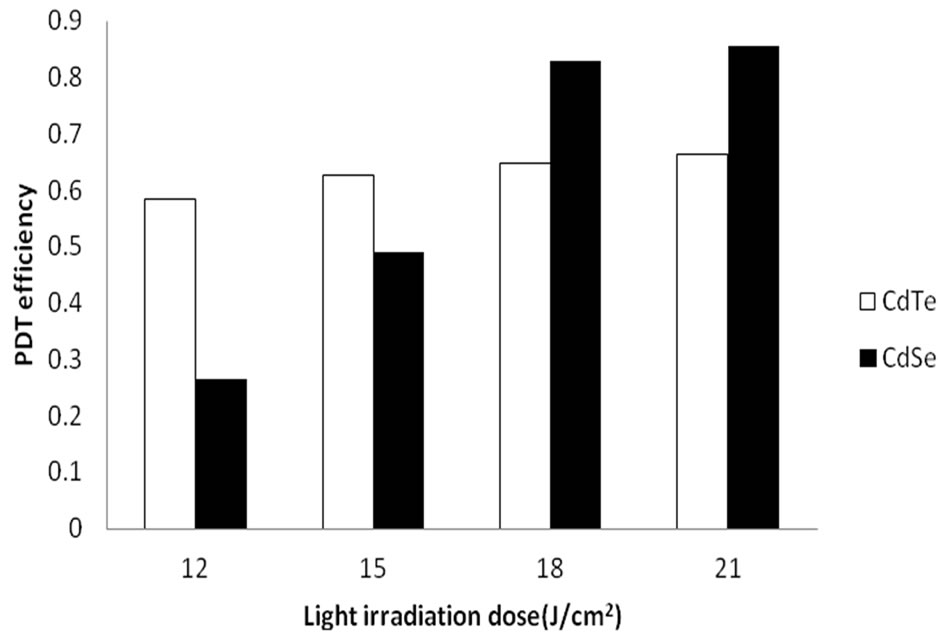
Figure 7. The inactivation efficiency of CdTe and CdSe under the best QDs concentration
图7. 最佳作用浓度下CdTe和CdSe量子点PDT效率的比较
量子点以其独特、无可比拟的物理化学特性在光动力疗法中备受关注,其作为PDT的光敏剂也呈现出良好的发展前景。但由于目前的研究主要集中在可行性的实验验证层次上,而且大多数量子点中含有重金属,其本身会对正常细胞产生一定的毒性[16],虽然通过包裹可以减小量子点的毒性,但其毒性依然存在,需要进一步的研究和评估,这也是量子点作为光敏剂应用于未来临床所必须要解决的关键问题之一。
7. 致谢
本文受到国家自然科学基金项目(61072029);广东省自然科学基金项目(10151063101000025);广州市科技计划项目(2010Y1-C111)联合资助,作者在这里表示感谢。
参考文献 (References)
[1] J. Tyrrell, S. M. Campbell and A. Curnow. Monitoring the accumulation and dissipation of the photosensitizer protoporphyrin IX during standard dermatological methyl-aminolevulinate photodynamic therapy utilizing noninvasive fluorescence imaging and quantification. Photodiagnosis and Photodynamic Therapy, 2011, 1(8): 30-38.
[2] C. P. Chang, D. J. Nagel and M. E. Zaghloul. Irradiance dependence of photobleaching of resorufin. Journal of Photochemistry and Photobiology A: Chemistry, 2011, 2(217): 430-432.
[3] J. S. Dysart, M. S. Patterson, T. J. Farrell, et a1. Relationship between mTHPC fluorescence photobleaching and cell viability during in Vitro photodynamic treatment of DP16 cells. Photochemistry Photobiology A, 2002, 2(75): 289-295.
[4] R. Bakalova, H. Ohba, Z. Zhelev, et al. Quantum dot anti2CD conjugates: Are they potential photosensitizers or potentiators of classical photosensitizing agents in photody namictherapy of cancer. Nano Letters, 2004, 9(4): 1567-1573.
[5] A. C. S. Samia, X. B. Chen and C. Burda. Semiconductor quantum dots for photodynamic therapy. Journal of the American Chemical Society, 2003, 51(125): 15736-15737.
[6] R. Generalov, S. Kavaliauskiene1, S. Westrom, et al. Entrapment in phospholipid vesicles quenches photoactivity of quantum dots. International Journal of Nanomedicine, 2011, 6: 1875-1888.
[7] S. P. Singh. Multifunctional magnetic quantum dots for cancer theranostics. Journal of Biomedical Nanotechnology, 2011, 7(1): 95-97.
[8] M. Nyk, K. Palewska, L. Kepinski, K. A. Wilk, et al. Fluorescence resonance energy transfer in a non-conjugated system of CdSe quantum dots/zinc-phthalocyanine. Journal of Luminescence, 2010, 12(130): 2487-2490.
[9] C. R. Kagan, C. B. Murray and G. Bawendim. Long-range resonance transfer of electronic excitations in close-packed Cdse quantum dot solids. Physical Review, 1996, 12(54): 8633-8643.
[10] L. Jasmina, J. C. Sung, M. Francoise, et al. Unmodified cadmium telluride quantum dots induce resctive oxygen species formation leading to multiple organelle damage and cell death. Chemistry and Biology, 2005, 11(12): 1227-1234.
[11] V. Biju, S. Mundayoor, R. V. Omkumar, et al. Bioconjugated quantum dots for cancer research: Present status, prospects and remaining issues. Biotechnology, 2010, 2(28): 199-213.
[12] H. Zeng, M. Korbelik, D. I. Mclean, et a1. Monitoring photoproduct formation and photobleaching by fuorescence spectroscopy has the potentialto improve PDT dosimetry with a verteporfin-like photosensitizer. Photochem Photobiol, 2002, 4(75): 398-405.
[13] 熊建文, 肖化, 张镇西. MTT法和CCK-8法检测细胞活性之测试条件比较[J]. 激光生物学报, 2007, 5(16): 526-531.
[14] 肖化, 熊建文, 吴继明等. ALA-PDT对白血病肿瘤细胞作用的参数研究[J]. 激光生物学报, 2004, 5(13): 353-357.
[15] D. D. Xu, W. S. C. Cho, P. Wu, et al. Photo-activated pheophorbide a inhibits the growth of prostate cancer cells. Laser Physics, 2011, 9(21): 1670-1674.
[16] Y. Han, G. Y. Xie, N. Liu, et al. Effects of CdTe quantum dots on the antioxidant enzymes activity and lipid peroxidation in testes of mice. Asian Journal of Ecotoxicology, 2010, 6(5): 894-898.
NOTES
*通讯作者。