Hans Journal of Biomedicine
Vol.05 No.03(2015), Article ID:15744,8
pages
10.12677/HJBM.2015.53004
Differentiation Ability of Periodontal Ligament Stem Cells in Different Scaffolds
Xiumei Chang1*, Yan Jin2
1Department of Stomatology, Dongguan Guangdong
2Department of Oral Histology and Pathology, School of Stomatology, The Fourth Military Medical University, Xi’an Shanxi
*通讯作者。
Email: *changxm307@163.com
Received: Jul. 1st, 2015; accepted: Jul. 18th, 2015; published: Jul. 24th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Objective: To investigate the performance of combine collagen gen and ceramic bovine bone for human periodontal ligament stem cells. Methods: Human periodontal ligament stem cells were cultured in vitro. The subsequent cell passaging was conducted in conditioned medium containing dexamethasone, beta-sodium glycerophosphate and ascorbid acid. Then the human periodontal ligament stem cells were divided into two groups: one was cultured in BBC and the other was cultured in LCM. Attachment was observed by SEM and proliferation was evaluated by cell counting, ALP was measured in vitro histochemical method, and differentiation was observed by HE stain after transplant into nude mice. Results: BBC improved the proliferation and differentiation of cells cultured in vitro, showing no difference in attachment between two groups. Conclusion: BBC can improve the proliferation and differentiation of human periodontal stem cells.
Keywords:Periodontal Ligament Stem Cells, Lyophilization Collagen Membrane, Ceramic Bovine Bone, Differentiation

不同接种条件对牙周膜干细胞体内外矿化 的影响
常秀梅1*,金岩2
1广东医学院,广东 东莞
2第四军医大学口腔医学院口腔组织病理教研室,陕西 西安
Email: *changxm307@163.com
收稿日期:2015年7月1日;录用日期:2015年7月18日;发布日期:2015年7月24日

摘 要
目的:分离培养人牙周膜干细胞(periodontal ligament stem cells,PDLSCs),观察不同接种条件下成牙能力。方法:体外培养人牙周膜干细胞,细胞与胶原凝胶混合,实验组,接种至陶瓷化骨(ceramic bovine bone, CBB),对照组接种至冻干胶原膜(lyophilization collagen membrane, LCM),矿化液连续培养2 w后,移植入免疫缺陷小鼠皮下上,培养6周取材。扫描电镜观察与材料的贴附情况,细胞计数观察细胞在材料上的粘附和增殖情况,组织化学方法检测不同支架上矿化培养后PDLSCs的碱性磷酸酶(ALP)。扫描电镜观察体外培养条件下细胞附着,基质分泌,组织学观察牙周组织形成能力。结果:扫描电镜下可见PDLSCs与CBB相容性好,细胞生长密集,长入向BBC空隙内,体内条件下,CBB组形成牙周膜–牙骨质复合体结构,LCM组未形成牙周组织。结论:体内外培养条件下,CBB均具有较好诱导作用,是牙齿组织再生研究的优势支架材料。
关键词 :牙周膜干细胞,冻干胶原膜,陶瓷化骨,分化

1. 引言
支架,微环境是组织再生的重要条件,支架维持细胞增殖的特定空间,适合的支架有助于细胞附着、增殖和分化,细胞与胞外基质相互依从、相互作用,才能维持细胞的正常形态并进行增殖、分化、迁移和信号传导等一系列生命活动 [1] 。细胞外基质复杂网络的调控和牙本质表面的羟基磷灰石结构是牙根发育期牙周膜干细胞分化的重要条件。牙周组织缺损时再生细胞失去了附着的支撑,研究适合的支架材料和最佳的接种条件一直组织再生研究的主要内容之一,本组研究不同支架材料和接种条件对牙周膜干细胞分化和形成牙齿组织的作用。
2. 材料和方法
2.1. 主要试剂和仪器
DMEM培养液、牛脑垂体提取物(BPE)、胎牛血清(Sigma公司,美国),倒置显微镜(Olympus公司,日本),8-甘油磷酸钠(Sigma公司,美国),I胶原酶、胰蛋白酶(Gibco公司,美国),超净工作台(苏州净安泰空气技术有限公司),CO2孵箱(Heraeus公司,德国),高速低温离心机(Kubota2100公司,日本)。
2.2. 方法
2.2.1. 样本采集
样本取自2012年10月~11月于广东医学院附属医院口腔科,因正畸治疗需要拔除的新鲜正常第一前磨牙(患者年龄11~14岁,已获知情同意)。所有研究对象均无全身系统性疾病。
2.2.2. 牙周膜细胞培养,方法同文献 [2]
将收集的牙齿在含10%双抗的DMEM培养瓶,封瓶口后立即送往实验室。在超净工作台内用含双抗的PBS自根尖至牙冠反复冲洗,用锐利尖刀片充分刮除牙颈部牙龈组织,含双抗的PBS冲洗后,加入0.25%胶原酶5 ml,置5% CO2,95%的湿度,
2.2.3. PDLSCs分离培养,方法同文献 [2]
将对数生长其牙周膜细胞悬液有限稀释至密度为10/ml,用加样器向96孔培养板每孔内加0.15 ml,使每孔0.1 ml细胞悬液中约1个细胞,经过
2.2.4. 陶瓷化骨颗粒的准备
将新鲜小牛肋骨切割成适当形状,经脱脂、脱蛋白,置于马沸炉中加温至800℃,持续3 h后,放入无菌器皿中备用。将制成的陶瓷化骨研成细小颗粒,消毒,备用。
2.2.5. 胶原膜的准备
本实验所用的生物膜为冻干胶原膜(第四军医大学口腔医院组织工程实验中心提供),其成分主要为I型胶原,无菌条件下剪取5 × 5 mm2的方片,环氧乙烷熏蒸4 h备用。
2.2.6. 细胞接种
取24孔细胞培养板,每孔内放置事先预备好的盖玻片,消毒备用,其中12孔放置消毒好的BBC颗粒(1~2) mm,将第三代细胞接种BBC上,其余12孔放入预先制备好的胶原膜,接种细胞作为对照组,各组细胞均用矿化液连续培养。
2.2.7. 扫描电镜观察细胞附着
取空白材料及细胞接种复合培养1周时,各1块复合物物,30 g/L戊二醛及2%的四氧化锇双重固定,脱水,醋酸异戊脂置换,干燥,喷镀金膜后扫描电镜观察。
2.2.8. 细胞贴壁和增殖检测
每组复合培养1周、2周各取3块/3孔,PBS清洗,去除未贴壁细胞,用0.25%胰酶消化,血球计数板进行细胞计数,观察不同组和不同培养时间细胞黏附数量及增殖情况各组取平均值。
2.2.9. ALP检测
每组复合物分别在培养1 W,2 W时各取3块/孔,0.25%胰酶消化,离心,计数,细胞调至1 × 104/ml,加入96孔板,每孔100 ul,37℃,5% CO2孵箱孵育24 h,PBS洗3次,每孔加入0.1% Triton X-100 50 ul,4过液。每孔加入ALP抗体100 ul,
2.2.10. 两组细胞材料复合物体内移植
将两组细胞支架复合物培养一周后即刻植入6周龄雌性BALB/c裸小鼠(中国医学科学院实验动物所提供)皮下;对照组是将同量CBB与LCM (第四军医大学组织工程中心)混合,植入相同条件的裸鼠皮下,无菌条件下切开裸鼠背部皮肤,潜行分离,制作皮下袋,分别植入实验组细胞材料复合体和对照组单纯材料组,避免植入体位于切口正下方,缝合皮肤,消毒,根据接种不同细胞对裸鼠进行标记。每组标本植入6只裸鼠,每个动物植入4个标本(植入实验已获广东医学院伦理委员会批准)。
2.2.11. 取材及组织学观察
术后8周取材,置于40 g/L的多聚甲醛中4℃固定24 h,甲酸-甲酸钠复合脱钙液4℃脱钙3~9 d,常规脱水,石蜡包埋,连续切片(4~5 um),HE染色显微镜下观察,照相。
3. 结果
3.1. 细胞形态学观察结果
人原代牙周膜细胞2 h即贴壁,部分出现集落生长,集落中央细胞呈多角形或长梭形,细胞较小,排列紧密,集落边缘细胞呈梭型,细胞大且较长,细胞形态为梭型类似呈纤维样细胞。克隆分离的PDLSCs为长梭形,形态均一,克隆生长。
3.2. 细胞材料复合物生长状况观察记录
扫描电镜观察可见煅烧骨为多孔状结构,表面粗糙(见图1),I型胶原膜为多孔网状结构(见图2),PDLSCs在两种支架材料上贴附生长伸展充分,细胞大部分为长梭形,生长旺盛,伸展充分(见图3,图4),在煅烧骨表面的细胞密度高,围绕孔壁并跨空隙并向空隙内生长,细胞间伸出突起相互连接,其间有明显的基质分泌(见图3),在胶原膜表面的细胞伸展充分,细胞间伸出突起相互连接,其间有明显的基质分泌,但细胞未深入膜的内部。(见图4)。陶瓷化骨表面在扫描电镜下为微颗粒状,具有微孔。培养1~2 d时,细胞附着与材料的表面,形态多样,有多个突起,细胞跨越微孔表面或向孔内长入,培养8 d时细胞连接成片呈多层生长,细胞接触紧密,部分区域有细胞外基质形成。而CBB复合胶原凝胶组细胞量明显多于LCM组,细胞分泌的胞外基质较交LCM组多(见图3、图4)。
3.3. 细胞的增殖特性测定
从细胞计数结果直方图来看,细胞附着后可保持较长时间的分裂增殖,细胞数量在接种后2 W达到最多,1 w和2 w时细胞数CBB组均高于LCM组,而接种72小时细胞贴壁数差别不大(见图5)。
3.4. ALP检测结果
不同组中PDLSCs ALP表达均为阳性,结果如图5,2 w组明显高于1 w组(P < 0.05),在两个时间点上,CBB组平均OD值在两个时间点上显著高于LCM组(P < 0.05),如表1所示。
3.5. 移植物体内观察结果
两组均出现明显的基质沉积,但CBB基质的矿化程度较牙周膜干牙囊细胞组高,类似牙周膜牙骨质复合体(见图6、图7),未接种细胞的空白材料未见组织形成如图(见图8)。LCM组取材时未见移植物。
4. 讨论
种子细胞,支架材料和细胞生长的微环境是组织再生研究必须具备的条件。即使有了理想的种子细胞,如果没有合适的载体或支架使细胞能在其上快速增殖并具有一定空间构架,组织的再生就难以实现。正常组织是由细胞不断分泌细胞外基质支撑细胞,维持组织稳定,组织缺损时,基质破坏,细胞赖以生存的空间改变,适宜的支架材料提供了细胞附着和增殖的空间,当细胞在特定的空间内增殖至一定密度,

Figure 1. SEM observing showed that LCM was poprous constructure 300 um
图1. 胶原膜的微孔结构 扫描电镜300 um
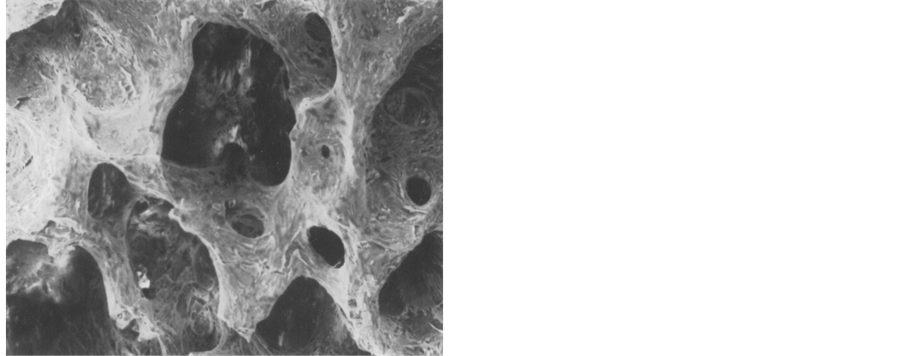
Figure 2. SEM observing showed that CBB was porous constructure 750 um
图2. CBB的微孔结构750 um
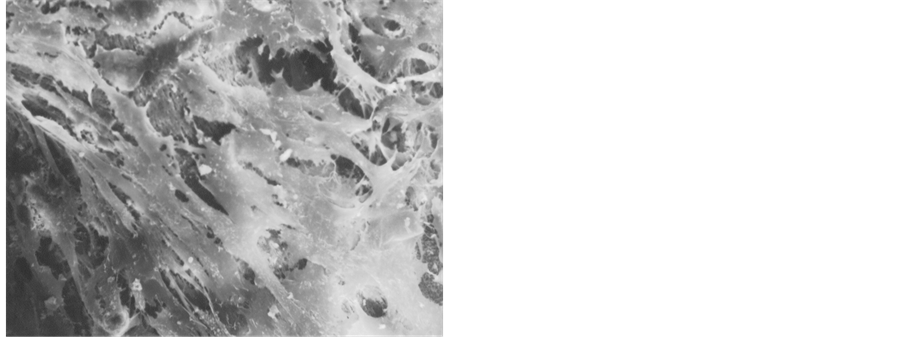
Figure 3. SEM observing showed that PDLSC’s good condition in CBB with gel 25 um
图3. PDLSCs在CBB的内生长,并伸出突起相互连接 扫描电镜25 um
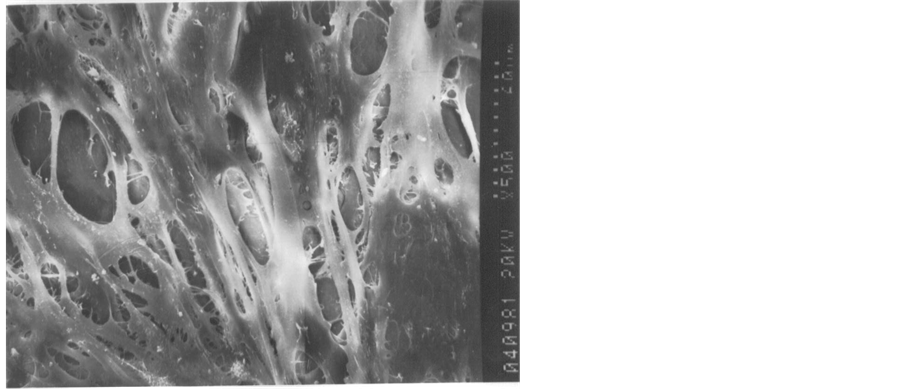
Figure 4. SEM observing showed that PDLSC’s good condition in LCM 60 um
图4. PDLSCs在胶原膜内生长,扫描电镜60 um
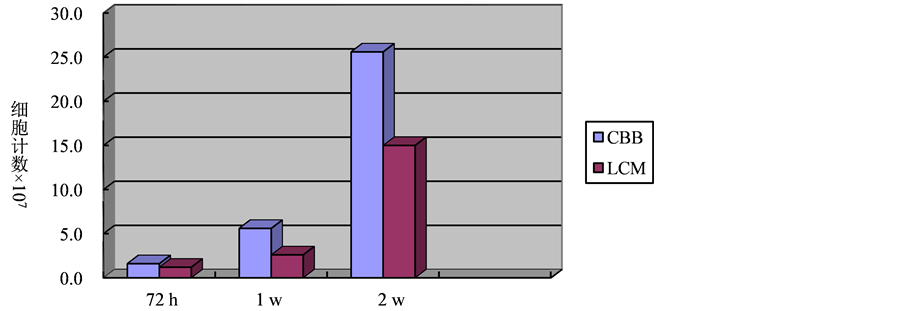
Figure 5. Counts of PDLSCs in two weeks in different scaffolds (107)
图5. PDLSCs两种材料复合培养两周增殖结果(107)
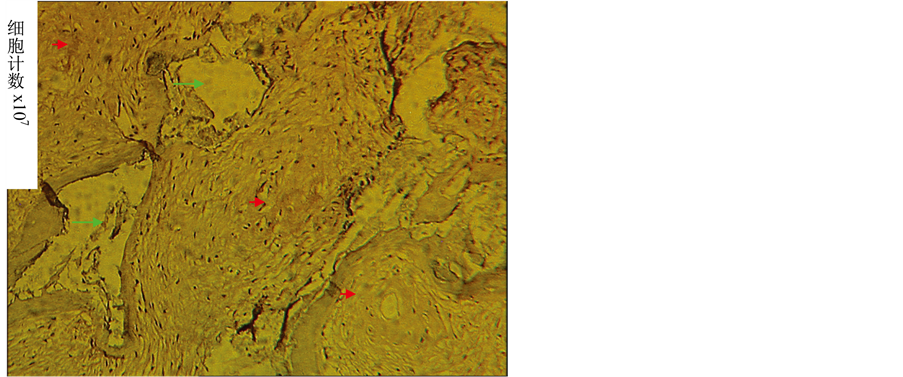
Figure 6. Cementum matrix formation in vivo by cultured PDLSCs ×100
图6. 移植物新生纤维紧绕基质样矿化组织(红色箭头所示为矿化基质,绿色为CBB降解后留的腔隙) ×100
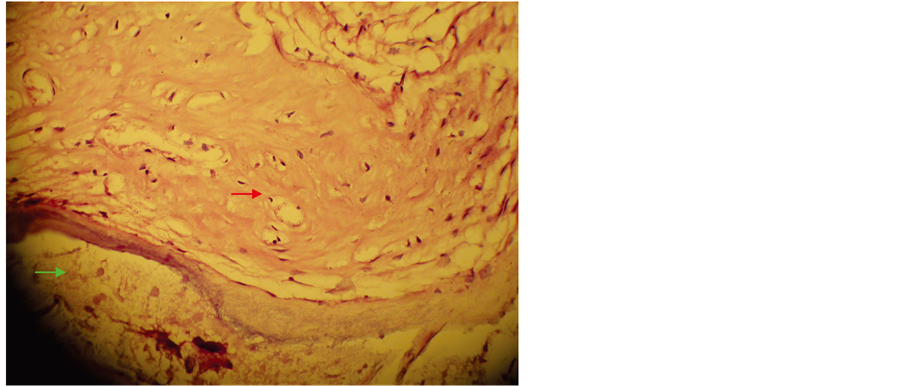
Figure 7. Cementum matrix formation in vivo by cultured PDLSCs ×200
图7. 移植物新生基质样矿化组织(红色箭头所示为矿化基质,绿色为CBB降解后留的腔隙) ×200
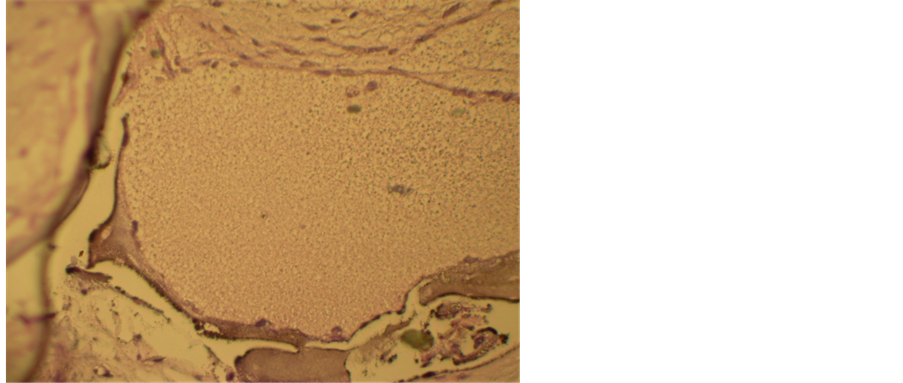
Figure 8. No new matrix formation in control ×200
图8. 未接种细胞的空白对照组无新生组织形成 ×200
Table 1. Mean OD value of ALP in PDLSCs (x ± s)
表1. PDLSCs表达ALP平均OD值
细胞之间就会相互交通,分泌基质并开始分化。牙周炎和根尖周炎时,炎症介质和机体自身免疫导致牙根和根尖周的牙周组织缺损,维持牙周组织稳定和平衡的牙周膜干细胞失去了生存的微环境,细胞赖以附着的基质是主要因素之一,支架材料对种子细胞的支撑和诱导,以及支架材料的降解时间都是影响组织再生尤为重要的因素,本实验观察了矿化液培养条件下CBB和LCM对人牙周膜干细胞增殖和分化的体内外作用。
实验中我们发现,在以CBB为载体立体条件下,用矿化液连续培养2 W,细胞ALP高于对照组。细胞计数观察发现,实验组随培养时间延长,平均细胞数也高于对照组,这可能是由于CBB表面的空隙结构密集,互相交通,增大了面积,细胞互相交通,相互接触,分泌基质。扫描电镜观察发现,两组细胞生长状态均较好,细胞互相交通,但CBB组基质分泌较多,这可能与CBB表面的羟基磷灰石晶体结构类似牙本质中的无机成分有关。牙本质是由羟基磷灰石和有机基质组成,牙本质是由成牙本质细胞分泌,有矿物离子沉积其中,形成矿化的牙本质。本组实验采用的载体材料CBB主要成分是羟基磷灰石,纯度高,X射线能谱分析结果表明,CBB钙磷原子数量比为1.67,接近人骨钙磷比值 [3] - [5] ,比人工合成的羟基磷灰石更有利于矿化组织细胞的生长和分化 [6] 。HANDA [7] 等将牛牙周膜干细胞与羟基磷灰石粉末混合后植入裸鼠皮下,六周后发现,只在羟基磷灰石的表面看到了牙骨质的形成,这可能是因为羟基磷灰石是成牙骨质细胞的前体细胞附着的关键之一,混合牙周膜干细胞的羟基磷灰石小颗粒能够模拟根部牙本质,使牙周膜干前体细胞附着于其上并向成牙骨质细胞分化,Pitaru及其合作者曾报道牙骨质附着蛋白与羟基磷灰石密切相关,在体内它具有吸引成牙骨质细胞群向根部牙本质上聚集的作用 [8] [9] 。BSP也与羟基磷灰石密切相关,具有使骨和血管形成的核心作用 [10] [11] 。因此,羟基磷灰石表面的CAP和BSP可以刺激成牙骨质细胞的前体细胞向该处迁移和附着,并向成牙骨质细胞分化,牙周膜干细胞在羟基磷灰石表面的附着和其他信号会诱导CAP和BSP的表达,对其向成牙骨质细胞分化具有关键的作用。
前期的实验中我们发现 [2] ,分离的牙周膜干细胞具有成纤维和成骨细胞的表型特征,具有向成骨、成牙骨质细胞分化的特定趋势。本组利用条件培养基培养条件下,细胞接种在CBB和LCM两种支架中,接种时为了减少细胞的流失,保证支架上细胞的密度,我们先将高浓度细胞与与胶原凝胶混合,将细胞凝胶接种至支架,这样增加了细胞的粘附,保证了细胞的高浓度接种。扫描电镜观察发现细胞之间相互交通,紧密连接,密度较大,这位细胞分化创造了条件,尤其CBB组,可见细胞伸入材料的空隙,紧密连接。培养液中维生素C是合成胶原和骨形成的必须物质;β一甘油磷酸可提供有机磷;地塞米松不仅能促进成骨细胞分化成熟,诱导成骨,还具有调节成骨样细胞产生胰岛素样生长因子,促进胶原合成,刺激碱性磷酸酶(ALP)活性的作用。
而LCM组表面细胞较密集,看不到材料内部空隙相互交通。同样诱导条件下,随时间推移,CBB组的牙周膜干细胞增殖交LCM组明显2 W时达最高峰,ALP也高于对照组,差异有统计学意义,提示牙周膜干细胞的增殖、分化均与支架材料的表面结构密切相关。
两组细胞支架复合物体内移植六月取材组织学观察发现,CBB组材料表面形成类牙周膜牙骨质复合体结构,而LCM组取材时未见移植物,推测原因,可能是LCM降解较早,未等PDLSCs基质分泌矿化,支架材料降解,细胞失去了赖以附着的支撑物,流失和凋亡所致。牙骨质的形成是一个非常复杂的过程,这一过程的发生受到胶原和非胶原蛋白、生长因子、磷酸盐、基质金属蛋白酶等多种细胞外基质分子网络的调控[12] 。本组设计观察了两种支架材料对细胞增殖和形成组织的影响。CBB配合胶原凝胶更有利于牙周组织的形成,是牙周组织再生研究的优良支架材料。
基金项目
东莞市高等院校科研机构科技计划项目(项目编号2011108102028),湛江市科技攻关计划项目(项目编号
文章引用
常秀梅,金 岩, (2015) 不同接种条件对牙周膜干细胞体内外矿化的影响
Differentiation Ability of Periodontal Ligament Stem Cells in Different Scaffolds. 生物医学,03,23-31. doi: 10.12677/HJBM.2015.53004
参考文献 (References)
- 1. Saygin, N.E., Giannobile, W.V., Somerman, M.J., et al. (2000) Molecular and cell biology of cementum. Periodontology, 24, 73-98. http://dx.doi.org/10.1034/j.1600-0757.2000.2240105.x
- 2. 常秀梅, 刘宏伟, 金岩, 等 (2009) 犬牙周膜干细胞体外分离培养和鉴定的实验研究. 华西口腔医学杂志, 27, 79-83.
- 3. 许永华, 施新猷, 胡蕴玉, 等 (2000) 牛陶瓷化骨与体外培养兔骨膜成骨细胞的相容性. 第四军医大学学报, 21, 512-514.
- 4. 程晓兵, 薛振恂, 周树夏, 等 (2002) 多孔块状B一礴酸三钙陶瓷兔颅骨骨膜下埋下植可吸收性的定量研究. 中国临床康复, 6, 189.
- 5. Minamide, A., Tamaki, T., Kawakami, M., et al. (1999) Experimental spinal fusion using sintered bovine bone coated with type I collagen and recombinant human bone morphogenetic protein-2. Spine, 24, 1863-1871. http://dx.doi.org/10.1097/00007632-199909150-00002
- 6. Matsumoto, T., Kawakami, M., Kuribayashi, K., et a1. (1999) Effects of sintered bovine bone on cell proliferation, collagen synthesis, and osteoblastic expression in MC3T3-E1 ostoblast-like cells. Journal of Orthopaedic Research, 17, 586-592.
- 7. Handa, K., Saito, M., Yamauchi, M., et al. (2002) Cementum matrix formation in vivo by cultured dental follicle cells. Bone, 31, 606-611. http://dx.doi.org/10.1016/S8756-3282(02)00868-2
- 8. Pitaru, S., Savion, N., Hekmati, H., et al. (1992) Binding of a cementum attachment protein to extracellular matrix components and to dental surfaces. Journal of Periodontal Research, 27, 640-646. http://dx.doi.org/10.1111/j.1600-0765.1992.tb01748.x
- 9. Liu, H.W., Yacobi, R., Savion, N.A., et al. (1997) Collagenous cementum-derived attachment protein is a marker for progenitors of the mineralized tissue-forming cell lineage of the periodontal ligament. Journal of Bone and Mineral Research, 12, 1691-1699. http://dx.doi.org/10.1359/jbmr.1997.12.10.1691
- 10. Hunter, G.K. and Goldberg, H.A. (1993) Nucleation of hy-droxyapatite by bone sialoprotein. Proceedings of the National Academy of Sciences of the United States of America, 90, 8562-8565. http://dx.doi.org/10.1073/pnas.90.18.8562
- 11. Falla, N., Van Vlasselaer, Bierkens, J., et a1. (1993) Characterization of a enriched ostioprogenitor population of the routine bone iTiRrrow. Blood, 82, 3580.
- 12. BarKana, I., Narayanan, A.S., Grosskop, A., Savion, N. and Pitaru, S. (2000) Cementum attachment protein enriches putative cementoblastic populations on root surfaces in vitro. Journal of Dental Research, 79, 1482-1488. http://dx.doi.org/10.1177/00220345000790070901
