<%JournalFullName%> Vol.<%Volume%> No.<%Issue%><%IssueYear%>, Article ID:<%PaperID%>,<%PageCount%> pages <%DOI%>
微波助离子液体中铜–铈共掺杂TiO2光催化剂的制备及微波强化光催化活性
Leiqing Wang1, Guiqin Zhang2, Xianjun Bi1*1Institute of Chemistry and Chemical Engineering, Yunnan Normal University, Kunming
2Department of Husbandry and Veterinary, Yunnan Agriculture Vocational and Technical College, Kunming
Email: *bixj159@aliyun.com
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



Received: Jan. 22nd, 2014; revised: Feb. 17th, 2014; accepted: Feb. 25th, 2014
ABSTRACT
Copper and cerium co-doped TiO2 photo-catalyst TiO2-Cu-Ce were obtained using titanium tetrabut-oxide as a precursor in [Bmim]PF6 ionic liquids which were prepared by microwave irradiation at room temperature. The crystal structure of catalytic samples were measured and characterized by XRD, IR, SEM, BET with the related analysis software. Catalytic degradation reaction could be quantified in terms of methyl orange with microwave irradiation (MW), ultraviolet lamp light (UV), and microwave irradiation‑ultraviolet lamp light (MW-UV). The results indicated that the optimized conditions of copper and cerium co-doped TiO2 were prepared at an n(Cu)/n(Ti) ratio 0.025, n(Ce)/n(Ti) ratio 0.050, dried in microwave with the power of 210 W for 20 min and calcined at 500˚C for 2 h. When the catalyst used to degrade methyl orange, the degradation rates of methyl orange under MW, UV and MW-UV were respectively 6.89%, 96.91%, 99.85%. Moreover, the degradation rate of methyl orange with MW-UV was all along the highest under the three degradation conditions, which indicated the microwave irradiation had the strengthening effect for degradation of methyl orange when TiO2-Cu-Ce used as the photo-catalyst. Structure analysis of catalyst showed that the main reason for the higher photo-catalytic activity was that TiO2-Cu-Ce had got higher surface area, almost similar particle size, larger total pore volume and wider average pore size.
Keywords:Microwave; Ionic Liquid; Copper and Cerium Co-Doped; TiO2 Photo-Catalysts; Microwave Enhancement

微波助离子液体中铜–铈共掺杂TiO2光催化剂的制备及微波强化光催化活性
王雷清1,张桂琴2,毕先钧1*
1云南师范大学化学化工学院,昆明
2云南农业职业技术学院畜牧兽医系,昆明
Email: *bixj159@aliyun.com
收稿日期:2014年1月22日;修回日期:2014年2月17日;录用日期:2014年2月25日

摘 要
在[Bmim]PF6离子液体中,用微波辐射干燥的方法制备了铜–铈共掺杂纳米二氧化钛光催化剂TiO2-Cu-Ce,用IR、XRD、SEM、BET对催化剂进行了表征。通过测试催化剂TiO2-Cu-Ce对甲基橙溶液的微波(MV)、紫外(UV)、微波–紫外(MV-UV)三种条件下的降解率,着重考察了微波加热功率、微波加热时间、煅烧温度、煅烧时间及铜和铈掺杂量等因素对TiO2-Cu-Ce催化活性的影响。结果表明,掺杂物质硝酸铜和硝酸铈与钛酸丁酯的物质的量之比分别为n(Cu)/n(Ti) = 0.025和n(Ce)/n(Ti) = 0.050,在微波功率为210 W时干燥20 min,再在高温箱式电阻炉中于500℃下煅烧2 h,所制得的TiO2-Cu-Ce催化剂具有较高的光催化活性;在MW、UV和MW-UV三种降解条件下,TiO2-Cu-Ce对甲基橙的降解率分别为6.89%、96.91%、99.85%;并且在三种降解条件下,甲基橙降解率始终是:MW-UV > UV > MW。这表明在紫外光照条件下,微波辐射具有强化TiO2-Cu-Ce催化剂降解甲基橙的作用。催化剂结构分析表明,TiO2中掺入铜和铈后制得的催化剂,具有粒径均匀,比表面积、孔容、平均孔径和半孔宽均较大等特点,这也是TiO2-Cu-Ce催化剂具有较高的光催化活性的主要原因。
关键词
微波;离子液体;铜–铈共掺杂;二氧化钛光催化剂;微波强化

1. 引言
近年来,煤、石油、天然气等能源造成的环境污染和不可再生问题日益显现,太阳能蕴藏量丰富(约可用五十亿年)同时不会产生废气来污染环境,因此太阳能的利用越来越受到人们重视。TiO2作为半导体催化剂可以利用紫外光进行光催化反应,而大多数研究者希望通过TiO2改性处理,能够生产出可利用太阳能的新型光催化材料,以应用于催化工业以降低生产成本[1] [2] 。对TiO2进行改性处理的方法有很多,比如制备纳米粒子、纳米线、纳米管、纳米薄膜等[3] -[5] ,还有金属、非金属、复合材料等的单掺杂、共掺杂以及某些材料上的负载等方法[6] -[10] 。
离子液体具有几乎为零的蒸气压、高热稳定性、强溶解能力和两亲性等优点,可以在互不相溶的两相中将两相混合均匀,形成的纳米粒子不易团聚、分散性好,在催化领域备受关注[6] -[10] 。微波是一种电磁波,由于微波加热具有加热均匀、受热无温度梯度、升温速率快等优点,因而与常规反应相比,微波加热能够加快反应进行,极大地缩短反应时间,所以微波加热被广泛用于纳米材料的制备等众多领域中[6] -[11] 。
最近,本课题组开展了微波助离子液体介质中金属离子掺杂TiO2光催化剂的制备,以及微波强化光催化活性的研究,旨在进一步提高TiO2催化剂的光催化活性[6] -[10] 。根据文献报道,在常规条件下金属离子Cu2+和Ce4+共掺杂能够使TiO2催化剂的光催化性能得以提高[12] -[14] ,因而本文探讨微波助离子液体介质中Cu2+和Ce4+共掺杂TiO2光催化剂的制备,并通过其对甲基橙的降解,考察其光催化性能,通过反应条件的优化以求进一步提高TiO2催化剂的光催化活性。
2. 实验部分
2.1. 主要试剂、仪器、离子液体的制备、催化剂的XRD等表征方法等详见文献[6]-[10]
硝酸铜、硝酸铈、钛酸丁酯、1-甲基咪唑、溴代正丁烷均为分析纯,XH-300UL电脑微波超声波紫外光组合催化合成仪、XH-200A电脑微波固液相合成/萃取仪均为北京祥鹄科技发展有限公司、美国康塔公司NOVE2000-e型表面分析仪、XL30ESEM-TMP型扫描电子衍射显微镜(荷兰)、Ten Sor27型红外光谱仪(德国Bruker)。
2.2. TiO2-Cu-Ce催化剂的制备
强烈搅拌下,往17.5 mL的无水乙醇中逐滴滴加3.4 mL的钛酸丁酯和一定量的[Bmim]PF6离子液体,滴加完后继续搅拌10 min,得到混合液A;按照所需的硝酸铈与钛酸丁酯物质的量比,称取一定量硝酸铈和硝酸铜溶于18 mL二次蒸馏水中,得到溶液B;将B逐滴滴加到A中,剧烈搅拌1 h,真空抽滤,洗涤,得白色溶胶,将其放入家用微波炉干燥一定时间,研磨后放入高温箱式电阻炉中煅烧,即得铜-铈共掺杂的TiO2催化剂TiO2-Cu-Ce。
2.3. 催化剂光催化活性的测定
光催化降解反应在XH-300UL电脑微波超声波组合催化合成仪中进行。向盛有50 mL10 mg/L甲基橙溶液的250 mL烧杯中加入50 mg催化剂,置于微波超声波组合催化合成仪中,恒温(25℃)条件下,分别在250 W高压汞灯(波长为365 nm),微波(500 W)-250 W高压汞灯、微波(500 W)三种条件下降解2 h (反应器距紫外光源15 cm),取上层清液离心后,测定吸光度A,利用公式:η = (A0 − A)/A0 × 100%计算其降解率(其中A0为甲基橙降解前的吸光度,A为甲基橙降解后的吸光度)。
3. 结果与讨论
3.1. 微波加热功率和加热时间对TiO2-Cu-Ce光催化活性的影响
在离子液体加入量为5.6 mL,掺杂物质硝酸铜、硝酸铈与钛酸丁酯的物质的量之比为n(Cu)/n(Ti) = 0.025、n(Ce)/n(Ti) = 0.050,微波加热时间20 min,煅烧温度500℃,煅烧时间2 h条件下,考察微波加热功率对TiO2-Cu-Ce光催化活性的影响,结果如图1所示。从图1可以看出,随着微波加热功率的增加,甲基橙的降解率先迅速增加后下降,当微波加热功率为210 W时,甲基橙的降解率达到极大值;在MW、UV、MW-UV三种条件下甲基橙降解率分别为6.89%、96.91%、99.85%,并且三种降解条件下的降解率始终是MW-UV > UV > MW,这说明在用紫外光照降解甲基橙时,微波辐射具有强化TiO2-Cu-Ce催化降解甲基橙的作用。微波加热主要是除去凝胶中的水分,水分子是极性分子,微波作用时极性分子的剧烈运动产生相互碰撞,摩擦生热,使液态水迅速升温气化而达到干燥的目的。微波是体加热,使催化剂内部和外部可以均匀受热,此功率下催化剂可以有效干燥,去除自由移动的水分,利于研磨,使所得到的催化剂的粒径比较均匀,团聚较少,催化剂的比表面积增大,进而促进催化剂与甲基橙溶液充分接触,提高了催化剂对甲基橙的降解率;但当微波功率过高时,催化剂表面自由移动的水分出去后,结合水及表面的羟基会继续失水,造成催化剂表面的羟基数目减少,活性位点降低,致使催化剂的光催化活性下降[15] [16] 。由此得到制备催化剂最佳微波加热功率为210 W。
图2为微波加热时间对TiO2-Cu-Ce光催化活性的影响(除微波加热功率为210 W外,其余条件同图1)。从图2可知,随着干燥时间增加,甲基橙的降解率先增加后下降,当微波加热时间为20 min时,甲基橙的降解率达到极大值;在MW、UV、MW-UV三种条件下甲基橙降解率分别为6.89%、96.91%、99.85%,并且三种降解条件下的降解率始终是MW-UV > UV > MW,这进一步说明用紫外光照降解甲基橙时,微波辐射具有强化TiO2-Cu-Ce催化降解甲基橙的作用。微波加热是一种内加热,物质吸收微波后,产生深层加热,微波加热时间较短时,凝胶内层中的水分不能充分汽化,研磨就不能充分进行,粒子团聚现象严重,导致所制得的催化剂在紫外光照时形成的电子–空穴对易堆积发生复合;但微波加热时间过长时,水分汽化完全后,凝胶表面的Ti-OH键会发生断裂,致使分子脱水,制得的催化剂表面的Ti-OH键数目减少,紫外光照射时,Ti-OH键断裂形成的活性羟基数目少,微波辐射时活性位点减小,从而导致催化剂的光催化活性降低[15] [16] 。由此得到制备催化剂最佳微波加热时间为20 min。
3.2. 煅烧温度和煅烧时间对TiO2-Cu-Ce光催化活性的影响
在离子液体加入量为5.6 mL,硝酸铜、硝酸铈与钛酸丁酯的物质的量之比为n(Cu)/n(Ti) = 0.025、n(Ce)/n(Ti) = 0.050,微波加热功率210 W,微波加热时间20 min,煅烧时间2 h条件下,考察煅烧温度对
Figure 1. The influence of microwave drying power on TiO2-Cu-Ce photo- catalytic activity
图1. 微波加热功率对TiO2-Cu-Ce光催化活性的影响
Figure 2. The influence of microwave drying time on TiO2-Cu-Ce photo-catalytic activity
图2. 微波加热时间对TiO2-Cu-Ce光催化活性的影响
TiO2-Cu-Ce光催化活性的影响,结果如图3所示。从图3可以看出,煅烧温度对催化剂活性的影响较大,随着煅烧温度升高,甲基橙的降解率先增大后减小,当煅烧温度为500℃时,甲基橙的降解率达到极大值,在MW、UV、MW-UV三种条件下,甲基橙降解率分别为6.89%、96.91%、99.85%,并且三种降解条件下的降解率始终是MW-UV > UV > MW,这同样说明在用紫外光照降解甲基橙时,微波辐射具有强化TiO2-Cu-Ce催化降解甲基橙的作用。据文献报道[12] -[15] ,纯TiO2在煅烧温度高于600℃时才会产生锐钛矿型TiO2,而铜和铈共掺杂TiO2催化剂在温度为500℃时就产生锐钛矿型TiO2,这表明铜和铈共掺杂使得TiO2光催化剂发生相变的温度降低了。煅烧温度对催化剂活性产生影响的原因是:当煅烧温度高于500℃时,TiO2-Cu-Ce催化剂中TiO2主要以锐钛矿型存在,锐钛矿型TiO2表面有更多的羟基与钛元素相连,经紫外光照射时,锐钛矿型催化剂可以吸收紫外光子的能量发生电子的跃迁,产生电子–空穴对;再加上微波辐射作用时,可以使催化剂表面的羟基迅速受热,生成活性羟基,同时微波可以抑制电子–空穴对的复合,催化剂表面温度升高,羟基和空穴成为活性位点,使有机污染物被氧化,生成中间体,中间体继续被矿化为小分子化合物[11] -[16] 。由此得到制备催化剂最佳煅烧温度为500℃。
图4是煅烧温度分别为450℃、500℃、550℃条件下TiO2-Cu-Ce催化剂的红外谱图。三个温度条件
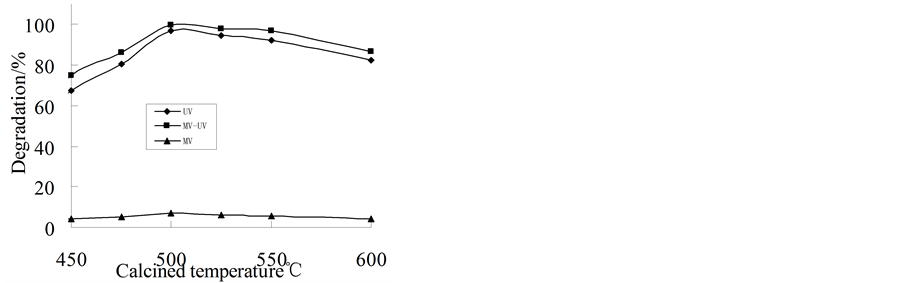
Figure 3. The influence of calcined temperature on TiO2-Cu-Ce photo-catalytic activity
图3. 煅烧温度对TiO2-Cu-Ce光催化活性的影响
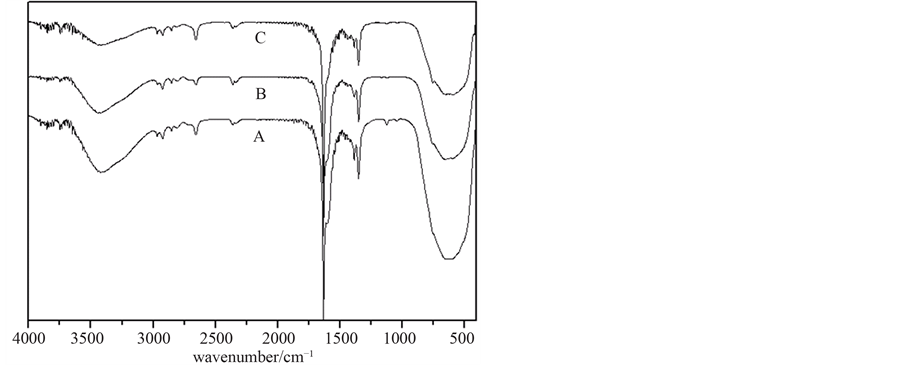
Figure 4. IR spectrum of TiO2-Cu-Ce at different calcined temperature, A. 450˚C; B. 500˚C; C. 550˚C
图4. 不同煅烧温度下TiO2-Cu-Ce红外谱图,A. 450℃;B. 500℃;C. 550℃
下,羟基的伸缩振动特征吸收峰分别出现在3419.7 cm−1、3421.6 cm−1和3419.7 cm−1处(1350.1 cm−1处的吸收峰属于Ti-OH的特征吸收峰),而Ti-O-Ti键的伸缩振动吸收峰分别出现在636.5 cm−1、640.3 cm−1和592.1 cm−1处,这表明温度低于500℃时,随着温度升高,羟基和Ti-O-Ti键的伸缩振动吸收峰均向高波数方向移动,导致催化活性随之升高;但当温度高于500℃时,随着温度升高,羟基和Ti-O-Ti键的伸缩振动吸收峰均向低波数方向移动,导致催化活性随之下降。
图5为煅烧时间对TiO2-Cu-Ce光催化活性的影响(除煅烧温度为500℃外,其余条件同图3)。从图5可以看出,随着煅烧时间的增长,甲基橙的降解率先增加后降低,当煅烧时间为2 h时,甲基橙的降解率达到极大值,在MW、UV、MW-UV三种条件下,甲基橙降解率分别为6.89%、96.91%、99.85%,并且三种降解条件下的降解率始终是MW-UV > UV > MW,这同样说明在用紫外光照降解甲基橙时,微波辐射具有强化TiO2-Cu-Ce催化降解甲基橙的作用。当煅烧时间为2 h时,催化剂颗粒没有出现烧结现象,催化剂为锐钛矿型,拥有较高的比表面积,可以与溶液充分接触,致使催化剂具有较高的光催化活性;而煅烧时间过长时,催化剂颗粒出现过度烧结现象,晶型被破坏,表面的羟基也会发生变化,使晶面的催化活性位点减少甚至消失,导致其光催化活性降低。由此得到制备催化剂最佳煅烧时间为2 h。
3.3. 铜掺杂量对TiO2-Cu-Ce光催化活性的影响
在离子液体加入量为5.6 mL,微波加热功率210 W,微波加热时间20 min,煅烧温度500℃,煅烧时间2 h,n(Ce)/n(Ti) = 0.075条件下,考察铜掺杂量对TiO2-Cu-Ce光催化活性的影响,结果如图6所示。
Figure 5. The influence of calcined time on TiO2-Cu-Ce photo- catalytic activity
图5. 煅烧时间对TiO2-Cu-Ce光催化活性的影响

Figure 6. The influence of n(Cu)/n(Ti) ratio on TiO2- Cu-Ce photo-catalytic activity
图6. 铜掺杂量对TiO2-Cu-Ce光催化活性的影响
从图6可以看出,随着铜掺杂量的增多,甲基橙的降解率先升高后下降,在铜掺杂量为n(Cu)/n(Ti) = 0.025时,甲基橙的降解率达到极大值,在MW、UV、MW-UV三种条件下,甲基橙降解率分别为4.98%、95.11%、98.42%,并且三种降解条件下的降解率始终是MW-UV > UV > MW。其原因可能是Cu2+与Ti4+半径相近,铜掺杂量较低时,部分铜元素置换TiO2晶格中的钛,造成二氧化钛晶格畸变。Cu2+的价电子排布为3d9,易得电子形成稳定结构,成为得电子中心,造成电子和空穴的分离,导致光催化活性提高。
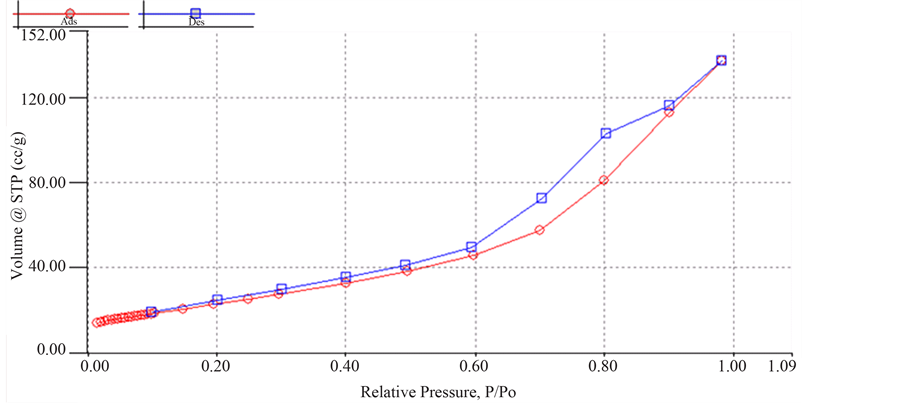
固定n(Ce)/n(Ti) = 0.075条件下,改变铜掺杂量制得的TiO2-Cu-Ce催化剂的红外谱图如图7所示,从该图可知,当n(Cu)/n(Ti)分别为0、0.025和0.050时,羟基的伸缩振动吸收峰依次出现在3421.6 cm−1、3444.7 cm−1和3421.6 cm−1处,钛氧键的特征吸收峰依次出现在592.1 cm−1、669.3 cm−1和592.1 cm−1处,这表明铜掺杂后羟基的伸缩振动吸收峰和钛氧键的特征吸收峰均向高波数方向移动,羟基和钛氧键的能量提高,催化剂的光催化活性增强。加之Cu2+具有较强的溶剂化作用,更易捕获表面的氧分子,形成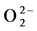 ,紫外光照射时,在TiO2-Cu-Ce的表面可以累积更多的表面羟基,形成游离活性羟基,羟基可以有效的吸收微波能,使反应体系局部温度迅速升高,加快自由基反应,甲基橙迅速被氧化为二氧化碳和水。
,紫外光照射时,在TiO2-Cu-Ce的表面可以累积更多的表面羟基,形成游离活性羟基,羟基可以有效的吸收微波能,使反应体系局部温度迅速升高,加快自由基反应,甲基橙迅速被氧化为二氧化碳和水。
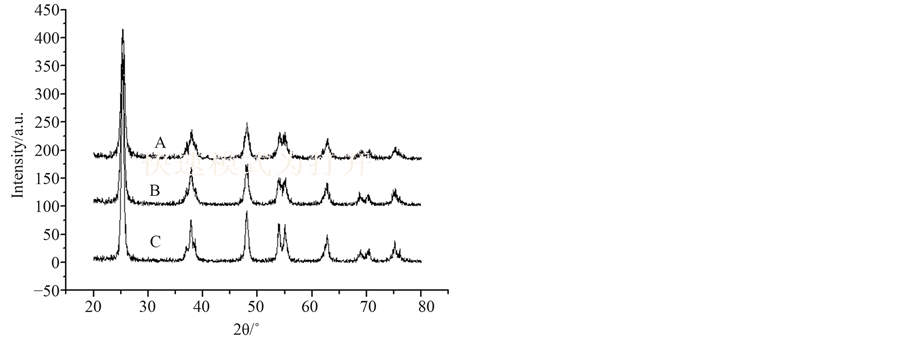
不同铜掺杂量条件下制备的TiO2-Cu-Ce催化剂的XRD图如图8所示。根据jade软件分析101晶面的粒径分别为12.4、17.0和15.9 nm,由此可知,随着掺杂量的增加,TiO2-Cu-Ce的粒径略有增加。Cu2+属于过渡金属,是一种变价元素,被掺入后,得电子形成Cu+,成为空穴–电子对的浅势捕获陷阱,铜和钛属于同一周期,Cu2+与Ti4+离子半径相近,掺杂后能级与钛匹配性好,从而可以替换TiO2晶格中的Ti,使晶格造成畸变,键长和键角发生变化,从而造成TiO2-Cu-Ce粒径改变;与TiO2-Ce相比,铜–铈共掺杂后TiO2-Cu-Ce催化剂101晶面,2倍衍射角由25.42减小为25.34,说明铜元素的掺入,使二氧化钛的晶格发生改变,导致催化剂的光催化活性提高。微波作用时可以促进TiO2-Cu-Ce表面水更好的脱附,形成活性羟基,增加对紫外光的吸收,提高催化剂光催化效果[15] [16] 。
3.4. 铈掺杂量对TiO2-Cu-Ce光催化活性的影响
在离子液体加入量为5.6 mL,微波加热功率210 W,微波加热时间20 min,煅烧温度500℃,煅烧时间2 h,n(Cu)/n(Ti) = 0.025条件下,考察铈掺杂量对TiO2-Cu-Ce光催化活性的影响,结果如图9所示。
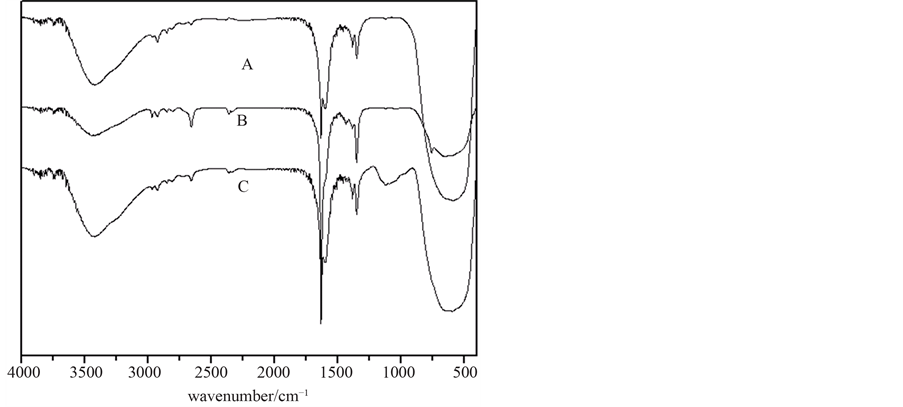
A. n(Cu)/n(Ti) = 0; B. n(Cu)/n(Ti) = 0.025; C. n(Cu)/n(Ti) = 0.050
Figure 7. IR spectrum of TiO2-Cu-Ce at different n(Cu)/n(Ti) ratio
图7. 不同铜掺杂量条件下制备TiO2-Cu-Ce的IR谱图

A. n(Cu)/n(Ti) = 0; B. n(Cu)/n(Ti) = 0.025; C. n(Cu)/n(Ti) = 0.050
Figure 8. XRD pattern of TiO2-Cu-Ce at different n(Cu)/n(Ti) ratio
图8. 不同铜掺杂量条件下制备TiO2-Cu-Ce的XRD图

Figure 9. The influence of n(Ce)/n(Ti) ratio on TiO2- Cu-Ce photo-catalytic activity
图9. 铈掺杂量对TiO2-Cu-Ce光催化活性的影响
从图9可以看出,随着铈掺杂量的增加,甲基橙的降解率先升高后下降,在铈掺杂量为n(Ce)/n(Ti) = 0.050时,甲基橙的降解率达到极大值,在MW、UV、MW-UV三种条件下,甲基橙降解率分别为6.89%、96.91%、99.85%,并且三种降解条件下的降解率始终是MW-UV > UV > MW。其原因可能是铈掺杂量较低时,铈元素掺入到TiO2晶格中,造成了二氧化钛的晶格畸变,形成了Ti3+氧化中心;Cu2+的价电子排布为3d9,易得电子形成稳定结构,同时铜离子还可以捕获空穴,而Ce4+的4f和5d电子层均无电子,在紫外光照射时,Ce4+易捕获光电子生成Ce3+,从而使Cu2+和Ce4+成为电子的接受体,电子还可以在Cu2+和Ce4+之间传递,导致载流子扩散长度的增加,延长了TiO2中电子–空穴的复合时间,使得TiO2-Cu-Ce催化剂光催化活性提高[12] -[14] 。
固定n(Cu)/n(Ti) = 0.025条件下,改变铈掺杂量制得的TiO2-Cu-Ce催化剂的红外谱图如图10所示,从该图可知,当n(Ce)/n(Ti)分别为0、0.050和0.075时,催化剂中羟基的伸缩振动吸收峰依次出现在3421.6 cm−1、3421.6 cm−1和3444.8 cm−1处,这表明随着铈掺杂量的增加,羟基的伸缩振动吸收峰向高波数方向移动,羟基的能量提高,催化剂的光催化活性随之升高。由于Ce4+的掺入引起了晶格膨胀,形成了晶格缺陷,更易捕获表面的氧分子,形成活性过氧基,加之Ce4+具有较强的溶剂化作用,利于羟基的附着,紫外光照射时,在TiO2-Cu-Ce的表面可以累积更多的表面羟基,形成游离活性羟基,羟基可以有效的吸收微波能,使反应体系局部温度迅速升高,加快自由基反应,甲基橙迅速被氧化为二氧化碳和水。
不同铈掺杂量条件下制备的TiO2-Cu-Ce催化剂的XRD图如图11所示。根据jade软件分析101晶面的粒径分别为13.4、13.7和17.0 nm,由此可知,随着铈掺杂量的增加,催化剂的粒径略有增加。Ce4+半径较大,其4 f和5 d都是空的,更易于结合O2−的电子,与O结合,从而可以替换TiO2晶格中的Ti,形成Ce-O-Ti键,使晶格造成畸变,键长和键角发生变化,从而造成TiO2-Cu-Ce粒径改变;另外,晶格畸变使分子的极性增大,表面的氢键打开,在微波辐射作用下,催化剂表面形成活性羟基,再加之紫外光照射时,引发自由基反应,有机物被矿化,最终形成无污染的小分子,使催化剂的光催化活性得以提高。
与单一元素掺杂相比,铜–铈共掺杂后TiO2-Cu-Ce催化剂部分晶面的不对称性提高,极性增强,在

A. n(Ce) /n(Ti) = 0; B. n(Ce)/n(Ti) = 0.050; C. n(Ce)/n(Ti) = 0.075
Figure 10. IR spectrum of TiO2-Cu-Ce at different n(Ce)/n (Ti) ratio
图10. 不同铈掺杂量条件下制备TiO2-Cu-Ce的IR谱图
A. n(Ce)/n(Ti) = 0; B. n(Ce)/n(Ti) = 0.050; C. n(Ce)/n(Ti) = 0.075
Figure 11. XRD pattern of TiO2-Cu-Ce at different n(Ce)/ n(Ti) ratio 图11. 不同铈掺杂量条件下制备TiO2-Cu-Ce的XRD图 微波辐射作用下,可以迅速启动极性基团的定向振动,使TiO2-Cu-Ce表面的水脱附下来,形成羟基,再加之紫外光照射时,催化剂吸收光子的能量,造成电子的跃迁,产生电子–空穴对,致使有机物中的键断裂,形成新的中间产物,中间产物在微波的作用下,也会急速振动,体系温度升高,有机污染物键被打开,致使其被氧化成无污染的小分子,从而导致催化剂的光催化活性提高。 在太阳光照射条件下,TiO2-Cu-Ce对甲基橙溶液的降解率如表1所示,从表1可知,随着太阳光照射时间的延长,甲基橙的降解率逐渐提高,当太阳光照射时间达到4 h时,甲基橙几乎达到完全降解,这表明铜–铈共掺杂TiO2-Cu-Ce催化剂具有良好的吸收可见光的性能,也说明铜-铈共掺杂可以使锐钛矿型TiO2的吸收带红移。 3.6. TiO2-Cu-Ce的SEM表征及比表面积分析 在离子液体加入量为5.6 mL,n(Cu)/n(Ti) = 0.025,n(Ce)/n(Ti) = 0.050,微波加热功率210 W,微波加热时间20 min,煅烧温度500℃,煅烧时间2 h条件下,所制得的TiO2-Cu-Ce催化剂SEM图如图12所示。从该图可以看出,TiO2-Cu-Ce催化剂的粒径为纳米级别,微粒近似球形,球形的比表面积较大,稳定性较好,可以充分接触甲基橙溶液,提高光催化活性。 用美国康塔公司的NOVA2000-e型表面分析仪,对所制备的催化剂进行测定,得到TiO2-Cu-Ce对氮气的吸附脱附图如图13所示(该图表示氮气吸附脱附的体积随相对压力的变化,图中红线为吸附曲线,蓝线为脱附曲线)。利用BET分析方法求得煅烧温度为500℃时,催化剂的比表面积为85.163 m2/g,孔容积为0.2132 cc/g,平均孔径为5.007 nm。500℃时TiO2-Cu催化剂(n(Cu)/n(Ti) = 0.025)的比表面积为85.201 m2/g,孔容积为0.1629 cc/g,平均孔径为3.825 nm。由此可知,掺入铈后,催化剂的比表面积变化不明显,但孔容、孔径增大。 图14为TiO2-Cu-Ce催化剂的半孔宽与孔容积及导数关系图(图中红线为氮气吸附体积随催化剂半孔 Table 1. The degradation rate of methyl orange for TiO2-Cu-Ce in sun light 表1. 太阳光照下TiO2-Cu-Ce对甲基橙的降解率 Figure 12. SEM spectrum of TiO2-Cu-Ce catalyst 图12. TiO2-Cu-Ce催化剂的SEM图 Figure 13. BET analysis of TiO2-Cu-Ce catalyst 图13. TiO2-Cu-Ce催化剂的BET曲线 Figure 14. DFT analysis of TiO2-Cu-Ce catalyst 图14. TiO2-Cu-Ce催化剂的DFT曲线 宽度的变化曲线,蓝线为氮气吸附体积的导数随催化剂半孔宽度的变化曲线),利用DFT方法分析求得催化剂的半孔宽为2.4852 nm。500℃时TiO2-Cu催化剂(n(Cu)/n(Ti) = 0.025)的半孔宽为2.1714 nm。从以上分析数据可以看出,TiO2-Cu-Ce催化剂的比表面积较大,较大比表面积增加了催化剂与降解物的接触面,导致催化活性提高。另外,催化剂还拥有较高的孔容积、平均孔径和半孔宽,这为光生–电子空穴对和活性羟基从催化剂表面形成后向溶液中移动提供了空间,同样导致催化剂具有较高的光催化活性。 4. 结论 1) 微波助离子液体中制备TiO2-Cu-Ce催化剂的最优条件为:离子液体用量5.6 mL,硝酸铜与钛酸丁酯的物质的量之比为0.025,硝酸铈与钛酸丁酯的物质的量之比为0.050,微波加热时间20 min,干燥功率210 W,煅烧温度500℃,煅烧时间2 h。 2) TiO2-Cu-Ce催化剂在微波、紫外、微波–紫外三种降解条件下,甲基橙降解率分别为6.89%、96.91%和99.85%。这表明在紫外光照条件下,微波辐射具有强化TiO2-Cu-Ce催化降解甲基橙的作用。这是因为紫外光照射时,催化剂吸收光子的能量,造成电子的跃迁,形成光生电子–空穴对,再加之以微波辐射时,催化剂易形成羟基,微波的热效应使体系温度迅速升高,导致有机污染物的降解速率加快。 3) TiO2-Cu-Ce催化剂结构分析表明,TiO2中掺入铜、铈后制得的催化剂,具有粒径均匀,比表面积、孔容积、平均孔径和半孔宽都较大等特点,这也是TiO2-Cu-Ce催化剂拥有较高的光催化活性的主要原因。 基金项目 国家自然科学基金资助项目(20663007)。 参考文献 (References) NOTES *通讯作者。