Hans Journal of Food and Nutrition Science
Vol.07 No.02(2018), Article ID:24805,9
pages
10.12677/HJFNS.2018.72008
Bound and Free Phenolics and Its Antioxidant Activity in Grape Pomace
Yaxin Ju, Ting Liu, Yan Zhou, Kai Sun, Changwei Ao*
College of Food Science and Technology, Hebei Agricultural University, Baoding Hebei

Received: Apr. 19th, 2018; accepted: May 2nd, 2018; published: May 9th, 2018

ABSTRACT
Grape pomace (GP) provides a rich source of phenolic which has the capacity to act as powerful antioxidant. In this study, aqueous ethanol (50%) was used to the extraction of free phenolic in grape skin and seeds. HCl (
Keywords:GPEs, Bound Phenolic Acid, Free Phenolic Acid, Antioxidant Activity
葡萄皮渣中结合态及游离态酚类物质 及其抗氧化活性
鞠亚辛,刘婷,周研,孙凯,敖常伟*
河北农业大学食品科技学院,河北 保定

收稿日期:2018年4月19日;录用日期:2018年5月2日;发布日期:2018年5月9日

摘 要
酿酒后的葡萄皮渣(GP)中含有丰富的酚类物质,大量文献报道了关于葡萄皮渣中游离态酚类物质的提取和分析,但少有关于皮渣中结合态酚类物质的分析。本研究探讨了葡萄皮渣和葡萄籽中结合态酚类的提取方法;定性和定量分析各提取物中游离态和结合态酚类物质并对其抗氧化活性进行测定和比较。以50%的乙醇分别提取葡萄皮渣和葡萄籽中游离态酚类物质;经乙醇提取后的皮渣和籽采用
关键词 :葡萄皮渣,结合态酚类,游离态酚类,抗氧化活性

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
我国是葡萄生产大国,年种植葡萄数百万亩,葡萄产量的60%以上用于酿酒。葡萄酒酿造过程中产生的葡萄皮渣废弃物占葡萄的一半左右 [1] 。当前葡萄皮渣的利用率普遍很低,绝大多数都被用于肥料、饲料甚至作为废渣垃圾排放,附加值很低,不仅造成环境污染,也是对原料的极大浪费。如何提高葡萄皮渣的综合利用率,降低生产成本,提高附加值和经济效益,减少环境污染,是我国迅速发展的葡萄加工业必须重视的一个重要环节。葡萄中含有较多的酚类物质,是葡萄主要活性物质之一。葡萄多酚主要分布在果皮和种籽中,在酿酒过程中一部分转移到了葡萄酒中,但还有很大一部分残留在压榨后的皮渣中,特别是葡萄籽中的酚类主要还存在于皮渣中 [2] 。据分析,酿造红葡萄酒剩余果皮中多酚含量可达3%~10%,籽中可达5%~13% [3] 。葡萄渣中含有的酚类物质包括原花青素、黄酮类化合物等 [4] ,果皮中主要有花色素类、白藜芦醇及黄酮类,葡萄籽中主要为儿茶素、槲皮苷、原花青素、单宁等 [5] 。
关于多酚化合物生理活性的研究是近年来天然产物研究的热点,也是多酚研究中发展最快的一个方向。许多试验研究资料均显示,多酚具有较强的抗氧化和清除自由基作用,并且还有明显的抑菌、抗癌、抗老化、抗辐射和预防心血管疾病等功效 [6] 。许多研究资料表明:葡萄多酚具有很强的抗氧化活性 [7] ,特别是对超氧阴离子的抑制率明显高于Vc、VE、β-胡萝卜素 [8] [9] ,还具有预防心脑血管疾病、抗突变、抗肿瘤、消炎、防治冠心病与中风等多种药理功能 [10] [11] ,并能有效保护正常细胞不受损伤 [12] [13] ,可广泛应用于食品医药及化妆品行业。
由于天然物质的多样性,酚类物质的提取过程受其在细胞壁中不同的结合方式以及易氧化等诸多因素影响 [14] 。葡萄皮渣中的酚类物质根据能否被有机溶剂直接提取可分为游离态酚类和结合态酚类。游离态酚类可直接被乙醇、甲醇或丙酮等有机溶剂提取;而结合态酚类主要是指与纤维素、半纤维素和果胶等物质结合在一起形成不溶物的酚类化合物。结合态酚类需要通过酶、酸或碱水解,使固定在细胞壁中的酚类被裂解,从而形成游离态酚类后才能被有机溶剂提取 [15] 。在很多植物细胞壁中存在着大量的结合态酚类 [16] 。Torre 等的研究证明酸、碱或酶可有效断裂小麦麸皮细胞壁中的酯键,释放出儿茶素,阿魏酸等一类的多酚物质 [17] [18] 。当前,很多研究报道了葡萄皮渣中多酚类物质的提取,然而一般主要集中在采用有机溶剂直接提取经干燥、粉碎后的皮或籽中的游离态酚类 [6] [19] 。由于结合态酚类通过这种方式不能被有效提取,所以导致葡萄皮渣中多酚类物质的提取率相对较低。为了更为充分地从葡萄皮渣中提取多酚,本试验设计采用前期以有机溶剂提取游离态酚类,再以酸和碱水解皮渣得以释放出结合态酚类后,再以有机溶剂提取。通过分别的两次提取过程以期能提高葡萄皮渣中酚类的提取率。另外通过定性及定量分析各提取物的总酚组成,评价各提取物的自由基清除效果。结果将为今后葡萄皮渣的高效回收利用、开发新型食品抗氧化剂等提供有价值的参考。
2. 材料与方法
2.1. 材料与试剂及仪器
葡萄皮渣来源于河北农业大学食品科技学院葡萄酒酿造实习工厂2013~2015年间酿造红葡萄酒后的葡萄皮渣,葡萄原料购于河北省张家口市怀来县葡萄种植基地,葡萄品种为赤霞珠(Cabernet Sauvignon)。
甲醇、乙醇、重硫酸钾、福林酚试剂和碳酸钠(分析纯)购置于天津市天力化学试剂公司。ABTS试剂、儿茶素、儿茶酸、咖啡酸、表儿茶素和阿魏酸等购置于Sigma公司。己烷、乙腈、乙酸乙酯、钨酸钠、钼酸钠和溴水购置于广东光华化学试剂有限公司。
2.2. 仪器与设备
UV-2802型紫外可见分光光度计(尤尼柯上海仪器有限公司);1200 Series高效液相色谱分析仪(美国Agilent Technogies有限公司)。
2.3. 方法
2.3.1. 葡萄皮籽中酚类物质的提取
葡萄皮渣中游离态和结合态酚类的提取参考Arranz等在小麦麸皮中结合态酚类物质的提取方法 [17] 。具体过程如下:前发酵(添加人工酵母发酵6~7天)结束后的红葡萄酒缪经压榨分离汁液得到葡萄皮和葡萄籽混合物,样品在50℃条件下烘干36 h,烘干的皮渣混合物经适当破损后用适宜孔径筛子将皮渣和籽分开,然后分别对葡萄皮和葡萄籽中酚类物质进行提取。对于皮梗中酚类的提取过程是:将干燥后的皮渣粉碎,过60目筛,取
将50%乙醇提取游离态酚类物质后的葡萄皮和葡萄籽经蒸发去除乙醇和水,分别称取干重
取上述同样处理的葡萄皮和葡萄籽分别称取
2.3.2. GPEs的总酚含量分析
GPEs总酚含量的测定采用福林酚试剂法测定 [19] 。具体过程如下:6组提取物(A, B, C, D, E, F)采用甲醇稀释成适宜浓度后,取0.2 ml分别加入到15 ml玻璃管中,然后各加入1.0 ml蒸馏水和0.2 ml福林酚试剂并摇匀。样品静置1分钟后,各加入7.5%的碳酸钠0.6 ml,然后避光放置20分钟后于765 nm下测定吸光度。每个样品测量3次。采用不同浓度的儿茶素甲醇溶液在与样品测定同样条件下绘制的标准曲线对提取物的总酚含量进行定量。各提取物的总酚含量表示为每克提取物中含有相当于儿茶素的毫克数。
2.3.3. GPEs对ABTS+的清除作用
GPEs的总抗氧化能力的测定采用ABTS+法 [20] 。ABTS溶液的配制:将20 mg ABTS试剂,9 mg重硫酸钾和6 ml蒸馏水混合,25℃温度下置于暗环境中放置16 h以上。使用前,用80%的乙醇将其稀释到734 nm下的吸光度为0.7 ± 0.02。
取GPEs不同浓度甲醇溶液900 μL注入酶标板孔中,每孔加入1800 μL的ABTS+溶液,样品对照组以900 μL甲醇代替样品,酶标仪检测波长设定为734 nm。按照式(1)计算ABTS+清除率。
ABTS+清除率% = (A对照 − A样品)/A对照 × 100%(1)
A对照和A样品分别是对照和样品的吸光值。
2.3.4. GPEs对DPPH自由基的清除作用
GPEs对自由基的清除效果采用DPPH法 [21] ,具体过程如下:取0.1 ml GREs不同浓度甲醇溶液加入到3.9 ml新制备的0.1 mM的DPPH甲醇溶液中。混合物摇匀后避光静置30分钟后517 nm测定吸光值。对照组采用0.1 ml甲醇溶液替代样品。按照式(2)计算DPPH自由基清除率。
DPPH自由基清除率(%) = (A对照 − A样品)/A对照 × 100% (2)
A对照和A样品分别是对照和样品的吸光值。
2.3.5. HPLC分析GPEs中的酚酸
分析采用美国安捷伦公司的1200 Series高效液相色谱分析仪。色谱分析条件如下:采用Promosil反向色谱柱(
流动相A:0.5%乙酸的水溶液;流动相B:甲醇:乙腈=3:1。
洗脱程序:0~2 min:5%B液 + 95%A液;2~10 min:25%B液 + 75%A液;10~20 min:40%B液 + 60%A液;20~30 min:50%B液 + 50%A液;30~40 min:100%B液 + 0%A液;40~45 min:100%B液 + 0%A液;45~50 min:5%B液 + 95%A液。
2.4. 数据处理
采用EXCEL2010对试验数据进行处理,采用SPSS17.0对试验数据进行方差分析。结果以平均值±标准差表示。
3. 结果与分析
3.1. GPEs中总酚含量的分析
儿茶素质量浓度X与吸光度Y呈现良好的线性关系,其标准曲线方程为Y = 0.0071X + 0.1573,R2 = 0.9881。由此标准曲线计算出GPEs中各样品的总酚含量如表1所示。
表1显示,比较各提取物的总酚浓度,经碱水解葡萄皮后所得提取物(E)中的总酚含量最高,达到14,647.8 µg/g,其次是用酸水解葡萄籽的提取物(D),数量为13352.0 µg/g,之后依次是F、C和B,葡萄皮的醇提取物(A)总酚含量最少,只有233.6 µg/g。另外,各提取物的样品重量与浓度相乘后得到对应的总酚含量,经碱水解的葡萄皮(E)得到的总酚量最多,达到14940.8 μg,其次是经酸水解的葡萄籽(D)的酚类含量,数量为9747.0µg,这部分多酚是通过酸碱水解后提取得到的酚类物质,属于结合态的酚类。从表一也可看出,未经水解的皮和籽的提取物总酚含量分别为289.7和1013.1 µg,经酸碱水解后的提取物总酚含量分别为2037.3、9747.0、14940.8和5459.8 µg,葡萄皮渣经酸碱水解后提取的结合态的酚类总量显著高于未水解提取的游离态的总酚含量。结果表明,通过醇提取游离态酚类后的葡萄皮渣再经酸碱水解可显著提高葡萄皮渣中酚类的提取率。
3.2. GPEs对ABTS+和DPPH自由基的清除作用
将经测得的不同浓度的样品吸光值代入公式(1),计算得出样品对ABTS+自由基离子的抑制率,不同样品的浓度梯度对ABTS+自由基的抑制率均呈现良好的线性关系,依据各自线性回归方程计算出他们的半数抑制率,结果如表2所示。
ABTS可被相关试剂氧化生成蓝绿色的自由基阳离子ABTS+,要进行避光处理。在有供氢能力的抗氧化剂(如酚类物质)存在下,ABTS+与被测物质反应,变成没有颜色的ABTS,体系褪色。对ABTS+的半数抑制率越小,即所需样品浓度越少,抗氧化能力越强。因此分析表2结果,B的抗氧化效果最好,
Table 1. Total phenolic content of GPREs
表1. GPREs的总酚浓度及含量
注:表中后两列列的数值为 mean ± S (n = 3),列中数据所示不同字母表示该列数据间具有显著差异性(P < 0.05)。
Table 2. ABTS and DPPH free radical scavenge activities of the GPEs
表2. GPEs对ABTS+和DPPH自由基的清除实验
注:表中的每个数值为 mean ± S (n = 3),表中数据所示不同字母表示该行数据间具有显著差异性(P < 0.05)。
对ABTS有较强的清除作用,在29.7 µg/ml的浓度时,即可对ABTS达到半数清除;其次是E和F的清除效果,在浓度分别为71.7 µg/ml和72.3 µg/ml时达到半数清除,这两种提取方法的差异性是不显著的,但也说明通过碱水解后可有效促进葡萄皮渣中结合态酚类抗氧化物的释放;A、D和C的半数抑制率依次增加,抗氧化性依次降低,且它们之间的差异性两两显著。本次实验的葡萄皮渣的乙醇提取物的总酚含量及抗氧化结果与赵静,M. José等人 [22] [23] 报道的结果相一致。
GPEs对DPPH自由基的清除效果如表2所示,其抗氧化能力的变化趋势基本类似于对ABTS+自由基的清除效果。清除能力最强的为也为B,两者无显著差异。最弱的为C。
3.3. GPREs提取物中主要酚类化合物分析
采用HPLC对GPEs提取物中主要酚类物质进行定性和定量分析。通过参考相关文献,选择了曾经报道过的主要6种葡萄皮渣中的酚类物质:没食子酸、儿茶酸、儿茶素、表儿茶酸、阿魏酸和咖啡酸作为标准品 [5] [6] [13] [23] [24] ,通过分析标准色谱图和样品色谱图中各物质的保留时间及紫外吸收光谱,鉴定出各提取物样品中含有没食子酸、儿茶酸、儿茶素、表儿茶素和阿魏酸等这五种物质。标准品与(a)、(b)、(c)、(d)、(e)和(f)六种提取物的色谱图见图1。通过外标法计算出每种样品中各物质的含量如表3所示。

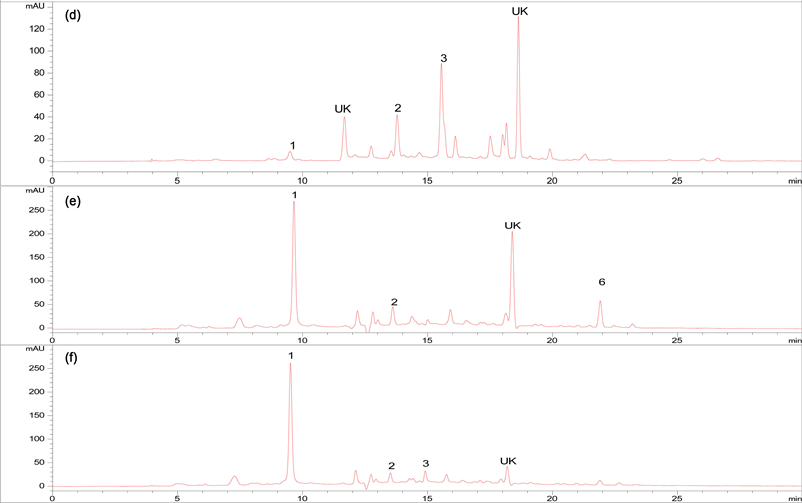 1:没食子酸,2:儿茶酸,3:儿茶素,4:咖啡酸,5:表儿茶素,6:阿魏酸;UK: 表示未能鉴定成分。(a) 葡萄皮渣50%乙醇提取物;(b) 葡萄籽50%乙醇提取物;(c) 葡萄皮渣盐酸水解物;(d) 葡萄籽盐酸水解物;(e) 葡萄皮氢氧化钠水解物;(f) 葡萄籽氢氧化钠水解物。
1:没食子酸,2:儿茶酸,3:儿茶素,4:咖啡酸,5:表儿茶素,6:阿魏酸;UK: 表示未能鉴定成分。(a) 葡萄皮渣50%乙醇提取物;(b) 葡萄籽50%乙醇提取物;(c) 葡萄皮渣盐酸水解物;(d) 葡萄籽盐酸水解物;(e) 葡萄皮氢氧化钠水解物;(f) 葡萄籽氢氧化钠水解物。
Figure 1. HPLC chromatograph of sic phenolic acid standard compounds and six GPEs
图1. 6种酚酸标准品和GPEs的HPLC谱图
Table 3. Content of phenolic acid in 6 GPEs
表3. GPEs中各酚类物质含量
注:表中的每个数值为 mean ± S (n = 3);“--” 表示在提取物中未能检测。
由表3看出A、B、C、D、E和F提取物中均检测出没食子酸,E、F和B中含量较高,含量分别达到0.47、0.43和0.39 mg/ml。除E以外其它提取物中都含有儿茶素;其次是儿茶酸含量;A和B中分别含有表儿茶素,只有E中含有阿魏酸,6种提取物中均未检测到咖啡酸。B中的儿茶素和表儿茶素含量较多,分别为0.347 mg/ml和0.335 mg/ml,在6种提取物中它也表现出最强的抗氧化能力。金青等 [24] 对葡萄皮渣的酚类化合物分析中也鉴定了没食子酸,儿茶素和儿茶酸等成分的存在。
4. 结论
葡萄皮渣经酸和碱水解后能显著促使其酚类物质的释放和增加总酚的提取率。采用50%乙醇提取葡萄皮渣和籽中游离态多酚的总量为1302.8 μg。采用酸水解提取的葡萄皮渣和籽中结合态酚类的总量为11,784.3 μg。而采用碱水解提取的结合态酚类总量为20,400.6 μg。葡萄皮渣经碱水解后,酚类提取物总量提高近20倍。对6种葡萄皮渣提取物中的5种主要酚类物质进行了定性和定量分析,各提取物中的主要酚类物质有没食子酸、儿茶素和儿茶酸等。对6种提取物的抗氧化测试结果均显示了较强的抗氧化能力。研究结果对今后更为高效的开发利用葡萄皮渣,提高其利用率提供了实验和理论依据。
基金项目
河北省自然科学基金,编号:C2016204046;河北省科技支撑计划项目,编号:16227109D。
文章引用
鞠亚辛,刘 婷,周 研,孙凯,敖常伟. 葡萄皮渣中结合态及游离态酚类物质及其抗氧化活性
Bound and Free Phenolics and Its Antioxidant Activity in Grape Pomace[J]. 食品与营养科学, 2018, 07(02): 65-73. https://doi.org/10.12677/HJFNS.2018.72008
参考文献
- 1. 赵静, 景浩. 不同品种葡萄皮、籽提取物多酚含量及抗氧化能力的比较研究[J]. 食品工业科技, 2009, 30(10): 154-159.
- 2. José, J.-P., Dolores, H., Tania, C.-G., et al. (2015) Assessment of White Grape Pomace from Winemaking as Source of Bioactive Compounds, and Its Anti-Proliferative Activity. Food Chemistry, 183, 78-82. https://doi.org/10.1016/S0891-5849(98)00315-3
- 3. 金青, 马晓云, 杨丽丽, 等. 不同溶剂对酿酒葡萄皮渣多酚组成的提取效果比较[J]. 中国食品学报, 2016(4): 182-190.
- 4. 张秀玲, 祝义伟, 孙佳平. 酿酒后的葡萄渣的综合利用[J]. 食品工业科技, 2008(7): 284-286.
- 5. 令博, 王捷, 吴洪斌, 等. 葡萄皮渣多酚超声波辅助提取工艺响应面法优化及抗氧化活性研究[J]. 食品科学, 2011(18): 24-29.
- 6. Makris, D.P., Kallithraka, S. and Kefalas, P. (2006) Flavonols in Grapes, Grape Products and Wines: Burden, Profile and Influential Parameters. Journal of Food Composition and Analysis, 19, 396-404. https://doi.org/10.1016/j.jfca.2005.10.003
- 7. 吴丹, 陈健初. 葡萄多酚的应用研究进展[J]. 食品科学, 2005, 26(3): 94-97.
- 8. 孙静涛, 董娟, 屈静雅, 等. 酿酒葡萄皮渣中多酚物质的提取及其对羟基自由基的清除研究[J]. 现代食品科技, 2012(12): 1743-1746.
- 9. Christina, D., Konstantina, K., Andreas, B., et al. (2015) A Comparative Study on Different Extraction Techniques to Recover Redgrape Pomace Polyphenols from Vinification Byproducts. Industrial Crops and Products, 75, 141-149. https://doi.org/10.1016/j.indcrop.2015.05.063
- 10. 刘军, 李进. 葡萄皮渣的综合利用[J]. 中外葡萄与葡萄, 2006(3): 53.
- 11. Hernan, H.T., Marcela, A.S., Luis, M.M., et al. (2015) Valorization of Grape Pomace: Extraction of Bioactive Phenolics with Antioxidant Properties. Industrial Crops and Products, 74, 397-405. https://doi.org/10.1016/j.indcrop.2015.05.055
- 12. Yamaguchi, F. (1999) Free Radical Scavenging Activity of Grape Seed Extract and Antioxidants by Electron Spin Resonance Spectrometry in an H2O2/NaOH/DMSO System. Journal of Agricultural and Food Chemistry, 47, 2544-2548. https://doi.org/10.1021/jf9806762
- 13. 郭新竹, 宁正祥. 天然酚类化合物及其保健作用[J]. 食品工业, 2002(3): 28-29.
- 14. 凌智群, 张晓辉. 原花青素的药理学研究进展[J]. 中国药理学通报, 2002, 18(1): 9-12.
- 15. Chou, E.J. (2001) Effect of Ingestion of Purple Grape Juice on Endothelial Function in Patients with Coronary Heart Disease. The American Journal of Cardiology, 88, 553-555. https://doi.org/10.1016/S0002-9149(01)01738-6
- 16. Joshi, S.S. (2000) Chemopreventive Effects of Grape Seed Proanthocyanidin Extract on Change Liver Cells. Toxicology, 155, 83-90. https://doi.org/10.1016/S0300-483X(00)00280-8
- 17. Marta, A.C., Carmen, G., María, L., et al. (2014) Effect of Experimental Parameters in the Pressurized Solvent Extraction of Polyphenolic Compounds from White Grape Marc. Food Chemistry, 157, 524-532. https://doi.org/10.1016/j.foodchem.2014.02.078
- 18. Verma, B., Hucl, P. and Chibbar, R.N. (2009) Phenolic Acid Composition and Antioxidant Capacity of Acid and Alkali Hydrolysed Wheat Bran Fractions. Food Chemistry, 116, 947-954. https://doi.org/10.1016/j.foodchem.2009.03.060
- 19. 李羚, 杨雪滢, 高云涛. 双水相分离与超声提取耦合法从葡萄籽中提取抗氧化活性物质研究[J]. 酿酒科技, 2008(5): 27-31.
- 20. Torre, P., Aliakbarian, B., Rivas, B., et al. (2008) Release of Ferulic Acid from Corn Cobs by Alkaline Hydrolysis. Biochemical Engineering Journal, 40, 500-506. https://doi.org/10.1016/j.bej.2008.02.005
- 21. Arranz, S. and Saura Calixto, F. (2010) Analysis of Polyphenols in Cereals May Be Improved Performing Acidic Hydrolysis: A Study in Wheat Flour and Wheat Bran and Cereals of the Diet. Journal of Cereal Science, 51, 313-318. https://doi.org/10.1016/j.jcs.2010.01.006
- 22. Andrea, A., Ariel, R.F., Patricia, P., et al. (2015) Characterization of Polyphenols and Evaluation of Antioxidant Capacity in Grape Pomace of the cv. Malbec. Food Chemistry, 178, 172-178. https://doi.org/10.1016/j.foodchem.2015.01.082
- 23. Ee, B., Alvarex, A.L., Garclayd, et al. (2010) Phenolic Profiles, Antioxidant Activity and in Vitro Antiviral Properties of Apple Pomace. Food Chemistry, 120, 339-342. https://doi.org/10.1016/j.foodchem.2009.09.073
- 24. Re, R., Pellegrini, N., Proteggente, A., et al. (1999) Antioxidant Activity Applying an Improved ABTS Radical Cation Decolorization Assay. Free Radical Biology and Medicine, 26, 1231-1237. https://doi.org/10.1016/S0891-5849(98)00315-3
NOTES
*通讯作者
