Bioprocess
Vol.3 No.1(2013), Article ID:9622,7 pages DOI:10.12677/BP.2013.31001
Optimization of Primary Tupaia Hepatocytes’ Isolation and Culture Condition*
1Faculty of Life Science and Technology, Kunming University of Science and Technology, Kunming
2Institute of Medical Biology, Chinese Academy of Medical Sciences & Peking Union Medical College, Kunming
3Chongqing Institute of Biotechnology, Chongqing Academy of Science & Technology, Chongqing
Email: #djj@imbcams.com.cn, #oliverxia2000@yahoo.com.cn
Received: Feb. 27th, 2013; revised: Feb. 29th, 2013; accepted: Mar. 12th, 2013
ABSTRACT:
Objectives: To get a long-term and stable culture of primary Tupaia hepatocytes (PTH) in vitro, the isolation and culture conditions were optimized through the single factor variation experiments. Methods: The isolation conditions of PTH, such as the formula of liver perfusate and enzyme digestion, the centrifugal factors, and the culture conditions such as cell culture density and medium component have been changed, and the counts, viability and growth status of cultured PTH was evaluated with trypan blue staining and cell counting, MTT detection and EDU labeling method. Results: We found that we can obtain liver cells at the highest yield and dynamic generation by perfusing with D-Hank’s solution with glucose, digesting with D-Hank’s solution containing 0.005 mol/L CaCl2 and 12 × 104 units/L collagenase = 4 \* ROMAN IV at 37˚C for 15 to 20 minutes, washing the obtained cells by gradient centrifugation three times. In addition, the primary tree shrew hepatocytes cultured in Williams’ ME basic medium which supplemented with growth factors (10 ng/ml), glucose (0.25%), ITS-X (1 × multiple), 1% of penicillin and 2% DMSO were able to maintain stable growth up to 42 days in vitro. Conclusion: Therefore, the optimized isolation and culture conditions for primary Tupaia hepatocytes cannot only improve the cell yield greatly and prolong the stable cell proliferation and growth time, but also give a hand to the researches which study the physiological and metabolic properties of hepatocytes and the infection mechanism of hepatotropic virus in tree shrew.
Keywords: Tree Shrews; Primary Hepatocytes Were Isolated and Cultured; Optimization
树鼩原代肝细胞分离培养条件优化*
薛兰洁1,冯 悦1,徐 明1,孙晓梅2,张华堂3,代解杰2#,夏雪山1#
1昆明理工大学生命科学与技术学院,昆明
2中国医学科学院/北京协和医学院昆明医学生物学研究所,昆明
3重庆市科学技术研究院重庆生物技术研究所,重庆
Email: #djj@imbcams.com.cn, #oliverxia2000@yahoo.com.cn
摘 要:
目的:通过优化树鼩原代肝细胞的分离及体外培养条件,获得能够在体外进行长期稳定培养的树鼩原代肝细胞。方法:优化肝脏灌流液、酶消化液及细胞离心速度等原代肝细胞分离条件,培养细胞密度和培养基配方等原代肝细胞培养条件,用台盼蓝染色细胞计数法、MTT检测法及EDU标记法评价所分离、培养树鼩原代肝细胞的数量、活力及生长状态。结果:添加葡萄糖的D-Hank’s液作为灌流液,含有0.005 mol/L CaCl2及12 × 104 units/L胶原酶IV的D-Hank’s液作为消化液,37℃消化15~20分钟,所获得细胞梯度离心洗涤三次,可获得最高得率及活力的原代肝细胞。在Williams’ ME基础培养基中添加生长因子(10 ng/ml),葡萄糖(0.25%)、ITS-X(1 × multiple)、1%青链霉素及2% DMSO时可以维持树鼩原代肝细胞体外稳定增殖生长达42天。结论:树鼩原代肝细胞分离与体外培养条件的优化,可大大提高细胞得率,延长细胞稳定增殖生长时间,有助于以树鼩为模型研究肝细胞生理代谢特性及嗜肝病毒感染机制。
收稿日期:2013年2月27日;修回日期:2013年2月29日;录用日期:2013年3月12日
关键词:树鼩;原代肝细胞;分离;培养;优化
1. 引言
树鼩(tree shrew, Tupaia belangeri)被认为是介于啮齿类与灵长类之间的一种小型哺乳动物,主要分布于云南、贵州、海南、两广地区及邻近东南亚国家。树鼩体型小、繁殖速度快、生理代谢和大体解剖远比啮齿类动物更接近人类,曾被分类为最低等的灵长类,广泛应用于人类疾病研究。利用树鼩已经建立了糖尿病模型,用于研究糖尿病的早期视觉变化[1];建立的急性肾衰竭模型已经应用于肾功能衰竭研究中[2]。树鼩对许多人类医学病毒表现出高度的易感性,如人单纯疱疹病毒、流感病毒、登革热病毒、乙型与丙型肝炎病毒等[3-7],有可能发展为多种病毒性疾病的动物模型。
原代肝细胞(Primary hepatocytes)是研究肝脏代谢病及嗜肝病毒感染与致病机制的重要工具,已经用于相关医学与生物学领域的研究。原代肝细胞的分离方法有很多种,主要分为非灌流法和灌流法两类。非灌流法即用物理或酶消化法处理肝组织,获得原代肝细胞的方法。早在1954年,Dulbecco等[8]首次利用胰酶分离大鼠肝细胞,建立了大鼠原代肝细胞的体外培养技术;刘友平等[9]将胰酶消化法与切割分离法结合起来,用于分离乳小鼠的肝细胞;Mitry等利用[10]利用机械剪切及强力吹打等物理手段,在临床上分离人的原代肝细胞,并用于肝细胞移植手术;王琳等[11]用胶原酶消化法分离新生小鼠肝细胞。1969年,Berry等[12]首次利用灌注法分离原代肝细胞;后来经过对操作技术的不断改进获得较好的分离培养效果[13,14],李涛等[15]采用门静脉顺行和肝静脉逆行离体胶原酶灌注法分离猪肝细胞,对于体型较大的动物,由于其肝组织也相对较大,两步灌流会出现消化不充分的现象。因此Gerlach等[16]在两步灌流的基础上创建了联合门静脉和肝动脉进行五步胶原酶灌流分离猪肝细胞。闵峰等[17]将两步灌注法应用于树鼩的原代肝细胞分离,尽管也实现了细胞体外培养,但细胞稳定增殖与生长的时间较短。与此同时,原代肝细胞的体外培养方法也在随着培养基及细胞培养技术的发展而不断改进,组织块培养法[18]、肝细胞和非实质细胞混合培养方法[19],将原代肝细胞与肝星状细胞系(CFSC-8B)共培养[20],均可使人原代肝细胞长期生长并维持其表型。也有研究者将一些新型材料和微载体技术与原代肝细胞的培养技术相结合,建立了微型多孔的原代肝细胞培养体系及三维结构培养方法[21,22]。
由于树鼩与人类的亲缘关系比啮齿类动物更接近,近年来关于树鼩原代肝细胞培养及在此基础上开展的嗜肝病毒的研究也日渐增多。Kock等[5]用人HBV、绒猴及土拨鼠肝炎病毒感染树鼩原代肝细胞,发现人和绒猴HBV可感染树鼩原代肝细胞,并可低水平复制;Guitart等[23]用HCV感染树鼩原代肝细胞,并进行HCV准中的进化分析发现HCV感染可激活肝细胞NF-kB应答基因,并呈现出炎症反应。
尽管树鼩原代肝细胞分离与体外培养已获得初步成功,在此基础上进行的多种病毒的感染性研究也初步表明树鼩有可能作为这些病毒性疾病的动物模型。然而,现有的树鼩原代肝细胞分离技术尚不能较为稳定、高得率的获得细胞,现有的体外培养技术仍不能选择性培养肝实质细胞,并使培养的生长增殖稳定较长时间。因此,本研究在已有研究基础上,将树鼩原代肝细胞的原位分离与体外培养条件做了进一步优化,实现了树鼩原代肝细胞高得率和体外长期稳定培养,为肝脏生理代谢特性及嗜肝性病毒感染与致病机制研究提供了有力工具,也为相关药物及病毒疫苗的开发奠定了技术基础。
2. 材料与方法
2.1. 材料
2.1.1.实验动物
树鼩为本实验室人工驯化的成年树鼩,雌雄均可,体重150 g~200 g,单笼喂养,自由饮水,饲养温度20℃~25℃。实验参照云南省实验动物管理相关规定,术前进行戊巴比妥钠肌肉注射麻醉,75%医用酒精胸腹部消毒。
2.1.2. 实验药品与试剂
Williams’ ME购自sigma公司,L-Glutaminc、牛血清白蛋白购Biosharp公司,胶原酶Ⅳ、ITS-X、胎牛血清购自GIBCO公司,EGF、HGF购自PeproTech公司。第一步灌流液(无钙Hepes缓冲液;D-Hank’s缓冲液;PBS缓冲液)加入0.1%葡萄糖;第二步灌流液:12 × 104 units/L胶原酶Ⅳ,0.005 mol/L CaCl2溶解于一步灌流液中;基础培养基为Williams’ ME;培养基添加成分:ITS、双抗、DMSO、HGF、EGF、葡萄糖、BSA、FBS、L-Glutamine。
2.2. 方法
2.2.1. 两步灌流法分离树鼩原代肝细胞
实验树鼩后肢肌肉注射盐酸氯胺酮麻醉,保定于解剖板上,75%酒精胸腹部消毒后,紫外照射10 min消毒,自下而上打开腹部,暴露肝脏,于肝门静脉原位灌注第一步灌流液,下腔静脉自然流出,灌注速度以15 ml/min为宜。待肝脏内血液完全被冲洗干净后,使用含钙及胶原酶Ⅳ液的第二步灌流液进行灌流,速度为15 ml/min,待轻压肝脏无弹性即可停止灌流。将肝脏取下置于培养皿中,加入适量的Williams’ Medium E基础培养基,用镊子轻轻剥离肝脏包膜将其中的肝细胞悬浮于培养基中。所取得的肝细胞悬液经2层纱布过滤后,再由200目细胞筛过滤,三次离心洗涤后,台盼蓝染色计算细胞数量及细胞活率。
2.2.2. 树鼩原代肝细胞分离条件的优化
对主要影响原代肝细胞得率(肝细胞数/总细胞数× 100%)和(活细胞数/总细胞数 × 100%)的几个因素进行优化。
取年龄相近,生长状态相似的树鼩进行原代肝细胞的分离,分别用3种不同的缓冲液:无钙Hepes缓冲液、D-Hank’s缓冲液及PBS缓冲液(均含0.1%葡萄糖)作为第一步灌流液。第二步灌流液(含钙胶原酶液)不变。细胞离心洗涤分三组进行比较(A: 1200 rpm/ min,1000 rpm/min,800 rpm/min;B: 1000rpm/min,800 rpm/min,600 rpm/min;C: 800 rpm/min,600 rpm/ min,400 rpm/min),离心时间均为2 min,去除非实质细胞及组织和细胞碎片。分离得到的细胞经台盼蓝染色,计算细胞得率和细胞活率。
2.2.3. 树鼩原代肝细胞培养条件的优化
鼠尾Ⅰ型胶原对细胞贴壁的影响:用含0.172%的无菌冰醋酸溶液溶解鼠尾Ⅰ型胶原至终浓度为50 ug/ml,以5 ug/cm2的量对细胞培养板进行包被,1 h后将包被液去掉,开盖在超净工作台中过夜晾干。将分离得到的树鼩原代肝细胞以105 cell/cm2密度接种于处理后的培养板中,以同样密度细胞接种未处理的细胞培养板中作为对照,4 h后显微镜下观察细胞贴壁情况。
维持培养基的优化:细胞贴壁后即可更换维持培养基,维持培养基在基础培养基Williams’ ME添加BSA、L-Glutamine及生长因子(HGF&EGF)。在此基础上对所添加的ITS-X (0.5×,1×,2×)、FBS (0%,5%,10%)、Glucose (0%,1%,2%)进行浓度优化。优化实验采用单因素变化培养效果比较完成,即在改变一种因素时,另外两种因素保持不变。细胞接种于预先处理过的培养板4 h后贴壁,更换新鲜的优化维持培养基,每24 h更换一次新鲜培养基,观察细胞状态变化。
2.2.4. 细胞生长检测
MTT检测细胞增殖:将条件优化后分离得到的树鼩原代肝细胞以105 cell/cm2密度接种于鼠尾I型胶原包被的48孔培养板中,从接种后24 h开始采用MTT法检测细胞活性,并绘制细胞生长曲线。
为了更加直观的体现的原代肝细胞的增殖,我们采用EDU跟踪标记的方式对细胞内的DNA变化进行检测,通过荧光染料Apollo与EDU发生结合后发出红色荧光,再通过Hoechst 33342染色后,在紫外激发光下显色的方式,对MTT生长曲线中细胞增殖比较明显的时间点进行检测,即增殖的细胞可以发出红色荧光,而未增殖的细胞只有紫外激发光下的蓝色光。EDU染料法测定细胞增值情况,测定时间为接种后24 h内,1 d~3 d,及5 d~7 d三个时间段,显微镜下观察细胞增值数量。
2.2.5. 统计学分析
所得数据采用SPSS17.0进行统计学处理,计量资料以平均数 ± 标准差(X ± S)表示。
3. 结果
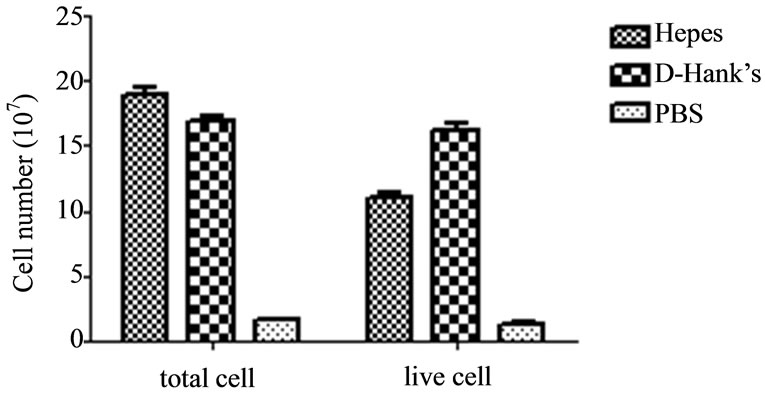
3.1. 灌流液的选择与优化
分别用D-Hank’s、Hepes和PBS缓冲液作为第一步灌流液,第二步消化液配方及细胞离心速度与培养条件不变的情况下,根据从体重相近的树鼩获得的总细胞数和细胞成活率,评价灌流液的优劣。D-Hank’s作为灌流液时得到的细胞数量和活细胞数都高于另外两种缓冲液,并且通过后期的培养观察,细胞状态也优于Hepes和PBS缓冲液作为第一灌注液时分离的细胞,PBS作为第一灌注液得到的细胞数量和细胞活力都明显低于另外两种缓冲液,而Hepes和D-Hank’s虽然在细胞得率上相近,但是活细胞率比较发现,D-Hank’s缓冲液比Hepes高35%(图1)。另外,我们也比较了灌流液中加入葡萄糖的灌注效果,葡萄糖添加与否对细胞得率、细胞成活率及细胞培养效果无明显影响。
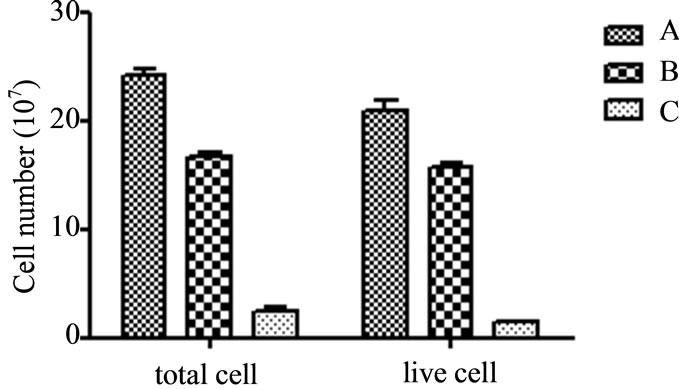
3.2. 细胞离心速度对分离的树鼩原代肝细胞生长的影响
原位灌注获得原代肝细胞悬液,采用梯度降速离心的方式分三组分离原代肝细胞。通过各离心速度组
 (a)
(a) (b)
(b)
Figure 1. The impaction of perfusate on cells’ availability and viability
图1. 灌注液对分离细胞得率、成活率的影响
的细胞得率和细胞成活率比较,发现B组离心条件获得的原代肝细胞,细胞数量和细胞成活率均较高。A组离心条件下获得的原代肝细胞虽然在数量上高于B组,但是细胞成活率下降了11%,较低的细胞成活率对细胞后期生长状态影响较大。C组离心速度降低,得到的细胞数量明显少于A和B组(图2)。B组可获得较高的细胞得率和细胞成活率,在以后的细胞分离过程中,采用此种离心条件。
3.3. 鼠尾Ⅰ型胶原对原代细胞贴壁生长状况的影响
胶原是细胞基质的主要类型,鼠尾I型胶原的加入有利于细胞贴壁。在优化条件下,分离得到的树鼩原代肝细胞,以105 cell/cm2的细胞密度接种于经过鼠尾I型胶原(50 ug/ml)处理过/未处理的细胞培养板中。接种4 h后观察细胞培养状态,含有鼠尾I型胶原的细胞培养板中的细胞贴壁效果明显,细胞出现明显的伸展生长状态(图3(a))。在未处理的培养板中,4小时时细胞尚未完全贴壁,不能看到伸展的细胞形态及细胞核(图3(b))。
3.4. 培养基的选择与优化
对培养基中主要添加物质做单因素变化,根据细
 (a)
(a) (b)
(b)
Figure 2. The impact of centrifugal conditions on cells’ availability and viability
图2. 不同离心条件对分离肝细胞得率和成活率的影响
 (a)
(a)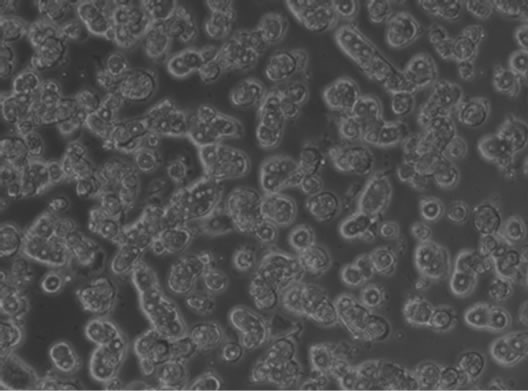 (b)
(b)
Figure 3. The promoter action of rat tail collagen type I on cells adherent culture (×100)
图3. 鼠尾Ⅰ型胶原对细胞贴壁生长的影响(×100)
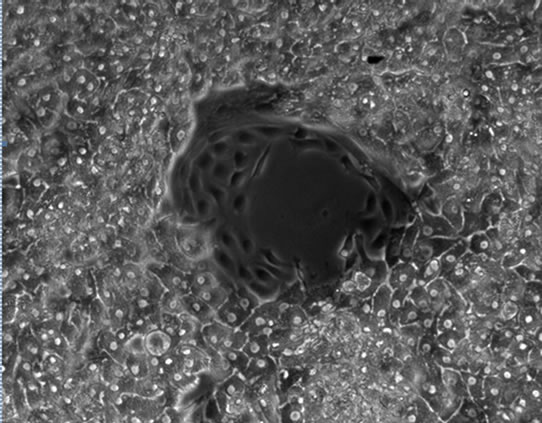
胞生长状态确定添加物FBS、Glucose及ITS对肝细胞生长状况的影响。结果表明,FBS对维持培养期间的细胞影响较大,添加FBS后,非实质细胞增殖成正比例关系,用10%FBS培养,第5天就出现非实质细胞增殖(图4(a)),5%体积添加孔中则推迟至第9天(图4(b))。ITS对非实质细胞的影响小于FBS,在添加量为2×时细胞培养至第23天后非实质细胞开始出现(图4(c))。Glucose对非实质细胞的的增殖并无明显促进作用,但无Glucose的培养细胞在第3天开始出现细胞萎缩的现象(图4(d)),添加1%和2%的Glucose,细胞能够稳定维持其正常的状态,培养至第30天未见明显非实质细胞增殖现象。综合以上,树鼩原代肝细胞的最优培养基为在Williams’ ME基础培养基添加0.15% BSA、0.003% L-Glutamine、2% DMSO、10 ng/ml生长因子、1%青链霉素混合液及1 × ITS 和1% Glucose。
3.5. 优化分离、培养条件下细胞培养状态观察
在优化的细胞分离、培养条件下,按照105 cell/cm2的密度接种于培养瓶中,细胞在体外稳定培养可达6周。细胞接种后4 h贴壁,第二天细胞完全贴壁呈伸展生长状态,汇合度在98%左右,少数细胞已经开始
 (a)
(a)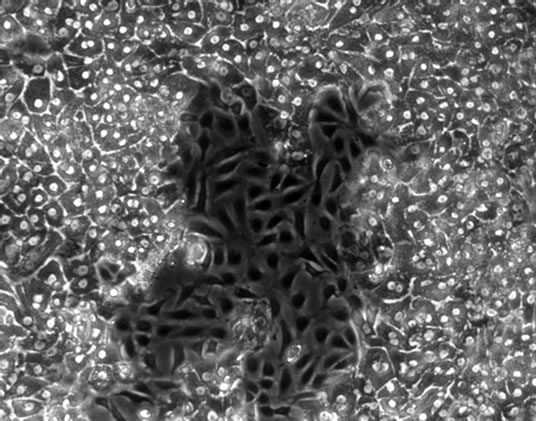 (b)
(b)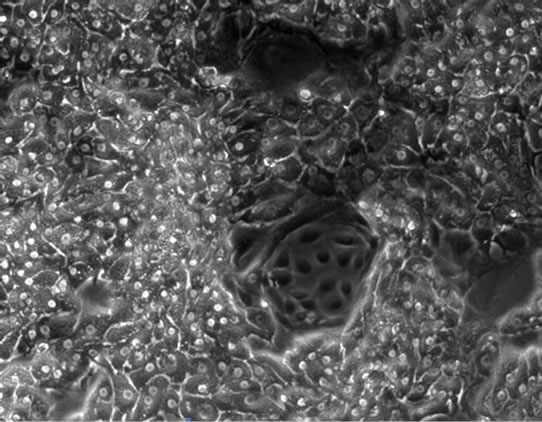 (c)
(c)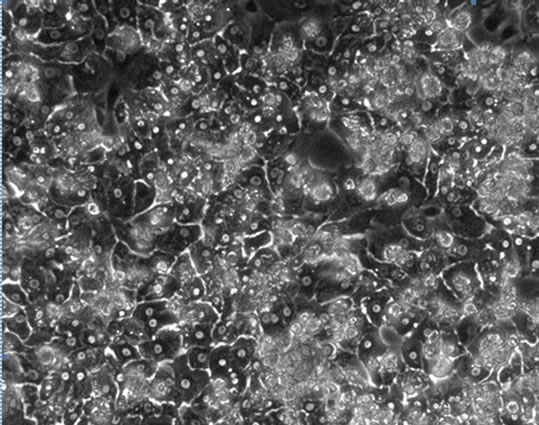 (d)
(d)
Figure 4. The impact of FBS, ITS and Glucose on the maintained cells’ growth (×100)
图4. FBS、ITS及Glucose对维持培养细胞生长状态的影响(×100)
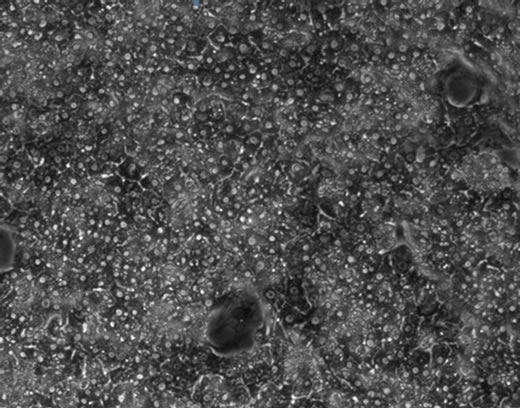
增殖。每两天更换一次培养基,在第6天细胞增殖并贴壁长满培养瓶(图5(a))。细胞维持这种良好生长状态到30天左右(图5(b)和(c)),直到第6周,细胞汇合度明显下降(图5(d)),已有部分细胞死亡。
 (a)
(a)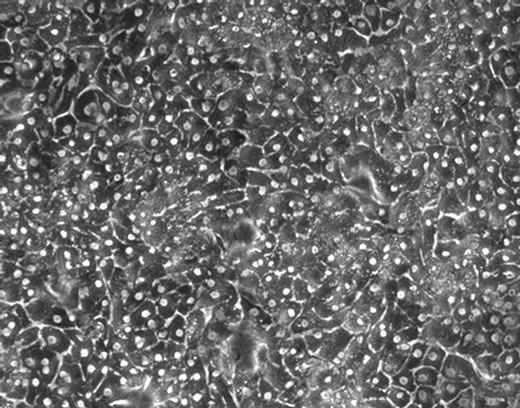 (b)
(b) (c)
(c) (d)
(d)
Figure 5. PTH cell’s growth under the optimized isolation and culture conditions (×100): (a)-(d) cell culture respectively to 18 d, 30 d, 6 d, 42 d
图5. 优化分离、培养条件下树鼩原代肝细胞生长状态(×100):(a)~(d)分别为细胞培养至第6d、18d、30d、42d时的状态
3.6. 细胞增殖检测
在优化的分离、培养条件下,将分离得到的细胞按照105 cell/cm2的密度接种于48孔板中,接种24h后MTT法检测细胞活力,以后每48 h检测一次,直到第21天(图6)。结果表明:细胞接种后由于肝组织细胞,尤其成纤维细胞的快速增殖,MTT检测值在第一周内呈现明显的升高现象。培养第七天后,由于成纤维细胞的凋亡,MTT值急剧降低,此后肝实质细胞增殖,MTT值增长并保持稳定至第5周,随着培养细胞的死亡而下降。
EDU可以将所有细胞核染为蓝色,增殖细胞核呈红色,根据染色情况可判断细胞是否处于增殖状态。根据MTT生长曲线选择接种后4~24 h,2~5 d,及7~9 d三个时间段作为EDU跟踪标记测定时间,显微观察计数增殖细胞数量。经观察,细胞贴壁后24 h内增殖细胞数量较少(图7(a)),而在第2~5天与7~9天跟踪标记期间,细胞增殖数量明显增多(图7(b)和(c))。从而更加直观的体现了MTT中细胞增殖时的状态。
4. 讨论
树鼩作为疾病模型越来越受到研究重视,树鼩原代肝细胞是研究肝脏疾病模型的重要工具,该类细胞的分离与培养在医学和生物学相关研究中具有重要作用。原代肝细胞的培养技术经过40多年发展,直到最近几年才应用到树鼩原代肝细胞的分离培养。在此过程中,细胞分离、培养条件不断得到发展和优化,但仍有多种因素影响树鼩原代肝细胞分离培养效果,其分离和培养条件仍需进一步优化。
已有的原代肝细胞分离方法以原位灌注法为主[17,24],也有研究者尝试采用肝组织块胰酶消化法进行细胞分离[25],但细胞的得率和成活率均比较低,故本研究选择原位灌注法分离肝细胞。原位灌注法中的灌流液是最先接触到肝细胞的缓冲液,且消化液的配制
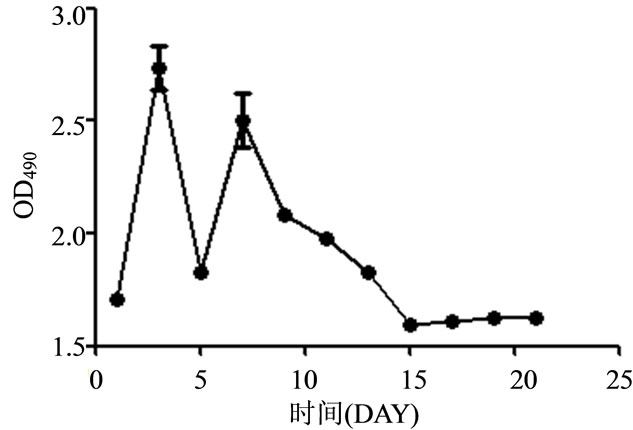
Figure 6. The MTT detection value curve of PTH under the optimized isolation and culture condition
图6. 优化分离、培养PTH生长状况后掉T标始出现细胞密度下降的现象检测值变化曲线
 (a)
(a)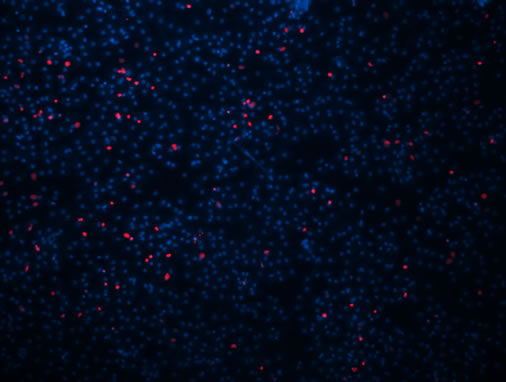 (b)
(b)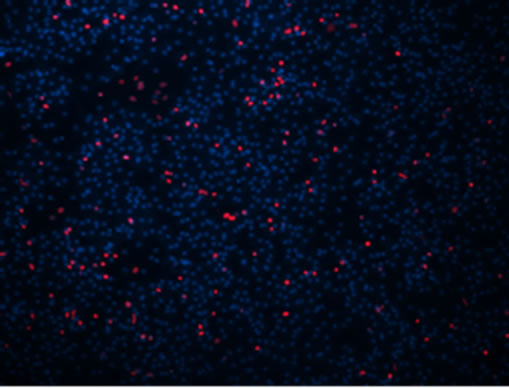 (c)
(c)
Figure 7. EDU marker of proliferating cells (×100)
图7. EDU标记增殖细胞(×100)
基础也是灌注液,灌流液的pH及渗透压对获得肝细胞的数量和活力具有重要的影响。本研究对报道过的几种灌注液进行了比较,结果表明添加0.1%葡萄糖的D-Hank’s作为灌注液效果最佳。灌注完成后的离心条件也是分离得到原代肝细胞的纯度及活力主要影响因素,离心力增大会提高细胞得率,但同时也降低细胞活力,本实验通过梯度降速,比较不同条件下细胞得率和活力,选择最佳的离心速度,既保证了细胞得率,又能提高细胞的纯度和活力。
培养原代肝细胞生长主要受到基础培养基、培养基中添加物及细胞生长基质的影响。我们对鼠尾Ⅰ型胶原影响细胞贴壁的效果进行了比较,细胞接种到培养板4小时,以胶原作为生长基质的培养板利于细胞贴壁,细胞形态清晰可见,在无胶原的基质上仅有少数细胞贴壁,细胞生长状况差。而在细胞贴壁后由于所分离的原代肝细胞中包含少量的非实质细胞,虽然有文献报道[19]非实质细胞分泌HGF,及其中的脂肪细胞分泌的胶原[26]有利于肝实质细胞的增殖及维持其生物学特性,但是非实质细胞的存在对于肝细胞的生长起着双刃剑的作用,若不能在保证实质细胞正常生长及分化的前提下有效抑制非实质细胞的生长,在培养期间非实质细胞,尤其是脂肪细胞,即所谓的“成纤维细胞”[26],在早期的培养中显微镜下很难观察到,4 d后开始增殖,并逐渐取代肝实质细胞,这些细胞一旦开始增殖就快速增殖,在空间上占据优势地位。因此我们在原代肝细胞的培养基中加入2%的DMSO [27],一方面使肝细胞在体外培养时保持良好的分化状态及非复制状态,另一方面抑制非实质细胞过度生长。而铺板时的细胞密度对于肝细胞的生长也存在一定的影响[28],实验中我们采用105 cell/cm2的密度将细胞接种于培养板中,细胞贴壁后24小时即可完全伸展,第三天细胞间成完全接触的状态。在优化条件下分离培养的树鼩原代肝细胞,第一周呈现明显的贴壁增殖现象,EDU染色也可见增殖细胞,观察细胞培养至第5周出现细胞的密度逐渐减小的现象,但保持细胞融合度70%以上的维持培养超过6周。
综上所述,本研究通过比较各因素对细胞的影响,优化了树鼩原代肝细胞的分离培养方法,最终能够使树鼩原代肝细胞体外培养达到6周,为利用树鼩原代肝细胞为基础的研究提供了有利的工具。但是原代肝细胞尚不能进行冻存和传代,限制了原代肝细胞的利用效率,因此有待进一步探索,为后续的研究提供更好的平台。
5. 致谢
本研究得到昆明理工大学生命科学与技术学院刘丽老师,庞义全同学的帮助,谨此致谢!
参考文献 (References)
[1] S. Ishiko, A. Yoshida, F. Mori, et al. Early ocular changes in a tree shrew model of diabetes. Nihon Ganka Gakkai Zasshi, 1997, 101(1): 19-23.
[2] M. Steinhausen, H. Thederan, D. Nolinski, et al. Further evidence of tubular blockage after acute ischemic renal failure in Tupaia belangeri and rats. Virchows Archiv A, 1978, 381(1): 13- 34.
[3] G. Darai, L. Zoller, B. Matz, et al. Experimental infection and the state of viral latency of adult tupaia with herpes simplex virus type 1 and 2 and infection of juvenile Tupaia with temperature-sensitive mutants of HSV Type 2. Archives of Virology, 1980, 65(3-4): 311-318.
[4] Y. Amako, K. Tsukiyama-Kohara, A. Katsume, et al. Pathogenesis of hepatitis C virus infection in Tupaia belangeri. Journal of Virology, 2010, 84(1): 303-311.
[5] J. Kock, M. Nassal, S. MacNelly, et al. Efficient infection of primary tupaia hepatocytes with purified human and woolly monkey hepatitis B virus. Journal of Virology, 2001, 75(11): 5084- 5089.
[6] X. Xu, H. Chen, X. Cao, et al. Efficient infection of tree shrew (Tupaia belangeri) with hepatitis C virus grown in cell culture or from patient plasma. Journal of General Virology, 2007, 88(9): 2504-2512.
[7] Y. Tong, Y. Zhu, X. Xia, et al., Tupaia CD81, SR-BI, claudin-1, and occludin support hepatitis C virus infection. Journal of Virology, 2011, 85(6): 2793-2802.
[8] R. Dulbecco, M. Vogt. Plaque formation and isolation of pure lines with poliomyelitis viruses. Journal of Experimental Medicine, 1954, 99(2): 167-182.
[9] 刘友平, 丁慧荣, 何涛等. 一种简单、经济、高效的大量肝细胞培养方法[J]. 生物学通报, 2005, 40(1): 47-48.
[10] R. R. Mitry, R. D. Hughes, M. M. Aw, et al. Human hepatocyte isolation and relationship of cell viability to early graft function. Cell Transplant, 2003, 12(1): 69-74.
[11] 王琳, 徐建波, 田元等. 一种分离新生小鼠肝细胞的简单方法[J]. 中国优生与遗传杂志, 2007, 15(1): 10-12.
[12] M. N. Berry, D. S. Friend. High-yield preparation of isolated rat liver parenchymal cells: A biochemical and fine structural study. Journal of Cell Biology, 1969, 43(3): 506-520.
[13] R. H. Bhogal, J. Hodson, D. C. Bartlett, et al. Isolation of primary human hepatocytes from normal and diseased liver tissue: A one hundred liver experience. PLoS One, 2011, 6(3): e18222.
[14] L. Pichard, E. Raulet, G. Fabre, et al. Human hepatocyte culture. Methods in Molecular Biology, 2006, 320: 283-293.
[15] 李涛, 彭志海, 孙星等. 经肝静脉与门静脉离体灌注分离猪肝细胞的比较研究[J]. 肝脏, 2005, 10(1): 22-23.
[16] J. Gerlach, J. Brombacher, M. Smith, et al. High yield hepatocyte isolation from pig livers for investigation of hybrid liver support systems: Influence of collagenase concentration and body weight. Journal of Surgical Research, 1996, 62(1): 85-89.
[17] 闵峰, 郝飞, 刘冰等. 树鼩肝细胞的分离和培养[J]. 世界华人消化杂志, 2001, 9(6).
[18] 聂兴草, 方峰. 一种改良的小鼠原代肝细胞培养方法[J]. 同济医科大学学报, 2000, 29(2).
[19] S. N. Bhatia, U. J. Balis, M. L. Yarmush, et al. Effect of cell-cell interactions in preservation of cellular phenotype: Cocultivation of hepatocytes and nonparenchymal cells. FASEB Journal, 1999. 13(14): 1883-1900.
[20] K. Banaudha, J. M. Orenstein, T. Korolnek, et al., Primary hepatocyte culture supports hepatitis C virus replication: A model for infection-associated hepatocarcinogenesis. Hepatology, 2010, 51(6): 1922-32.
[21] S. R. Khetani, S. N. Bhatia. Microscale culture of human liver cells for drug development. Nature Biotechnology, 2008, 26(1): 120-126.
[22] S. Wang, D. Nagrath, P. C. Chen, et al. Three-dimensional primary hepatocyte culture in synthetic self-assembling peptide hydrogel. Tissue Engineering: Part A, 2008, 14(2): 227-236.
[23] A. Guitart, J. I. Riezu-Boj, E. Elizalde, et al. Hepatitis C virus infection of primary tupaia hepatocytes leads to selection of quasispecies variants, induction of interferon-stimulated genes and NF-kappaB nuclear translocation. Journal of General Virology, 2005, 86(11): 3065-3074.
[24] 张顶, 高丽, 张远旭等. 树鼩肝细胞体外分离培养体系的复建及主要影响因素分析[J]. 动物学研究, 2009, 30(1): 24-30.
[25] 张晶晶, 苏建家, 杨光. 两种原代树鼩肝细胞的分离和培养方法的研究[J]. 四川动物, 2009, 28(2): 170-171.
[26] J. J. Maher, D. M. Bissell, S. L. Friedman, et al. Collagen measured in primary cultures of normal rat hepatocytes derives from lipocytes within the monolayer. Journal of Clinical Investigation, 1988, 82(2): 450-459.
[27] E. E. Cable, H. C. Isom. Exposure of primary rat hepatocytes in long-term DMSO culture to selected transition metals induces hepatocyte proliferation and formation of duct-like structures. Hepatology, 1997, 26(6): 1444-1457.
[28] K. Mizuno, O. Higuchi, H. Tajima, et al. Cell density-dependent regulation of hepatocyte growth factor receptor on adult rat hepatocytes in primary culture. Journal of Biochemistry, 1993, 114(1): 96-102.
NOTES
*基金项目:研究得到国家自然科学基金资助项目(81260248),国家重大基础研究计划(973)项目(2009CB522502),国家科技支撑计划项目(2011BAI15B01-21, 2012BAI39B01)的支持。
#通讯作者。