Bioprocess
Vol.05 No.01(2015), Article ID:14830,4
pages
10.12677/BP.2015.51001
Influences on Fluidity of Artificial Cell Membrane by Cholic Acid
Jinye Zheng, Lujun Li, Wenyan Xie, Xiyan Hou, Liying Zhang, Shengdi Fan, Liming Jin*
College of Biological Science Dalian Nationalities University, Dalian Liaoning
Email: *jlm@dlnu.edu.cn
Received: Jan. 19th, 2015; accepted: Feb. 6th, 2015; published: Feb. 12th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
The natural phospholipid DMPC and Ala, a kind of synthetic peptide lipid, were used to prepare artificial cell membrane vesicles. 10%, 20% and 30% cholic acid were added into the samples, respectively. DPH was taken as the fluorescence reagent and the influences on the fluidity of two kinds of vesicle samples were examined by fluorescence polarization technology. The results showed that in the setting temperature range, cholic acid of different concentrations had little effect on the fluidity of DMPC vesicles. For Ala vesicles, in the temperature range of gel phase, polarization value decreased while the fluidity increased with the elevation of cholic acid concentrations. However, in the temperature range of liquid phase, cholic acid of different concentrations showed little effect. This research provides the theory basis on interaction mechanism of cholic acid and cell membrane in the natural organism.
Keywords:Artificial Cell Membrane, Fluidity, Cholic Acid, DPH, Fluorescence Polarization Technology

胆酸对人工细胞膜流动性的影响
郑金冶,李璐均,谢文妍,侯熙彦,张丽影,范圣第,金黎明*
大连民族学院 生命科学学院,辽宁 大连
Email: *jlm@dlnu.edu.cn
收稿日期:2015年1月19日;录用日期:2015年2月6日;发布日期:2015年2月12日

摘 要
以天然磷脂1,2-二-十四烷基磷脂酰胆碱(DMPC)和合成肽脂Ala制备人工细胞膜,向不同样品中分别加入10%、20%、30%的胆酸,以1,6-二苯基-1,3,5-己三烯(DPH)作为荧光试剂,利用荧光偏光法检测不同浓度胆酸对人工细胞膜的流动性的影响。结果表明,在实验设置的温度范围内,不同浓度的胆酸对DMPC囊泡的流动性影响不大。Ala囊泡在凝胶态温度下,随着胆酸浓度的增加,偏光值P值逐渐减小,流动性增大;而在液晶态温度下,不同浓度胆酸对Ala囊泡的流动性影响不大。本实验为阐明生物体内胆酸和细胞膜的相互作用机理提供了参考依据。
关键词 :人工细胞膜,流动性,胆酸,DPH,荧光偏光法

1. 引言
细胞是一切生物体的基本结构单位,细胞均由细胞膜、细胞质和细胞核组成。细胞膜在细胞的新陈代谢中起着重要作用,它与许多生命现象和生命活动密切相关,是能量转换、物质运输、生物传感和信号传导的场所。因此,对于细胞膜的研究有重要意义。但是,天然细胞膜不稳定,且结构复杂,给相关研究带来了很大难度,因此,对细胞膜进行简化研究已日益受到人们的关注,许多结构简单的模拟生物膜作为细胞膜或者生物膜的模型被广泛的加以研究,这些模拟膜包括泡囊或脂质体、双层磷脂膜(BLM)、LB膜(Langmuir Blodgett film)等[1] 。本课题组一直从事仿生体系细胞信号转导的研究,主要使用天然磷脂和合成肽脂质来制备多种人工细胞膜,继而研究人工细胞膜的性质,并且研究在人工细胞膜上的细胞信号转导机制[2] -[6] 。
细胞膜的流动性(fluidity)是细胞膜重要的生物物理特征,改变细胞膜的流动性可以改变细胞膜的功能。适宜的膜流动性对细胞膜功能的正常表现是一个极为重要的条件,一切膜的基本活动均在细胞膜的流动状态下进行[7] 。因此,研究细胞膜的流动性是了解细胞膜结构与功能的一个重要指标。
胆酸是胆汁的主要成分之一,在生物体内可以形成胶束,从而清除体内脂溶性垃圾。在此过程中,胆酸与细胞膜有一定的相互作用,但是,其相互作用机理至今尚不清楚。
本文首先利用天然磷脂1,2-二-十四烷基磷脂酰胆碱(DMPC)和合成的肽脂质N,N-二-十六烷基-Na-6-三甲胺基己酰基-L-丙氨酰胺(N+C5Ala2C16)制成两种人工细胞膜,分别在其中加入不同浓度的胆酸,采用荧光偏光法测定胆酸对两种人工细胞膜流动性的影响,以期为阐明生物体内胆酸和细胞膜的相互作用机理提供参考依据。
2. 实验部分
2.1. 仪器与试剂
LS-55型荧光分光光度计(美国PE公司);Sonifier 250D杯型超声仪(美国BRANSON公司);HI98128型pH计(美国Hanna公司);移液器(德国Brand公司);超纯水装置(美国MILLIPORE公司)。
1,6-二苯基-1,3,5-己三烯(DPH),N-2-羟乙基哌嗪-N'-2-乙基磺酸(HEPES),胆酸,均为美国Sigma试剂。1,2-二-十四烷基磷脂酰胆碱(DMPC)为日本NOF Corporation试剂。其它均为国产分析纯试剂。
2.2. 实验方法
2.2.1. 肽脂质的合成
肽脂质N,N-二-十六烷基-Na-6-三甲胺基己酰基-L-丙氨酰胺(N+C5Ala2C16,以下简称Ala)的合成包括如下四个步骤:(a) α-氨基被保护的丙氨酸在DCC的作用下与双十六烷基胺缩合;(b) 氨基酸残基脱保护;(c) 得到的产物与溴代酰氯反应,引入连接部位;(d) 季铵盐极性头部的引入 [8] 。
2.2.2. 样品调制
将肽脂质Ala和磷脂DMPC分别溶于氯仿,使其终浓度为0.5 mM。分别加入0%,10%,20%,30%的胆酸。将DPH用氯仿溶解,加入上述混合物中,使其终浓度为10−4 mM。在氮气流下使溶剂挥发制成薄膜,真空干燥3 h,彻底去除溶剂。加入HEPES缓冲溶液(10 mM,pH 7.0),30˚C水浴温育20 min后,旋涡振荡,最后用杯型超声仪在25˚C、60 W条件下超声处理10 min,得到样品溶液,即分别含有0%,10%,20%,30%胆酸的肽脂质Ala囊泡和磷脂DMPC囊泡共8个样品。
本文所用主要化合物的结构如图1所示。
2.2.3. 荧光测定
使用LS-55 型荧光分光光度计测定胆酸加入比例分别为0%,10%,20%,30%的肽脂质Ala和磷脂DMPC囊泡8个样品的荧光偏振值P,设定激发波长和发射波长分别为360 nm和430 nm。在15℃~35℃范围内,以温度为横坐标,以荧光偏振值P为纵坐标作图。
3. 结果与讨论
荧光偏光法是研究温度对细胞膜流动性作用的一种常用方法 [9] [10] 。已知荧光偏光测试的原理为:在光线入射和检测处加入垂直的滤光片,光源光束经入射单色器色散,提取所需波长单色光照射于样品上,由样品发出的荧光经发射单射器射散后照射于光电倍增管,光电倍增管把荧光强度信号转化成电信号并经放大器放大后于记录器或读出信号。
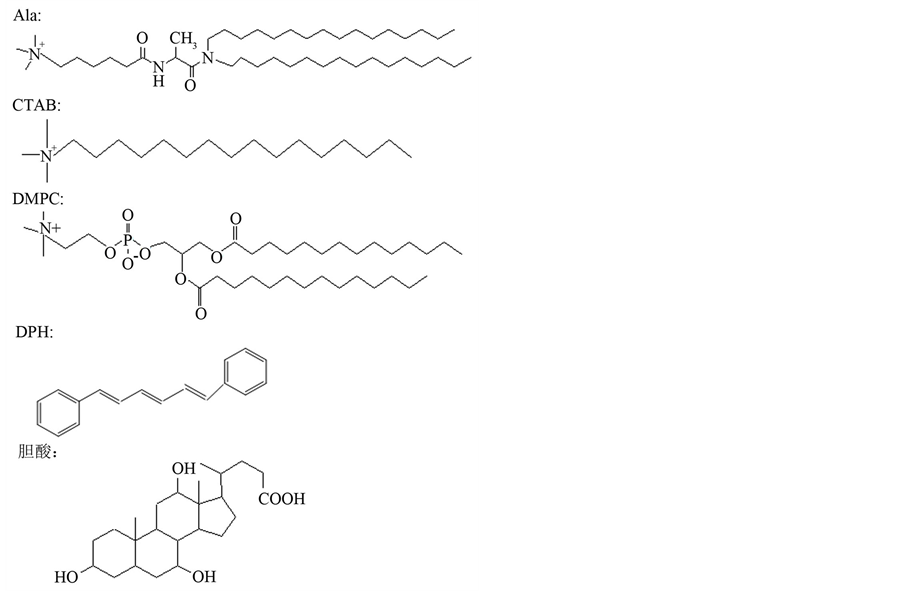
Figure 1. Structural formula of main compounds
图1. 主要化合物结构式
偏光度以P表示:
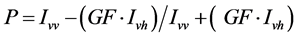
其中:P——偏光度;Ivv——垂直光强;Ivh——水平光强;GF——偏光因子。
从偏光度P的定义式中可以看出,荧光偏光度P值越大,说明介质的流动性越小。
本实验以DPH作为荧光探针,采用荧光偏光法研究胆酸对人工细胞膜流动性的影响。DPH是一种刚性分子,在亲水介质中以顺式结构存在,几乎没有荧光,但它一旦进入疏水的环境后,则成为全反式结构而发出强烈的荧光。将人工细胞膜和DPH共同温育,DPH很容易插入膜脂双层中并发出荧光,DPH插入的方式是分子的长轴与膜脂双层的脂肪链分子长轴平行。因此,DPH可以作为荧光标记物用以衡量介质流动性的大小。
田文杰等指出,相变是双层膜囊泡的重要性质之一 [4] 。膜的流动性与温度有密切关系,温度升高将引起脂质由有序排列的凝胶相到无序排列的液晶相的转变,转变时的温度称为相变温度(Tm)。从图2,图3中可以看到,随着温度的升高,磷脂DMPC囊泡和肽脂质Ala囊泡的P值都下降,即流动性升高,这符合随着温度的升高,膜的流动性增强的普遍规律。
从图2中可以看出,在实验设置的温度范围内,在磷脂DMPC囊泡样品中加入10%,20%,30%不同浓度的胆酸后,样品的P值与不加胆酸的DMPC囊泡样品的P值相比变化不大,这可能是由于胆酸分子中含有三个羟基,分子间氢键作用较强,使得胆酸分子能够聚集在一起,形成相分离状态,故加入胆酸对DMPC膜的流动性影响不大。
从图3中可以看出,在实验设置的温度范围内,在肽脂质Ala囊泡样品中,在高于相变温度的条件下,10%,20%,30%不同浓度的胆酸对肽脂质Ala囊泡样品的P值影响不大;但在低于相变温度的条件下,加入胆酸后使Ala囊泡样品的P值下降,且随着加入胆酸浓度的增高,P值下降程度增大。这可能是由于胆酸能与肽脂质Ala形成分子间氢键,从而影响其流动性,而这种影响在有序排列的凝胶相要远远大于无序排列的液晶相。具体作用机理还有待于进一步分析。
4. 结论
本文采用荧光偏光法研究了不同浓度的胆酸对合成肽脂质Ala和天然磷脂DMPC形成的人工细胞膜
 注:0,1,2,3分别表示胆酸加入比例为0,10%,20%,30%
注:0,1,2,3分别表示胆酸加入比例为0,10%,20%,30%
Figure 2. Influence on fluidity of DMPC vesicles of cholic acid
图2. 胆酸对DMPC囊泡流动性的影响
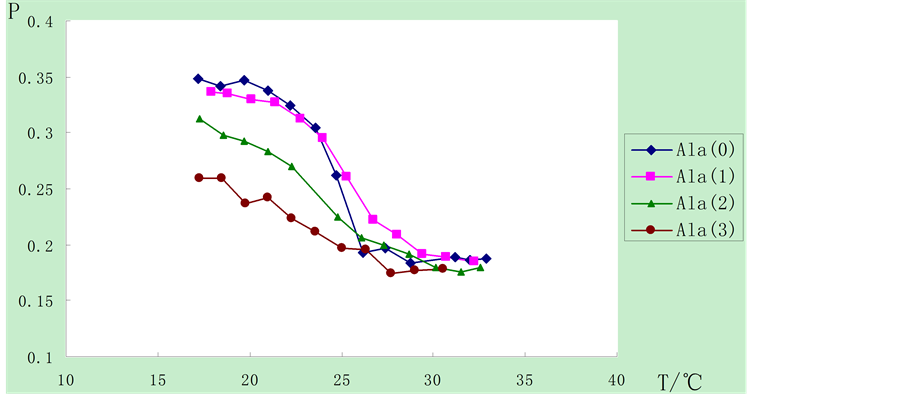 注:0,1,2,3分别表示胆酸加入比例为0,10%,20%,30%
注:0,1,2,3分别表示胆酸加入比例为0,10%,20%,30%
Figure 3. Influence on fluidity of Ala vesicles of cholic acid
图3. 胆酸对Ala囊泡流动性的影响
的流动性的影响,得出在实验设置的15℃~35℃温度范围内,10%,20%,30%的胆酸对天然磷脂DMPC人工细胞膜的流动性的影响不大;而对合成肽脂质Ala人工细胞膜的流动性有影响,且这种影响在有序排列的凝胶相要远远大于无序排列的液晶相。本实验结果为阐明生物体内胆酸和细胞膜的相互作用机理,以及研究胆酸对合成肽脂质人工细胞膜的作用提供了一定参考依据。
基金项目
国家自然科学基金(21372037);辽宁省教育厅项目(L2013510);中央高校基本科研业务费(DC201501020302);大连民族学院“太阳鸟”项目。
文章引用
郑金冶,李璐均,谢文妍,侯熙彦,张丽影,范圣第,金黎明, (2015) 胆酸对人工细胞膜流动性的影响
Influences on Fluidity of Artificial Cell Membrane by Cholic Acid. 生物过程,01,1-5. doi: 10.12677/BP.2015.51001
参考文献 (References)
- 1. 王建国, 江黎丽, 惠飞, 等 (2007) 脱氧胆酸钠与支撑磷脂双层膜作用的电化学研究. 化学学报, 3, 239-245.
- 2. Tian, W.J., Sasaki, Y., Kikuchi, J., et al. (2005) Switching of enzymatic activity through functional connection of molecular recognition on lipid bilayer membranes. Supramolecular Chemistry, 17, 113-119.
- 3. 刘宝全, 赵明明, 王剑锋, 等 (2010) 人工细胞膜上天然酶与人工受体的分子间通讯. 化学研究与应用, 7, 930- 933.
- 4. 田文杰, 佐佐木善洪, 池田泄志, 等 (2004) 仿生信号转导体系的构建: 囊泡表面磷脂信号分子诱发的乳酸脱氢酶的激活. 化学学报, 13, 1230-1236.
- 5. 佟大维, 赵明明, 王剑锋, 等 (2007) 辅酶I诱导阳离子囊泡的聚集和酶分散的研究. 精细化工, 12, 1176-1179.
- 6. 刘宝全, 王剑锋, 石太德, 等 (2011) 利用超分子体系模拟生物体G蛋白耦联受体型信号转导过程. 大连民族学院学报, 3, 248-252.
- 7. 沈同, 王镜岩 (2000) 生物化学. 高等教育出版社, 北京, 447-449.
- 8. 张乾顺, 田文杰, 金黎明, 等 (2008) 新型复合脂质体Cerasome稳定性的研究. 大连民族学院学报, 3, 214-216.
- 9. 张鹰, 曾新安, 温其标, 等 (2008) 荧光偏振法研究脉冲电场对酿酒酵母细胞膜流动性影响. 光谱学与光谱分析, 1, 156-160.
- 10. 强蕴蕴, 张阳, 支周, 等 (2001) 应用荧光偏振技术研究缺氧再灌注培养血管内皮细胞膜流动性. 西安医科大学学报, 4, 371-373.