Medical Diagnosis
Vol.2 No.1(2012), Article ID:534,5 pages DOI:10.12677/md.2012.21001
The Molecular Cloning and Bioactivity Characterization of Unknown Gene 1C10 from Medicinal Fungus Agrocybeaegerita
1Department of Clinical Immunology, Guangdong Medical College, Dongguan
2Department of Occupational and Environmental Health, Guangdong Medical College, Dongguan
3The College of Life Sciences, Wuhan University, Wuhan
Email: liangyi@gdmc.edu.cn
Received: Feb. 29th, 2012; revised: Mar. 9th, 2012; accepted: Mar. 10th, 2012
ABSTRACT:
Objective: The antitumor-associated gene of Agrocybe aegerita was cloned to identify the bioactivity. Method: cDNA library was constructed and the gene 1C10 was obtained by random sequencing. The differential expression of the gene was analyzed by high-throughout sequencing. The eukaryotic expression vector was constructed to detect cell apoptosis and senescence activity. Result: The gene of 1C10 was cloned with 728 bp and 107 amino acid residues. The high-throughout sequencing analyse showed that 1C10 was highly expressed in the fruiting body. The expression in HeLa cells could induce the cell apoptosis instead of senescence. Conclusion: 1C10 was identified to have antitumor activity by cDNA library and sequencing, which was fundation for further study.
Keywords: Medicinal Fungus; Antitumor Activity; cDNA Sequence
药用真菌杨树菇未知基因1C10克隆及其抗肿瘤活性初步鉴定
梁 一1*,郭莲仙2*,孙 慧3
1广东医学院检验学院临床免疫教研室,东莞
2广东医学院公共卫生学院劳动卫生与环境卫生教研室,东莞
3武汉大学生命科学学院,武汉
Email: liangyi@gdmc.edu.cn
摘 要:
目的:克隆杨树菇抗肿瘤相关蛋白基因,初步鉴定其活性。方法:构建cDNA文库,随机测序得到杨树菇基因1C10。高通量测序分析其在菌丝体和子实体的差异表达。构建真核表达质粒检测其在HeLa细胞中表达引起的细胞凋亡及衰老的变化,初步鉴定其抗肿瘤活性。结果:得到全长为728 bp的杨树菇基因1C10,编码107个氨基酸,高通量测序分析发现其在子实体中为高表达。在真核细胞中表达会引起肿瘤细胞的凋亡而非衰老。结论:通过构建cDNA文库及测序初步鉴定出具抗肿瘤活性的杨树菇未知基因1C10,为进一步研究其活性及机理奠定基础。
收稿日期:2012年2月29日;修回日期:2012年3月9日;录用日期:2012年3月10日
关键词:药用真菌;抗肿瘤活性;cDNA序列
1. 引言
药用真菌因其独特的药理活性被越来越多的研究者关注[1-3]。其中蛋白质组分占子实体干重约10%~ 40%[4],但长期以来,仅有上百种蛋白/多肽被分离,且多集中在对其氨基酸组成、活性分析等初步研究。已有十多种药用真菌蛋白被报道具很强的抗肿瘤活性(nM级)[5,6],包括凝集素、核糖体失活蛋白、核糖核酸酶、泛素类蛋白、抗真菌蛋白等,提示蛋白质是药用真菌中另一类重要的抗肿瘤活性组分[7]。
相对于多糖,药用真菌的抗肿瘤活性蛋白研究不足的原因,可能是由于药用真菌基因组信息缺乏,不易克隆蛋白基因序列的缘故。目前随着高通量测序技术的成熟,国内外学者也都致力于对药用真菌基因组的测序工作。2006年,来自19个大学的研究人员组成的团队开始首次对食用菌平菇Pleurotus ostreatus基因测序组的测序,2007年开始对双胞蘑菇Agaricus bisporus的基因组测序,目前这些项目均已完成[8],极大地推动了药用真菌活性蛋白的研究工作。药用真菌杨树菇活性蛋白在体内和体外试验中均表现出显著的抗肿瘤活性[7],本文通过构建cDNA文库测序的方法,克隆药用真菌杨树菇Agrocybe aegerita具抗肿瘤活性的未知基因,并对其进行初步活性鉴定。
2. 材料与方法
2.1. 材料
杨树菇(Agrocybe aegerita)子实体由华中农业大学食用菌研究所培育,品种为杨树菇3号,采集之后迅速冷冻于液氮罐中保存。RNA提取试剂盒是Qiagen公司的RNeasy Plant Mini Kit,SMART cDNA Library Construction Kit购于Clontech公司。真核表达载体pGEFP-C1系本实验室保存,HeLa细胞购于中国典型培养物保藏中心(CCTCC),转染试剂为invitrogen公司的Lipofectamine 2000。衰老相关β-galactosidase检测试剂盒购自上海杰美生物公司,碘化丙锭PI购于武汉大风生物技术有限公司。
2.2. cDNA文库及基因测序
使用RNeasy Plant Mini Kit提取杨树菇子实体总RNA,按照SMART cDNA Library Construction Kit说明书构建cDNA文库。即在合成cDNA的反应中事先加入的3'末端带Oligo (dG)的SMART引物,由于逆转录酶以mRNA为模板合成cDNA,在到达mRNA的5'末端时碰到真核mRNA特有的“帽子结构”,即甲基化的G时会连续在合成的cDNA末端加上几个 (dC),SMART引物的Oligo (dG)与合成cDNA末端突出的几个C配对后形成cDNA的延伸模板,逆转录酶会自动转换模板,以SMART引物作为延伸模板继续延伸cDNA单链直到引物的末端,这样得到的所有cDNA单链的一端有含Oligo (dT)的起始引物序列,另一端有已知的SMART引物序列,合成第二链后可以利用通用引物进行扩增。由于有5'帽子结构的mRNA才能利用这个反应得到能扩增的cDNA,因此扩增得到的cDNA就是全长cDNA。
对文库进行随机测序,得到的序列用CodonCode Aligner软件去掉低质量序列、载体序列、重复序列等,用Phrap拼接同源EST,并与NCBI非冗余蛋白库比对(BLASTX)。
2.3. 转录组测序
提取样品总RNA后,用带有Oligo (dT)的磁珠富集mRNA。加入fragmentation buffer将mRNA打断成短片段,以mRNA为模板,用六碱基随机引物(random hexamers)合成第一条cDNA链,然后加入缓冲液、dNTPs、RNase H和DNA polymerase I合成第二条cDNA链,在经过QiaQuick PCR试剂盒纯化并加EB缓冲液洗脱之后做末端修复、加poly(A)并连接测序接头,然后用琼脂糖凝胶电泳进行片段大小选择,最后进行PCR扩增,建好的测序文库用Illumina HiSeq™ 2000进行测序。测序得到的原始图像数据经base calling转化为序列数据,结果以fastq文件格式存储,包括reads的序列以及reads的测序质量。
2.4. 真核表达质粒构建及转染
通过引物Forward:ccgaattccatggtcagttctgtcg,reverse:cggggtacctcatgcgatccatggtg,将1C10基因克隆到真核表达载体pGEFP-C1上。HeLa细胞按每孔约3 × 104个细胞接种于6孔细胞培养板,37℃培养过夜,待细胞密度为80%~90%使用Lipofectamine 2000转染真核表达质粒。
2.5. PI染色及流式细胞仪分析
按照上述方法转染待质粒,继续培养48 hr。使用荧光显微镜检测转染效率。细胞用PBS重悬洗涤1次,75% 乙醇重悬后,加RNase A (终浓度0.25 mg/ml) 37℃孵育1 hr,终浓度50 mg/ml的碘化丙啶4℃避光染色30 min,流式细胞计数仪检测荧光强度分布(激发波长488 nm)。
2.6. 衰老相关β-galactosidase检测
按照上述方法转染质粒,使用β-galactosidase衰老相关试剂盒里对细胞进行染色,细胞呈现蓝色部位为衰老细胞特异性酶(β-半乳糖苷酶)活性位点。
2.7. 统计学方法
应用统计软件SPSS13.0进行数据分析,组间比较采用单因素方差分析,两两比较采用LSD-t检验,p < 0.05有统计学意义。
3. 结果
3.1. 1C10基因序列及数据分析
杨树菇cDNA文库构建成功,随机测序获得杨树菇Agrocybe aegerita 1C10序列(如图1所示),长728bp。用NCBI的ORF Finder程序分析其开放阅读框,5’-非翻译区为28 bp,3’-非翻译区376 bp,其中末尾有18 bp的poly-A。含有长324 bp的开放阅读框(包括一个终止密码子),编码107个氨基酸。使用BLASTP搜索数据库,未找到相似度较高的氨基酸序列这一结果表明1C10序列是杨树菇中全新基因。
3.2. 1C10基因在杨树菇菌丝体和子实体的差异表达
分别提取杨树菇菌丝体和子实体的总RNA,在华大基因研发中心使用Illimina HiSeq 2000进行测序。原始测序结果进行去除杂质和组装处理,得到尽可能长的非冗余Unigene。将1C10基因与Unigene进行比对,分别得到其在菌丝体和子实体中的reads数分别为5和342,如表1所示。为消除基因长度和测序量差异对计算基因表达的影响[9],使用RPKM法对Unigene的表达量进行统计,在菌丝体和子实体中分别为0.7471和50.8093。这说明1C10基因在菌丝体和子实体中均有表达,但在子实体中为高表达。
3.3. 真核表达质粒构建及转染
PCR扩增连在cDNA文库构建质粒载体pDNR-lib上的1C10基因,扩增结果如图2(a),将基因克隆到pEGFP-C1载体上,酶切鉴定结果如图2(b)。真核表达载体构建完成后,用pEGFP-C1空载体作为对照,以相同的量转染入6孔板的HeLa细胞,48小时后通过标签GFP在荧光显微镜下检测转染效率,图2(c)表明转染效率可达80%以上。
3.4. 1C10表达对HeLa细胞的影响
使用碘化丙啶染色以及流式细胞仪分析发现,1C10基因的表达可引起HeLa细胞亚二倍体峰细胞群也就是凋亡细胞数目的增多,如图3(a)所示。转染空质粒对照凋亡峰只有2.24%,而1C10基因的表达诱导细胞出现24.6%的亚二倍体峰,说明1C10的表达可显著诱导细胞出现凋亡。
转染质粒48小时后,使用衰老相关β-galactosidase检测试剂盒对细胞进行染色,光学显微镜观察,每个样品随机选取4个视野,计算SA-β-Gal呈阳性反应的细胞比例,统计结果如图3(b)所示,转染1C10基因与对照组相比没有显著性差异。
4. 讨论
药用真菌中蛋白组分的研究十分不足,重要原因之一在于其基因信息的缺乏。由于其繁殖特点(有性或无性繁殖,菌丝的异宗结合,不同遗传背景的菌丝纽结成子实体等特点),使得基因克隆非常困难,因此,构建cDNA文库结合表达序列标签分析将有助于获得大量基因信息,从而推动对药用真菌抗肿瘤蛋白的研究。
1C10基因在数据库中未检索到相似度较高的基因,属杨树菇新基因。通过高通量测序的Unigene表

Table 1. The differential expression of 1C10 in mycelium and fruiting body of Agrocybe aegerita
表1. 1C10基因在杨树菇菌丝体(M)和子实体(F)中的差异表达分析

Figure 1. The gene from Agrocybe aegerita and the deduced amino acid sequence
图1. 杨树菇Agrocybe aegerita 1C10基因序列及氨基酸序列


Figure 2. The construction and the transformation of the plasmid pEGFP-C1-1C10. (a) The PCR result of 1C10; (b) The result of enzyme digestion of the plasmid pEGFP-C1-1C10; (c) The transformation of the plasmid pEGFP-C1-1C10. The plasmid with GFP-tag was transformed into HeLa cells, and after 48 h the result was observed and pictured by fluorescence microscope (pEGFPC1-C was the control)
图2. pEGFP-C1-1C10真核质粒构建及转染。(a) 1C10基因扩增; (b) pEGFP-C1-1C10质粒酶切鉴定结果; (c) pEGFP-C1-1C10质粒转染,带有GFP标签的质粒转染HeLa细胞, 48小时后荧光显微镜观察并照相(pEGFP-C1-C)为空载体对照
达差异分析发现,1C10基因在子实体中有高表达,菌丝体中表达量较低。在真核细胞中1C10表达可以引起HeLa细胞的凋亡,该分子的活性及作用机制值得进一步研究。
cDNA文库构建的质量很大程度上反应在重组cDNA片段的序列完整性,要从文库中分离获得目的基因完整的序列和功能信息,要求文库中的重组cDNA片段足够长以便尽可能地反应出天然基因
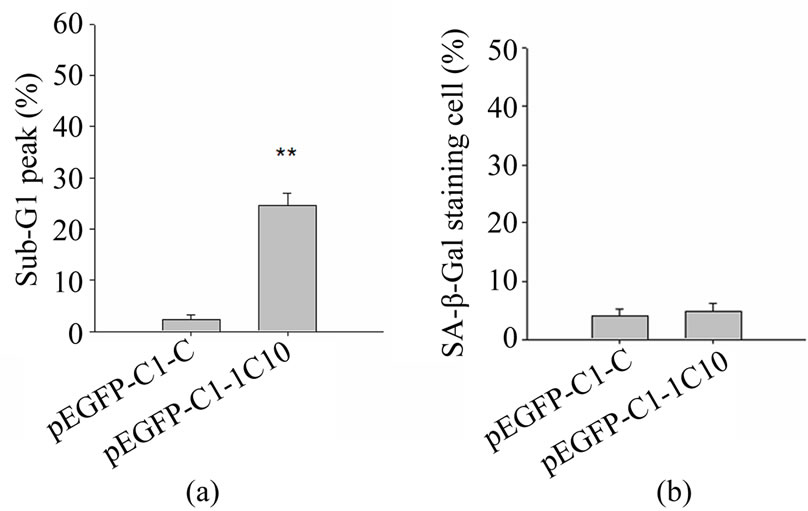
Figure 3. The effect of the expression of 1C10 on HeLa cells. (a) The plasmids were transformed into HeLa cells, and after 48 h, the cells were detected by PI staining and flow cytometry. pEGFPC1-C was used as blank control, and the statistical data was collected by three experiments performed. ** indicated that p value < 0.01; (b) The cells was stained for 16 h by the senescence associated β-galactosidase detection kit, and the percentage of positive cells was statistically collected in the four microscopic fields random selected
图3. 检测1C10基因表达对HeLa细胞的影响。(a) 转染质粒48小时后,PI染色结合流式细胞仪检测细胞。pEGFP-C1-C为转入空质粒对照,三次流式试验的统计学数据,**表示p < 0.01; (b) 使用衰老相关β-galactosidase检测试剂盒染色16小时,随机挑选4个视野计数阳性反应即衰老细胞比例的统计数据
的结构。本文使用基于SMART技术构建文库的方法,根据其原理应该是全长的cDNA。由测序结果也看到本实验中构建的cDNA文库比较成功,测序得到的246条EST序列,大部分(>70%都可以找到ORF,以及5’上游的终止密码子以及3’的polyA序列,说明SMART技术是比较成熟的适用于构建全长cDNA文库的方法。
本文通过cDNA文库构建及测序,快速对杨树菇大量基因信息进行分析,并进一步通过构建真核表达质粒,转染入HeLa细胞中,初步筛选到多个具有抗肿瘤活性的基因,包括泛素蛋白酶系统相关分子,及本文的1C10等分子,说明该方法对快速大量地研究未知基因种群的活性蛋白具有优势,值得重视。
5. 致谢
感谢国家自然科学基金(No. 81102850),广东省医学科研基金(A2011434),东莞市高等院校科研项目基金(No. 2011108102049)及广东医学院博士启动基金项目(XB1106)给予本研究的支持。
参考文献 (References)
[1] A. T. Borchers, C. L. Keen and M. E. Gershwin. Mushrooms, tumors, and immunity: An update. Experimental Biology and Medicine, 2004, 229(5): 393-406.
[2] A. T. Borchers, J. S. Stern, R. M. Hackman, et al. Mushrooms, tumors, and immunity. Proceedings of the Society for Experimental Biology and Medicine, 1999, 221(4): 281-293.
[3] B. Z. Zaidman, M. Yassin, J. Mahajna, et al. Medicinal mushroom modulators of molecular targets as cancer therapeutics. Applied Microbiology and Biotechnology, 2005, 67(4): 453-468.
[4] W. Breene. Nutritional and medicinal value of specialty mushrooms. Journal of Food Protection, 1990, 53(10): 883-894.
[5] T. B. Ng, Peptides and proteins from fungi. Peptides, 2004, 25 (6): 1055-1073.
[6] N. T. Wang, V. E. C. Ool. Lectins from mushrooms. Mycological Research, 1998, 102(8): 897-906.
[7] C.Y. Liang, H. H. Liu, R. Luan, T. Che, S. Jiang, D. Y. Xie and H. Sun. The tumor rejection effect of protein components from medicinal fungus. Biomedicine & Preventive Nutrition, 2011, 1(4): 245-254.
[8] http://www.jgi.doe.gov/
[9] A. Mortazavi, B. A. Williams, K. McCue, et al. Mapping and quantifying mammalian transcriptomes by RNA-Seq. Nat Methods, 2008, 5(7): 621-628.
NOTES
*equal author contribution.