Medical Diagnosis
Vol.05 No.03(2015), Article ID:15997,7
pages
10.12677/MD.2015.53006
To Analyze the Adverse Drug Reaction of Asprin and Clopidogrel during the Treatment for Platelet Aggregation
Zhixun Huang1*, Huifang Zhang2, Xiaoyun Shen1, Taorang Zhou1, Shijing Qian1
1Department of Pharmacy, Shanghai Tongji Hospital, Shanghai
2Shibei Hospital, Shanghai
*通讯作者。
Email: *huangzx59@QQ.com, *huangzx59@hotmail.com
Received: Aug. 15th, 2015; accepted: Aug. 30th, 2015; published: September 7th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Objective: To analyze the adverse drug reaction and their risk factors of Aspirin and Clopidogrel during the treatment for platelet aggregation, providing reference for clinical medication. Methods: Based on 2009-2012 database of Shanghai ADRs center, ADR cases about Aspirin and Clopidogrel were analyzed retrospectively through age groups or randomized by combination and independence for retrospective analysis. Also the types of reports, severity of diseases, the original disease, the reason of medication, organ damage by ADR, as well as the initial period and results of ADRs were applied as the observation indexes and were analyzed by using the SPSS software. Results: In the groups of combination and independence, their p value of baseline characteristics was above 0.05 (p > 0.05), which indicated no statistical significance. In contrast, p values of observation index correlation test, report types, severity, bleeding part, ADR results and the initial period of ADR were below the level of 0.05 (p < 0.05). Comparing the independent risk factors between these two groups, the result of p values of severity reports, death or life threat, bleeding, ADR results, and ADR onset of three months was the same (p < 0.05). The result of multivariable Logistic regression analysis was received forward step by step, ADR didn’t recover, OR was 3.404, 95% CI was 1.518 - 7.634; For weeks of the ADR onset, OR was 3.329, 95% CI was 0.86 - 12.884. Conclusion: The percentage of ischemia and bleeding in the combined group was higher than that of independent group, and the unrecovered ratio in the independent group was 2.44 times than that in the combined group, which might be related to antiplatelet resistance, combined interaction and low dosage. In the long-term antiplatelet therapy, ischemia, risk of bleeding should be involved in the comprehensive evaluation, and it should develop an individual preventive measure and medication for keeping balance and getting maximum benefits between antiplatelet effects and reducing the risk of bleeding.
Keywords:Aspirin, Clopidogrel, Adverse Drug Reaction, Analysis

阿司匹林与氯吡格雷抗血小板凝聚不良反应临床分析
黄之训1*,张惠芳2,沈筱云1,周陶然1,钱石静1
1上海市同济医院药剂科,上海
2上海市北医院,上海
Email: *huangzx59@QQ.com, *huangzx59@hotmail.com
收稿日期:2015年8月15日;录用日期:2015年8月30日;发布日期:2015年9月7日

摘 要
目的:分析阿司匹林、氯吡格雷在抗血小板聚集治疗中的ADR及影响ADR结果的危险因素,为临床用药提供参考。方法:以2009-2012年上海ADR中心数据库阿司匹林和氯吡格雷病例为基数,通过年龄或单抗和双抗治疗随机分组进行回顾性分析,以报告类型、严重程度、原患疾病、用药原因、ADR致器官损害、ADR起始发病日、ADR结果作为观察指标,使用SPSS软件进行分析。结果:单抗和双抗两组基线特征比较差异无统计学意义(p > 0.05)。两组观察指标相关性检查及单因素独立危险因素比较,严重程度、出血、ADR结果和ADR最初阶段发病p < 0.05;多因素Logistic回归分析,ADR未好转OR = 3.404、95% CI 1.518~7.634;ADR周内发病OR = 3.329、95% CI 0.86~12.884。结论:双抗组的缺血、出血事件几率高于单抗组,单抗组未好转几率是双抗组的2.44倍,可能与抗血小板药物抵抗、合并用药的相互作用及剂量不足有关。长期抗血小板治疗应综合评估患者缺血、出血风险,制定个体化的预防措施和给药方法,在抗血小板效果与降低出血风险之间以取得平衡和最大获益。
关键词 :阿司匹林,氯吡格雷,不良反应,分析

1. 引言
阿司匹林与氯吡格雷已广泛应用于冠心病、缺血性脑卒中的一、二级预防及经皮冠状动脉介入治疗(Percutaneous coronary intervention PCI)后的抗血小板凝聚,大量的循证医学证据显示了其抗血小板作用对缺血性疾病防治益处,尤其在急性冠脉综合症(Acute coronary syndrome ACS)发生和进展过程中发挥着重要作用[1] 。但阿司匹林与氯吡格雷抗血小板凝聚的常规治疗中均存在着心血管终点事件和与用药相关的不良事件(Adverse drug events ADE)。同一种抗血小板药物可因个体不同产生不同的抗血小板效应,低反应性者缺血事件增加,反之出血风险增加。缺血、出血事件或副反应均归属于临床ADE。当ADE出现后一般经对症治疗及调整剂量或停药处理,均会得到转归,但也有部分患者出现药品不良反应(Adverse drug reaction ADR)后在相当的治疗期间没有转归而遭受药源性反应折磨。本研究旨在分析两种药物对不同病因治疗中出现的ADE及影响ADR结果转归因素做回顾分析,以此对临床提供用药参考。
2. 资料与方法
2.1. 临床资料
筛选2009~2012年本地区以阿司匹林与氯吡格雷作为怀疑药物导致的ADR病例,排除重复用药、合并使用其他抗凝药(肝素、华法林、西洛他唑、血滞通等) 及非甾体类药的病例,对入选的ADR病例按治疗用药随机分组对照,进行回顾性分析。
2.2. 观察指标
性别、年龄、报告类型、严重程度选择、原患疾病、用药原因、ADR致器官损害、ADR起始发病时间(日)、ADR结果作为分析用观察指标。
2.3. 统计方法
使用SPSS19.0软件,计量资料用(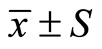 )表示;计数资料用x2检验或秩和检验;统计量概率p < 0.05为差异有统计学意义;分类变量采用比值比(odds ratio OR)作为效应尺度(effect magnitude),并用95%置信区间(95% Confidence Interval, 95% CI)表达。
)表示;计数资料用x2检验或秩和检验;统计量概率p < 0.05为差异有统计学意义;分类变量采用比值比(odds ratio OR)作为效应尺度(effect magnitude),并用95%置信区间(95% Confidence Interval, 95% CI)表达。
3. 结果
3.1. 治疗分组一般特征
患者随机分组为标准组(双抗),每日1次给予阿司匹林100毫克联合氯吡格雷75毫克;单抗组,每日1次给予氯吡格雷37.5~300毫克独立使用。标准组111人,其中男84人,女27人,年龄29~90岁,平均63.66 ± 13.387岁。单抗组143人,其中男99人,女44人,年龄34~93岁,平均65.45 ± 12.336岁。两组基线特征比较差异无统计学意义(均p > 0.05),入组时两组的一般资料均衡可比。
3.2. 两组治疗后的观察指标比较
组间各项观察指标差异均有显著性(p < 0.01) (表1)。两组相关性因素的危险因子比较,差异显著(p < 0.01) (表2)。胃肠道、皮下组织、肺、鼻、眼、脑、牙、肾均有不同程度出血反应(表3)。标准双抗组的再次血栓反应大大超过单抗组,而单抗组暴露的消化系统、皮肤黏膜、呼吸困难、胸痛肌痛等反应均高于标准双抗组(表4)。
3.3. 影响转归因素分析
两组总共有48例至报告日ADR未转归,占全部ADR的18.9%。双抗组与单抗组之比是27.08%:72.92%。将两组治疗方法作为变量因素y经卡方检验单抗组未好转的危险几率OR值是双抗组的2.44倍,将单抗组赋值1,双抗组赋值0 (对照水平),将单因素分析差异有统计意义的相关危险因素进行多因素逐步筛选Logistic回归,作为影响转归的危险因素进入模型的自变量有报告类型、严重程度选择、出血部位、ADR结果、初始发病日等级、ADR对器官损害。结果显示,ADR结果与ADR对器官损害、ADR初始发病日等级是ADR至报告日未转归的主要危险因素。将自变量ADR结果“未好转”,ADR损害器官系统“再次血栓”,ADR初始发病日等级“>1年”为参照水平设哑组回归分析,步进概率入选标准为0.10,剔除标准为0.15。得到影响ADR结果的危险因素的Logisic逐步回归分析(表5)。
Table 1. The correlation test of observation index of two groups
表1. 两组观察指标相关性检验
Table 2. The contrast of risk factors of two groups
表2. 两组风险因素对比
Table 3. The contrast of bleeding organs in two groups
表3. 两组出血部位对照
Table 4. The contrast organ damage in two groups
表4. 两组器官损害对照
Table 5. Logistic regression analysis equation of parameter estimation
表5. Logistic 回归分析方程参数估计
4. 讨论
4.1. 主要终点缺血事件分析
目前指南推荐的双抗剂量和时间为均一化标准治疗,未对患者进行风险分层,无法判断患者用药疗效,对存在个体差异的患者抗凝效果也不相同,反应低下或无反应是缺血发生的主要事件或称抗血小板药物抵抗,标准双抗治疗7 d时,约14%患者对双抗治疗无反应(抑制率 ≤ 20%),约66%患者对双抗治疗呈现不同反应[2] ,约11%~44%患者存在氯吡格雷抵抗(clopidogrel resistance CR) [3] ,5.30%~7.20%患者对阿司匹林抵抗(aspirin resistance AR)或无抵抗[4] ,多数术后患者阿司匹林治疗反应优于氯吡格雷[5] ,对阿司匹林反应良好的患者,约40%对氯吡格雷反应低下或无反应,而对氯吡格雷反应良好患者对阿司匹林反应均良好或有效,刘玲等研究提示标准常规剂量双抗的大多数患者没有达到充分或者受到有效的抗血小板聚集效果。Yamagami [6] 采用“西洛他唑200 mg∙d−1 + 阿司匹林100 mg∙d−1”的方案和常规标准双抗组方案的远期疗效比较发现前者支架再狭窄发生率低于后者,血小板高反应性患者每天常规剂量服用75 mg CR发生率高,血小板抑制效果差,缺血事件发生率高[5] [7] ,这些研究表明CR与缺血事件或再次血栓有相关性。
氯吡格雷是噻吩吡啶类无活性的药物前体,须经过CYP450酶氧化水解成活性代谢产物后不可逆地与血小板表面二磷酸腺苷(ADP)受体P2Y12的半胱氨酸残基结合形成二硫键,抑制纤维蛋白原与血小板糖蛋白GPIIb/IIIa受体结合及继发的ADP介导糖蛋白GPIIb/IIIa复合物的活化,进而抑制血小板的聚集。CYP450酶中CYP3A4、CYP2C19同工酶是对氯吡格雷活性转化过程起决定作用的主要代谢酶。
2008年美国心脏学会、心脏病基金会、胃肠病学会联合推荐急性心梗后服用阿司匹林和联合应用氯吡格雷或抗凝剂的患者同时加用质子泵抑制剂(PPI)。然而奥美拉唑、埃索美拉唑、兰索拉唑等PPI都主要经CYP2C19代谢,近年研究认为PPI可降低氯吡格雷疗效而增加心血管事件,有CYP2C19功能缺失的患者相比于正常者服用同样剂量的氯吡格雷,发生心脑血管不良事件如心梗、支架血栓甚至死亡的几率明显增加,当然也有研究认为氯吡格雷是多酶代谢,不会因某种药酶的改变而使其代谢受到较大影响,但由于氯吡格雷主要依赖CYP2C19代谢,笔者仍然同意FDA的警示:氯吡格雷与PPI不仅确实存在相互作用,还要高度警惕其他也可能抑制或诱导CYP2C19或经CYP2C19代谢的药物。他汀类药物在动脉粥样硬化中的多重保护作用使临床常与氯吡格雷联用,亲脂性他汀(洛伐他汀、辛伐他汀、阿托伐他汀)需在肝脏经CYP3A4代谢开环活化,由于代谢过程是竞争CYP3A4同一结合位点的过程,具有高亲和力的药物与位点结合同时会抑制低亲和力药物的生物转化,所以同样会影响氯吡格雷的效应。
4.1.4. 药物抵抗对策
本研究中标准双抗组与单抗组的总缺血事件比是17.12%:6.29%,因回顾性分析缺少基因检测和血小板弹力图检测数据,无法准确判断缺血事件患者的AR或CR真实情况,但依据文献认为总体缺血事还是会与AR或CR相关,此外还与双抗组氯吡格雷为标准剂量75 mg、单抗组剂量75~300 mg相关。
目前针对CR的防治对策主要有以下一些措施:首先应积极地早期对基因多态性引起的氯吡格雷个体差异有充分的认识,对于中高危患者条件许可可进行基因多态性检测或在服用负荷剂量氯吡格雷后6 h通过血小板弹力图实验进行确认是否出现抵抗,并及时调整抗血小板治疗方案;其次可以通过加大负荷剂量或维持剂量150 mg [7] ;第三,可以选用三联(双抗加用西洛他唑)或新型血小板抑制剂,最新研究表明替格瑞洛能达到最大临床获益而不增加出血风险;第四,必须同时接受预防动脉硬化、稳定斑块和存在胃肠道出血风险因子的患者使用他汀和PPI,建议选用与氯吡格雷代谢途径不同的亲水性他汀(瑞舒伐他汀、普伐他汀、氟伐他汀等)和具有CYP2C19、CYP1A2双通道代谢的泮托拉唑可最大限度降低心血管不良事件发生;第五,鉴于氯吡格雷与PPI的生物半衰期相近,建议错开服用,急性心血管事件多在早上9~11点发生,氯吡格雷可在早餐后服用,人体胃酸在夜间分泌高于白天,PPI在晚餐前服用可有效抑制夜间胃酸分泌高峰而不干扰消化系统正常生理功能,加大服药间距即可避免彼此之间产生竞争抑制的干扰。
4.2. 次要终点出血事件的发生分析
CAPRIE研究,接受氯吡格雷和阿司匹林严重出血事件发生率分别为1.4%和1.6%,胃肠道出血发生率为2.0%和2.7%,阿司匹林侵害消化道的局部作用是刺激胃黏膜磷脂层,破坏胃、肠黏膜屏障;全身作用是抑制环氧化酶(COX)导致促进上皮细胞增生、增加胃黏膜血流量的前列腺素(PG)生成减少。氯吡格雷与阿司匹林不同,其本身并不直接引起消化道损伤,但它可通过抑制血小板衍生的生长因子和血小板释放的血管内皮生长因子从而阻碍新生血管生成和延迟溃疡愈合时间甚至引发出血,其更多发生在已存在消化道黏膜病变患者。本研究两组间总器官出血双抗47例,单抗32例;胃肠道出血双抗33例,单抗10例;经Fisher精确检验sig = 0.042;p < 0.05,两组间的出血比有统计学意义,OR = 2.247;95% CI 0.972~5.194,胃出血风险比2.247倍。一项病例对照研究显示[8] ,不同抗血小板药物发生上消化道出血的风险比分别为低剂量阿司匹林OR = 1.8;氯吡格雷OR = 1.1;阿司匹林联合氯吡格雷时OR = 7.4,显然双抗用药可显著增加消化道出血危险性。大部分ACS或PCI患者会接受标准双抗治疗,与单独使用阿司匹林或氯吡格雷相比出血风险明显增加。抗血小板聚集治疗过程中活动性器官出血常会停药,但ACS和PCI患者停药会增加血栓危险,因此是否停药需平衡患者的血栓和出血风险,不能停药或对血小板反应高者应及时调整剂量,个体化给药十分必要。
4.3. 影响ADR结果的危险因素
将单因素分析差异有统计学意义的可能相关危险因素进行多变量Logistic逐步回归分析,最终选入模型的变量有13个,模型系数的综合检验卡方x2 = 58.831,sig = 0.000,p < 0.01。模型拟合残差卡方检验x2 = 4.892,sig = 0.769。ADR结果未好转危险因素是好转的3.404倍,ADR一周内起始发病的危险因素是起始发病日大于一年的3.329倍,在ADR未好转情况下各系统器官暴露的危险因素从大到小依次为皮肤黏膜、泌尿肾功能、神经与精神、呼吸、肌肉与骨骼、血液病、全身反应(含过敏性休克)、消化系统(不含出血)、器官出血、循环系统、感觉系统。至报告日ADR未转归的患者中有3个在ADR起始发病日3天、60天、68天死亡;用药原因分别为冠心病、心梗、脑梗;直接死因为胃肠道出血、TTP伴心衰、心肌梗死,其他未转归的患者大部分在继续服用氯吡格雷,部分伴随合并用药包括胰岛素类、奥美拉唑、洛伐他汀、辛伐他汀、阿托伐他汀等药物。合并用药是否是ADR预后的危险因素也值得深思和深究。
Ertugrul等[9] 对108例糖尿病患者应用全血阻抗法检测发现AR与空腹血糖和糖化血红蛋白呈正相关。Ajjan等[10] 报道高血糖易导致血小板对阿司匹林反应减低的原因归结于高水平的血糖影响了阿司匹林对于环氧化酶的乙酰化,后者导致血小板对阿司匹林的低反应性减低或AR的产生。同样氯吡格雷反应的个体差异也与胰岛素抵抗有关[11] 。奥美拉唑、埃索美拉唑、雷贝拉唑等PPI可抑制CYP2C19,从而使得氯吡格雷抗血小板作用降低[12] 。亲脂他汀类药物竞争CYP通道也会影响氯吡格雷代谢效果[13] 。ACS和PCI患者出院随访中继续服用氯吡格雷合并使用PPI和他汀,与独立使用氯吡格雷患者比较其可增加患者死亡和再次住院风险[14] 。
综合目前多数证据,理论上氯吡格雷在药物代谢过程中应该会与包括PPI、亲脂他汀类存在一定程度相互作用,但这种互动能带来多少不良的临床预后尚无充分证据。因此在临床实践中应该结合不同患者的个体差异和临床特点,综合评估其缺血、出血风险,制定个体化的预防措施和给药方法,在抗血小板效果与降低出血风险之间取得平衡和最大获益。
基金项目
上海市食品药品监督管理局科技情报研究所委托课题(药品不良反应临床研究——聚焦抗凝药GJ1206)。
文章引用
黄之训,张惠芳,沈筱云,周陶然,钱石静. 阿司匹林与氯吡格雷抗血小板凝聚不良反应临床分析
To Analyze the Adverse Drug Reaction of Asprin and Clopidogrel during the Treatment for Platelet Aggregation[J]. 医学诊断, 2015, 05(03): 29-35. http://dx.doi.org/10.12677/MD.2015.53006
参考文献 (References)
- 1. 赵助飞, 王飞 (2011) 氯吡格雷治疗急性冠脉综合症的临床疗效及其对血小板P选择素和C反应蛋白的影响. 中国药房, 36, 3411-3413.
- 2. 李敏, 刘玲, 葛良, 等 (2013) 血栓弹力图评价抗血小板药物疗效对颅内外动脉支架术后再狭窄的影响. 中华老年多器官疾病杂志, 2, 120-124.
- 3. Lemesle, G., Delhayc, C., Sudre, A., Broucq-sault, D., Rosey, G., Bauters, C., et al. (2009) Impact of high loading and maintenance dose of clopidogrel within the first 15 days after percutaneous coronary intervention on patient outcomc. American Heart Journal, 157, 375-382. http://dx.doi.org/10.1016/j.ahj.2008.09.013
- 4. 何倩, 焦洁茹, 赵雅洁, 等 (2012) 阿司匹林抵抗的相关临床研究. 诊断学理论与实践, 6, 593-598.
- 5. 刘玲, 杨防, 李敏, 等 (2012) 血栓弹力图评价患者颅内外动脉狭窄支架置入术后抗血小板聚集药物的疗效. 中国脑血管病杂志, 2, 67-71.
- 6. Yamagami, H., Sakai, N., Matsumaru, Y., Sakai, C., Kai, Y., Sugiu, K., et al. ( 2012) Periprocedural cilostazol trcayment and restenosis after carotid artery stenting: The Retrospective Study of In-Stent Restenosis after Carotid Artery Stenting (ReSISteR-CAS). Journal of Stroke and Cerebrovascular Diseases, 21, 193-199. http://dx.doi.org/10.1016/j.jstrokecerebrovasdis.2010.06.007
- 7. 唐发宽, 林乐健 (2010) 血栓弹力图检测老年冠心病患者经皮冠状动脉介入治疗后血小板反应性. 中华老年心脑血管病杂志, 10, 879-881.
- 8. Hallas, J., Dall, M., Andries, A., Andersen, B.S., Aalykke, C., Hansen, J.M., et al. (2006) Use of single and combined antithrombotic therapy and risk of serious upper gastrointestinal bleeding: Population based case-control study. BMJ, 333, 726-730. http://dx.doi.org/10.1136/bmj.38947.697558.AE
- 9. Ertugrul, D.T., Tutal, E., Yildiz, M., Akin, O., Yalçın, A.A., Üre, Ö.S., et al. (2010) Aspirin resistance is associated with glycemic contrl, the dose of aspirin, and obesity in type 2 diabetes mellitus. The Journal of Clinical Endocrinology & Metabolism, 95, 2897-2901. http://dx.doi.org/10.1210/jc.2009-2392
- 10. Ajjan, R., Storey, R.F. and Grant, P.J. (2008) Aspirin resistance and diabetes mellitus. Diabetologia, 51, 385-390. http://dx.doi.org/10.1007/s00125-007-0898-3
- 11. Curbel, P.A., Bliden, K.P., Hialt, B.L. and O’Connor, C.M. (2003) Clopidogrel for coronary stenting: Response variability, drug resistance, and the effect of pretreatment platelet reactivity. Circulation, 107, 2908-2913. http://dx.doi.org/10.1161/01.CIR.0000072771.11429.83
- 12. Gilard, M., Arnaud, B., Cornily, J.C., Le Gal, G., Lacut, K., Calvez, G., et al. (2008) Influence of omeprazole on the antiplatelet action of clopidogrel ussociated with aspirin: The randomized, double blind OCLA (Omeprazole Clopidgrel Aspirin) study. Journal of the American College of Cardiology, 51, 256-260. http://dx.doi.org/10.1016/j.jacc.2007.06.064
- 13. Lau, W.C., Waskell, L.A., Watkins, P.B., Neer, C.J., Horowitz, K., Hopp, A.S., et al. (2003) Atorvastatin reduces the ability of clopidogrel to inhibit platelet aggregation: A new drug-drug interaction. Circulation, 107, 32-37. http://dx.doi.org/10.1161/01.CIR.0000047060.60595.CC
- 14. Ho, P.M., Maddox, T.M., Wang, L., Fihn, S.D., Jesse, R.L., Peterson, E.D., et al. (2009) Risk of adverse outcomes associated with concomitant use of clopidogrel and proton pump inhibitors following acute coronary syndrome. JAMA, 301, 937-944. http://dx.doi.org/10.1001/jama.2009.261
