Hans Journal of Agricultural Sciences
Vol.07 No.04(2017), Article ID:21291,7
pages
10.12677/HJAS.2017.74037
Construction of Diploid Photoperiod-Sensitive Male Sterile Lines and Restorer Lines by Anthers and Unfertilized Ovary Culture Techniques
Liqi Tong1, Wei Wang2, Zhaojian Song1, Xianhua Zhang1, Yuchi He1, Yuhua Liu2, Detian Cai1,2*
1College of Life Sciences, Hubei University, Wuhan Hubei
2Wuhan Polyploid Biotechnology Co., Ltd., Wuhan Hubei
*通讯作者。

Received: Jun. 16th, 2017; accepted: Jun. 29th, 2017; published: Jul. 7th, 2017

ABSTRACT
[Objective] Using double heterosis of polyploidization and distant hybridization to select new rice varieties is a new breeding strategy. After breeding the polyploid meiosis stability line and solving the bottleneck problem of low seed setting rate of polyploidy, the theory and breeding practice of polyploid rice urgently need suitable breeding materials. [Method] In this paper, the photoperiod and thermo-sensitive genic male sterility of PS001 and polyploid rice restorer line PR-T1 are used as experimental materials. They are used to anther and unfertilized ovary culture, and to get their diploid, respectively. [Result] In this paper, it creates a set of lines that contains diploid and tetraploid. The lines are photoperiod and thermo-sensitive genic male sterility and restorer line. [Conclusion] It is concluded that the anther and unfertilized ovary culture could be used to rapidly purify varieties and shorten the stable time of traits to achieve the purpose of rapid breeding, but also to create the appropriate materials for theoretical research.
Keywords:Polyploid Rice, Anther and Unfertilized Ovary Culture, Photo-Thermosensitive Genic Male Sterile Lines, Callus, Diploid
利用花药和未受精子房培养技术创建二倍体光温敏雄性核不育系与恢复系
童丽琦1,王维2,宋兆建1,张献华1,何玉池1,刘育华2,蔡得田1,2*
1湖北大学生命科学学院,湖北 武汉
2武汉多倍体生物科技有限公司,湖北 武汉

收稿日期:2017年6月16日;录用日期:2017年6月29日;发布日期:2017年7月7日

摘 要
[目的] 利用远缘杂交和多倍体双重优势选育水稻新品种是育种的新途径。在选育出多倍体减数分裂稳定性品系,解决多倍体结实率低的瓶颈问题后,开展多倍体水稻的理论和育种实践迫切需要合适的育种材料。[方法] 本文以多倍体水稻光温敏雄性核不育系PS001和多倍体水稻恢复系PR-T1为实验材料,分别对其进行花药和未受精子房培养而得到二倍体。[结果] 从而构建成二倍体和四倍体配套的光温敏水稻雄性核不育系和恢复系材料。[结论] 证明了利用花药和未受精子房培养既可以快速纯化品种,缩短性状稳定年限,达到快速育种的目的,又可以创造合适的用于理论研究的材料。
关键词 :多倍体水稻,花药和未受精子房培养,光温敏雄性核不育系,愈伤组织,二倍体品系

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
[本研究的重要意义]世界粮食短缺的危机是一个严峻的问题。虽然近几年杂交水稻育种,选育超级稻等品种取得重要进展,但距离增产30%~50%的目标还相当远。在这种形势下,用合适的育种材料来开展多倍体水稻的理论和育种实践就更具有直接的现实意义和应用价值。[前人研究进展]世界科学家在充分利用杂种优势、分子育种和C3作物C4化方面做了大量的研究 [1] [2] 。从植物自然进化途径及主要粮棉油作物是多倍体,它们经由二倍体野生种向多倍体栽培种进化的同时,产量成倍增加的自然启示下,蔡得田、袁隆平、卢兴桂(2001)提出利用远缘杂交和多倍体双重优势选育超级稻的战略 [3] 。但是遭遇多倍体水稻结实率低的瓶颈问题。对于水稻结实率低的原因,鲍文奎等 [4] 认为是生理上营养不正常分布和遗传因素引起的。[本研究切入点]在历经20年研究选育出的二个多倍体减数分裂稳定性(PMeS)品系(专利号 ZL200410060786.2)后,结实率提高到70%以上,解决了瓶颈问题 [5] 。但是在探索高结实等理论问题和选育杂交品种过程中,缺少2X,4X配套的材料。[拟解决的问题]本文充分利用花药培养和未受精子房培养,可以获得单倍体的优势,选用优良的四倍体光温敏雄性核不育品系PS001和四倍体恢复系PR-T1,进行花药和未受精子房培养,意在培养出二倍体PS001-2X和PR-T1-2X,从而构成二倍体、四倍体材料体系,有利于多倍体水稻育种的理论研究和杂种选配应用。
2. 材料与方法
2.1. 试验材料
本文所用材料PS001是具有PMeS基因、可育期高结实和不育期雄性不育稳定的四倍体品系 [3] 。它是湖北大学蔡得田实验室通过十余年的籼粳杂交和回交选择而选育出具有多倍体减数分裂稳定性(Polyploid Meiosis Stability, PMeS)基因特性的多倍体水稻品系PMeS-1 [5] ,作为亲本与多倍体水稻光温敏雄性核不育系培矮64s杂交选育而获得的稳定品系–多倍体水稻光温敏核不育系 [6] 。有研究证实了减数分裂的稳定是高结实的保障 [7] 。另一材料多倍体恢复系PR-T1为具有PMeS基因高结实特性和高产的偏粳型品系 [8] 。
2.2. 方法
2.2.1. 取材及前处理
2016年8月中旬,从试验田里取出叶枕距为2.5~3.5 cm处于花粉发育的单核靠边期的稻穗 [9] ,用无菌水沾湿的纱布包好后,放入干净的塑料袋中封口、置于4℃冰箱中处理3~5天后再进行实验操作。
2.2.2. 花药和未受精子房培养的诱导培养基
本试验根据其培养对象不同于普通外植体,而是植物生殖器官的培养 [6] ,即花药离体培养和子房离体培养。根据培养的类型和特点,采用了液体培养和固体培养两种,其中液体培养又分为液体管式漂浮法和液体摇瓶法。固体诱导培养基用的是水稻SK3培养基 [10] ,激素用的是2,4-D + KT [11] 两种不同的固体培养基;液体培养基采用水稻SK3培养基,激素只用二甲四氯苯氧乙酸(MCPA),用的方法是管式漂浮法和液体摇瓶法两种。
2.2.3. 愈伤组织诱导
将经低温3~5天处理的幼穗置于在超净工作台上,经70%酒精处理30 S~60 S时间后,用无菌水清洗一次,之后用0.1%升汞溶液处理8 min,然后挑取顶尖淡绿色、下部乳白色的颖花(单核靠边期) [11] ,用尖镊子去掉颖壳,将带有花药和子房的无壳颖花接种在上述诱导培养基中。
培养材料都先放入35℃的培养箱中暗培养三天,后放入26℃~28℃的培养箱中暗培养 [12] 。其中液体摇瓶法的培养基放入35℃、100 r/min的摇床中暗培养三天,后调低培养温度至26℃~28℃、转速不变继续暗培养。液体培养材料在10天左右可观察到子房明显膨大的现象,40多天后可见子房破裂后出现淡黄色小颗粒愈伤,后逐渐变大。固体培养材料在40天左右可见开裂的花药上出现淡黄色小颗粒愈伤,后逐渐变大,同时伴随有子房组织膨大的现象。
2.2.4. 分化出苗和生根培养
待诱导的愈伤组织生长良好、呈现淡黄色、松紧适度时,将愈伤组织接转入分化培养基中分化培养直到长出绿苗,分化培养基MS + 1 mg/L 2,4-D + 2 mg/L KT + 0.2 mg/L NAA,28℃光照培养,当绿苗至10 cm左右时,再接种到生根培养基中28℃光照培养,生根培养基为1/2MS + 0.5 mg/L 6-BA + 0.6 mg/L NAA及0.02%活性碳。
2.2.5. 炼苗移栽
生根的绿苗经打开瓶塞加水。在常温下炼苗3天后,将试管苗根部培养基洗净后,即可移栽到大田间。
3. 研究结果与分析
3.1. 多倍体水稻花药和子房的固体培养
图1展示了多倍体水稻花药培养和未受精子房培养及出苗过程。当固体培养的多倍体水稻材料在10天左右即可看到明显的子房膨大现象,但花药仅少数膨大(图1(a));40天左右可见开裂的花药上出现淡
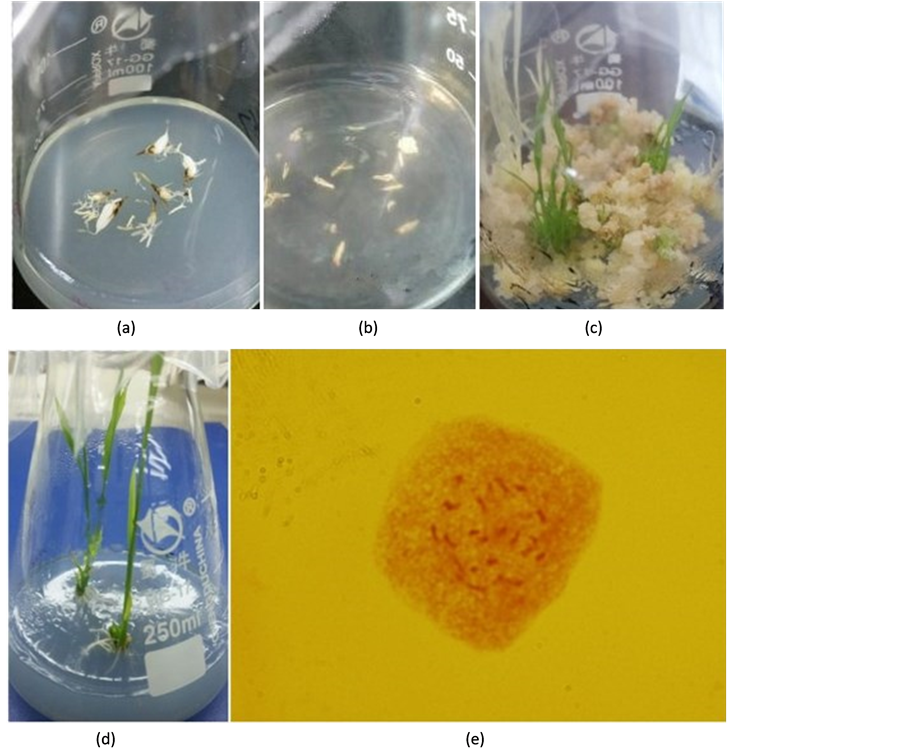 (a) 膨大的子房和花药;(b) 膨大子房和花药挑出的愈伤组织;(c) 愈伤组织分化出苗;(d) 生根后成完整试管植株;(e) 试管苗的根尖染色体观察,2n = 2x = 24。
(a) 膨大的子房和花药;(b) 膨大子房和花药挑出的愈伤组织;(c) 愈伤组织分化出苗;(d) 生根后成完整试管植株;(e) 试管苗的根尖染色体观察,2n = 2x = 24。
Figure 1. The callus and plantlets from anther and unfertilized ovary culture in solid culture method
图1. 固体培养下的花药和未受精子房培养出愈伤组织和分化出苗
黄色小颗粒愈伤,后逐渐变大,同时伴随有子房组织膨大裂开出愈伤组织的现象(图1(b))。40天后将生长良好、呈淡黄色、松紧适度的愈伤组织挑按于分化培养基上培养,历经25天后逐渐分化出芽苗(图1(c));再将其转入到生根培养基中分化出根以致形成完整的试管植株(图1(d)),取小植株的根尖经染色体检查后确定它们为二倍体苗,2n = 2x = 24 (图1(e))。
3.2. 不同液体培养方式对花药未受精子房培养的影响
实验中采用了两种方式培养,即液体漂浮培养和液体摇瓶培养,其效果有很大差异。
周嫦、杨弘远等对未受精子房培养有深入的研究,发现在未受精子房的诱导中二甲四氯苯氧乙酸(MCPA)具有显著作用 [13] 。蔡得田等对野生稻和光温敏核不育系进行过研究,发现这两种水稻的花药培养和未受精子房培养之间存在明显差异。并建议液体培养基用管式漂浮法容易出愈伤。借鉴这一结果和方法,在诱导培养基里加入0.2 mg/L的二甲四氯苯氧乙酸(MCPA)诱导愈伤,与固体2,4-D + KT的诱导方法进行对比。
PS001为光温敏核不育系,所取的材料比PR-T1恢复系要多一些。虽然在液体培养基(图2)里普遍可见子房膨大,但摇瓶的液体培养基里花药及膨大的子房都因自身重力下沉而淹没,基本没有子房破裂出现愈伤组织,可是在管式漂浮法培养中出现子房膨大、破裂并长出愈伤的现象。比较液体和固体培养,可见表1和表2呈现出的两个品系间的培养效果差异和培养方式效果差异。光温敏核不育系PS001和恢复系PR-T1分别做了403个和181个带有花药和子房的颖花接种。
如表1所示,光温敏核不育系PS001在在激素2,4-D + KT的固体培养基中出现了5个愈伤。在液体摇瓶中仅仅有一个花药长出了愈伤,但这个愈伤在后期分化的时候,逐渐发黑死掉,可能是愈伤由于自身重力在液体培养基里面浸没的时间太长,而失去了活性。在液体管式静置法的培养基里,长出了2个愈伤。如表2所示,恢复系PR-T1在固体培养基中出现了16个愈伤;在液体培养基管式静置法时长出了2个愈伤;在液体摇晃方法的培养基里,由于膨大的子房,后来在摇晃中都沉到瓶底,之后花药和膨大的子房在瓶底都逐渐变黑死掉。
光温敏核不育系PS001的403个颖花中,诱导率在1.98%;恢复系T1的181个颖花中,诱导率在9.94%,愈伤组织诱导率差异有5倍,这可能与PS001是不育系正处于不育期有关,也可能与品种本身基因型有关 [14] ,更可能与取材时正与当时持续高温时期重合相关。
根据实验数据看:光温敏核不育系PS001,用激素2,4-D + KT的固体培养基较为适宜。激素对恢复系T1的影响并不大。在培养方式上,由上述实验数据来看,固体培养最好,液体管式静置的方法次之。
3.3. 花药诱导出苗和绿苗率的研究
如表3所示,对这两个品系进行出苗和绿苗率的统计显示,光温敏核不育系PS001的诱导出苗和绿苗率都很低,绿苗率只有5.18%;而恢复系PR-T1的出苗率也不是很高,但是绿苗率比PS001还是高约3.5倍。这些数据表明了,不同材料分化出苗的能力不同,分化速度也有差异,仍有些愈伤尚且在分化阶段,难以出苗,同时其诱导出绿苗和白化苗的能力也不同,特别是PS001在固体2,4-D + KT培养基上比液体管式MCPA培养基出愈伤多,但所出的白化苗尤其多(如图2(e)),看来2,4-D和高温促进形成白化苗,在多倍体水稻培养中也得到证明 [15] 。
 (a) 管式漂浮培养的子房和花药;(b) 管式漂浮法培养的膨大子房和花药愈伤组织;(c) 愈伤组织分化出苗;(d) 摇瓶培养的子房和花药(可见沉没的子房和花药);(e) 培养中出现的白化苗。
(a) 管式漂浮培养的子房和花药;(b) 管式漂浮法培养的膨大子房和花药愈伤组织;(c) 愈伤组织分化出苗;(d) 摇瓶培养的子房和花药(可见沉没的子房和花药);(e) 培养中出现的白化苗。
Figure 2. Anther and unfertilized ovary in the liquid culture
图2. 液体培养中的花药和未受精子房
Table 1. Callus induction of PS001 in anther and unfertilized ovary culture in solid and liquid culture method
表1. PS001在固、液方式下花药及未受精子房出愈伤情况
Table 2. Callus induction of PR-T1 in anther and unfertilized ovary culture in solid and liquid culture method
表2. PR-T1在固、液方式下花药及未受精子房出愈伤情况
Table 3. The comparison of the seedling induction rate and green plantlet rate in anther culture of two lines
表3. 两个品系的花药诱导出苗和绿苗率的比较
4. 讨论
4.1. 多倍体水稻花药及未受精子房培养可以获得单倍体
由于目前人口的增加,耕地的减少,世界粮食短缺的严重危机,要求人们开展水稻育种的新思路 [16] [17] [18] [19] 。众多学者研究表明,花药培养的出愈率和分化率是由材料的生理状态 [20] 、培养基、培养条件、外植体和材料的基因型等多种因素控制 [21] 。但是多倍体水稻的花药培养研究较少。程治军 [22] 等曾利用四倍体水稻普通品系存在减数分裂不稳定而易出现变异的特性而选育突变体。周嫦、杨弘远 [13] 等对未受精子房培养有深入的研究,蔡得田等曾获得野生稻和光温敏核不育水稻品系的植株。本实验,成功地证明了四倍体水稻花药和未受精子房培养都能够获得单倍体即二倍体植株,为构建2X,4X材料体系和杂交配组提供了有利条件。
4.2. 培养基成分和培养方式的影响
一般花药离体培养之前会对材料进行不多于8天的低温预处理,以降低花药褐变率 [23] 。实验操作更加要严格无菌,暗培养初期必须接受热激处理 [12] 温度在35℃为宜,之后放到26℃~28℃的培养箱中培养。本实验用到的花药及子房培养的诱导培养基,是以水稻SK3培养基为基础,不过据文献显示,大多表明用蔗糖和麦芽糖作碳源的比单独只用蔗糖的培养效果要好 [24] ,本实验其比例为1:1。对于激素浓度,本实验采取的终浓度是2,4-D 1 mg/L + KT 0.5 mg/L;MCPA是0.2 mg/L。这些激素都比其他外植体培养的激素浓度低,采用激素浓度过高则抑制其后分化生长 [25] ,这也是花药离体培养的一大特点,与未受精子房漂浮培养只用很低MCPA浓度的特点(周嫦等)相符合。
5. 结论
本实验就花药和未受精子房的培养方式上,表明了固体培养最好,其次是液体管式漂浮法。恢复系PR-T1出愈率比光温敏核不育系PS001高,绿苗率恢复系PR-T1也高,表明了出愈率、绿苗率与材料本身特性有关,另绿苗率也与激素浓度有关。本实验成功地证明了四倍体水稻花药和未受精子房培养都能够获得单倍体即二倍体植株。为后期的2X,4X成套体系的建成,多倍体水稻育种理论研究和杂交选配提供良好材料。
基金项目
国家自然科学基金资助项目(31271690, 31571639),湖北省自然科学基金资助项目(2015CFB295)和武汉市品牌农业发展计划项目。
文章引用
童丽琦,王 维,宋兆建,张献华,何玉池,刘育华,蔡得田. 利用花药和未受精子房培养技术创建二倍体光温敏雄性核不育系与恢复系
Construction of Diploid Photoperiod-Sensitive Male Sterile Lines and Restorer Lines by Anthers and Unfertilized Ovary Culture Techniques[J]. 农业科学, 2017, 07(04): 281-287. http://dx.doi.org/10.12677/HJAS.2017.74037
参考文献 (References)
- 1. 李霞, 焦德茂. 转C4光合基因水稻及其在育种中的应用[J]. 分子植物育种, 2005, 3(4): 550-556.
- 2. 张边江, 陈全战, 焦德茂. 转C4光合固碳相关基因水稻的研究进展[J]. 植物学通报, 2008, 25(2): 161-166.
- 3. 蔡得田, 陈建国, 陈冬玲, 戴兵成, 张维, 宋兆建, 杨之帆, 杜超群, 唐志强, 何玉池, 张道生, 何光存, 朱英国. 两个具多倍体减数分裂稳定性的多倍体水稻品系的选育[J]. 中国科学(C辑: 生命科学), 2007, 37(2): 217-226.
- 4. 鲍文奎, 秦瑞珍, 吴德瑜, 陈志勇, 宋文昌, 张玉华. 高产四倍体水稻无性系[J]. 中国农业科学, 1985, 18(6): 64- 66.
- 5. 张献华. 栽培稻(Oryza sativa)与斑点野生稻(Oryza punctata)不同倍性基因组间杂种的创建研究[D]: [博士学位论文]. 武汉: 湖北大学, 2013.
- 6. 蔡得田, 陈冬玲, 祝虹, 金聿. 从“湖北光敏感核不育水稻”的未受精子房和花药培养出单倍体植株[J]. 实验生物学报, 1988, 21(4): 401-404.
- 7. He, Y.C., Ge, J, Wei, Q., et al. (2011) Using a Polyploid Meiosis Stability (PMeS) Line as a Parent Improves Embryo Development and the Seed Set Rate of a Tetraploid Rice Hybrid. Canadian Journal of Plant Science, 91, 325-335. https://doi.org/10.4141/CJPS09190
- 8. 杨玉廷, 于翠梅, 宋贺, 徐海, 徐正进. 不同穗型籼粳杂交稻F1代花药培养条件的优化[J]. 沈阳农业大学学报, 2011, 42(3): 354-357.
- 9. 赵海岩, 郑文静, 王昌华, 张燕之, 滕国峰. 水稻花药培养及后代选育[J]. 辽宁农业科学, 2005(1): 5-7.
- 10. 李贵节. 水稻花药发育的细胞形态学精细分期[J]. 重庆师范大学学报, 2011, 28(3): 56-59.
- 11. 冯双华, 侯海军, 廖江林, 欧阳俊闻, 肖国樱. 不同因素对水稻温敏核不育系香125S花药培养的影响[J]. 农业现代化研究, 2007, 28(3): 358-360.
- 12. 张跃非, 李碧如. 温度在水稻花药培养过程中的影响研究[J]. 吉林农业, 2010(11): 68-76.
- 13. 杨弘远, 周嫦. 被子植物离体受精与合子培养研究进展[J]. 植物学报, 1998, 40(2): 95-101.
- 14. 陈英. 影响籼稻花药培养诱导率的因素及基因型的作用研究[J]. 遗传学报, 1991, 18(4): 358-365.
- 15. 陈红, 秦瑞珍. 水稻花药培养过程中各种影响因子的研究进展[J]. 中国农业科技导报, 2007, 9(3): 52-56.
- 16. Higashi, T. (1988) Current Status and Projects of High Yield Rice Varieties in Future. Agriculture and Horticulture, 63, 797-799.
- 17. Khush, G.S. (1994) Increasing the Genetic Yield Potential of Rice: Prospects and Approaches. IRC Newsletter, 43, 1-8.
- 18. 杨守仁, 张龙步, 陈温福, 徐正进, 王进民. 水稻超高产育种的理论和方法[J]. 中国水稻科学, 1996, 10(2): 115-120.
- 19. 袁隆平. 杂交水稻超高产育种[J]. 杂交水稻, 1997, 12(6): 1-6.
- 20. Herath, H.N.I., Bandara, D.C., Samarajeewa, P.K., et al. (2009) Effect of Low Temperature Pre-Treatment on Anther Culture in Selected Indica, Japonica Rice Varieties and Their Inter Sub-Specific Hybrids. Ceylon Journal of Science (Biological Sciences), 38, 11-16.
- 21. Belinskaya, V. (2010) Genotypic Features of Morphogenesis in Spring Barley Anther Culture. Cytology and Genetics, 44, 103-107. https://doi.org/10.3103/S0095452710020052
- 22. 程治军, 秦瑞珍, 张欣, 雷财林, 郭秀平, 万建民. 多倍体化引起植物表型突变的分子机理研究[J]. 作物学报, 2005, 31 (7): 940-943.
- 23. 姚炎, 刘向东, 汪珍春, 张桂权, 张平. 低温预处理对水稻花药培养中花药壁褐变的结构影响[J]. 热带亚热带植物学报, 2006, 14(4): 307-311.
- 24. 朱永生, 陈葆棠, 张端品. 提高水稻籼粳杂交后代花药培养力的研究[J]. 华中农业大学学报, 2001, 20(4): 314- 317.
- 25. 陈英, 李良材, 朱进, 王瑞丰, 李淑媛, 田文忠, 郑世文. 水稻花粉植株的诱导条件及其遗传学表现的研究[J]. 中国科学, 1974(1): 40-51.
