World Journal of Forestry
Vol.2 No.2(2013), Article ID:9758,3 pages DOI:10.12677/WJF.2013.22002
The Improvement Methods of Leaf Chloroplast Pigment Separation Effect*
College of Forestry and Horticulture, Xinjiang Agricultural University, Urumqi
Email: sxfgl@126.com
Received: Dec. 31st, 2012; revised: Jan. 28th, 2013; accepted: Feb. 10th, 2013
Copyright © 2013 Guili Sun et al. This is an open access article distributed under the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
ABSTRACT:
The experiment of chloroplast pigment extraction and separation is an indispensable experiment in Plant Physiology Course. But the leaf chloroplast pigment separate effects are not very good due to low chloroplast pigment content in the experimental material with the chloroplast pigment extraction more difficult, chromatographic separation ribbon unclarity and even the chloroplast pigment ribbon type incomplete. For the experiment the key to success, the research analyzes Chlorophyll materials choosing the bright green leaf, which has the characteristic of less mechanical tissue and cellulose, high chlorophyll content. If not green leaf, we can use dry leaf powder instead of green leaf. In the process of chloroplast pigment extraction, we add ethanol and calcium carbonate to ensure the blade fully polished and chlorophyll not destroyed. The paper spill was prepared and the chloroplast was stained in advance so that all the students have perceptual knowledge. According to the practical experience from above three aspects, we have a good experiment effect on teaching.
Keywords: Chloroplast Pigment; Extraction; Separate Effect; Improvement Methods
提高叶绿体色素分离效果的方法*
孙桂丽,李 疆,齐曼·尤努斯,徐 敏
新疆农业大学林学与园艺学院,乌鲁木齐
Email: sxfgl@126.com
摘 要:
“叶绿体色素提取和分离”实验,是高等院校农学《植物生理学》课程中必做的一个实验,但在实验中,常因实验材料中色素含量低、提取制备较难、层析分离后色带清晰度差、甚至色带种类不全等诸多因素,最后影响了实验结果。本研究针对实验成败关键之处,从以下几个方面作了改进和提高:提取叶绿素的叶片选鲜绿的,机械组织、纤维素较少、叶绿素含量高的种类,如无新鲜叶片也可用干叶粉代替;叶绿体色素提取过程中加入乙醇和碳酸钙,保证叶片被充分研磨且叶绿素不能被破坏;纸捻子提前制备,并沾好叶绿素,让学生有感性认识。以上三个方面的改进和完善,取得了很好的实验教学效果。
收稿日期:2012年12月31日;修回日期:2013年1月28日;录用日期:2013年2月10日
关键词:叶绿体色素;提取;分离效果;改进方法
1. 引言
“叶绿体色素提取和分离”实验,是高等院校大农学《植物生理学》课程中必做的一个实验,也是高中《生物》四个必做实验中难度最大的一个。该实验的目的在于验证叶绿体色素的种类及性质、叶绿体色素在植物光合作用中的作用,加深对光合作用相关内容的理解。但在实验中,常因实验材料中色素含量低、提取制备较难、层析分离后色带清晰度差、甚至色带种类不全等诸多因素,最后影响了实验结果。作为农业院校的学生必须把这个实验的原理、方法、难点理解透彻,为将来从事相关工作打下坚实的基础。笔者针对实验成败关键之处,如提取叶绿素材料的选择,叶绿体色素提取、分离方法的选择与改善,纸捻子的制备等方面,进行改进和完善,取得了很好的教学效果。
2. 叶绿体色素分离实验原理
叶绿素(chlorophyll)是高等植物进行光合作用的重要物质,同时也是绿色植物的主要色素,高等植物叶绿体中的色素有叶绿素a、叶绿素b、叶黄素、胡萝卜素,在一些藻类中还有叶绿素c和叶绿素d[1]。它们都是不溶于水,只溶于丙酮、乙醇和石油醚等有机溶剂,在颜色上,叶绿素a呈蓝绿色,叶绿素b呈黄绿色,胡萝卜素呈橙黄色、叶黄素呈鲜黄色。这四种色素分离原理为:四种色素在层析液中的含量不同,因分子量大小的不同、分子极性的不同,而随层析液在滤纸上的扩散速度不同,其中胡萝卜素的分子量最小,极性最弱,含量最少,扩散速度最快,色素带幅度最窄,叶黄素次之,叶绿素b的分子量最大,极性最强,扩散速度最慢[2]。叶绿素a因其单位叶片量中的含量最多而色素带带幅最宽[3]。
3. 方法步骤
1) 制备滤液:叶绿体中色素的提取,这是进行色素分离的前提条件[4]。取新鲜绿色植物的叶片3~4 g,擦干净,去掉中脉剪碎,放入研钵中,加入1 g左右石英砂和碳酸钙,加2~3 ml的95%的乙醇,研磨至糊状,再加10~15 ml 95%乙醇,提取3~5 min,上清液过滤于三角瓶中,残渣用10 ml 95%乙醇冲洗,一同过滤于三角瓶中。如无新鲜叶片(这对于北方冬季比较寒冷的地区比较适用,尤其在新疆),也可用事先制好的叶干粉提取。取新鲜叶片,先用105℃杀青,再在80℃下烘干,研成粉末,密闭贮存。用时称叶粉1 g放入小烧杯中,加95%乙醇20~30 ml浸提,并随时搅动。待乙醇呈深绿色时,滤出浸提液备用。
2) 取直径11 cm圆形定性滤纸一张,在其中心戳一圆形小孔(直径约3 mm)。另取一张滤纸条(5 cm × 1.5 cm),用滴管吸取乙醇叶绿体色素提取液沿纸条的长度方向涂在纸条的一边,使色素扩散的宽度限制在0.5 cm以内,风干后,再重复操作数次,然后沿长度方向卷成纸捻,使浸过叶绿体色素溶液的一侧恰在纸捻的一端。
3) 将纸捻带有色素的一端插入圆形滤纸的小孔中,使与滤纸刚刚平齐(勿凸出)。
4) 取直径为10 cm的培养皿两个(所用培养皿底、盖直径应相同,且略小于滤纸直径,以便将滤纸架在培养皿边缘上)。在一培养皿内放一康维皿,在康维皿中央小室中加入适量的推动剂,把带有纸捻的圆形滤纸平放在康维皿上,使纸捻下端浸入推动剂中。迅速盖好培养皿,实验装置如图1所示。此时,推动剂借毛细管引力顺纸捻扩散至圆形滤纸上,并把叶绿体色素向四周推动,不久即可看到各种色素的同心圆环。如无康维皿,也可在培养皿中放入一平底短玻管或塑料药瓶盖,以盛装推动剂。
5) 当推动剂前沿接近滤纸边缘时,取出滤纸,风干,即可看到分离的四条色素带,四条色素带呈同心环状,从外向内依次是橙黄色的胡萝卜素、鲜黄色的叶黄素、蓝绿色的叶绿素a、黄绿色的叶绿素b(见图1)。
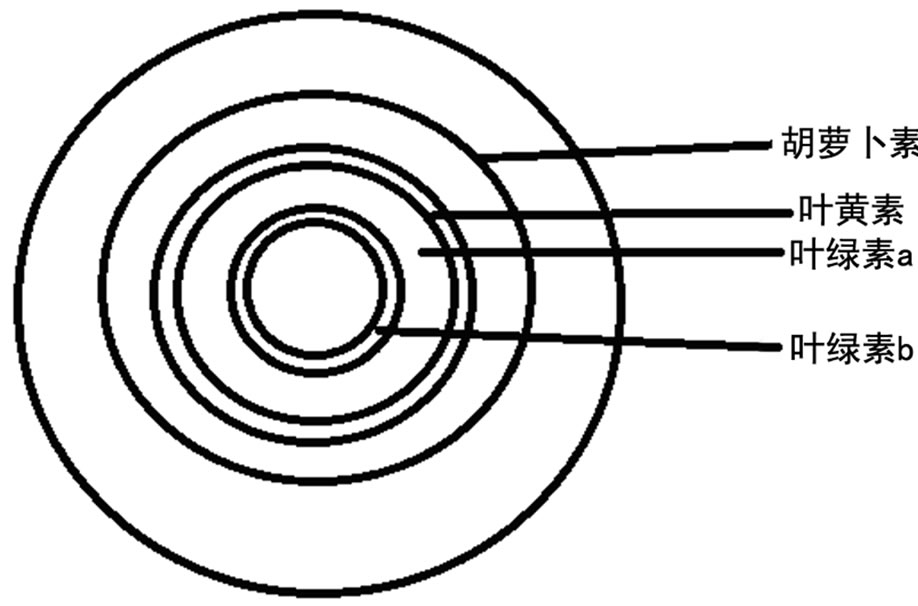
Figure 1. Leaf chloroplast pigment separation effect
图1. 叶绿素分离效果示意图
4. 提高叶绿体色素分离效果的方法与途径
通过查阅文献资料,再参考笔者的实践经验,针对实验成败的关键之处,如实验材料的选择、提取液色素含量的高低、色素提取的难易、纸捻子的制备等,对实验方法进行改良。
4.1. 实验材料的选择
关于实验材料,有关教材或实验指导书中大多选用的是新鲜的菠菜叶[5,6],但菠菜有季节性限制,且需要花钱购买。通过笔者实践比较研究,发现实际上有很多植物的叶片均可作为实验材料,但植物叶片必须是鲜绿的,且不宜是革质或蜡质的,也就是机械组织、纤维素较少、叶绿素含量高的种类。有的文章报道采用油菜、芹菜、菊花,我们实验室是就地取材,采用的是蜀葵、吊兰的叶片,效果也不错。
另外,由于新疆冬季比较寒冷、漫长,如果做实验的班级学生过多,提取叶绿素的材料来源就有问题,常常是实验室的所有蜀葵、吊兰的叶片全部被拔光,甚至别的实验室的也有同样的遭遇,所以笔者通过实验发现用干叶粉(夏季收集叶片磨成粉)提取叶绿素效果也不错,甚至比新鲜叶片的效果还好,这既解决了冬季材料短缺的问题,又改善了叶绿素的分离效果。
通过对比发现:用干叶粉提取叶绿体色素,滤液为深绿色,滤渣为浅绿色;而用新鲜叶片研磨过滤,滤液为浅绿色或黄绿色(或清或浊),滤渣为深绿色。笔者曾做过这样一个试验,将新鲜叶片的滤渣置于烧杯中,加入少量NaCl重新加入酒精或丙酮,搅拌过滤,滤液为深绿色,取用做层析,效果不错。试分析原因,推测可能有以下两点:1) 水分的存在增加了提取叶绿素的难度。叶绿体色素不溶于水,溶于酒精、丙酮等有机溶剂。色素溶于有机溶剂时,各色素分子分散在有机溶剂分子之间,它们之间的作用力是很弱小的范德华力,色素可以很容易被提取出来。而当水和乙醇相遇时,水分子和乙醇分子靠氢键相互吸引[7,8]。这样,一方面水分子和乙醇分子之间的引力远大于色素分子和乙醇分子之间的引力,乙醇分子被水分子所吸附。水分越多,乙醇分子被吸附的就越多。另一方面,水分子又极力排斥色素分子。竞争的结果,水分子吸附部分乙醇分子,这些乙醇分子就不能与色素分子结合,导致部分乙醇不能溶解色素,水分越多,叶绿体色素的提取越困难,过滤时,留在滤渣中的色素也越多,滤渣呈深绿色。2) 胶体的吸附也增加了提取叶绿素的难度。植物细胞的细胞质是一种胶体物质。在实验中,细胞虽然被研碎,但胶体依然存在。由于胶体有较强的吸附性,色素被胶体所吸附,因而不能被有机溶剂所提取,所以滤渣中还含有大量的叶绿素,呈深绿色。
4.2. 色素的提取、分离方法的选择与改善
色素提取困难,是导致提取液色素含量低的原因。在步骤1)中,学生操作时常出现的问题是绿叶还未被充分研磨,乙醇已挥发得差不多了研磨不充分,得到的滤液色素含量太低,二氧化硅和碳酸钙加得太多,使滤液中含大量的碳酸钙,滤液浑浊,还有的同学不加碳酸钙而导致叶绿色素被破坏,使滤液的颜色变成黑绿色,从而影响叶绿色素的扩散。针对上述情况,我在实验中作了相应的处理,例如将乙醇用量增至3~4 ml,将“少许”二氧化硅和碳酸钙的用量进行量化约1 g,并在学生动手操作前出示已剪碎的叶片、已研磨成糊状的叶的样品、已制作好的滤液样品,从而使学生有了一定的感性认识,提高了实验的成功率。
叶绿体色素分离方法有纸层析法、溶液分离法和柱层析分离法[8]。纸层析法中四种色素能清晰分辨;溶液分离法胡萝卜素不易分辨;柱层析分离法叶绿素a、b明显,叶黄素较浅。我们采用纸层析法。其分离装置如图2所示。

Figure 2. Leaf chloroplast pigment separation installation
图2. 叶绿体色素分离装置示意图
4.3. 纸捻子的制备
在步骤2)中,由于学生的操作不够熟练,操作时常出现的问题是滤纸条上色素不是很均匀,扩散宽度过大,导致在层析时部分色素会溶解在层析液中,使分离的色素带效果差。还有些学生把滤纸条的长度方向搞错,影响后面色素的扩散效果,另外学生对于滤纸条,沾取色素后最终颜色没有感性认识,从而造成重复沾取次数不足,颜色过浅,浓度偏低,导致色素扩散时有些色素带不明显或者不出现。针对上述情况,在实验中我作了相应的处理,提前把滤纸条沾好色素,拿着样条给学生讲解滤纸条上需要沾取色素的方向、宽带和颜色,让学生有了一定的感性认识,提高了实验的成功率。
5. 结果与讨论
通过以上分析发现叶绿体色素带分离实验,其成功的关键在于以下几个方面:
1) 植物叶片必须是深绿的,且不宜是革质或蜡质的,即机械组织、纤维素较少、叶绿素含量高的种类,研磨前应去除叶柄、大的叶脉,研磨要迅速、充分,充分研磨使叶绿体完全破裂,提取较多的色素。冬季也可用干叶粉提取叶绿色素。
2) 滤纸条色素的颜色为深绿色,要求含有较多的色素,且色素不能被破坏(叶绿素不稳定,易被活细胞内的叶绿素酶水解),所以要求研磨的时候加入少量的二氧化硅和碳酸钙(加入SiO2和CaCO3一定要少,否则滤液浑浊,杂质多,颜色浅,实验效果差。),且滤纸条沾取滤液时要多沾几次(至少7、8次),并且每一次一定要等到待滤液干后再沾,如此反复直至滤纸条色素颜色为深绿色为止。
参考文献 (References)
[1] 佘小平. 关于提取和分离叶绿体色素的几个问题[J]. 生物学通报, 1987, 12(8): 32-33.
[2] 陈英水. 关于色素分离试剂改进的实践与研究[J]. 生物学通报, 2010, 45(12): 40-41.
[3] 杨培俊, 秦峰秀. 几种层析液对滤纸圆盘分离叶绿体色素的影响[J]. 生物学通报, 2007, 42(9): 51-52.
[4] 唐伟斌. 叶绿体色素提取和分离实验失败原因初探[J]. 邢台师范高专学报, 2000, 15(2): 55-56.
[5] 李好样, 冯轶雪. 菠菜色素的提取与分离[J]. 太原师范学院学报(自然科学版), 2004, 3(3): 64-66.
[6] 黄持都, 胡小松, 廖小军, 吴继红. 叶绿素研究进展[J]. 中国食品添加剂, 2007, 3: 114-118.
[7] 潘亚平. 叶绿体提取液中色素分离实验方法的改进[J]. 生物学杂志, 1999, 19(6): 41.
[8] 杨建虹, 陶冶. 大量分离叶绿素a和b的方法[J]. 植物生理学通讯, 2002, 38(2): 156-158.
NOTES
*基金项目:中国博士后基金、新疆维吾尔自治区地方项目(Y251081) 和新疆农业大学果树学自治区重点学科开放课题共同资助。