International Journal of Psychiatry and Neurology
Vol.04 No.02(2015), Article ID:15939,6
pages
10.12677/IJPN.2015.42002
Influence of GM1 on Nogo-A Expression in Cerebral Cortex for the Brain Trauma Rats
Xiangdong Wang*, Xinliang Ren, Tiezhu Guo, Yanhong Wang, Jianhong Li, Zhiqiang Zhao
Department of Neurosurgery, The Heji Hospital Affiliated to Changzhi Medical College, Changzhi Shanxi
*通讯作者。
Email: *wxd770913@163.com
Received: Aug. 3rd, 2015; accepted: Aug. 17th, 2015; published: Aug. 24th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Objective: To observe the effects of the ganglioside (GM1) on Nogo-A expression in cerebral cortex for the rats which have brain trauma, to explore the possible mechanisms of GMl promoting the nerve repair of traumatic brain injury. Methods: SPF SD rats of 100 were randomly divided into four groups: no operation group (n = 10), sham operation group (n = 20), saline model group (n=35), GMI group (n=35). ELISA was used to detect Nogo-A expression in parietal cerebral cortex at different time. Results: By immunohistochemical method we observed in model group: the number Nogo-A positive cells increased at 24 hours in the model, and still slightly increased till 72 hours; in group GM1: the number Nogo-A of positive cells increased gradually in the early time, and became largest at24 h, then started to decrease, the application of GM1, after brain trauma, the increase in the number of Nogo-A positive cells was more delayed. Conclusions: the number of Nogo-A positive cells increased significantly after brain trauma, and inhibited the CNS regeneration after injury. After brain trauma, the ganglioside GM1 partially inhibited Nogo-A expression, and the mechanism might be through the stability of cell membrane, which played its neuroprotection roles in experimental traumatic brain injury in rats.
Keywords:Nogo-A, Brain Trauma, Ganglioside (GM1)

神经节苷脂对脑外伤大鼠大脑皮质Nogo-A表达的影响
王向东*,任新亮,郭铁柱,王彦宏,李建红,赵志强
长治医学院附属和济医院神经外科,山西 长治
Email: *wxd770913@163.com
收稿日期:2015年8月3日;录用日期:2015年8月17日;发布日期:2015年8月24日

摘 要
目的:观察神经节苷脂(GM1)对脑外伤大鼠大脑皮质中Nogo-A表达的影响,探讨GM1促进脑外伤神经修复的可能机制。方法:采用SPF级SD大鼠100只,随机分为空白对照组(n = 10)、假手术组(n = 20)、损伤后生理盐水组(n = 35)和损伤后GM1组(n = 35)。通过HE染色观察各组大鼠脑组织不同时间点病理情况;用免疫组化的方法观察Nogo-A阳性细胞数量。结果:通过免疫组化的方法观察损伤后生理盐水组:Nogo-A阳性细胞在造模24时即明显升高,至72 h时仍呈升高的趋势;GMl组:Nogo-A的阳性细胞数早期逐渐升高,至24 h时数量最多,之后开始减少,应用GMl后,Nogo-A的阳性细胞数量的增加较为延后。结论:Nogo-A在颅脑损伤后其阳性细胞数量显著增高,抑制中枢神经损伤后的再生,神经节苷脂GM1在脑损伤后可部分抑制Nogo-A的表达,机制可能通过稳定细胞膜、减轻细胞水肿,从而发挥对实验性脑外伤大鼠的神经保护作用。
关键词 :Nogo-A,脑外伤,神经节昔脂

1. 引言
目前随着科技的进步,现代化交通工具特别是汽车,电动车等的广泛应用,以及高层建筑的增加,颅脑损伤患者越来越多,颅脑损伤已经成为危害人们健康和生命的一个重要因素。而颅脑损伤后的救治,特别是神经细胞的保护及修复治疗尤为重要。
Nogo-A是由Nogo基因表达的一种具有轴突再生抑制作用的蛋白质分子,自从Nogo-A蛋白及其受体NgR被发现,中枢神经损伤再生机制的研究就成为神经科学研究领域的热点。随着对Nogo-A、NgR研究的深入,人们对其从分子到蛋白,从表达到分布、功能,都有了一定的认识,但仍存在问题和困惑。有人发现,在大鼠颅脑创伤后,阻断或抑制Nogo-A的表达,能够促进中枢神经系统损伤后结构和功能的恢复[1] 。
神经节苷脂(GM1)是一种脑神经保护剂,具有刺激中枢神经系统损伤后潜在的代偿机制,促进“神经重构”(包括神经细胞的生存、轴突和突触生长),在细胞的发育、分化、修复神经组织、神经元的可塑性等方面起着重要作用,有利于增加脑循环的血供量;并有利于脑细胞的修复和再生,抑制脑神经元细胞的凋亡[2] -[4] ,国内尚未查到从分子生物水平研究GM1治疗颅脑损伤大鼠康复机制的文献报道。因此我们采用大鼠脑外伤模型,观察应用GM1后各时间点脑外伤大鼠大脑皮质Nogo-A的表达变化,初步探讨GM1对Nogo-A的作用。
2. 材料与方法
2.1. 材料
采用SPF级SD大鼠100只,随机分为空白对照组(n = 10)、假手术组(n = 20)、损伤后生理盐水组(n = 35)和损伤后GM1组(n = 35)。假手术组20只,假手术组只行头皮切开和颅骨钻孔,缝合术后腹腔注射生理盐水5 d。脑外伤模型70只,分为损伤后生理盐水组35只,伤后腹腔注射生理盐水5 d;GM1组35只,伤后腹腔注射GM1 5 d。以上各组动物分别处理后于12 h,24 h,3 d,5 d四个时间点使其断头致死。将脑组织标本浸泡在30%蔗糖、40 g/L多聚甲醛溶液中,待3天后,用石蜡固定,切片,通过HE染色观察各组新生大鼠脑组织病理情况;用免疫组化的方法观察Nogo-A阳性细胞数量。
药物神经节苷脂(GMl,商品名“申捷”,山东齐鲁制药有限公司生产,生产批号:4101191EN,注射剂,20 mg/2mL)。
2.2. 方法
2.2.1. 动物模型
采用Feeney’s自由落体硬脑膜外撞击方法制造模型。大鼠术前禁食8 h,禁水2 h,将大鼠用10%水合氯醛(400 mg/kg)腹腔注射麻醉,俯卧位固定于手术台上,右侧颅顶部备皮,常规碘酒、酒精消毒,铺无菌巾,选取右侧颅顶旁正中切口,长约
2.2.2. 组织取材、染色
在预定时间点用10%水合氯醛(400 mg/kg)腹腔注射麻醉大鼠,仰卧位固定,胸腹部剃毛,常规碘酒、酒精消毒,铺无菌巾,取前正中切口,切开皮肤、皮下组织,打开胸腔,于主动脉根部置一根医用4号缝线,剪开左心室置管入主动脉升部,用丝线结扎固定,剪开右心耳,用0.1 M磷酸盐缓冲液(pH = 7.4)快速灌洗至组织变白,然后用40 g/L多聚甲醛0.1 M磷酸盐缓冲液(PH = 7.4) 500 ml灌注固定,半小时后断头取脑,创伤组取创伤部位周边皮质及对侧相应区域皮质约1.0 cm3。正常对照组和假手术组大鼠则取双侧大脑对应顶叶皮质约1.0 cm3。标本取出后随即用40 g/L多聚甲醛0.1 M磷酸盐缓冲液(PH = 7.4)固定,72小时后石蜡包埋,连续切片,切片厚度5 mm,以备免疫组织化学染色。
2.2.3. 免疫组织化学检测
各实验动物组脑切片分别采用SABC法进行免疫组化染色,按SABC免疫组化试剂盒说明书中的步骤进行,兔抗大鼠Nogo-A抗体(武汉博士德生物工程有限公司)稀释度为1:150,二抗采用即用型SABC试剂盒内的二抗原液,DAB显色。分别分组检测Nogo-A在脑外伤大鼠脑组织中的表达。
Nogo-A的表达以胞浆及轴突棕黄色着色为阳性,采用Image-Pro Plus6.Oq全自动图像分析系统,每张切片在高倍镜下(10 × 40)随机选取伤侧大脑半球互不重叠的6个视野,测出阳性反应产物的IOD值和面积area,计算出阳性反应产物的平均光密度值 = IOD/area,从而得出统计学数据。
2.3. 统计学分析
所有数据均以均数 ± 标准差(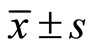 )表示,应用SPSS16.0统计软件分析,各组间比较采用方差分析,以P < 0.05表示差异有统计学意义。
)表示,应用SPSS16.0统计软件分析,各组间比较采用方差分析,以P < 0.05表示差异有统计学意义。
3. 结果
3.1. 脑外伤大鼠脑HE染色观察
通过HE染色观察,12 h时间点观察:神经细胞出现水肿,局部神经元出现核仁消失、核固缩现象;24 h时间点观察:神经元水肿,数量有所减少,核仁消失,核固缩;神经基质水肿;72 h时间点观察:大脑皮质神经元数量明显减少,正常结构消失,星形胶质细胞肿胀,出现脑实质坏死,胶质细胞增生。
3.2. 大鼠脑组织Nogo-A表达变化
本实验结果显示Nogo-A蛋白主要在少突胶质细胞表达.此外神经元也有表达,蛋白染色定位于胞浆及突起,呈棕黄色。
通过免疫组化的方法观察损伤后生理盐水组(见表1):Nogo-A阳性细胞在造模24时即明显升高,至3 d,时仍呈较高水平,5 d开始下降;GMl组:Nogo-A的阳性细胞数早期逐渐升高,至3 d时数量最多,但少于生理盐水组,之后开始减少,应用GMl后,Nogo-A的阳性细胞数量的增加较为延后。
4. 讨论
目前对于Nogo-A和NgR作用机制的研究已经取得了长足进展,针对其作用的各个环节进行干扰、抑制、拮抗来促进受损的神经恢复,都已经取得了一定成果。但是Nogo-A和NgR复杂信号转导途径的面纱还没有揭开,同时二者作为正常神经纤维髓鞘的组成成分[5] ,其生理功能目前还不甚明确,还需要更深入的研究。国内外对于Nogo-A及其受体的表达研究主要是针对缺血缺氧性脑损伤,脑梗死及脊髓损伤的研究[6] -[16] ,对于脑外伤后脑组织中Nogo-A及其受体的表达研究报导较少,但目前研究发现,在颅脑创伤、局灶脑缺血后Nogo-A蛋白水平明显升高,其升高程度与脑损伤严重程度呈正相关,并与预后有密切关系。因此,Nogo-A蛋白可作为判断颅脑创伤程度、指导治疗及评价预后的敏感性生化指标[5] [17] [18] 。
神经节苷脂在中枢神经系统中含量尤为丰富,外源性神经节苷脂人血后与脂蛋白结合,可通过血脑屏障进入神经系统,尤其高度局限于受损病灶区域,嵌合于神经细胞膜中,参与神经重构的生理过程,从而促进神经细胞修复和功能的恢复;另外,其可通过抑制脂质过氧化反应及减少兴奋性氨基酸的释放,减轻脑损害;还可促进细胞膜各种酶活性恢复,防止钙超载,减轻血管痉挛及脑水肿,发挥脑保护作用[19] [20] 。
研究发现神经节苷脂具有良好的脑细胞保护作用,其机制可能是抑制Nogo-A蛋白表达,降低血清Nogo-A蛋白水平密切相关[21] [22] 。
Table 1. The expression of Nogo-A on the edge of the trauma of focal brain tissue
表1. Nogo-A在创伤灶边缘脑组织中表达
(与假手术组比较,*P < 0.05)
本研究采用大鼠颅脑损伤模型研究神经节苷脂对脑外伤大鼠大脑皮质Nogo-A表达的影响。结果发现,与空白对照组及假手术组比较。损伤后生理盐水组:Nogo-A阳性细胞在造模24时即明显升高,至3 d时仍呈较高水平,5 d开始下降;GM1组:Nogo-A的阳性细胞数早期逐渐升高,至3 d时数量最多,但少于生理盐水组,之后开始减少,应用GM1后,Nogo-A的阳性细胞数量的增加较为延后。
说明神经节苷脂具有较好的神经保护作用,其作用机制可能是抑制Nogo-A蛋白表达。Nogo-A在颅脑损伤后其阳性细胞数量显著增高,抑制中枢神经损伤后的再生,神经节苷脂GM1在脑损伤后可部分抑制Nogo-A的表达,可能通过稳定细胞膜、减轻细胞水肿,从而发挥对实验性脑外伤大鼠的神经保护作用。但是对于如何稳定细胞膜,以及如何减轻细胞水肿等的分子机制还有待于进一步研究。
基金项目
山西省教育厅高等学校科技创新项目:20111109。
文章引用
王向东,任新亮,郭铁柱,王彦宏,李建红,赵志强. 神经节苷脂对脑外伤大鼠大脑皮质Nogo-A表达的影响
Influence of GM1 on Nogo-A Expression in Cerebral Cortex for the Brain Trauma Rats[J]. 国际神经精神科学杂志, 2015, 04(02): 7-12. http://dx.doi.org/10.12677/IJPN.2015.42002
参考文献 (References)
- 1. Marklund, N., Morales, D., Clausen, F., Hånell, A., Kiwanuka, O., Pitkänen, A., et al. (2009) Functional outcome is im-paired following traumatic brain injury in aging nogo-A/B-deficient mice. Neuroscience, 163, 540-551. http://dx.doi.org/10.1016/j.neuroscience.2009.06.042
- 2. 李计成, 李晓明, 戴如飞, 等 (2013) 单唾液酸四己糖神经节苷脂对颅脑损伤患者血清中神经元特异性烯醇化酶的影响及其临床意义. 实用心脑肺血管病杂志, 2, 36-38.
- 3. 张跃, 周明清, 王洋鑫 (2010) 单唾液酸四己糖神经节苷脂对脑卒中患者早期康复的影响. 中国现代医生, 36, 167-185.
- 4. 邱观养, 黄丹丹, 邓耀芳, 等 (2013) 神经节苷脂治疗急性脑梗死的临床疗效观察叨. 中国医药指南, 1, 532-533.
- 5. 古磊, 甄云 (2012) Nogo-A及其受体NgR 对中枢神经系统损伤后修复的影响. 中国医药导报, 1, 9-11.
- 6. 陈大鹏, 王华, 姚裕家 (2006) 缺氧缺血新生鼠脑组织Nogo-A含量变化. 四川医学, 27, 225-227.
- 7. Jiang, W., Xia, F., Han, J. and Wang, J. (2009) Patterns of Nogo-A, NgR, and RhoA expression in the brain tissues of rats with focal cerebral infarction. Translational Research, 154, 40-48. http://dx.doi.org/10.1016/j.trsl.2009.04.005
- 8. 刘仁红, 周晓光, 熊爱华, 等 (2007) Nogo-A mRNA在缺氧缺血性脑损伤新生大鼠脑组织中的表达. 中华围产医学杂志, 1, 37-40.
- 9. 吴功雄, 张海伟, 徐杰, 等 (2005) 神经生长抑制因子Nogo-A在缺血性脑梗塞大鼠脑组织中的表达. 中国病理生理杂志, 21, 143-147.
- 10. Zhou, C.M., Li, Y., Nanda, A. and Zhang, J.H. (2003) HBO suppresses Nogo-A, Ng-R, or RhoA expression in the cerebral cortex after global ischaemia. Biochemical and Biophysical Research Communications, 309, 368-376. http://dx.doi.org/10.1016/j.bbrc.2003.08.006
- 11. Mingorance, A., Fontana, X., Soriano, E. and del Río, J.A. (2005) Overexpression of myelin associated glycoprotein after axotomy of the perforant pathway. Molecular and Cellular Neuroscience, 29, 471-483. http://dx.doi.org/10.1016/j.mcn.2005.03.016
- 12. Cheatwood, J.L., Emerick, A.J., Schwab, M.E. and Kartje, G.L. (2008) Nogo-A expression after focal ischemic stroke in the adult rat. Stroke, 39, 2091-2098. http://dx.doi.org/10.1161/strokeaha.107.507426
- 13. Eslamboli, A., Grundy, R.I. and Irving, E.A. (2006) Time-dependent increase in Nogo-A expression after focal cerebral ischemis in marmoset monkeys. Neuroscience Letters, 408, 89-93. http://dx.doi.org/10.1016/j.neulet.2006.08.056
- 14. Maier, I.C., Ichiyama, R.M., Courtine, G., Schnell, L., Lavrov, I., Edgerton, V.R., et al. (2009) Differential effects of anti-Nogo-A antibody treatment and treadmill training in rats with incomplete spinal cord injury. Brain, 132, 1426-1440. http://dx.doi.org/10.1093/brain/awp085
- 15. Harel, N.Y., Song, K.H., Tang, X. and Strittmatter, S.M. (2010) Nogo receptor deletion and multimodal exercise improve distinct aspects of recovery in cervical spinal cord injury. Journal of Neurotrauma, 27, 2055-2066. http://dx.doi.org/10.1089/neu.2010.1491
- 16. 朱薇薇, 赵红洋, 温天莲, 等 (2010) 缺氧缺血性脑损伤新生大鼠脑Nogo受体水平及NEPl-4O的神经保护作用.中华儿科杂志, 2, 138-142.
- 17. 沈剑虹, 文立, 马进 (2007) 大鼠弥漫性轴索损伤对脑内NgR 表达的影响. 交通医学, 4, 347-349, 354.
- 18. 林在楷, 田恒力, 吴炳山, 等 (2010) 急性闭合性颅脑损伤患者血清Nogo-A蛋白的变化. 上海交通大学学报:医学版, 1, 70-72.
- 19. 刘晓祥, 杜忠胜, 明大庆, 等 (2007) 神经节苷脂治疗重型颅脑损伤疗效分析(附46例报告). 山东医药, 15, 40-41.
- 20. 张彦 (2011) 神经节苷脂联合高压氧治疗新生儿缺氧缺血性脑病125例l临床观察. 山东医药, 12, 87-88.
- 21. 王树兴, 彭龙锋, 曲绍霞, 等 (2012) 神经节苷脂对重型颅脑创伤患者血清Nogo-A蛋白水平的影响. 山东医药, 3, 72-74.
- 22. 虞欢东, 曹利民, 裴静波 (2014) 神经节苷脂对重型颅脑损伤患者血清S100B蛋白和Nogo-A蛋白水平的影响及疗效观察. 中国医药导报, 6, 59-61.
