Hans Journal of Surgery
Vol.1 No.3(2012), Article ID:4995,6 pages DOI:10.12677/HJS.2012.13003
AFP Specific Liver Tumor Vaccines Inhibit Hepatocellular Carcinoma Growth
1Hepatobiliary Surgery Division, Tenth People’s Hospital, Tongji University, Shanghai
2Internal Medicine Division, First People’s Hospital, Shanghai Jiao Tong University, Shanghai
3Department of Surgery and Immunology, Cancer Institute of Pittsburgh University, Pittsburgh, USA.
Email: yliu6633@yahoo.com.cn
Received: Jul. 14th, 2012; revised: Jul. 26th, 2012; accepted: Aug. 1st, 2012
ABSTRACT:
Objective: Alpha-fetoprotein (AFP), a tumor-associated antigen for hepatocellular carcinoma (HCC), is an established biomarker for hepatocellular cancer (HCC). In this study, we detected antitumor activity of AFP specific T cells in vitro. Methods: We created a lentivirus expressing AFP (Lenti-AFP) and investigated the antitumor activity of AFP-specific CD4+ and CD8+ T cells(liver tumor vaccines), which were activated by either AFP peptide-pulsed or Lenti-AFP-engineered DC in vitro. Results: Our research demonstrated that the AFP-specific T cells could efficiently kill HepG2 cells, by significantly increasing the level of IL-2, IFN-γ、TNF-α、perforin and granzyme B, as well as by inhibiting the production of IL-10 (a negative regulator of T cell activation). Conclusion: AFP-specific CD4+ and CD8+ T cells (liver tumor vaccines) which were activated by either AFP peptide-pulsed or Lenti-AFP-engineered DC have obviously antitumor activity. This study provides new insight into the design of DC activated antigen-specific T cell-based clinical trials
Keywords: Alpha-Fetoprotein (AFP); Dendritic Cell; Cytokine; AFP-Specific T Cells
AFP特异性肝癌疫苗抑制肝细胞癌生长
刘 扬1,王跃如2,Lisa H. Butterfield3
1同济大学附属第十人民医院肝胆外科,上海
2上海交通大学附属第一人民医院内科,上海
3美国匹兹堡大学肿瘤研究所,外科及免疫学组,匹兹堡,美国
Email: yliu6633@yahoo.com.cn
摘 要:
目的:甲胎蛋白作为一种肿瘤特异性抗原,是临床上诊断肝癌的重要指标。本研究中,我们检测了AFP特异性T细胞的体外抗肿瘤免疫活性。方法:我们采用经过AFP抗原决定簇肽刺激或慢病毒转染的树突状细胞(dendritic cells, DC),活化AFP特异性的CD4+T细胞和CD8+T细胞(肝癌疫苗),并在体外检测了这群T细胞对人肝癌细胞HepG2的杀伤活性。结果:本研究结果显示,AFP特异性的CD4+T细胞和CD8+T细胞体外能有效杀伤HepG2细胞,上调培养体系中IL-2、IFN-γ、TNF-α、穿孔素、颗粒酶的水平,对于T细胞活化的负调控因子IL-10,具有显著的抑制作用。结论:经DC活化后的AFP特异性T细胞具有显著的体外抗肿瘤免疫活性,为肝细胞癌的临床免疫治疗提供了依据。
收稿日期:2012年7月14日;修回日期:2012年7月26日;录用日期:2012年8月1日
关键词:甲胎蛋白;树突状细胞;细胞因子;AFP特异性T细胞
1. 引言
肝细胞癌(HCC)位居国人恶性肿瘤发病率第二位,年死亡人数超过30万人,只有少数患者(<20%)适合手术治疗,因此应用肝癌特异性抗原的肿瘤疫苗治疗成为当前研究的热点。甲胎蛋白(AFP)是肝细胞癌特异性抗原,约60%~70%的HCC患者血清AFP不同程度升高。
树突状细胞(DC)是目前公认的体内抗原递呈功能最强的专职抗原递呈细胞,能有效的激活幼稚T细胞,处于启动、调控并维持免疫应答的中心环节,在机体抗肿瘤免疫中具有十分重要的作用。临床研究显示,实体肿瘤的DC浸润与预后较好有关,而DC受损则免疫抑制增强且肿瘤恶化。Butterfield等[1,2]鉴定出一系列可被人T细胞识别的HLA-A*0201限制性AFP免疫决定簇肽和亚免疫决定簇肽,并应用于I/II期临床实验(安全性和有效性)。本文作者[3,4]随后报道了使用AFP抗原决定簇肽和亚决定簇肽片段刺激DC,能有效诱发抗肝癌的特异性细胞免疫反应。有研究显示,CD4+辅助性T细胞可能通过促进CD8+T细胞扩增并增加肿瘤杀伤性细胞因子的释放,发挥潜在的抗肿瘤免疫作用[5]。
在前期研究工作的基础上[6],我们应用HLAA*0201限制性AFP抗原决定簇肽和亚决定簇肽以及慢病毒转染的AFP刺激的树突状细胞与人外周血T细胞共同培养,在体外人肝癌细胞株模型上验证了AFP抗原特异性T细胞的抗肿瘤免疫活性,为临床治疗肝细胞癌提供了实验基础,现报道如下。
2. 材料与方法
2.1. 健康捐献者
通过标准的HLA血清分型及基因分型方法确定所有捐献者均为HLA-A2阳性(血液来自上海市中心血站自愿献血者)。
2.2. 多肽合成
多肽由上海生工生物工程技术有限公司合成(Shanghai, P.R.China),用氨基酸分析和质谱证实了氨基酸的序列正确,多肽纯度 > 95%。
2.3. 肝癌细胞株
表达HLA-A2+的HCC细胞株(AFP阳性)购自美国BD公司。
2.4. 统计分析
用SPSS 11.0统计软件处理各组数据,实验结果以mean ± SD表示,采用配对t检验,p < 0.05为具有统计学意义。
2.5. AFP慢病毒载体的构建
以pWPXL-MOD2为骨架,将目的基因构建到双GFP表达的慢病毒载体中,替换其中一个GFP,形成AFP与GFP共表达的慢病毒载体。使用PCR方法从HepG2细胞基因组中获取AFP基因片段,引入BamH1和Sal1酶切位点。对空载体pWPXL-MOD2和PCR的回收产物用BamH1和Sal1进行双酶切及连接反应。采用ProFection Mammalian Transfection System制备慢病毒穿梭质粒及其辅助包装元件载体质粒。简言之,慢病毒包装细胞转染用胰蛋白酶消化对数生长期的293T细胞,细胞密度为0.5 × 109/L时,重新接种于25 mL的15 cm细胞培养皿,于37℃,50 mL/L CO2培养箱内培养。制备慢病毒包装系统中四种质粒DNA溶液(pRSv-REV 10 ug,pMD 1 g~pRRE 15 ug,pMD2G 7.5 ug,AFP质粒20 ug),定容至1800 ul,再加入CaCl2 (2.5 mol/L)200 ul,混匀后加入2XHEBS缓冲盐溶液2000 ul,室温放置20~30 min;当细胞密度达60%~70%时转染。将DNA和磷酸钙混合液转移至含单层细胞的培养液中,混匀,培养12 h后弃去含有转染混和物的培养液,加入PBS 15 mL,轻摇后弃去,重复该步骤3次;每瓶细胞中加入含100 mL/L胎牛血清的细胞培养液15 mL,继续培养48 h。收集转染72 h的293T细胞上清液;将收集的上清液于4℃,4000 g离心10 min,10 cm/r,收集上清液;将上清液以0.45 μm滤器过滤;于40 mL超速离心管中,4℃,72,000 g/min离心120 min;500 ul PBS重悬病毒沉淀。
2.6. DC的分离和培养
DC的获取如文献所述,通过静脉穿刺抽取外周血,通过Ficoll密度梯度离心法分离外周血单核细胞(PBMC)。PBMCs(3~4 × 107)接种于T-25培养瓶中,加入含抗生素及5%~10%人AB血清的RPMI1640培养基,于37℃培养箱中培养2 h。用PBS轻轻漂洗,去除未贴附的细胞,已贴附的细胞在含有800 U/mL GM-CSF和500 U/mL IL-4的培养基中培养7 d。冲洗后收集未贴附及贴附较弱的细胞(DC)。形态学和基因分型检测显示,这些细胞中一般含有30%~50%的DC。
2.7. 从PBMC中分离CD8+T,CD4+T淋巴 细胞
通过免疫磁珠法分别分离出CD8+T细胞和CD4+T细胞。流式细胞术分析结果显示,分离后得到的CD8+T细胞,CD4+T细胞的纯度均大于98%[3]。
2.8. 通过AFP抗原决定簇肽刺激以及慢病毒转染DC获得AFP特异性的CD8+T和 CD4+T细胞
通过AFP抗原肽刺激DC获得AFP特异性的CD8+T和CD4+T细胞的方法如前人所述。简言之,室温下用含10 μg/mL AFP抗原肽的无血清RPMI 1640培养液刺激HLA-A2+样本来源的DC 120 min。DC经离心计数后,按1:20的比例与自体同源CD8+T细胞或CD4+T细胞于24孔板中共培养1周,RPMI 1640培养液中含有抗生素,10%人AB血清及10 ng/mL IL-7,每3~4 d添加IL-2 10 U/mL。培养一周后,计数未贴附的细胞,用以抗原肽处理后的DC再刺激1周。刺激两次后,收集细胞检测。在含2%人AB血清的RPMI1640培养基中用携带人AFP全长cDNA的重组慢病毒表达载体Lenti-AFP转染DC 2 h。转染后的DC以1 × 105 cells/mL的密度铺板,与CD8+T细胞或CD4+T细胞共培养于含有10%人AB血清及25 ng/mL IL-7的培养液中(DC:T = 1:20),每隔3 d补充10 U/mL。
2.9. AFP特异性的CD8+T和CD4+T淋巴细胞对HepG2肝癌细胞的体外杀伤活性
将上一步得到的CD8+T细胞单独或连同CD4+T细胞,与HepG2细胞共同培养(CD8+T细胞:HepG2 = 1:1)于96孔板中,总体积200 µL,并设淋巴细胞和靶细胞对照,每实验组设3个复孔。培养18 h后加入5 mg/mL MTT 10 µL,继续培养6 h,弃上清,加DMSO 100 µL,于570 nm处测定吸光度值(A),杀伤率 = [1 – (实验孔A值–淋巴细胞对照孔A值)/靶细胞对照孔A值] × 100%。
2.10. 淋巴细胞增殖的测定
制备细胞悬液,加入到96孔培养板中(2 × 105个/孔),每实验组设3个复孔。细胞加入20 µL 1 µ Ci/孔的[3H]胸腺嘧啶,于37℃、5%CO2孵育箱中培养6 h后,用细胞收集仪将细胞收集至玻璃纤维膜上。加闪烁液后,用液闪仪测定每分钟脉冲数(cpm),以刺激指数(SI)表示增殖程度:SI = 实验孔cpm/对照孔cpm。
2.11. 细胞因子的检测
将上述单细胞悬液加入到96孔培养板中(2 × 105个/孔),每实验组设3个复孔。细胞于于37℃、5%CO2孵育箱中培养24 h后,收集上清,用双抗体夹心ELISA法检测上清中细胞因子的水平。方法如下:1) 包被:将稀释好的一抗加入96孔酶标板中,每孔100 µL,4℃过夜;2) 封闭:用含0.05%吐温–20的PBS洗3次后,加入200 µL含10%FCS的PBS,室温封闭2 h;3) 加样:加入100 µL标准品或样品,4℃过夜;4) 加二抗:每孔加入100 µL稀释后的二抗,室温放置1 h;5) 加酶:每孔加入100 µL稀释后的辣根过氧化物酶,室温放置1 h;6) 加底物:将底物TMB稀释为0.1 mg/mL,加入0.1%H2O2,每孔100 µL;8) 显色:室温显色30 min后,加入2 M H2SO4终止反应,于450 nm处测吸光度值,校正波长为570 nm,根据标准曲线换算出培养上清中细胞因子的含量,结果用pg/mL表示。
3. 结果
3.1. AFP抗原肽刺激及慢病毒转染处理后的DC能显著促进T细胞增殖
本实验体系中,以人HepG2肝癌细胞cDNA为模板,PCR扩增出AFP基因片段,构建成Lenti-AFP慢病毒载体或阴性对照病毒Lenti-LacZ(mock)。以该慢病毒载体转染293T细胞,包装慢病毒表达载体,再以包装好的慢病毒体外感染DC。首先,我们检测了慢病毒转染率和AFP表达情况。如图1(A)所示,以18SRNA为内参,AFP过表达率为(5.31 ± 0.11)。同时也用蛋白印记分析的方法对细胞裂解物中AFP的含量进行验证。结果如图1(A)和1(B)所示。
(A) AFP在慢病毒转染DC中的基因表达结果,以18SRNA为内参。(B) AFP的蛋白印记分析结果。结果以mean ± SD表示,与阴性对照相比,**p < 0.01,实验重复3次,得到类似结果。
3.2. AdvAFP转染的DC细胞能激活CD8+T细胞产生针对一系列AFP肽段的特异性的免疫应答
为了检测慢病毒转染DC对细胞免疫应答的影响,我们检测了T细胞的增殖程度。我们使用了两种方法检测抗原递呈作用:第一,使用慢病毒转染DC,得到能持续加工递呈AFP抗原的成熟DC;第二,使用AFP蛋白联合GM-CSF/IL-4刺激未成熟的DC,模拟HCC患者体内高水平的AFP刺激血循环中不成熟的DC递呈AFP抗原的过程。研究结果显示(图2),慢病毒转染DC能显著促进T细胞增殖水平(刺激指数,SI = 3.68 ± 0.07,p < 0.01);使用AFP肽段处理的DC,尽管刺激效果略逊于前者,但同样具有统计学意义(p < 0.01),与Butterfield等报道一致,AFP抗原决定簇肽(AFP137,AFP158,AFP325,AFP542)与亚AFP抗原决定簇肽(AFP1,AFP492,AFP547,AFP555)刺激T细胞增殖的能力显示出一定的等级差异。
3.3. AFP特异性CD4+T细胞和CD8+T细胞通过调节相关细胞因子的产生,有效杀伤HepG2细胞
体外实验结果显示,无论是AFP抗原肽刺激处理后的DC,还是通过基因工程方法得到的LentiAFP/DC,都能够显著的促进T细胞增殖。鉴于AFP特异性的免疫反应,尤其是T细胞反应在抗肿瘤免疫中的重要作用,我们检测了经抗原肽刺激或慢病毒转染处理后的DC诱导的AFP特异性的CD8+T和CD4+T细胞对人肝癌细胞HepG2的杀伤活性。AFP特异性的CD8+T和CD4+T细胞的获得方法如材料与方法中所述。将HepG2细胞分为两组,第一组加入DC处理后的AFP特异性CD8+T细胞;另一组加入DC处理后的CD4+T细胞和CD8+T细胞(每组HepG2:CD8+T = 1:1)。培养24小时后检测效应细胞对肝癌细胞的杀伤活性。研究结果显示(图3),经Lenti-AFP/DC激活的特异性T细胞对HepG2细胞有较强的杀伤作用;经负载AFP抗原决定簇肽(AFP542,AFP158,AFP325,AFP137)的DC激活的特异性T细胞对HepG2细胞也具有较强的杀伤作用,且呈现出一定的等级关系;而经负载亚AFP抗原决定簇肽的DC激活的特异性T细胞对HepG2细胞的杀伤作用相对较弱。总体而言,
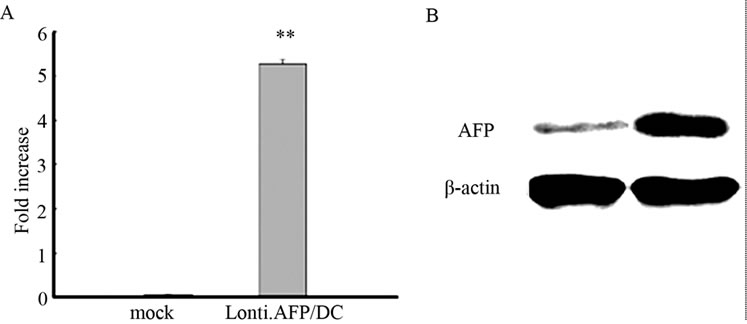
Figure 1. Lentivirus transfection rate and AFP expression level
图1. 慢病毒转染率及AFP表达情况
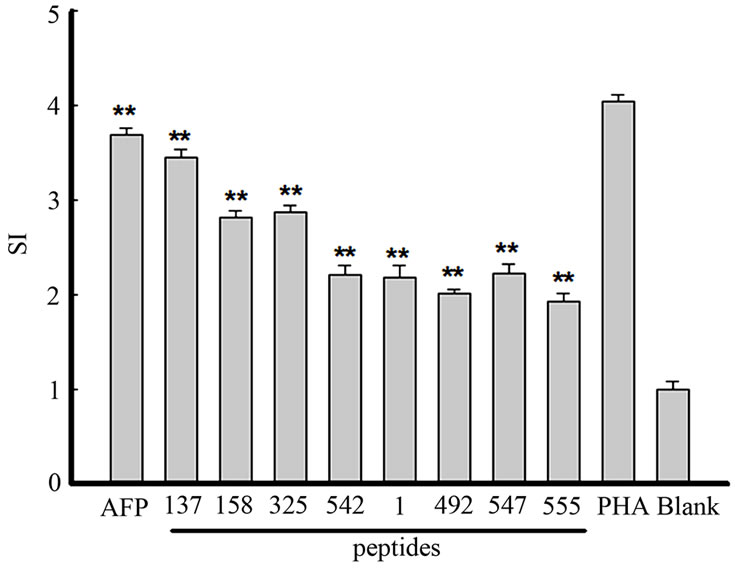
Figure 2. AFP peptide-pulsed and Lenti-AFP transduced DC could significantly induce T cell proliferation (**p < 0.01)
图2. AFP抗原肽刺激及慢病毒转染处理的DC能显著促进T细胞增殖水平(**p < 0.01)
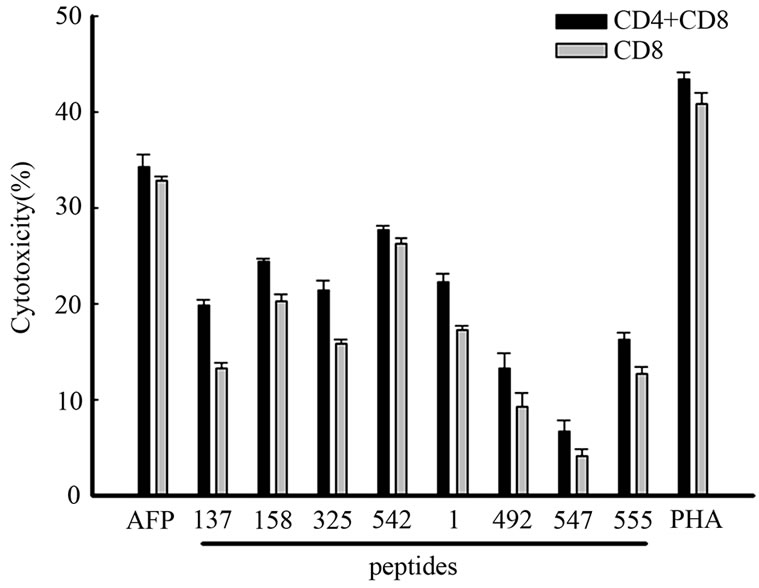
Figure 3. Killing activity of DC-activated AFP-specific CD8+ T and CD4+ T cells on HepG2 cell
图3. 活化的AFP特异性CD4+T细胞和CD8+T细胞对HepG2细胞的杀伤作用
CD4+T细胞与CD8+T细胞混合组对HepG2细胞的杀伤活性略强于CD8+T细胞处理组,但组间无显著性差异。
3.3. T细胞免疫应答的过程中细胞因子的产生和变化
为了检测AFP特异性的CD4+T细胞和CD8+T细胞对HepG2细胞的杀伤活性是否与调节相关细胞因子的水平有关,我们用ELISA的方法检测了培养上清中IL-2、IFN-γ、IL-10、TNF-α、穿孔素、颗粒酶、FasL的含量。研究结果显示,经DC活化后的AFP特异性T细胞能显著增高培养上清中IL-2、IFN-γ、TNF-α、穿孔素、颗粒酶的水平(图4,图5(A)),尤以Lenti-AFP/DC处理后的T细胞作用最为强烈,而其他的AFP抗原决定簇肽和亚AFP抗原决定簇肽对这些细胞因子也有一定的增强作用,且呈现出一定的等级关系,但是我们并没有检测到CD4+T细胞/ CD8+T细胞混合组与CD8+T细胞处理组的组间差异。和对照相比,经DC处理后的各组T细胞均能明显降低培养上清中IL-10的水平(图5(B)),而对FasL的表达没有影响(图5(C))。
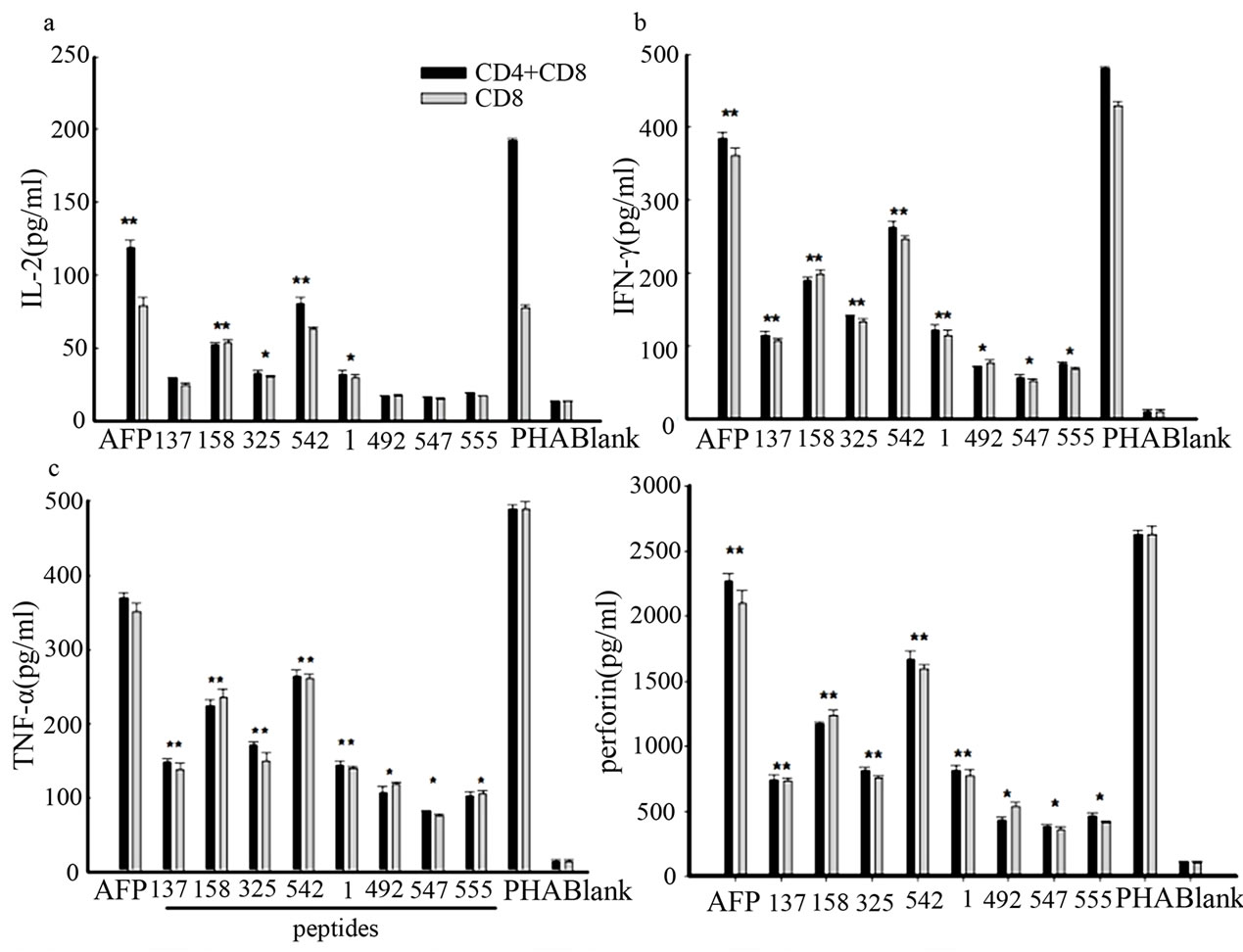
Figure 4. DC-activated AFP-specific CD8+ T and CD4+ T cells could increase expression of antitumor cytokines
图4. 活化的AFP特异性CD4+T细胞和CD8+T细胞上调抗肿瘤细胞因子的表达

Figure 5. DC-activated AFP-specific CD8+ T and CD4+ T cells modulated cytokines profiles in supernatant
图5. 活化的AFP特异性CD4+T细胞和CD8+T细胞调节培养上清中细胞因子的水平
4. 讨论
抗原递呈是T细胞活化过程中的一个重要步骤,树突状细胞(DC)是功能强大的专职抗原递呈细胞,是机体免疫的起始细胞[7]。近年来,发现肿瘤及其微环境通过多种途径减少肿瘤患者体DC的数量并可抑制DC的成熟,从而下调或抑制其抗原提呈及免疫起始功能,并且可以诱导调节性DC的产生,介导免疫耐受,最终实现免疫逃逸。故调节DC细胞在免疫耐受与免疫应答之间的平衡成为肿瘤疫苗治疗的一个重要发展方向。目前国内外研究的主要方法有在体外培养DC的过程中加入外源性肿瘤匀浆或纯化蛋白,或直接将肿瘤抗原导入DC,输入体内后激活CD4+T和CD8+T细胞,发挥抗肿瘤免疫活性。在本研究中,我们用慢病毒载体转染AFP,以及多个AFP抗原决定簇肽片段处理的树突状细胞与人外周血T细胞共培养,诱导AFP特异性的T细胞免疫应答,体外在人肝癌细胞模型上验证了抗原特异性T细胞的抗肿瘤免疫活性。实验结果显示,AFP特异性的CD4+T和CD8+T细胞对人AFP阳性肝癌HepG2株细胞有显著的杀伤活性。
抗肿瘤免疫应答反应中涉及大量细胞因子表达的变化。我们的体外研究结果显示,AFP特异性的CD4+T和CD8+T细胞能显著增加细胞培养上清液中IL-2、IFN-γ、TNF-α、穿孔素、颗粒酶的含量,证实其抗肿瘤免疫活性与这群细胞因子表达上调密切相关。IL-10是已知的抗原特异性T细胞活化的抑制剂,在HCC患者血清中可以检测到IL-10含量的升高;在DC-T细胞共培养体系中加入外源性的IL-10中和性抗体可以促进Th1细胞功能。这些现象提示,降低IL-10水平对于抗肿瘤免疫具有十分积极的意义。在本研究中,我们的实验结果显示,经慢病毒转染DC处理,或是抗原肽刺激的DC处理后的AFP特异性CD4+T和CD8+T细胞能显著降低IL-10的含量。
目前认为杀伤性T细胞(CTL)诱导的细胞凋亡途径有两条分子机制:一是FasL/Fas通路,另一个是Perforin/Granzyme B通路。在本研究中,我们检测了培养上清和血清中Perforin/Granzyme B以及FasL的水平,实验结果显示,AFP特异性T细胞能显著增加Perforin/Granzyme B的表达水平,而对FasL的表达水平没有影响。因此,我们推论AFP特异性CD4+T和CD8+T细胞对肿瘤细胞的杀伤作用与Perforin/Granzyme B通路有关。在本研究中,我们使用AFP特异性的CD8+T细胞单独或与CD4+T细胞联用,处理HepG2细胞。实验结果显示,CD4+T细胞/CD8+T细胞混合处理组,或是单纯CD8+T细胞处理组均对HepG2细胞有较强的杀伤活性,但混合处理组的杀伤活性更强,且体外实验结果显示,混合组有更多的IL-2的产生,表明CD4+辅助性T细胞可能通过促进CD8+T细胞扩增发挥潜在的抗肿瘤免疫作用[4]。
总言之,经DC活化后的AFP特异性CD4+T和CD8+T细胞(肝癌疫苗)具有显著的体外抗肝细胞癌免疫活性,有望成为AFP阳性肝细胞癌的免疫治疗新方法,也为今后肝细胞癌的临床治疗提供了可靠的实验基础。
参考文献 (References)
[1] L. H. Butterfield, A. Ribas, D. M. Potter and J. S. Economou. Spontaneous and vaccine induced AFP-specific T cell phenoltypes in Subjects with AFP-positive hepatocellular cancer. Cancer Immunol. Immunother, 2007, 56: 1931-1943.
[2] L. H. Butterfield, A. Ribas, V. B. Dissette, et al. A phase I/II trial testing immunization of hepatocellular carcinoma patients with dendritic cells pulsed with four AFP peptides. Clinical Cancer Research, 2006, 12: 2817-2825.
[3] Y. Liu, S. Daley, V. N. Evdokimova, et al. Hierarchy of alpha fetoprotein (AFP)-specific T cell responses in subjects with AFPpositive hepatocellular cancer. Journal of Immunology, 2006, 177: 712-721.
[4] Y. Liu, L. H. Butterfield, X.-H. Fu, et al. Lentivirally engineered DC activate AFP-specific CD8+/CD4+ T cells whcich inhibit hepatocellular carcinoma growth in vitro and in vivo. International Journal of Oncology, 2011, 39: 245-253.
[5] V. N. Evdokimova, Y. Liu, D. M. Potter and L. H. Butterfield. AFP specific CD4+ helper T cell responses in healthy donors and HCC patients. Journal of Immunotherapy, 2007, 30: 425-437.
[6] 刘扬, 陆崇德, 吴孟超等. HLA-A*0201限制性AFP抗原决定簇肽特异性肝癌疫苗的制备[J]. 同济大学学报(医学版), 2009, 30: 30-33.
[7] A. K. Palucka, H. Ueno, J. Fay, et al. Dendritic cells: A critical player in cancer therapy? Journal of Immunology, 2008, 31: 793-805.