Hans Journal of Surgery
Vol.2 No.4(2013), Article ID:12365,3 pages DOI:10.12677/HJS.2012.24006
Research of Change of Serum Concentration of Cytokines TGF-β and VEGF in Post-Burned Hypertrophic Scar Patients
1Department of Plastic Surgery, The Affiliated Foshan Hospital of Sun Yat-sen University, Foshan
2Department of Plastic Surgery, The Second Affiliated Hospital of Sun Yat-sen University, Guangzhou
Email: shenruihaohao@163.com, #zxmrwk@126.com
Received: Jun. 17th, 2013; revised: Jun. 25th, 2013; accepted: Jul. 10th, 2013
Copyright © 2013 Rui Shen et al. This is an open access article distributed under the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
ABSTRACT:
Objective: To explore the dose and its clinic significance of profibrotic cytokines of TGF-β and VEGF in the serum of hypertrophic scar patients at excessive stages. Methods: Serum samples of 74 inpatients were collected, who were admitted to our hospital between 2009, 8 and 2011, 8 and were suffering from post-burned hypertrophic scars at various stages. Serum samples of 12 cases of healthy persons were also collected as the control group. Hypertrophic scar groups were divided into 4 subgroups according to the phase of scars and using the ELISA method to detect the concentrations of TGF-β and VEGF in serum of the trials. Results: The doses of TGF-β and VEGF began to increase in 1 to 3 months hypertrophic scar group and achieved summit concentration in 4 to 6 months scar group. The concentration of TGF-β and VEGF degreased gradually with the maturation of hypertrophic scars. Conclusions: High concentration of TGF-β and VEGF in the serum can reflect the level of metabolic activity in the tissue of hypertrophic scars. TGF-β and VEGF may be a promising marker in discerning the growth and development of hypertrophic scars.
Keywords: Hypertrophic Scar; Post-Burned; Serum; Marker; TGF-β; VEGF
烧伤后增生性瘢痕患者血清中TGF-β、VEGF的浓度检测及意义*
沈 锐1,张金明2#,张凤刚1,杜永军1,宋红梅1,陈晓东1,徐路生1
1中山大学附属佛山医院整形外科,佛山
2中山大学附属第二医院整形外科,广州
Email: shenruihaohao@163.com, #zxmrwk@126.com
摘 要:
目的:探讨烧伤后增生性瘢痕患者血清中TGF-β、VEGF浓度变化及意义。方法:选择2009,8~2011,8我科住院的烧伤后增生性瘢痕患者共74例,根据创面愈合后瘢痕增生时间长短分组,分为4组,选择12例正常人作为正常对照组,共5组。用酶联吸附法(ELISA)检测患者血清中TGF-β、VEGF的浓度,5组之间统计比较分析。结果:瘢痕患者血清中TGF-β、VEGF含量与瘢痕增生时段关系密切,1~3月早期瘢痕组血清中TGF-β、VEGF含量开始增加,随瘢痕的发展升高,4~6个月瘢痕组血清中TGF-β、VEGF含量达到了高峰。随着瘢痕成熟,TGF-β、VEGF浓度又逐渐下降。结论:烧伤后增生性患者血清中TGF-β、VEGF的含量可较好地反映增生性瘢痕代谢活跃程度,是增生性瘢痕增生活跃程度敏感的标记物。
收稿日期:2013年6月17日;修回日期:2013年6月25日;录用日期:2013年7月10日
关键词:增生性瘢痕;烧伤后;血清;标记物;TGF-β;VEGF
1. 引言
增生性瘢痕(hypertrophic scar, HS)是以胶原纤维等细胞外基质过度生成、沉积为特征的皮肤纤维化疾病[1]。临床治疗方法多样,但是缺乏十分有效的治疗手段。另外,目前临床上尚缺乏一种准确、可重复评价瘢痕增生程度的指标,不利于抗瘢痕药物与方法的疗效评价、优化与筛选,也深刻影响着瘢痕治疗的进展。
转化生长因子β(transforming growth factor β, TGF- β)与血管内皮生长因子(vascular endothelial growth factor,VEGF)是目前研究得比较透彻的,对瘢痕增生起明显促进作用的细胞因子,两因子均可在瘢痕组织局部表达、分泌,其表达的量甚至与瘢痕增生的程度密切相关[2-5]。那么这两种瘢痕形成促进因子是否能够分泌入血液,能不能通过检测烧伤后瘢痕患者血液中TGF-β、VEGF两因子的浓度来评价瘢痕增生的程度,该实验在这方面进行了有益的探索。
2. 对象和方法
2.1. 一般资料
病例及标本的选择:选择2009年8月~2011,8月期间我烧伤整形外科住院的烧伤后瘢痕患者74例,分属于瘢痕增生的不同时期。其中男49例,女25例,最大年龄55岁,最小年龄18岁,平均年龄为27.9 ± 13.4岁,所有受试者均无外伤、无妊娠,无罹患其它结缔组织疾病,亦无其它影响检测结果的局部或全身性疾病,为了减少瘢痕面积对实验结果的影响,规定瘢痕面积均不得大于体表面积的10%。另选12例健康人群作为正常对照组,所采取的检测均获得受试者或其家属知情同意,经医院伦理委员会审核通过。74例瘢痕患者根据创面愈合后瘢痕增生的不同时段分组,分为4组:1) 1月~3月的早期瘢痕组;2) 4月~6月的瘢痕组;3) 7月~12月的瘢痕组:4) 1年以上的接近成熟期的增生性瘢痕组。与正常对照组一起,共为5组。检测其血清中TGF-β、VEGF的浓度的水平。
2.2. 主要试剂和仪器
试剂盒来自于北京生物技术研究所,其它为常用试剂。采用生物素双抗夹心酶联免疫吸附法(ELISA)对标本血清中TGF-β、VEGF含量进行测定。
2.3. 实验标本的制备
抽取静脉血2 ml,置干燥管,室温下静置3小时,在3000 rpm离心机内离心,离心15 min。用移液管移取血清0.5 ml,置于离心管,标本放于−70℃超低温冰箱内保存,待标本收集完成后,对实验标本统一进行检测,以避免不同批次实验试剂和实验操作人员对实验结果产生影响。
2.4. 用ELISA试剂盒对血清中TGF-β、 VEGF的浓度进行检测
标本解冻。标准品的稀释。根据待测样品数量决定所需的板条数。加样:1,空白管对照孔不加样品、生物素标记的抗TGF-β1抗体以及链霉素亲和素- HRP,只加显色剂A&B和终止液,其余操作相同;2,标准品孔:加入标准品50 µg,链霉素亲和素- HRP(标准品中已事先整合好生物素抗体,故不加);3,待测样品孔:加入样本40 µl,然后各加入抗TGF-β1抗体10 µl、链酶亲和素-HRP,盖上封板膜,轻轻振荡混匀,37℃温育60分钟。配液、洗涤、显色、终止按试剂盒要求操作。最后测定:用空白孔调零,450 nm波长依序测量各孔的吸光度(OD值),根据标准品的浓度以及对应OD值计算出保准曲线的直线方程,再根据样品的OD值在回归方程上算出对应的样品浓度。
2.5. 实验结果统计学分析
实验结果用SPSS统计软件13.0进行分析。P < 0.05认为差别有统计学意义。
3. 结果
与正常对照组比较,创面愈合后1~3月瘢痕组血清中TGF-β、VEGF的浓度已有升高。4~6月瘢痕组达到了最高水平,但随着增生性瘢痕的逐渐成熟,到瘢痕趋向成熟时(1年以上瘢痕),TGF-β、VEGF的浓度又明显下降,但仍未恢复到正常水平,见表1。
4. 讨论
增生性瘢痕形成与皮肤损伤程度相关,可发生在
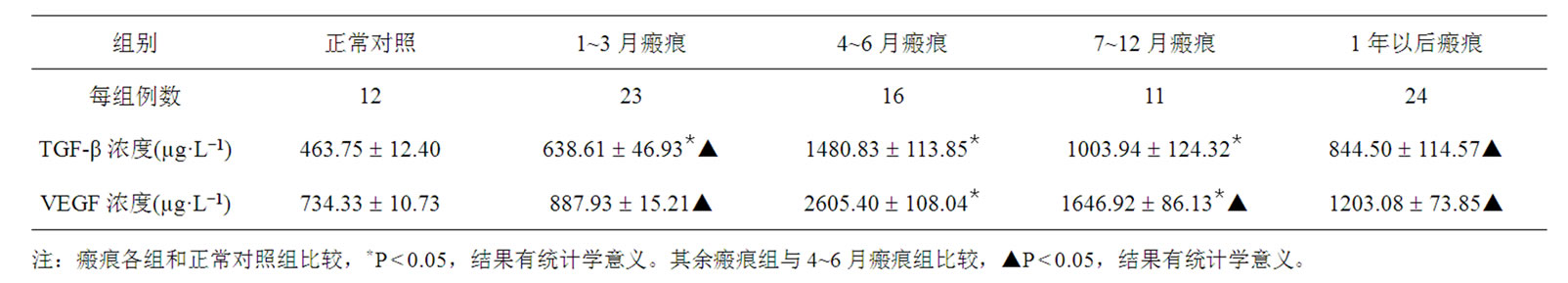
Table 1. Change of serum concentration of cytokines TGF-β and VEGF of post-burned hypertrophic scars at excessive stages
表1. 烧伤后不同时期增生性瘢痕血清中TGF-β、VEGF的浓度水平(`x ± s µg.L−1)
身体任何部位,多见于严重烧伤、擦伤、撕脱伤等等[6]。增生性瘢痕形成后,其外在表现实际上处在不断演进之中,早期瘢痕颜色鲜红,质地韧,明显突出于正常皮肤平面,但随着时间延长,瘢痕逐渐成熟,颜色变浅,质地变软,表面充血的血管亦不复存在。据此,临床上可以根据肉眼观察与简单的检查,如根据瘢痕颜色、硬度、厚度、瘢痕挛缩程度及其它伴随症状,如有无痛、痒症状等指标就可以评判瘢痕增生程度,方便指导临床瘢痕的诊疗工作,也可将这些瘢痕简单的指标制成量表来规范应用,其中著名的是温哥华瘢痕量表(Vancouver scar scale, VSS),该方法优点是简单、易行,缺点是存在着一定主观性和随意性,临床应用上存在一定争议,临床上,寻找更为客观的指标来评价瘢痕增生程度实属必要[7]。
瘢痕是创伤的过度愈合,瘢痕形成与瘢痕局部细胞因子及其信号转导途径的异常活化关系密切[8]。TGF-β直接地通过促进瘢痕组织内成纤维细胞增殖以及合成胶原纤维,而VEGF通过促进瘢痕内部大量的血管增生,为瘢痕增生提供充分的氧气、营养供应,间接地促进瘢痕胶原合成,两细胞因子均能明显地促进瘢痕增生与形成[9]。但是瘢痕促进因子TGF-β、VEGF瘢痕组织表达后能否分泌入血,瘢痕患者血液中TGF-β与VEGF的浓度变化与瘢痕增生时段之间的关系是否密切,TGF-β、VEGF两因子是否可以作为评价瘢痕增生程度的标记物,国、内外尚未见这方面的报道[7,10]。
实验结果显示不同时期的瘢痕组织合成的TGF- β、VEGF能够入血全身分布,表现为患者血清中TGF-β、VEGF的浓度不同程度的升高,两因子的浓度变化与瘢痕临床演进过程基本一致。1~3月早期瘢痕组患者血清中TGF-β、VEGF开始升高,临床表现为瘢痕开始增生,4~6月瘢痕组患者血清中TGF-β、VEGF的浓度达到了最高水平,这时瘢痕增生最为严重。随着,7~12月瘢痕组患者血清中TGF-β、VEGF的浓度又逐渐下降,以至于1年以后瘢痕组TGF-β、VEGF的浓度趋向于正常(但是不能达到正常水平),临床表现为瘢痕逐渐趋向成熟。实验结果表明:烧伤创面愈合后,创面愈合调控因子异常上升,是致使烧伤后增生性瘢痕形成重要原因,同时患者血清中TGF- β、VEGF是评价瘢痕增生的理想标记物。
相对于温哥华瘢痕量表,增生性瘢痕患者血清中TGF-β、VEGF的浓度变化能够更准确地评价瘢痕组织胶原代谢情况以及反映患者瘢痕增生情况,可以作为评价烧伤后增生性瘢痕增生程度较为敏感的、客观的标记物。缺点是需要患者抽血检查,具有一定的创伤,实验检查和结果之间有一定的时间差,同时瘢痕患者血清中TGF-β、VEGF的浓度变化不但与瘢痕时段有关,也与瘢痕面积大小等因素相关,实验结果准确性可能受到干扰,临床应用时尚需进一步完善。如两种方法结合使用,可弥补两者的各自不足。
瘢痕疙瘩局部切除后复发率极高,有学者提出假说,认为在瘢痕疙瘩在形成以前,有典型的损伤后潜伏(有时原发损伤不明显而被患者忽略),如果第二次触发(例如单纯的外科切除),则会很快复发,病变常常较前增大。该特点可比作一个免疫反射弧:最初的接触导致致敏阶段、记忆形成和效用机制。瘢痕疙瘩形成的第二阶段类似于第二次免疫反应。但是该假说没能找到答案[11]。有趣的是,在临床工作中,为严重瘢痕患者实行植皮手术时,其远离瘢痕局部供皮区瘢痕增生往往较明显,令人困惑。该实验的结果可能有助于解释这些假说与现象,我们的推测:瘢痕或瘢痕疙瘩局部组织表达、分泌过量的瘢痕TGF-β、VEGF,并分泌入血全身分布,如果其他部位新添创伤或手术,那么创伤或手术局部组织液体中TGF-β、VEGF的浓度因叠加效应势必较高,瘢痕增生可能异常明显。介导瘢痕疙瘩“免疫反应”的不是抗体,而可能是血液中高浓度的瘢痕促进因子TGF-β、VEGF。因此,我们可将身体有增生性瘢痕或瘢痕疙瘩存在看成一种“获得的”的“瘢痕体质”,可能对身体其他部位再发损伤形成的继发瘢痕产生不利影响。
参考文献 (References)
[1] G. B. Pitzer, K. G. Patel. Proper care of early wounds to optimize healing and prevent complication. Facial Plastic Surgery Clinics of North America, 2011, 19(3): 491-504.
[2] D. Honardoust, M. Varkey and Y. Marcoux. Reduced decorin, fibromodulin, and transforming growth factor-[beta]3 in deep dermis leads to hypertrophic scarring. Journal of Burn Care & Research, 2012, 33(2): 218-227.
[3] N. S. Mogili, V. R. Krishnaswamy, M. Jayaraman, et al. Altered angiogenic balance in keloids: A key to therapeutic intervention. Translational Research, 2012, 159(3): 182-189.
[4] D. S. Steinbrech, B. J. Mehrara, D. Chau, et al. Hypoxia upregulates VEGF production in keloid fibroblasts. Annals of Plastic Surgery, 1999, 42(5): 514-519; Discussion 519.
[5] T. A. Wilgus, A. M. Ferreira, T. M. Oberyszyn, et al. Regulation of scar formation by vascular endothelial growth factor. Laboratory Investigation, 2008, 88(6): 579-590.
[6] J. Y. Yang, S. Y. Yang. Are auricular keloids and persisitent hypertrophic scars resectable? The role of intrascar excision. Annals of Plastic Surgery, 2012, 69(6): 637-642.
[7] D. M. Perry, D. A. McGrouther and A. Bayat. Current tools for noninvasive objective assessment of skin scars. Plastic and Reconstructive Surgery, 2010, 126(3): 912-923.
[8] R. J. Matthew, G. S. Gautam, P. A. Joseph, et al. Novel therapies for scar reduction and regenerative healing of skin wounds. Trends in Biotechnology, 2008, 26(4): 173-180.
[9] 沈锐, 利天增. 组织缺氧与增生性瘢痕的关系[J]. 国际外科学杂志, 2006, 33(1): 70-73.
[10] J. A. Duncan, J. S. Bond, T. Mason, et al. Visual analogue scale and ranking: A suitable and sensitive method for assessing quality. Plastic and Reconstructive Surgery, 2006, 118(4): 909-918.
[11] 王炜. 整形外科学[M]. 杭州: 浙江科学技术出版社, 1999: 428.
NOTES
*基金项目:佛山市重点科技攻关项目(No. 200808053);佛山卫生局项目(No. 2008054)。
#通讯作者。