Botanical Research
Vol.1 No.1(2012), Article ID:569,7 pages DOI:10.4236/br.2012.11001
Responses of Three Endophyte Fungi Species Isolated from Natural Grass to Abiotic Stresses
College of Life Sciences, Nankai University, Tianjin
Email: happygirlwmy521@163.com, ybgao@ nankai.edu.cn
Received: Feb. 23rd, 2012; revised: Mar. 20th, 2012; accepted: Mar. 21st, 2012
ABSTRACT:
Biological and physiological characteristics of three Neotyphodium species, isolated from native grasses, were compared with the model endophyte Neotyphodium coenophialum, isolated from tall fescues, under different temperature, water and salt conditions. Three Neotyphodium species included Neotyphodium gansuense, Neotyphodium sibiricum and Neotyphodium sp., among which N. sp. was isolated from Leymus chinensis while the other two species were isolated from Achanatherum sibiricum. The results showed that the optimal temperature for the four endophytes was 25˚C. The model endophyte N. coenophialum was unable to grow at 32˚C, but the other endophytes were able to grow at 10˚C - 32˚C. Four fungi could not grow when the PEG concentration was 15%. For N. sp., it tended to increase when PEG concentration was 10%, and this situation is similar to N. coenophialum. For N. gansuense and N. sibiricum, the growth was not influenced till the PEG concentration was up to 10%. Under the treatment of NaCl, the biomass of N. sibiricum and N. coenophialum significantly increased, but the growth of N. gansuense and N. sp. were significantly restrained at 0.3 mol/L NaCl. N. sibiricum was unable to grow at 1.5 mol/L NaCl, but N. coenophialum can still grow under 3 mol/L NaCl. As a result, three species of endophytes which were isolated from native grasses can tolerate high temperature than the model endophyte. For the ability of resistance to osmotic stress, only N. sp. is similar to the model endophyte and two endophytes from A. sibiricum was significantly lower than model endophyte. For different salt stress, the tolerance of three native species was significantly lower than the model species.
Keywords: Neotyphodium; Endophyte; Physiology; Natural Grass; Resistance
天然禾草中三种内生真菌对非生物胁迫耐性的比较研究
魏茂英,尹立佳,贾 彤,朱敏杰,任安芝,高玉葆
南开大学生命科学学院,天津
Email: happygirlwmy521@163.com, ybgao@ nankai.edu.cn
摘 要:
从天然禾草羽茅和羊草中分离获得3种不同的内生真菌,即Neotyphodium gansuense、Neotyphodium sibiricum和Neotyphodium sp.。在不同的温度、盐分和渗透胁迫条件下比较3种内生真菌的生长状况,并以分离自高羊茅中的模式菌株Neotyphodium coenophialum为对照。结果表明,3种内生真菌与模式菌株的最适生长温度均为25℃,但模式菌株N. coenophialum在32℃时没有生长,而从天然禾草中分离获得的内生真菌在10℃~32℃温度范围内均可生长。当PEG浓度超过15%时,3种内生真菌与模式菌株均不能生长,N. sp.在10%时仍长势良好,与N. coenophialum相似,而N. sibiricum和N. gansuense在10% PEG浓度时,生长受到显著抑制。在盐分处理时,N. sp.和N. gansuense在0.3 mol/L的NaCl浓度下,生长受到显著抑制;而N. sibiricum在1.5 mol/L的NaCl浓度时生长才受到显著抑制,但耐盐性均不及N. coenophialum,后者在3.0 mol/L的NaCl浓度下还可以生长。总体看来,从天然禾草中获得的3种内生真菌与模式菌株相比较,耐高温的能力更强;耐渗透胁迫的能力只有羊草中的N. sp.与模式菌株接近,而羽茅中的两种菌株的耐渗透胁迫能力却显著低于模式菌株;对于不同的盐浓度胁迫,3种菌株的耐盐性都显著低于模式菌株。不同种类内生真菌在渗透胁迫方面的耐性与其宿主植物表现相一致。
收稿日期:2012年2月23日;修回日期:2012年3月20日;录用日期:2012年3月21日
关键词:Neotyphodium;内生真菌;生理;天然禾草;抗逆性
1. 引言
内生真菌是指其生活史的某一时期生活在植物组织内,并且没有引起该宿主植物明显病害症状的一类真菌[1]。内生真菌与植物共生在自然界是非常普遍的,在一些重要的林木、灌木与草本中相继发现了内生真菌的存在,甚至在蕨类、苔藓、藻类中也有发现。Petrini(1991)估算,每种植物平均大约有4~5种专性内生真菌,而全世界内生真菌种类已达到在100万种以上。目前,人们发现在近80属290多种禾草中含有内生真菌,所以禾草类内生真菌与宿主植物的关系受到了广泛关注,这些内生真菌大部分属于子囊菌纲的香柱菌属,其中从香柱菌属演化而来的无性型Neotyphodium与禾草的关系尤为密切,受到广泛关注。
关于内生真菌对禾草的影响研究主要集中在与内生真菌共生的两种人工禾草高羊茅(Festuca arundinacea Schreb.)和黑麦草(Lolium perenne L.)上,在对高羊茅——内生真菌共生关系的研究中,多数学者以感染内生真菌Neotyphodium coenophialum的KY31品种为研究对象,已有的大量研究表明,内生真菌感染能显著提高宿主高羊茅对非生物胁迫如干旱[2-5]、高温[6]、盐碱[7]、刈割[8]、营养[9]等的耐性。
真菌种类不同,所具有的耐非生物胁迫特点也不相同。如Whiting等人研究发现Phaeoacremonium inflatipes的最适生长温度是30℃;在水势为–8.3 MPa时,P. chlamydospora仍可以生长[10]。李婷等人发现低质量浓度的铜镉处理(7.5 mg/L)均促进了Boletus edulis菌丝的生长[11]。Carvalho等研究发现Glomus geosporum孢子在盐浓度为20‰时比10‰时有更强的萌发力[12]。
在对菌根真菌和宿主植物相互关系的研究中,研究者发现对高温、干旱等非生物胁迫具有很好抗性的菌株也能够增强宿主植物的抗性。如Subramanian等人发现G. intraradices具有一定的抗旱性[13],当将该真菌接种到玉米并进行干旱实验后发现,接种组比对照组具有较高的叶片水势和叶面积比以及较低的气孔导度,显著提高了玉米的耐旱能力[14]。黄艺等人研究发现,不同真菌对环境中的过量盐,具有不同的抗性,如红绒盖牛肝在0.1 mol/L Na2SO4中长势良好[15],对盐碱土生长下的油松接种红绒盖牛肝后发现,接种植物生物量比未接种对照的生物量高出43.58%[16],大大缓解了盐渍土壤对宿主植物的抑制作用。我国有丰富的内生真菌资源,目前在我国的天然草地中发现含有内生真菌的禾草已经有13属25种禾草[17]。具有抗性的内生真菌菌株也有类似于菌根真菌中发现的提高宿主植物抗性的能力,如Chunjie Li发现N. coenophialum在pH5的培养基上不影响生长,在pH3时能略有生长[18],将含有该菌的高羊茅进行pH3的酸性胁迫,发现相比于对照,染菌组具有较高的生物量和分蘖[19]。因此在体外条件下对不同来源的内生真菌进行抗性筛选,不仅可以对内生真菌的抗性进行比较,而且可以进一步将筛选的抗性内生真菌人工转接到不感染内生真菌的植物中以提高其抗逆能力。
本文以从内蒙古草原广泛分布的野生牧草羽茅(Achnatherum sibiricum (L.) Keng)和羊草(Leymus chinensis (Trin.) Tzvel.)中分离的内生真菌为研究对象,并以分离自高羊茅中的模式菌株N. coenophialum为对照,在离体培养条件下,通过比较3种内生真菌在不同温度、盐分和渗透条件下的生长特性以探讨不同种内生真菌的抗逆性差异及其对宿主植物可能存在的有益作用,从而为揭示两者共生关系本质提供科学依据。
2. 材料和方法
2.1. 材料
羊草和羽茅均为内蒙古中东部草原常见种,多数地理种群中的羊草不感染内生真菌或感染率极低,只有阿巴嘎旗种群的染菌率较高(最高达80%)。而在此分布区中的羽茅,内生真菌的感染率均接近于100%[20,21],只是其中的内生真菌种类随生境的不同有所差异,在偏干旱的环境中,内生真菌N. sibiricum占优势,在水分充足的环境中,内生真菌N. gansuense占优势[22]。
供试菌种:分离自高羊茅的N. coenophialum 其菌落白色毛毡状,质地紧密,气生菌丝较短,产孢少,生长最慢;分离自羽茅的N. gansuense菌落白色,绵状疏松,气生菌丝较丰富,生长最快,是在中国发现的第一个Neotyphodium内生真菌[23];分离自羽茅的N. sibiricum生长速率与N. gansuense较大不同,生长缓慢,质地紧密。分离自羊草的N. sp.其菌落白色,绵状疏松,气生菌丝较丰富,产孢多,生长较快。
2.2. 方法
2.2.1. 测定生长曲线
将四种内生真菌培养在50 ml三角瓶中,每瓶添加YM液体培养基40 ml,放在摇床上控制条件为25℃,200 r/min。每天定时用剪过的枪头取1 ml等分到96微孔板中,用酶联免疫检测仪在630 nm处测定吸光度值。以YM培养基的吸光度值为对照,用吸光度值的平均值对时间(d)做四种内生真菌的标准生长曲线,每天重复数3瓶。
2.2.2. 温度处理
将四种内生真菌在PDA培养基上25℃培养几周作为备用菌落。在9 cm的培养皿中注入PDA培养基,用3.7 mm的打孔器在备用菌落边缘打孔并注入到试验用培养基中央。将培养皿分别置于10℃、25℃、32℃、37℃下培养,每个处理重复5次,一个月后测定菌落直径。
2.2.3. 渗透胁迫处理
PEG是一种惰性的非离子长链多聚体,易溶于水,具有很强的吸水性,使溶液中水分子减少,从而降低了溶液的渗透压,且PEG无毒性,并且不能被内生真菌吸收利用,因此可以作为渗透调节剂模拟干旱胁迫。用聚乙二醇-6000(PEG 6000)调节渗透势[24],通过添加不同质量的PEG 6000可以形成不同的渗透胁迫处理来模拟干旱胁迫。实验设定6个处理梯度,浓度分别为0%、5%、10%、15%、20%、25%。取1 ml对数期的菌液加入到三角瓶中,于摇床上25℃,200 r/min培养,每个处理重复5次。待培养期末,用真空抽滤机抽滤在滤纸上,并用蒸馏水冲洗数次,将菌丝与滤纸置于烘箱内80℃烘干至恒重,冷却后分析天平称重。
2.2.4. 盐分处理
用NaCl调节YM培养基的盐分浓度。将N. sp.与N. gansuense的盐浓度设定为0、25、50、100、200、300 mmol/L;N. sibiricum盐浓度设定为0、250、500、1000、1500、2000 mmol/L;KY31的盐浓度设定为0、250、500、1000、1500、2000、3000 mmol/L。取1 ml对数期的菌液加入到三角瓶中,于摇床上25℃,200 r/min培养,每个处理重复5次。待对照组菌丝长满后,用真空抽滤机抽滤在滤纸上,并用蒸馏水将培养基冲洗干净,将菌丝与滤纸置于烘箱内80℃烘干至恒重,冷却后分析天平称重。
2.3. 数据处理
采用SPSS16.0单因素方差分析来计算各处理对不同内生真菌生长百分数的差异显著性。
3. 结果
3.1. 温度对内生真菌生长的影响
N. coenophialum,N. sp.,N. gansuense,N. sibiricum四种内生真菌在10℃和32℃下都能生长,在25℃状态下生长最好;在37℃下只有N. gansuense,N. sibiricum略有生长。N. sp.,N. gansuense,N. sibiricum三种内生真菌32℃的生长与10℃时无显著差异,而N. coenophialum在32℃时生长状况要显著差于10℃。说明本实验所采用的3种内生真菌与模式菌株相比具有较好的耐高温特性(图1,图2)。
3.2. PEG模拟干旱对内生真菌生长的影响
N. sp.与N. coenophialum在10% PEG浓度下都能正常生长,在15%浓度时基本不生长;N. gansuense,N. sibiricum在5%浓度处理下能够正常生长,在10%浓度时基本不能生长。对于分离自羊草的N. sp.,5%与10%浓度的PEG都能明显促进它的生长。而对于羽茅中的两种菌N. gansuense与N. sibiricum,N. gansuense的耐旱性要优于N. sibiricum(图3)。
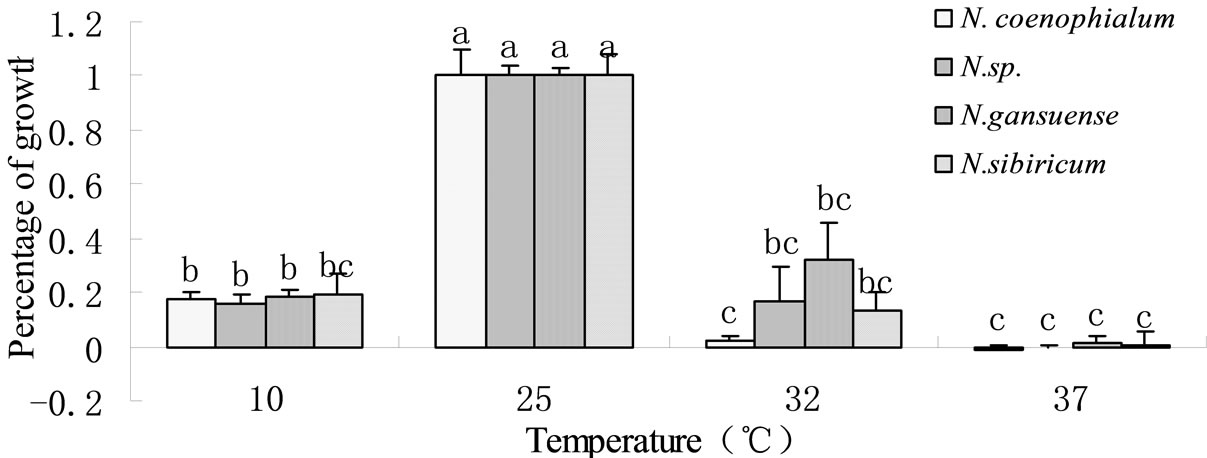
Figure 1. Effect of different temperature on growth of four endophyte. Different letters indicate significant differences (P < 0.05)
图1. 不同温度条件下四种内生真菌的生长情况。图中的不同字母代表处理之间显著性差(P < 0.05)

Figure 2. Effect of different temperature on growth of four endophyte, 10℃, 25℃, 32℃, 37℃. Different letters indicate different endophyte. (a) N. coenophialum; (b) N. sp.; (c) N. gansuense; (d) N. sibiricum
图2.不同温度条件下四种内生真菌的生长情况,每幅图中四列从左到右处理温度依次为10℃、25℃、32℃、37℃。不同字母代表四种菌。(a) N. coenophialum;(b) N. sp.;(c) N. gansuense;(d) N. sibiricum

Figure 3. Effect of different drought stress on growth of four endophyte. (a) N. coenophialum; (b) N. sp.; (c) N. gansuense; (d) N. sibiricum. Different letters indicate significant differences (P < 0.05)
图3. 不同PEG浓度胁迫下四种内生真菌生长百分数。(a) N. coenophialum;(b) N. sp.;(c) N. gansuense;(d) N. sibiricum。图中的不同字母代表处理之间显著性差异(P < 0.05)
3.3. 盐分胁迫对内生真菌生长的影响
由图4可以看出,当氯化钠浓度达到1.5 mol/L时,N. coenophialum生长才开始受到抑制,在3 mol/L的浓度下,仍可以生长。N. sp.在50 mmol/L浓度时生长良好,在300 mmol/L氯化钠浓度时生长才受到显著抑制。N. gansuense在200 mmol/L氯化钠浓度以下时,生物量无明显变化,生长状况良好;但在低浓度处理如25 mmol/L、50 mmol/L氯化钠浓度时,生物量略有增加,当处理浓度达到300 mmol/L时,生长受到抑制,差异显著。当盐浓度从0~1 mol/L递增时,N. sibiricum生长并未呈现出抑制现象,可以看出其对盐浓度变化的适应能力较强,当氯化钠浓度达到1.5 mol/L时,N. sibiricum完全不能生长,3种内生真菌耐盐能力由大到小的顺序为N.sibiricum,N. sp.,N. gansuense。
4. 讨论
以人工禾草高羊茅和黑麦草为材料的大量研究表明,内生真菌感染可以显著提高宿主植物的抗逆性,比如干旱[5]、高温[6]和盐碱[7]胁迫等,而这些耐性与Neotyphodium属内生真菌的作用密切相关。已有研究表明,对非生物胁迫具有优良耐性的菌根真菌也能提高宿主植物的相应耐性。我国有丰富的内生真菌资源,到目前为止,在天然草地中至少发现有13属25种禾草带有内生真菌[25],如果具优良耐性的内生真菌也被证实能够增强禾草宿主的相应耐性,那么我们就可以通过筛选抗性菌株,然后人工导入到天然禾草中,以提高天然禾草的耐性。
通过与模式菌株比较发现,3种分离自我国天然禾草中的内生真菌的耐高温、低温性无显著差异,均优于模式菌株。四种Neotyphodium属内生真菌的最适生长温度都是25℃,且在10℃~32℃条件下都可以生长,这与White等人(1987)报道的N. coenophialum的最适生长温度是25℃相同[26];Li(2006)发现N. gansuense、N. coenophialum菌的最适生长温度也是25℃,超过35℃时菌落不能生长[18]。
我们对内生真菌进行渗透胁迫实验发现,羽茅中的两种内生真菌N. gansuense与N. sibiricum,在10% PEG浓度下基本不能生长,但是N. gansuense的耐旱性略好于N. sibiricum,但都不及N. sp.和模式菌株的耐旱性好。N. sp.、N. gansuense、N. sibiricum三种内生真菌在耐渗透胁迫能力上与感染该种内生真菌的植物表现相一致,本研究中内生真菌菌株N. sp.是从分布于较干旱的阿巴嘎旗羊草分界点分离获得,内生真菌N. gansuense、N. sibiricum从分布于较湿润生境中的羽茅分离得到,从宿主植物所处的原生生境可知,感染内生真菌的羊草的耐旱性明显好于羽茅的耐旱性,这一结果与菌根真菌中的研究结果相一致,如Morte等人发现Terfezia claveryi真菌具有一定耐旱
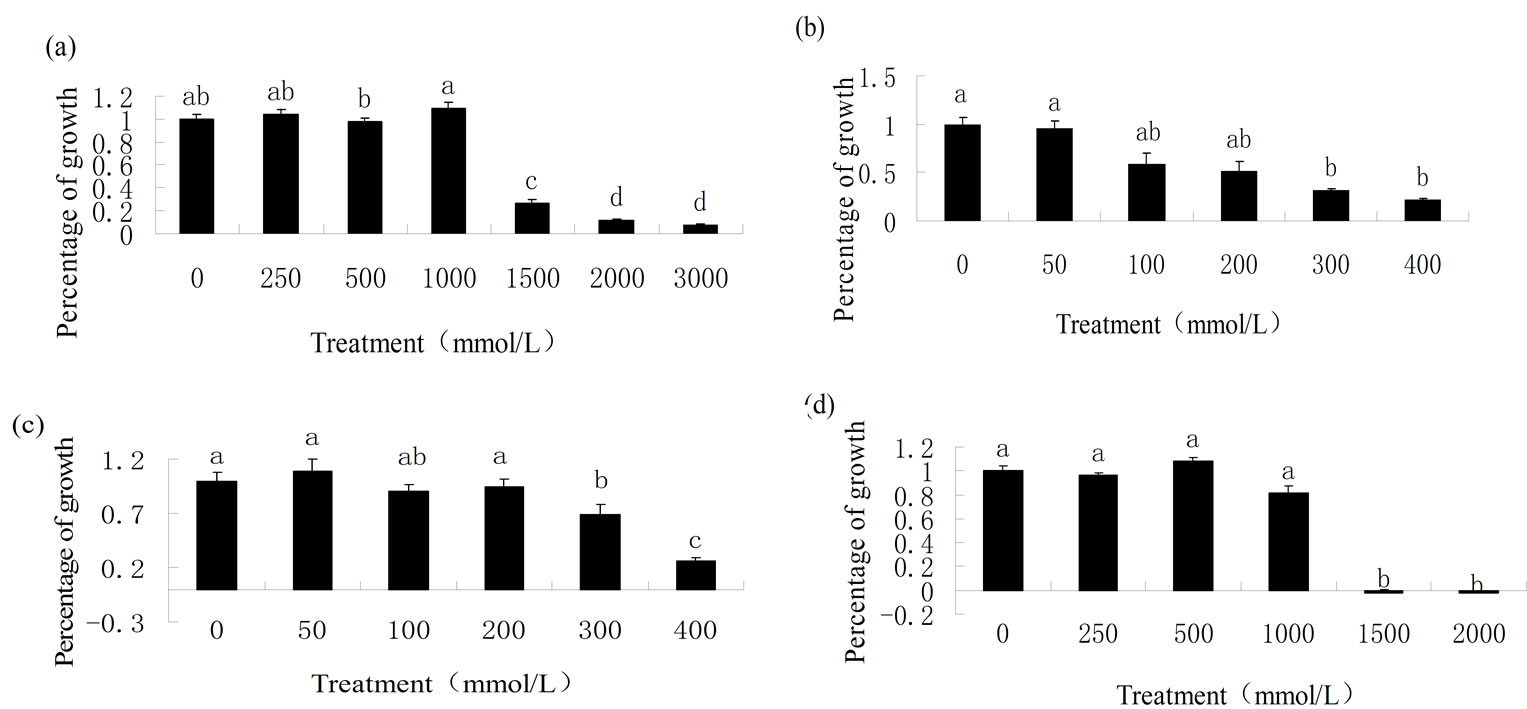
Figure 4. Effect of different salt stress on growth of four endophyte. (a) N. coenophialum; (b) N. sp.; (c) N. gansuense; (d) N. sibiricum. Different letters indicate significant differences (P < 0.05)
图4. 不同氯化钠浓度胁迫四种内生真菌生长百分数。(a) N. coenophialum;(b) N. sp.;(c) N. gansuense;(d) N. sibiricum。图中的不同字母代表处理之间显著性差异(P < 0.05)
性[27],在含有该菌的植物Helianthemum almeriense上进行水分胁迫实验,在水分胁迫后期,菌根化植株的水势、存活量、净光合、N、P、K含量等均比非菌根化植物高[24]。
Carvalho等[12]研究发现盐度的增加对Glomus geosporum孢子的萌发没有显著影响,且在盐浓度为20‰时比10‰时有更强的萌发力,将感染G. geosporum的羊草进行盐碱胁迫发现,染菌植物具有较高的根冠比和分蘖数[28],即耐盐菌株的感染也显著增强了宿主植物的耐盐性。本研究中,三种内生真菌的耐盐性均不及模式菌株,N. coenophialum在3 mol/L的氯化钠浓度下仍可以生长,表现出非常强的耐盐性,宿主植物的耐盐性与内生真菌相类似,1% NaCl浓度下,感染N. coenophialum的高羊茅与未感染的相比有更高的叶片存活率[7]。
总之,从天然禾草中获得的3种内生真菌与模式菌株相比较,耐高温的能力更强;耐渗透胁迫的能力只有羊草中的N. sp.与模式菌株接近,而羽茅中的两种菌株的耐渗透胁迫能力却显著低于模式菌株,这与野外观测到染菌羊草分布于较干旱的地区,而羽茅分布于较湿润的生境下相符,不同种类内生真菌在渗透胁迫方面的耐性与其宿主植物表现相一致;对于不同的盐浓度胁迫,3种菌株的耐盐性都显著低于模式菌株,而含有相应抗性菌株的羊草和高羊茅在该抗性方面也具有相应的提高。对于天然禾草而言,内生真菌是一个丰富的资源库,可以进行活体研究,通过体外筛选不同优势的抗性菌株,人工导入到天然禾草中,研究能否提高天然禾草的耐性,从而增加牧草的产量,阐明内生真菌与天然禾草之间的相互关系将会对生态农牧业带来巨大的经济效益和生态效益。
5. 致谢
感谢国家自然科学基金项目(No. 30970460),教育部高等学校博士学科点专项科研基金项目(No. 20090031110026),教育部留学回国人员科研启动基金项目(2009-2011)给予的基金支持。
参考文献 (References)
[1] O. Petrini. Fungal endophytes of tree leaves. In: J. H. Andrews, S. S. Hirano, Eds, Microbial Ecology of Leaves. New York: Springer-Verlag, 1991: 179-197.
[2] R. H. White, M. C. Engelke, S. J. Morton, et al. Acremonium endophyte effects on tall fescue drought tolerance. Crop Science, 1992, 6(32): 1392-1396.
[3] S. G. Assuero, J. A. Tognetti, M. R. Colabelli, et al. Endophyte infection accelerates morpho-physiological responses to water deficit in tall fescue. New Zealand Journal of Agricultural Reasearch, 2006, 49(4): 359-370.
[4] A. A. Elmi, C. P. West. Endophyte infection effects on stomatal conductance, osmotic adjustment and drought recovery of tall fescue. New Phytologist, 1995, 131(1): 61-67.
[5] F. Bayat, A. Mirlohi and M. Khodambashi. Effects of endophytic fungi on some drought tolerance mechanisms of tall fescue in a hydroponics culture. Russian Journal of Plant Physiology, 2009, 56(4): 510-516.
[6] 杜永吉, 王祺, 韩烈保. 内生真菌Neotyphodium typhinum感染对高羊茅光合特性的影响[J]. 生态环境学报, 2009, 18(2): 590-594.
[7] M. R. Sabzalian, A. Mirlohi. Neotyphodium endophytes trigger salt resistance in tall and meadow Fescues. Journal of Plant Nutrition and Soil Science, 2010, 173(6): 952-957.
[8] D. P. Belesky, J. M. Fedders. Does endophyte influence regrowth of tall fescue? Annals of Botany, 1996, 78(4): 499-505.
[9] P. C. Lyons, J. J. Evans and C. W. Bacon. Effects of the fungal endophyte Acremonium coenophialum on nitrogen accumulation and metabolism in tall fescue. Plant Physiology, 1990, 92(3): 726-732.
[10] E. C. Whiting, A. Khan and W. D. Gubler. Effect of temperature and water potential on survival and mycelial growth of Phaeomoniella chlamydospora and Phaeoacremonium spp. Plant Disease, 2001(85): 195-201.
[11] 李婷, 黄艺, 黄志基. 重金属胁迫下外生菌根真菌Boletus edulis重金属积累分配与生长微环境变化[J]. 生态环境, 2005, 14(6): 870-875.
[12] L. M. Carvalho, P. M. Correia and M. A. Martins-loucao. Arbuscular mycorrhizal fungal propagules in a salt marsh. Mycorrhiza, 2004(14): 165-170.
[13] K. S. Subramanian, C. Charest, L. M. Dwyer, et al. Effects of arbuscular mycorrhizae on leaf water potential, sugar content, and P content during drought and recovery of maize. Canadian Journal of Botany, 1997, 75(9): 1582-1591.
[14] K. S. Subramanian, C. Charest, L. M. Dwyer, et al. Arbuscular mycorrhizas and water relations in maize under drought stress at tasselling. New Phytologist, 1995, 129(4): 643-650.
[15] 黄艺, 姜学艳, 季海波等. 过量钠盐胁迫对种外生菌根真菌生长和钠元素积累的影响[J]. 微生物学通报, 2004, 31(3): 45- 49.
[16] 黄艺, 姜学艳, 梁振春等. 外生菌根真菌接种和施磷对油松幼苗抗盐性的影响[J]. 生态环境, 2004, 13(4): 622-625.
[17] 南志标, 李春杰. 禾草——内生真菌共生体在草地农业系统中的作用[J]. 生态学报, 2004, 24(3): 605-616.
[18] C. J. Li, Z. B. Nan and F. Li. Biological and physiological characteristics of Neotyphodium gansuense symbiotic with Achnatherum inebrians. Microbiological Research, 2008, 163(4): 431-440.
[19] G. P. Cheplick. Effect of simulated acid rain on the mutualism between tall fescue (Festuca arundinacea) and an endophytic fungus (Acremoniumco enophialum). International Journal of Plant Sciences, 1993, 154 (1): 134-143.
[20] 张欣, 李熠, 魏宇昆等. 内蒙古中东部草原羽茅Epichloe属内生真菌的分布及rDNA-ITS序列系统发育[J]. 生态学报, 2007, 27(7): 2904-2910.
[21] 王银华, 任安芝, 魏宇昆等. 内蒙古中东部草原羽茅内生真菌的分类[J]. 菌物学报, 2008, 27(6): 841-851.
[22] 张欣. 内蒙古中东部草原羽茅种群内生真菌的多样性及与宿主植物协同进化的研究[D]. 南开大学博士学位论文, 2009.
[23] C. Li, Z. Nan, V. H. Paul, et al. A new Neotyphodium species symbiotic with drunken horse grass Achnatherum inebrians in China. Mycotaxon, 2004, 90(1): 141-147.
[24] O. Chazen, W. Hartung and P. M. Neumann. The different effects of PEG 6000 and NaCI on leaf development are associated with differential inhibition of root water transport. Plant, Cell & Environment, 1995, 18(7): 727-735.
[25] Z. B. Nan, C. J. Li. Neotyphodium in native grasses in China and observations on endophyte host interaction. In: V. H. Paul, P. D. Dapprich, Eds., Proceedings of the 4th International Neotyphodium Grass Interactions Symposium, Soest, 2000: 41-50.
[26] J. F. White, G. Morgan-Jones. Endophyte-host associations in forage grasses. X. Cultural studies on some species of Acremonium sect. albo-lanosa, including a new species, A. starrii. Mycotaxon, 1987, 30: 87-95.
[27] A. Morte, C. Lovisolo and A. Schubert. Effect of drought stress on growth and water relations of the mycorrhizal association Helianthemum almeriense-Terfezia claveryi. Mycorrhiza, 2000, 10(3): 115-119.
[28] Y. F. Zhang, P. Wang, Y. F. Yang, et al. Arbuscular mycorrhizal fungi improve reestablishment of Leymus chinensis in bare saline-alkaline soil: Implication on vegetation restoration of extremely degraded land. Journal of Arid Environments, 2011, 75(9): 773-778.