Asian Case Reports in Vascular Medicine
Vol.1 No.1(2012), Article ID:7152,3 pages DOI:10.4236/acrvm.2012.11001
The Clinical Study of Transient Ischemic Attack on Cerebral Ischemic Tolerance*
Department of Neurology, Qinhuangdao Second Hospital, Changli
Email: linxd888@163.com
Received: Oct. 18th, 2012; revised: Oct. 25th, 2012; accepted: Nov. 9th, 2012
ABSTRACT:
Objective: To explore whether transient ischemic attack (TIA) is significantly associated with subsequent cerebral infarction. Methods: A total of 415 patients were enrolled in this study and were divided into TIA (n = 205) and control group (n = 210), based on presence or absence of TIA before the ischemic cerebral infarction occurrence. The cerebral infarct volume and Neurological deficit scores were compared between the two groups. Furthermore, multiple linear model analysis was conducted to evaluate the impact of TIA on the volume of infarction and Neurological deficit scores in patients who had TIA before. Results: The volume of cerebral infarction and Neurological deficit scores in patients with TIA were significantly lower than those of the control group (P < 0.05). TIA duration, TIA frequency, level of Homocysteine and Hypersensitive C-reactive protein were significantly associated with the volume of cerebral infarction and Neurological deficit scores (P < 0.05). Conclusion: Prior TIA may have a positive impact on the cells of brain. The duration and frequency of TIA and level of Homocysteine and Hypersensitive C-reactive protein are independent risk factors of the volume of cerebral infarction and Neurological deficit scores.
Keywords: Transient Ischemic Attacks; Cerebral Infarction; The Volume of Cerebral Infarction; Homocysteine; Hypersensitive C-Reactive Protein
短暂性脑缺血发作对脑缺血耐受影响的初步研究*
林晓东,赵 丽,王学敏,朱 静,田小卫
秦皇岛第二医院神经科,昌黎
Email: linxd888@163.com
摘 要:
目的:探讨短暂性脑缺血发作(transient ischemic attack, TIA)与脑梗死间的相关性。方法:根据患者脑梗死前是否发生同侧TIA,将所有研究对象分为TIA组和对照组,将2组人群脑梗死体积和临床神经功能缺损程度评分进行比较;同时观察TIA组患者TIA发作持续时间、发作次数等因素对脑梗死体积和临床神经功能缺损的影响。结果:先发TIA患者的脑梗死体积和临床神经功能缺损评分均显著低于对照组(P < 0.05)。TIA持续时间、发作次数、同型半胱氨酸、超敏C反应蛋白等因素均对脑梗死体积和临床神经功能缺损评分产生显著影响。结论:先发TIA有可能对后继脑梗死患者的脑细胞有一定的积极作用,并且脑梗死体积和临床神经功能缺损程度与特定的TIA发作持续时间、发作次数、同型半胱氨酸、超敏C反应蛋白显著相关。
收稿日期:2012年10月18日;修回日期:2012年10月25日;录用日期:2012年11月9日
关键词:短暂性脑缺血发作;脑梗死;梗死体积;同型半胱氨酸;超敏C反应蛋白
1. 引言
短暂性脑缺血发作(transient ischemic attack, TIA)是由于脑、脊髓或视网膜局灶性缺血引起的、未伴发急性梗死的短暂性神经功能障碍,症状持续时间不超过1 h。TIA首次发生后1个月内发生脑梗死的比率占4%~8%[1]。临床研究发现,有部分TIA患者对后继脑梗死具有神经保护作用,即缺血耐受现象。我们对发生脑梗死的TIA患者进行观察,探讨TIA在脑缺血耐受方面的临床意义。
2. 对象与方法
2.1. 对象
2005年3月~2010年10月秦皇岛市第二医院神经内科住院患者,有TIA发作史的脑梗死(TIA组)205例,男108例,女97例,年龄36~78岁,平均62.8 ± 2.6岁;合并症:高血压182例,糖尿病64例,冠心病45例。无TIA发作史的脑梗死(对照组)210例,男113例,女97例,年龄34~75岁,平均62.1 ± 2.2岁,合并症:高血压177例,糖尿病59例,心脏病43例。两组病例均符合中国脑血管病防治指南诊断标准[1]。两组在年龄、性别和合并症等方面无差别(P > 0.05),见表1。
2.2. 入组标准和排除标准
入组标准为:1) TIA和脑梗死的诊断符合中国脑血管病防治指南诊断标准;2) 脑梗死患者为首次发病即发生梗死,且发病 > 12 h,之前未有TIA发作,影像学检查为单个梗死灶。排除标准:1) 既往有陈旧性脑梗死发生;2) 影像学有多发性梗死灶或脑出血征象。
2.3. 观察指标
1) 脑梗死灶体积所有患者皆于梗死72 h后复查头颅CT,依据Pullicino方法,即病灶最大层面长轴 × 短轴 × 层面数 × π/6,计算脑梗死责任病灶的体积。

Table 1. The baselines of the two groups (cases)
表1. 两组患者基线情况(例数)
2) 神经功能缺损评分 治疗前及治疗后15 d、30 d采用1995年全国脑血管病会议推荐的《卒中临床神经功能缺损程度评分标准》[2]进行神经功能评分,将病情程度分为轻度(0分~15分)、中度(16分~30分)和重度(30分~45分)。治疗中病情有加重或异常表现随时复查颅脑CT。
3) 依据TIA持续时间分为三个亚组:≤10 min组(71例)、11~20 min组(92例)、≥20 min组(42例)。根据TIA发作次数分为1次组、2~3次组和>3次组。
2.4. 统计学分析
计量资料以均数±标准差(x ± s)表示,用SPSS 14.0统计软件进行成组t检验,计数资料的比较采用卡方检验,P < 0.05提示差别有统计学意义。
3. 结果
1) 两组间梗死灶体积 TIA组0.34~21 ml3,平均7.68 ± 0.84 ml3;对照组0.38~28.3 ml3,平均11.2 ± 0.92 ml3,差异有统计学意义(P < 0.05)。
2) 两组神经功能缺损评分 治疗前及治疗后15 d,30 d,TIA组评分分别为21 ± 3,14 ± 2,7 ± 3;对照组为26 ± 5,20 ± 2,16 ± 3。两组不同时间点评分比较差异均有统计学意义(P < 0.05),见表2。
3) TIA持续时间与脑梗死体积及神经功能受损情况。
结果显示,TIA持续时间在10~20 min人群,脑梗死体积比TIA持续时间 <10 min和>20 min人群均小,组间差异有统计学意义(P < 0.001)。TIA持续时间 < 10 min和>20 min人群比较差异无统计学意义(P > 0.05)。TIA持续时间在10~20 min组神经功能评分低于TIA持续时间 < 10 min组和>20 min组,组间差异有统计学意义(P < 0.001),但TIA持续时间< 10 min和20 min以两组者的神经功能评分则差异无统计学意义(P > 0.05),详见表3。

Table 2. Comparison of pre-and post-treatment neurological deficit score between the two groups
表2. 治疗前后两组神经功能缺损评分比较
4) TIA发作次数与脑梗死体积及神经功能受损情况。
TIA发作次数在2~3次组脑梗死体积和神经功能评分均显著低于TIA发作1次组(P < 0.001和P = 0.022);而发作次数在3次以上组,其脑梗死体积和神经功能评分均与发作1次组差异无统计学意义(P > 0.05),见表4。
5) TIA与其他危险因素交互作用对脑梗死严重程度的影响所选各影响因素赋值,见表5。
以代表脑梗死神经功能缺损严重程度为因变量的多元逐步回归分析结果显示,与神经功能缺损严重程度有关的依次为TIA、吸烟、同型半胱氨酸(Hcy)、超敏-C反应蛋白(Hs-CRP)、房颤、家族史。见表6。
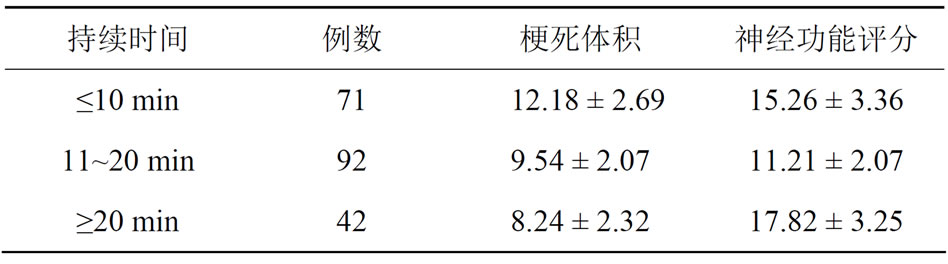
Table 3. Association of TIA duration with the volume of cerebral infarction and neurological deficit
表3. TIA 持续时间与脑梗死体积及神经功能受损情况

Table 4. Association of TIA frequency with the volume of cerebral infarction and neurological deficit
表4. TIA发作次数与脑梗死体积及神经功能受损情况
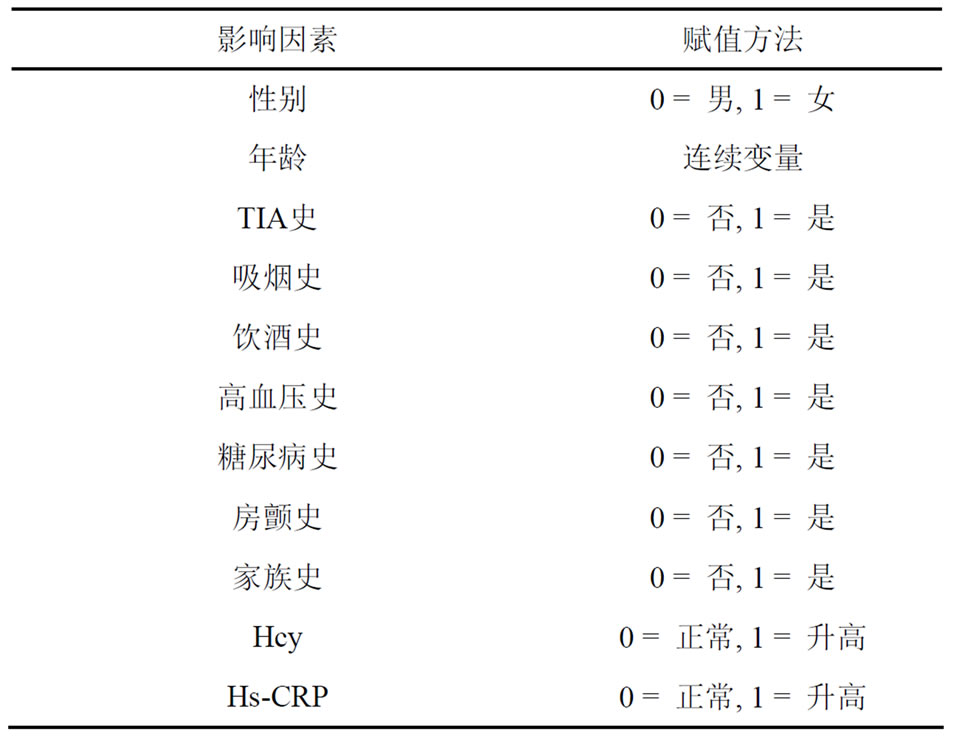
Table 5. The influencing factors assignment
表5. 各影响因素赋值情况
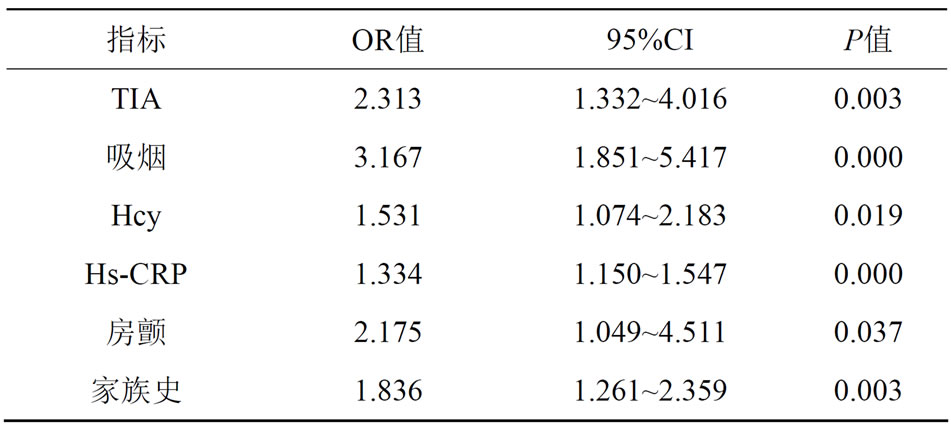
Table 6. Multiple stepwise regression analysis of neurological deficit score as the dependent variable
表6. 以神经功能缺损严重程度评分为因变量的多元逐步回归分析
4. 讨论
许多生命器官当受到足够强度的亚致死性环境改变时,对另外一种致死性环境变化获得短暂耐受,这种耐受反应从细菌到哺乳动物不同种属中均可观察到。1990年,Kitagawa等[3]首先在脑部证实这一现象,发现TIA可对1~7 d后的再次严重缺血产生部分保护作用。Moncayo等[4]对2492例首次发生脑梗死的患者进行研究,发现TIA病史与脑梗死的良好预后具有相关性,病前无TIA病史的患者发生脑梗死时病情更严重,神经功能缺损更明显。Masada等[5]认为,大脑中动脉闭塞15 min并不能引起相应脑区神经元死亡,但却可以对3 d后的永久性脑缺血产生保护作用。这种耐受现象与保护血脑屏障的完整性,减轻再次缺血后的血管源性脑水肿有关。近年来,国内学者苏民等[6]研究表明,脑梗死前发生的TIA有可能对人脑产生缺血耐受作用,其保护性与TIA持续时间、发作次数及与脑梗死间隔时间有一定关系。周雪珍[7]观察120例患者,有TIA发作史者神经功能缺损的程度以及预后均好于对照组。刘柳等[8]研究显示,TIA组患者的梗死体积小于单纯梗死组,神经功能缺损的程度较轻,并且预后明显好于对照组。
本研究参考了2002年TIA工作组提出的TIA新概念选择病例,研究结果显示,先发TIA对后继脑梗死患者的脑细胞保护确实具有一定的积极作用,并且脑梗死体积和临床神经功能缺损程度与TIA发作持续时间、发作次数及其与脑梗死间隔时间显著相关,即在TIA持续10~20 min时、发作2~3次这些情况下,其对后继脑梗死时脑细胞的保护作用最为显著,与国内外的临床研究结果相近。从而表明,预处理时间过短、发作次数较少,均不能有效激活内源性保护机制,不能产生缺血耐受,无法对脑细胞产生保护作用;预处理较频繁或持续时间过长则可引起脑细胞的坏死。给予合适的缺血预处理时间和频次,掌握适当的时机可以最大限度地提高脑组织的抗损伤能力[9,10]。
我们又通过多元逐步回归法分析了TIA与其他危险因素交互作用对脑梗死严重程度及预后的影响,发现TIA与后继脑梗死关系密切,存在独立相关性。另外我们发现,Hcy、Hs-CRP也起着相当重要的作用。由此我们推断,脑梗死前发生的TIA可能对人脑产生缺血耐受作用,从而减轻随后严重脑梗死的神经功能缺损程度,改善脑梗死的预后。
脑缺血耐受实际上是外界刺激激活了机体内在的保护机制,增加了对后续更严重损伤的抵抗。研究脑缺血耐受可以阐明脑缺血时机体的内源性保护机制,有助于开发神经保护药物,并可通过提高神经元对缺血缺氧的耐受性,延长缺血性脑血管病的治疗时间窗,减轻缺血性卒中的临床后遗症。总之,缺血耐受是机体的自我保护现象,TIA是否能产生神经保护作用尚需开展大规模临床前瞻性研究,我们将在今后的工作中对TIA与脑梗死的关系做进一步研究。
参考文献 (References)
[1] 饶明利. 中国脑血管病防治指南(试行版)[M]. 卫生部疾病控制司中华医学会神经病学分会, 2005: 35.
[2] 中华医学会神经科学会. 各类脑血管病诊断要点. 中华神经科杂志, 1996, 29(6): 379-383.
[3] K. Kitagawa, M. T. Matsumoto, et al. “Ischemic tolerance” phenomenon found in the brain. Brain Research, 1990, 528(1): 21-24.
[4] J. Moncaya, G. R. De Freitas, J. Bogousslavsky, et al. Do transient ischemic attacks have a neuroprotective effect? Neurology, 2000, 54(11): 2089-2094.
[5] T. Masada, Y. Hua, G. Xi, et al. Attenuation of ischemic brain edema and cerebrovascular injury after ischemic preconditioning in the rat. Journal of Cerebral Flow and Metabolism, 2001, 21(1): 22-33.
[6] 苏民, 王大力, 赵晓晶等. TIA对后继脑梗死神经保护作用的临床研究[J]. 中华神经医学杂志, 2006, 5(7): 728-730.
[7] 周雪珍. 短暂脑缺血发作对后继脑梗死的影响[J]. 临床和实验医学杂志, 2008, 7(6): 6-7.
[8] 刘柳, 何远宏. 短暂性脑缺血发作对首发脑梗死的神经保护作用[J]. 中国老年学杂志, 2007, 27(19): 1901-1902.
[9] J. M. Pradillo, D. Fernández-Lopez, I. Garcia-Yébenes, et al. Toll-like receptor 4 is involved in neuroprotection afforded by ischemic preconditioning. Journal of Neurochemistry, 2009, 109(1): 287-294.
[10] U. Dirnagl, K. Becker and A. Meisel. Preconditioning and tolerance against cerebral ischaemia: From experimental strategies to clinical use. Lancet Neurology, 2009, 8(4): 398-412.
NOTES
*项目来源:秦皇岛市科技局指导项目(第二批)(编号:20090213035)。