Asian Case Reports in Vascular Medicine
Vol.2 No.1(2013), Article ID:9463,5 pages DOI:10.12677/ACRVM.2013.21001
The Application of ABI in Peripheralvascular Disease Using the Method of CDFI in Type 2 Diabetic
Department of Ultrasonography, The First Affiliated Hospital of Baotou, Baotou
Email: ygz670708@163.com
Received: Dec. 19th, 2012; revised: Jan. 10th, 2013; accepted: Jan. 21st, 2013
ABSTRACT:
Purpose: Research the relationship between ABI (ankle brachial index) and diabetes mellitus with vascular disease using color Doppler ultrasound in diabetic patients, providing the early information of diabetic vascular disease to the clinicians. Objects and Methods: Choose 44 healthy volunteers (group A) and 65 patients in our hospital diagnosed as type 2 diabetes with WHO diagnostic criteria and clinical characteristics and collected the various clinical data. Then, measured ABI using the method of CDFI With Philips IU22 color ultrasound diagnostic apparatus, ABI equal 0.9 as the Separatrix, the PAD group (group B) with ABI less than 0.9 and greater than 0.9 belongs to the non-PAD group (group C). Single factor analysis of variance compared the two groups of patients in ABI and age, gender, disease duration, FPG, HbA1c, TG, CHOL, HDL-C, LDL-C, EDD, with P < 0.05 considered statistically significant. Results: 65 patients with T2DM patients with ABI less than 0.9 in 21 cases, there’s gangrene and ulcer in foot 1 case, there dorsalis pedis artery fluctuations reduced, intermittent claudication or pain at rest in 6 patients (33%), while the group B in 3 patients (4%) dorsalis pedis artery pulse weakened, intermittent claudication or pain at rest, two groups there were significant differences (P < 0.05). The more significantly the ABI value reduced, the more significantly different in age, duration, TG, LDL-C, HbA1c between the two group (P < 0.05). Conclusion: The application of ABI in peripheralvascular disease using the method of CDFI in type 2 diabetes mellitus can be used to test the seriousness of vascular complications.
Keywords: Type 2 Diabetes Mellitus (T2DM); Ankle Brachial Index (ABI); Peripheralvascular Disease (PAD); Color Doppler
彩色多普勒技术测定动脉踝肱指数在2型糖尿病外周血管病变中的应用
闫国珍,何俊峰,袁彦芬
包头医学院第一附属医院超声科,包头
Email: ygz670708@163.com
摘 要:
目的:采用彩色多普勒血流成像技术测定2型糖尿病患者的踝肱指数,研究踝肱指数与糖尿病合并血管病变的关系,为临床T2DM患者血管病变的早期诊断提供依据。方法:选择健康志愿者40例(A组)及包头医学院第一附属医院住院的65例2型糖尿病患者,均按WHO诊断标准及临床特点确诊,采用飞利浦IU22彩色超声诊断仪测定踝肱指数,以踝肱指数 < 0.9为外周血管病变组(B组),踝肱指数 ≥ 0.9为非外周血管病变组(C组),应用单因素方差分析比较两组病人的年龄、性别、病程、血脂及糖化血红蛋白等各项检验指标及踝肱指数,以P < 0.05认为差异有统计学意义。结果:65例2型糖尿病患者中B组21例,其中出现足部的坏疽及溃疡的1例,出现足背动脉搏动减弱、间歇性跛行或静息痛6例,下肢动脉的硬化狭窄17例;C组44例,其中足背动脉搏动减弱、间歇性跛行或静息痛有3例,无一例发生足部的坏疽及溃疡,无下肢动脉的硬化狭窄,两组间差异有统计学意义(P < 0.05)。结论:2型糖尿病患者中踝肱指数降低程度与外周血管病变发生率呈正相关,两组组临床资料比较,前者具有年龄大、病程长、血脂、糖化血红蛋白明显升高的特点。彩色多普勒血流成像技术检测2型糖尿病患者踝肱指数,可用于判断2型糖尿病患者外周血管病变程度,为临床预防其的发生发展提供可靠依据。
收稿日期:2012年12月19日;修回日期:2013年1月10日;录用日期:2013年1月21日
关键词:2型糖尿病;踝肱指数;外周血管病变;彩色多普勒技术
1. 引言
近年来,2型糖尿病(Type 2 diabetes mellitus,简称T2DM)发病率明显上升,T2DM患者多并发血管病变,血管并发症是导致T2DM死亡的最主要原因,临床上常用下肢血管病变代表外周血管病变的严重程度。外周血管病变(peripheral arterial disease,简称PAD)是T2DM患者的严重并发症,极易造成糖尿病足坏疽甚至截肢致残,因此早期治疗、早期诊断、阻止外周血管病变的发展具有重要意义。
踝肱指数(ankle brachial index, ABI)是血管外科最常用、最简单的一种检查外周血管病变的方法,通常是通过测量踝部胫后动脉或胫前动脉以及肱动脉的收缩压,得到踝部动脉压与肱动脉压之间的比值,是一种可重复和最易于进行的客观确定肢体缺血严重程度的检查方法。
传统方法测定踝肱指数的工具包括血压袖带和连续波形多普勒探头,测量上臂和踝部的最高收缩压,然后将踝部收缩压除以臂部的收缩压计算出ABI。有研究表明,踝肱指数测量存在以下不足:1) 踝肱指数对存在动脉钙化的患者的测量结果不可靠[1-3],因为动脉硬化会导致脚踝血压测量值虚假地升高,从而导致假阴性的出现[4]。这种情况恰恰经常发生在糖尿病患者[5,6];2) 测量踝肱指数非常耗时[7];3) 静息踝肱指数值对检测轻度的周围血管疾病不敏感[8,9],有时需要在让患者在跑步机运动6分钟后在进行测试,以增加测量的灵敏度,导致评估时间增加,较为费时;4) 因操作较为繁复,踝肱指数测量缺乏标准化的规程,这会减低其可信度[10,11];5) 测量踝肱指数需要有经验的人员,才能得到一致、准确的结果[12]。
鉴于此,本研究改革传统方法,通过彩色多普勒血流动力学原理观察2型糖尿病患者的外周血管病变,同时采用直接观察外周血管血流的方法测定踝肱指数,为糖尿病血管病变早期筛查、早期诊断提供一种全新的、更为直观可信的测定踝肱指数的方法,为临床防治2型糖尿病的外周血管病变提供重要的临床依据。
2. 材料与方法
2.1. 研究对象
选择健康志愿者40例(男女各半,除外周血管疾病及高血压、糖尿病等相关疾病)及按ADA(美国糖尿病协会)2012年糖尿病诊疗标准确诊为2型糖尿病、并于2012.01~2012.11月在我院住院的患者65例,其中男20例,女45例,年龄30~82岁,平均(58.8 ± 11.2)岁,糖尿病病程1月~25年不等,平均(8.4 ± 2.7)年。常规记录患者年龄、性别、病程,均进行身高、体质量、血压测量,计算体质量指数,行糖化血红蛋白、总胆固醇、甘油三脂、高密度脂蛋白、低密度脂蛋白、眼底常规及十二导联心电图检查,询问有无间歇性跛行、静息痛等表现,体检有无足背动脉搏动减弱、肢端坏疽等。
首先采用彩色多普勒血流动力学方法测定踝肱指数,正常对照组定为A组;2型糖尿病患者以踝肱指数小于0.9为分界,小于0.9为外周血管病变组,定为B组,大于等于0.9为非外周血管病变组,定为C组。然后再采用彩色多普勒血流动力学方法,检查下肢血管的情况,包括管壁回声、管腔内径、内中膜厚度、血流频谱形态、血流速度等指标,逐一记录,对比分析A、B、C三组外周血管情况。
2.2. 实验仪器与操作方法
采用飞利浦IU22彩色多普勒超声诊断仪,探头频率5.0~10 MHZ。
彩色多普勒超声血流动力学检查根据所检部位让患者取静态仰卧位/俯卧位,沿股动脉、腘动脉、胫后/胫前动脉、足背动脉顺序,依次自上而下逐一扫查,血管分叉处及关节附近血管作为重点观察,进行双侧对比。
根据受检者体形和检测部位选择合适的袖带,与测压计相连,并将袖带缠于受检者臂部或踝部,严格按照美国心脏病协会(AHA)推荐的肱动脉血压测量要求测量肱动脉压,采用同样方法测量踝动脉压(图1)。踝肱指数ABI = 踝动脉收缩压/肱动脉收缩压。
测压时注意事项:1) 手握测压计球囊,快速对袖带进行充气,待动脉搏动声消失后,继续充气使压力再升高至少20 mmHg以确保动脉完全塌陷;2) 放气过程中密切注意测压计读数和血流恢复时的第一声此时对应的读数即为该动脉的收缩压;3) 读数完成以后迅速放气至0;4) 对同一动脉测量三次取平均值,每次间隔至少30秒以使静脉充血恢复。
以上检查采用双盲对照的方法,设计、实施、评估均由有丰富血管超声经验、接受过系统科研方法培训的高年资医生完成,每次操作尽量由同一检测人员进行,对所有的患者采用相同的测量顺序,结果测量3次后取平均值。
2.3. 统计学方法
所有数据均应用SPSS11.0统计软件分析,计量资料采用均数 ± 标准差(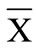 ± S)表示,采用单因素方差分析(One-way ANOVA)的方法统计,对病变危险因素做多元线性回归及Logistic回归法,以P < 0.05为差异有统计学意义。
± S)表示,采用单因素方差分析(One-way ANOVA)的方法统计,对病变危险因素做多元线性回归及Logistic回归法,以P < 0.05为差异有统计学意义。
3. 结果
通过A、B、C三组(健康志愿者40例及65例2型糖尿病患者)踝肱指数测定结果,对外周血管病变程度进行初步分级(见表1)。
踝肱指数正常值为0.9~1.3;
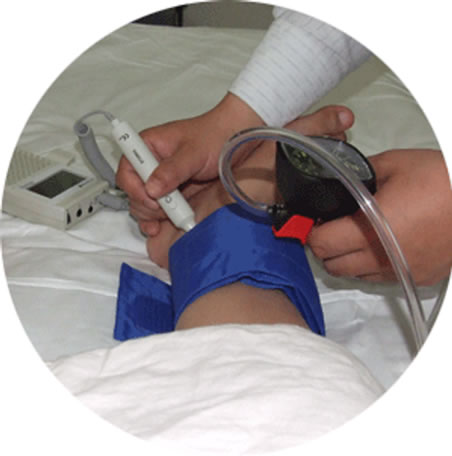
Figure 1. The measurement of ankle artery pressure
图1. 踝动脉压测量

Table 1. The compare between ABI and the seriousness of vascular complications
表1. 外周血管病变程度与踝肱指数比较
轻度外周血管病变(间歇性跛行)踝肱指数0.9~ 0.7;
显著外周血管病变(静息痛、足背动脉搏动减弱)踝肱指数0.7~0.4;
严重外周血管病变(肢端溃疡、坏疽)踝肱指数小于0.4;
极重度外周血管病变(血管壁钙化、足背动脉搏动消失)踝肱指数大于1.3。
3.1. 2型糖尿病外周血管病变临床表现与踝肱指数
A组40例健康志愿者踝肱指数均在0.9~1.3。
B组21例2型糖尿病患者踝肱指数小于0.9,占患者总数的32%。其中,出现足部坏疽及溃疡1例,其踝肱指数小于0.4;出现足背动脉搏动减弱、间歇性跛行或静息痛6例,其踝肱指数均在0.4~0.7之间;踝肱指数值减低程度与外周血管病变程度呈正相关。
C组44例2型糖尿病患者与40例健康志愿者相似,踝肱指数均在0.9~1.3之间,占患者总数的68%。其中,出现足背动脉搏动减弱、间歇性跛行或静息痛3例,B、C两组间外周血管病变发病率相比较,差异有统计学意义(P < 0.05)。
3.2. 2型糖尿病外周血管病变情况彩色多普勒血流动力学结果
A组40例健康志愿者外周血管检查未见异常:检查中见所检血管管壁正常,内中膜光滑,管腔通畅,血流频谱形态正常,呈典型“双向或三相”血流频谱,血流速度正常范围,第一相为大而快速的收缩期正向血流,第二相为舒张早期较小的反向血流,第三相为舒张晚期小而平坦、低速的正向血流(图2、图3)。
B组通过下肢血管彩色多普勒血流动力学检查可

Figure 2. The PW picture of peripheralvascular in healthy volunteers
图2. 健康人下肢动脉血流频谱模式图
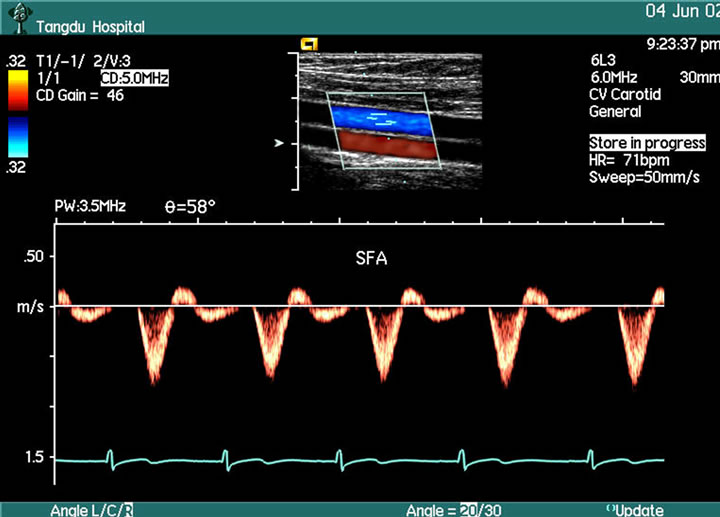
Figure 3. The PW picture of superficial femoral artery in healthy volunteers (ABI 1.08)
图3. 健康人股浅动脉血流频谱图(踝肱指数1.08)
见血管管壁回声增强,内中膜毛糙,紧贴管壁可见斑块形成,管腔狭窄,血流频谱形态失常,可见反向血流频谱消失,血流速度较正常明显增高。其中,管腔的狭窄率达40%~80%的占17例(占B组81%)(图4)。
C组,通过下肢血管彩色多普勒血流动力学检查可见血管管壁回声正常,内中膜稍毛糙,管腔通畅,血流频谱形态正常,血流频谱正常,血流速度较正常稍增高。其中,2例出现管腔轻度狭窄,分别为25%,36%(占B组4.5%)。B、C两组间外周血管病变程度相比较,差异有统计学意义(P < 0.05)(图5)。
2型糖尿病B、C两组组临床资料分析比较,年龄、病程、糖化血红蛋白、总胆固醇、甘油三脂、高密度脂蛋白、胆固醇、低密度脂蛋白等数据差异有统计学意义(P < 0.05),B组具有年龄大、病程长、血脂及糖化血红蛋白高等特点(见表2、3)。
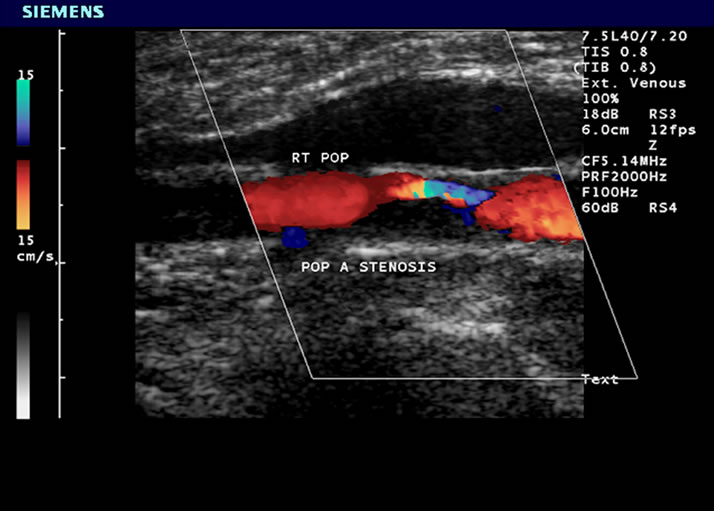
Figure 4. The CDFI of popliteal artery in diabetes mellitus with vascular disease (ABI 0.32)
图4. 2型糖尿病严重外周血管病变腘动脉彩色血流图(踝肱指数0.32)

Figure 5. The CDFI of ankle artery in diabetes mellitus with vascular disease (ABI 0.80)
图5. 2型糖尿病轻度外周血管病变踝动脉彩色血流图(踝肱指数0.80)
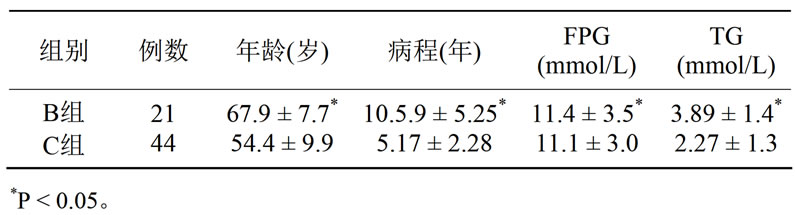
Table 2. The clinical data compare between group A and group B
表2. B组与C组临床资料比较( ± S)
± S)

Table 3. The clinical data compare between group B and group C
表3. B组与C组临床资料比较( ± S)
± S)
4. 讨论
近年来2型糖尿病发病率逐渐上升,糖尿病患者不仅有糖代谢异常,而且还有脂肪和蛋白质代谢异常。目前认为,2型糖尿病外周血管病变的主要致病机理为胰岛素抵抗及非酶糖基化。其中,胰岛素抵抗症候群可出现于糖尿病发病前,包括高胰岛素血症、血脂代谢异常、肥胖、高血压等。高血糖状态下血糖与血循环及组织中的蛋白质非酶结合形成非酶糖基化终末产物对粥样硬化的发展起到重要作用。
2型糖尿病患者发生动脉粥样硬化最重要的危险因素包括病程、年龄、脂质代谢异常、高胰岛素血症、高血糖状态、高血压、肥胖和吸烟等,本实验单因素方差分析显示病程、年龄、糖化血红蛋白、血脂代谢紊乱为糖尿病外周血管病变发生的显著危险因素,研究发现,糖尿病合并外周血管病变组患者年龄大、病程长、血脂及糖化血红蛋白均明显升高,与外周血管病变程度呈正相关。2型糖尿病外周血管病变时,由于动脉管腔的狭窄或闭塞造成肢体血流动力学障碍,产生诸如间歇性跛行、静息痛、溃疡和坏疽等一系列症状,重者可致残致死,须早期诊断,早期干预。
正常人体两侧肢体对称部位所测得的血压是相近的,若两侧肢体对称部位所测得的血压差大于2.67千帕(20 mmHg)以上,则提示压力低的一侧肢体动脉近端有狭窄或阻塞;若上肢血压正常,下肢血压异常,则用患侧下肢与健康上肢节段性血压的比值,作为测定肢体缺血程度的指标,这个比值称为踝/肱指数(ABI)。在正常情况下,下肢血压高于上肢,故踝肱指数通常大于1.0。研究表明,踝肱指数异常通常可资反映2型糖尿病患者外周血管病变的程度[13]。
本研究证实,正常人休息时踝肱指数的范围为0.9~1.3,低于0.7预示着外周血管显著病变,低于0.4预示着外周血管严重病变,当踝肱指数大于1.3则提示血管壁钙化以及血管失去收缩功能,同样也反映十分严重的周围血管疾病,一般认为这样的病人若不积极治疗将可能面临截肢的危险。由于踝肱指数在同一个体的反复多次检查结果比较稳定,所以可用做一种有效的动态检查方法检测外周血管疾病因时间推移而发生的变化。
理论上认为,2型糖尿病外周血管病变患者,下肢血压低于上肢,血压越低,踝肱指数越小,病人的缺血症状越重。但是,传统方法测定踝肱指数采用连续波多普勒诊断仪,因无法直视血管内改变,不可避免地存在一些不足:首先,传统方法测定踝肱指数没能显示所检血管管腔结构,无法区分管腔内病变与管腔外压迫性病变,无法确定病变的性质,可能会发生定位错误;其次,有时在静息状态下,2型糖尿病外周血管病变患者,如伴有远端腹主动脉或髂总动脉的狭窄或闭塞,踝肱指数显示正常,唯有运动或负荷试验后测量才有可能发现阳性结果,所以,有些运动后患肢有缺血症状者,如未经诱发直接进行踝肱指数测量,可导致假阴性诊断;再次,有严重动脉中层钙化的患者,通过血压袖带不可能压闭小腿的动脉,节段性血压测定可发生假性高压,亦会导致踝肱指数异常增高;最后,2型糖尿病外周血管病变患者如同时伴有锁骨下动脉狭窄闭塞时,上肢肱动脉血压力测定不准确,踝肱指数测量受到极大干扰,极易造成判断失误[14-16]。
本实验测定踝肱指数,采用彩色多普勒超声显像的方法,可以首先明确观察动脉的形态,明确动脉阻塞的部位、范围及程度,大致了解动脉阻塞的性质(管腔外压性阻塞、血栓阻塞以及动脉本身病变导致管腔闭塞等),还可精确测定动脉管腔的直径,腔内血流速度,动脉壁有无钙化以及阻塞部位以远的动脉条件和侧支循环建立的情况等。
采用彩色多普勒超声血流动力学方法较传统连续多普勒诊断仪测定踝肱指数具有无可比拟的优点:1) 配备扩音器可代替听诊器听诊血流声音,听音更精准;2) 手握测压计球囊对袖带进行充气时,可以直接看到管腔结构逐渐减小直至完全塌陷;放气过程中可以直接观察到血流恢复,以此时对应的读数为该动脉的收缩压,测量结果更为可靠;3) 可直接观察到管壁钙化,如踝肱指数大于1.4,直接给临床医外周血管钙化的诊断,可避免误诊误治;4) 对肥胖患者可进行反复、多处、加压的方法,提高诊断的阳性率,避免传统方式测定时因检测困难引起的漏诊漏治。
综上所述,外周血管病变是2型糖尿病重要的并发症,其发病率、致残率高。无疑,2型糖尿病外周血管病变诊断的金标准是血管造影,但因有创,临床未能广泛应用,彩色多普勒血流动力学检查具有无损伤、灵敏度高、可重复性强的优点,可弥补血管造影检查技术之不足,被称为无创血管造影,联合踝肱指数检测对可作为2型糖尿病外周血管病变首选检查方法。
对疑有外周血管病变患者早期进行彩色多普勒血流动力学检查,可了解动脉闭塞性病变的存在与否、病变的部位和严重程度,评定临床治疗路径,明确手术的指征。但是,彩色多普勒血流动力学检查作为一种影像学检查,是对患者病史、体检和动脉造影等临床资料的补充,不能代替其他检查手段,全面评价糖尿病外周血管病变需要对上述各项信息进行综合分析,并以此作为2型糖尿病外周血管病变危险性的预测因子之一,建议病史长、高龄、高血压、吸烟、高脂血症等危险因素的患者应定期进行踝肱指数测量,积极进行早期干预,纠正异常改变,延缓或阻止外周血管病变发展,提高患者生活质量。
参考文献 (References)
[1] M. Al-Qaisi, D. M. Nott, D. H. King and S. Kaddoura. Ankle brachial pressure index (ABPI): An update for practitioners. Vascular Health and Risk Management, 2009, 5: 833-841.
[2] M. M. McDermott, M. H. Criqui, K. Liu, J. M. Guralnik, P. Greenland, G. J. Martin and W. Pearce. Lower ankle/brachial index, as calculated by averaging the dorsalis pedis and posterior tibial arterial pressures, and association with leg functioning in peripheral arterial disease. Journal of Vascular Surgery, 2000, 32(6): 1164-1171.
[3] M. A. Allison, W. R. Hiatt, A. T. Hirsch, J. R. Coll and M. H. Criqui. A high ankle-brachial index is associated with increased cardiovascular disease morbidity and lower quality of life. Journal of the American College of Cardiology, 2008, 51(13): 1292- 1298.
[4] American Diabetes Association. Peripheral arterial disease in people with diabetes. Diabetes Care, 2003, 26(12): 3333-3341.
[5] V. Aboyans, E. Ho, J. O. Denenberg, L. A. Ho, L. Natarajan and M. H. Criqui. The association between elevated ankle systolic pressures and peripheral occlusive arterial disease in diabetic and nondiabetic subjects. Journal of Vascular Surgery, 2008, 48(5): 1197-1203.
[6] S. Novo. Classification, epidemiology, risk factors, and natural history of peripheral arterial disease. Diabetes, Obesity and Metabolism, 2002, 4(Suppl. 2): S1-S6.
[7] C. A. Doubeni, R. A. Yood, S. Emani and J. H. Gurwitz. Identifying unrecognized peripheral arterial disease among asymptomatic patients in the primary care setting. Angiology, 2006, 57(2): 171-180.
[8] R. Stein, I. Hriljac, J. L. Halperin, S. M. Gustavson, V. Teodorescu and J. W. Olin. Limitation of the resting ankle-brachial index in symptomatic patients with peripheral arterial disease. Journal of Vascular Medicine, 2006, 11(1): 29-33.
[9] P. S. Montgomery, A. W. Gardner. The clinical utility of a sixminute walk test in peripheral arterial occlusive disease patients. Journal of the American Geriatrics Society, 1998, 46(6): 706- 711.
[10] N. U. Jeelani, B. D. Braithwaite, C. Tomlin and S. T. MacSweeney. Variation of method for measurement of brachial artery pressure significantly affects ankle-brachial pressure index values. European Journal of Vascular and Endovascular Surgery, 2000, 20(1): 25-28.
[11] M. F. Caruana, A. W. Bradbury and D. J. Adam. The validity, reliability, reproducibility and extended utility of ankle to brachial pressure index in current vascular surgical practice. European Journal of Vascular and Endovascular Surgery, 2005, 29(5): 443-451.
[12] V. Kaiser, A. D. Kester, H. E. Stoffers, P. J. Kitslaar and J. A. Knottnerus. The influence of experience on the reproducibility of the ankle-brachial systolic pressure ratio in peripheral arterial occlusive disease. European Journal of Vascular and Endovascular Surgery, 1999, 18(1): 25-29.
[13] B. L. Bendermacher, J. A. Teijink, E. M. Willigendael, et al. A clinical prediction model for the presence of peripheral arterial diseasethe benefit of screening individuals before initiation of measurement of the ankle-brachial index: An observational study. Vascular Medicine, 2007, 12(1): 5-11.
[14] D. Treat-Jacobson, J. G. Regensteiner, M. A. Creager, J. W. Olin, S. H. Krook, D. B. Hunninghake, A. J. Comerota, M. E. Walsh, M. M. McDermott and W. R. Hiatt. Peripheral arterial disease detection, awareness, and treatment in primary care. JAMA, 2001, 19(286): 1317-1324.
[15] H. H. Feringa, J. J. Bax, V. H. van Waning, et al. The long-term prognostic value of the resting and postexercise ankle-brachial index. Archives of Internal Medicine, 2006, 166(5): 529-535.
[16] S. H. Wild, C. D. Byrne, F. B. Smith, A. J. Lee and F. G. Fowkes. Low ankle-brachial pressure index predicts increased risk of cardiovascular disease independent of the metabolic syndrome and conventional cardiovascular risk factors in the Edinburgh Artery Study. Diabetes Care, 2006, 29(3): 637-642.