Asian Case Reports in Vascular Medicine
Vol.04 No.04(2016), Article ID:18939,6
pages
10.12677/ACRVM.2016.44004
The Relationship between Cardiac Transcriptional Factor NKX2.5 and Congenital Heart Disease
Ping Ouyang1, Sen Wang2, Hao Liu1, Mengfei Lin1, Tao Li1
1Guangdong Provincial Key Laboratory of Medical Molecular Diagnostics, Dongguan Research Center, Guangdong Medical University, Dongguan Guangdong
2Histology and Embryology Department of Basic Medical College, Guangdong Medical University, Dongguan Guangdong

Received: Oct. 13th, 2016; accepted: Nov. 12th, 2016; published: Nov. 15th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Congenital heart defects (CHDs) are cardiovascular malformations formed during fetal period. It’s the commonest malformation for the newborns. The morbidity is about 1% in all the live birth infants. CHD is also a common disease that leads to children death. Previous studies have confirmed that genetics play an important role in the development of CHD. NKX2.5 is a cardiac transcriptional factor and plays a pivotal role in heart early development and maintenance of adult hearts. Plenty of studies have reported that NKX2.5 mutations lead to atrial septal defect, ventricular septal defect and atrioventricular block. Functional analysis identified that the transcriptional activity, DNA-binding activity and nuclear localization of the NKX2.5 mutant proteins have been changed. The expression of the downstream genes regulated by NKX2.5 can also be changed. Here, we will focus on the relationship of NKX2.5 and CHD, discussing partial molecular mechanisms of CHD.
Keywords:Congenital Heart Defects, NKX2.5, Gene Mutation

心脏转录因子NKX2.5与先天性心脏病的关系
欧阳平1,王森2,刘浩1,林梦飞1,李涛1
1广东医科大学,东莞科研中心,广东医科大学广东省医学分子诊断重点实验室,广东 东莞
2广东医科大学基础医学院组织学与胚胎学教研室,广东 东莞

收稿日期:2016年10月13日;录用日期:2016年11月12日;发布日期:2016年11月15日

摘 要
先天性心脏病(congenital heart disease, CHD)是胎儿时期心脏血管发育异常所致的心血管畸形,也是最常见的新生儿畸形之一,其发病率约占出生活产婴儿的约1%。先天性心脏病也是儿童死亡的主要原因之一。已有的研究发现遗传因素在CHD发病中具有很重要的作用。NKX2.5是一个重要的心脏转录因子,在心脏的早期发育和成体心脏的维护中均起很重要的作用。已有较多研究报道NKX2.5基因突变导致房间隔缺损(atrial septal defect, ASD)、室间隔缺损(ventricular septal defect, VSD)和房室传导阻滞(atrioventricular block, AVB)等CHD表型产生。突变的NKX2.5的转录活性、DNA结合活性和核定位等功能发生改变,并影响NKX2.5下游基因的表达。我们将主要论述NKX2.5和CHD的关系,讨论NKX2.5突变引起CHD发生的可能机制。
关键词 :先天性心脏病,NKX2.5,基因突变

1. 引言
先天性心脏病(congenital heart disease, CHD)简称先心病,是胎儿时期心脏血管发育异常所致的心血管畸形,也是最常见的新生儿畸形之一,其发病率约占出生活产婴儿的约1%,CHD是新生儿致死致残的一个重要原因 [1] 。先天性心脏病的病因复杂,临床表现多种多样,其发病原因可能与遗传、宫内感染、大剂量放射性接触和药物等因素有关。有些CHD症状明显,一般在0~15岁时即可发现;有一些病人可能没有表现出明显症状,直至复杂病况出现时才能发现其具有CHD [2] 。根据CHD的严重程度,外科修补或内科封堵手术都能有效的治疗CHD。由于遗传基因突变导致的CHD病人,即使做了心脏修补手术也可能出现一些其他的并发症,比如心律不整、心内膜炎和心力衰竭,因此也需要注意观察,有可能还需要额外的外科手术 [2] [3] 。值得一提的是,CHD中的心脏传导系统的异常是伴随一生的非常危险的致死因素,且症状随着年龄增加而逐渐加重 [4] 。因此,对CHD病人进行遗传基因检测,找出致病基因,对病人手术后的生活质量和生存率都很重要。
对心脏发育中的一些转录调控回路的研究,发现心脏转录因子在CHD发生发展中起重要作用 [5] [6] [7] 。许多转录因子,比如NKX2.5、GATA4和TBX5在心脏的早期发育中都有作用 [8] [9] 。在这里,我们主要讨论心脏转录因子NKX2.5在早期心脏中的作用,其突变导致的CHD表型,并讨论其导致CHD的可能机制。
2. 早期心脏发育
人类胚胎的心血管系统在第三周开始发育,到第八周结束 [10] 。心脏发育起始于前面侧板中胚层内心脏祖细胞的分化。心脏的胚胎发育可分为四步:分段发育、融合连接、扭曲旋转和顺序分隔。人的胚胎发育的第16/17天,血管母细胞增殖形成鼓励的内皮细胞团;18~19天,生心板形成;胚胎发育的第23天,单个心管形成,开始低效率的收缩;第26天,单个心房心脏形成;第29天,形成两个心房;第30天血液循环开始,第49天心脏四腔室形成,但是直至出生才发育成成熟心脏。其中主要的发育事件包括心管的形成、心脏的环化、心脏的扭转、房室分隔、流出通道的形成以及传导系统和血管的发育 [10] 。
3. 先天性心脏病的分类
根据临床表型有无紫绀的特点,可分为紫绀型(cyanotic)心脏病和非紫绀型(acyanotic)心脏病 [11] 。紫绀就是指面、手足的皮肤从青紫色变成暗紫色,是由于大量含氧量少的血液流到该处所引起的症状。紫绀型心脏病是指在心脏和大血管结构异常,导致血液出现由右至左分流,常伴有肺动脉高压,临床上早期即出现“紫绀”的先心病,常见的有大血管转位(transposition of great vessels, TGV)、单心室(single ventricle)、肺动脉闭锁(pulmonary atresia, PA)和三尖瓣闭锁(tricuspid atresia, TA)等等,其中最常见分是法洛氏四联症(tetralogy of fallot, TOF)。非紫绀型心脏病包括动脉导管未闭(patent ductus ateriosus, PDA)、心室间隔缺损(ventricular septal defect, VSD)、心房间隔缺损(atrial septal defect, ASD)和大动脉缩窄(coarctation of aorta)等等。这些病当中,除ASD外,其他大多数出生后早期就被发现。严重时可出现呼吸困难、发育迟缓。但是轻型者,能像正常人一样发育成长直至成年。常见的先天性心脏病的有ASD、VSD、PDA和TOF,其中ASD和VSD的形成都是在房室分隔时候形成的,如果更早期的发育出现问题,个体就不能存活 [12] 。
4. NKX2.5简介
NKX2.5蛋白是一个重要的心脏转录因子。人类NKX2.5位于染色体5q34,编码324个氨基酸,蛋白分子量为35 kDa。NKX2.5蛋白质包含3个结构域:TN结构域(TN,氨基酸10-21),homeodomain (HD,氨基酸138~197)和NK2-specific 结构域(NK2-SD,氨基酸212-234) (见图1) [13] [14] [15] 。其中,HD结构域由3个α-螺旋组成,其中helix-3称为辨识螺旋,可利用本身和DNA的碱基形成氢键而与DNA的大沟结合,helix-1和helix-2的作用是与helix-3成90˚并位于helix-3的上方,稳定helix-3和DNA之间的结合。HD对于DNA结合、转录激活、蛋白质-蛋白质相互作用和蛋白质二聚化是必须的。NK-2的结合序列5'T(C/T)AAGTG3'序列是特异的,而且这个结合的特异性是由HD的第三个螺旋的第54位酪氨酸残基决定的。NK2-SD结构域是NK-2家族特有的区域,在体外报告基因实验中表现出抑制转录活性。目前关于TN结构域的作用不清楚 [16] 。
NKX2.5是心脏发育的早期标记物,在小鼠E7.5时期,NKX2.5就在心肌发生板的内胚层和中胚层细胞核中就开始强烈表达,胚胎时期整个心脏表达,心脏成熟后仅在心室肌处表达 [16] 。NKX2.5在心脏的形态发生、向右环化、房室特化和分隔以及功能上的成熟和工作心肌细胞核传导系统的维持中都起作用 [10] 。
5. NKX2.5突变与先天性心脏病的关系
人类NKX2.5突变引起CHD,主要表型为ASD、房室传导阻滞(atrioventricular block,AVB)、TOF和VSD等 [17] - [22] 。NKX2.5突变分布于其基因各区域,据不完全统计,已报道的与CHD相关的突变有93个,包含错义突变、无义突变、插入突变和缺失突变 [13] 。另外,NKX2.5也与心室致密化不全(noncompaction)相关 [4] 。心室致密化不全症,又称为海绵状心肌,为罕见的先天性心肌疾病,发病率为0.05%~0.24%,是由于胚胎时期疏松的心肌组织致密化过程障碍引起的一种先天畸形。其临床症状变化很大,有的没有症状,有的导致严重心脏病甚至猝死。笔者曾对一个CHD家系进行研究,疾病表型为ASD、AVB、心室致密化不全、晕厥和猝死,发现了NKX2.5杂合2 bp插入突变,位于第2号外显子,该突变导致第171位氨基酸移码,并在第175位氨基酸后终止,命名为L171RfsX5,该突变与疾病共分
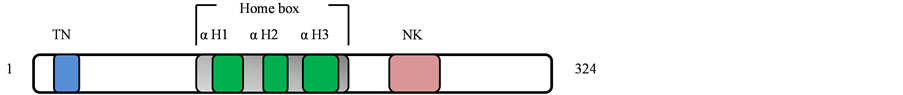
Figure 1. Schematic presentation of the structure of NKX2.5 protein
图1. NKX2.5结构示意图
离,说明了NKX2.5突变可以导致心室致密化不全 [4] 。由于遗传异质性和NKX2.5突变的表型复杂性,目前NKX2.5的基因型和表型间的关系仍不能确定。
6. NKX2.5突变导致先天性心脏病的机制
由于心脏发育的机制复杂,目前还不完全清楚NKX2.5在心脏发育中的完整信息。研究发现NKX2.5-/-的小鼠心脏环化受阻,约在E10.5时期胚胎致死,死于循环衰竭 [23] 。小鼠E12.5天时用他莫昔芬诱导的NKX2.5基因敲除,小鼠在E17.5时期死亡,E16时发现心脏心律不齐、心脏收缩缺陷和结构缺陷等疾病 [5] 。对心室肌特异性的敲除NKX2.5基因导致心脏肥大、肌节排列紊乱、心小梁过度增生的心肌致密化不全表型 [24] 。另外,NKX2.5表达的精确调控对于心脏发育十分重要。用β-MHC启动子过表达NKX2.5基因,小鼠也出现AVB和心脏结构缺陷的症状 [25] 。在转基因小鼠模型中,用亚德利亚霉素诱导心肌凋亡,过表达野生型NKX2.5蛋白的小鼠心肌凋亡数少,而过表达突变蛋白的小鼠心肌凋亡多,体外心肌培养细胞也呈现出相同的变化 [26] 。体外试验发现部分NKX2.5突变后表现出转录活性降低、核定位改变、DNA结合活性改变和蛋白-蛋白相互作用减弱等现象 [13] 。
NKX2.5参与多条信号通路调节心脏发育。一方面,NKX2.5受其他信号通路的调节,其上游信号通路主要包括WNT、BMP、FGF信号通路,其中BMP信号诱导NKX2.5的产生和随后心脏的分化。NKX2.5的表达依赖于BMP-2,BMP-4等的调控。另一方面,NKX2.5又调控其他基因的表达 [10] 。NKX2.5的下游调节基因可能包括TBX5、ANF、CARP、S100A1、ANKRD1和Cx43等 [4] [13] [27] ,这些下游基因编码重要的结构蛋白和对心肌细胞特化起重要作用的转录调控因子。
NKX2.5还可以与其他心脏转录因子作用,共同调节下游基因。研究发现NKX2.5与GATA4协同作用,调节下游基因ANF的表达 [28] 。体外实验中,过表达NKX2.5和GATA4诱导ANFp-Luc的荧光素酶活性比单独表达NKX2.5强烈 [29] 。免疫共沉淀和GST pull-down实验证实在体内和体外实验中NKX2.5和GATA4直接相互作用,NKX2.5是通过其HD结构域,GATA4是通过其锌指结构域。由于TBX5突变也导致心脏畸形,对于NKX2.5和TBX5的蛋白质-蛋白质相互作用也研究的较多,研究发现NKX2.5的HD结构域和TBX5的N端及T-box结构域直接相互作用,共同作用调控ANP和细胞缝隙蛋白Cx40的表达 [30] 。
由于NKX2.5蛋白在心脏发育中参与复杂的信号通路调节,因此作为一个转录因子,NKX2.5蛋白一级结构和三级立体结构的正确及其表达量的精确调控对心脏的发育十分重要,任何改变都可能影响其上下游信号通路的基因表达,对心脏发育造成损害从而形成CHD。
7. 研究展望
先天性心脏病的遗传学机制是复杂的,目前我们仅能解决大概三分之一的潜在分子机制。NKX2.5在心血管发育过程参与大量复杂的通路,作用重大。已有的功能研究揭示了部分NKX2.5突变对心脏发育的影响,但还需要更深入全面的研究才能真正理解NKX2.5在心脏发育异常中的作用。目前能普遍接受的观点仍是所有心脏发育中的分子表达水平降低所致,一些其他的模型,比如遗传学中的two-hit假说也逐渐的获得了重视 [2] 。强大的基因组分析技术将是解开CHD复杂性的钥匙。随着基因组关联分析和高通量测序技术的发展,有可能弄清楚CHD表型与遗传变异的对应关系。目前的研究重点是弄清楚心脏祖细胞的异常表达调控,以及miRNA在CHD中的作用 [7] 。
综上所述,通过大量的模型系统以及人类遗传学研究,我们获得了大量心脏发育所需的转录因子修饰和互作信息。这些包括NKX2.5在内的转录因子的修饰、靶标以及互作分子的变异都可能导致CHD的发生。还需要更进一步的研究才能更加明确这些因子是如何调控心脏发育,以及突变是如何影响这些转录因子的信号通路从而导致CHD的产生。
基金项目
本文受国家自然科学基金青年基金项目(81200082),广东省医学科研基金项目(B2012272)和广东医科大学博士启动基金项目(B2011019)资助。
文章引用
欧阳平,王 森,刘 浩,林梦飞,李 涛. 心脏转录因子NKX2.5与先天性心脏病的关系
The Relationship between Cardiac Transcriptional Factor NKX2.5 and Congenital Heart Disease[J]. 亚洲心脑血管病例研究, 2016, 04(04): 21-26. http://dx.doi.org/10.12677/ACRVM.2016.44004
参考文献 (References)
- 1. Torres-Cosme, J.L., Rolón-Porras, C., Aguinaga-Ríos, M., et al. (2016) Mortality from Congenital Heart Disease in Mexico: A Problem on the Rise. PloS ONE, 11, e0150422. http://dx.doi.org/10.1371/journal.pone.0150422
- 2. Chung, I.M. and Rajakumar, G. (2016) Genetics of Congenital Heart Defects: The NKX2-5 Gene, a Key Player. Genes (Basel), 7, e6. http://dx.doi.org/10.3390/genes7020006
- 3. Ouyang, P., Zhang, H., Fan, Z., et al. (2016) A R/K-Rich Motif in the C-Terminal of the Homeodomain Is Required for Complete Translocating of NKX2.5 Protein into Nucleus. Gene, 592, 276-280. http://dx.doi.org/10.1016/j.gene.2016.07.022
- 4. Ouyang, P., Saarel, E., Bai, Y., et al. (2011) A de Novo Mutation in NKX2.5 Associated with Atrial Septal Defects, Ventricular Noncompaction, Syncope and Sudden Death. Clinica Chimica Acta, 412, 170-175. http://dx.doi.org/10.1016/j.cca.2010.09.035
- 5. Akazawa, H. and Komuro, I. (2005) Cardiac Transcription Factor Csx/Nkx2-5: Its Role in Cardiac Development and Diseases. Pharmacology & Therapeutics, 107, 252-268. http://dx.doi.org/10.1016/j.pharmthera.2005.03.005
- 6. Baban, A., Postma, A.V., Marini, M., et al. (2014) Identification of TBX5 Mutations in a Series of 94 Patients with Tetralogy of Fallot. American Journal of Medical Genetics Part A, 164A, 3100-3107. http://dx.doi.org/10.1002/ajmg.a.36783
- 7. Hirayama-Yamada, K., Kamisago, M., Akimoto, K., et al. (2005) Phenotypes with GATA4 or NKX2.5 Mutations in Familial Atrial Septal Defect. American Journal of Medical Genetics Part A, 135, 47-52. http://dx.doi.org/10.1002/ajmg.a.30684
- 8. McCulley, D.J. and Black, B.L. (2012) Transcription Factor Pathways and Congenital Heart Disease. Current Topics in Developmental Biology, 100, 253-277. http://dx.doi.org/10.1016/B978-0-12-387786-4.00008-7
- 9. Akazawa, H. (2015) Mechanisms of Cardiovascular Homeostasis and Pathophysiology—From Gene Expression, Signal Transduction to Cellular Communication. Circulation Journal, 79, 2529-2536. http://dx.doi.org/10.1253/circj.CJ-15-0818
- 10. 吴秀山. 心脏发育概论[M]. 北京: 科学出版社, 2006: 322-323.
- 11. Bhat, V., Belaval, V., Gadabanahalli, K., Raj, V. and Shah, S. (2016) Illustrated Imaging Essay on Congenital Heart Diseases: Multimodality Approach part III: Cyanotic Heart Diseases and Complex Congenital Anomalies. Journal of Clinical and Diagnostic Research, 10, TE01-TE10. http://dx.doi.org/10.7860/jcdr/2016/21443.8210
- 12. Talwar, S., Kumar, M.V., Sreenivas, V., et al. (2016) Factors Determining Outcomes in Grown Up Patients Operated for Congenital Heart Diseases. Annals of Pediatric Cardiology, 9, 222-228. http://dx.doi.org/10.4103/0974-2069.189113
- 13. Ouyang, P., Liu, Y., Huang, Z., et al. (2015) Readthrough on Transcription Factor NKX2.5 Premature Stop Codon by tRNA Suppressors. Hereditas, 37, 367-373.
- 14. Schott, J.J., Benson, D.W., Basson, C.T., et al. (1998) Congenital Heart Disease Caused by Mutations in the Transcription Factor NKX2-5. Science, 281, 108-111. http://dx.doi.org/10.1126/science.281.5373.108
- 15. Draus, J.M., Hauck, M.A., Goetsch, M., et al. (2009) Investigation of Somatic NKX2-5 Mutations in Congenital Heart Disease. Journal of Medical Genetics, 46, 115-122. http://dx.doi.org/10.1136/jmg.2008.060277
- 16. Harvey, R.P. (1996) NK-2 Homeobox Genes and Heart Development. Developmental Biology, 178, 203-216. http://dx.doi.org/10.1006/dbio.1996.0212
- 17. Zhou, M., Liao, Y. and Tu, X. (2015) The Role of Transcription Factors in Atrial Fibrillation. Journal of Thoracic Disease, 7, 152-158.
- 18. Ellesoe, S.G., Johansen, M.M., Bjerre, J.V., et al. (2016) Familial Atrial Septal Defect and Sudden Cardiac Death: Identification of a Novel NKX2-5 Mutation and a Review of the Literature. Congenital Heart Disease, 11, 283-290. http://dx.doi.org/10.1111/chd.12317
- 19. Tong, Y.F. (2016) Mutations of NKX2.5 and GATA4 Genes in the Development of Congenital Heart Disease. Gene, 588, 86-94. http://dx.doi.org/10.1016/j.gene.2016.04.061
- 20. Pabst, S., Wollnik, B., Rohmann, E., et al. (2008) A Novel Stop Mutation Truncating Critical Regions of the Cardiac Transcription Factor NKX2-5 in a Large Family with Autosomal-Dominant Inherited Congenital Heart Disease. Clinical Research in Cardiology, 97, 39-42. http://dx.doi.org/10.1007/s00392-007-0574-0
- 21. Gutierrez-Roelens, I., Roy, L.D., Ovaert, C., et al. (2006) A Novel CSX/NKX2-5 Mutation Causes Autosomal-Domi- nant AV Block: Are Atrial Fibrillation and Syncopes Part of the Phenotype? European Journal of Human Genetics, 14, 1313-1316. http://dx.doi.org/10.1038/sj.ejhg.5201702
- 22. Dentice, M., Cordeddu, V., Rosica, A., et al. (2006) Missense Mutation in the Transcription Factor NKX2-5: A Novel Molecular Event in the Pathogenesis of Thyroid Dysgenesis. Journal of Clinical Endocrinology & Metabolism, 91, 1428-1433. http://dx.doi.org/10.1210/jc.2005-1350
- 23. Lyons, I., Parsons, L.M., Hartley, L., et al. (1995) Myogenic and Morphogenetic Defects in the Heart Tubes of Murine Embryos Lacking the Homeo Box Gene NKX2-5. Genes & Development, 9, 1654-1666. http://dx.doi.org/10.1101/gad.9.13.1654
- 24. Pashmforoush, M., Lu, J.T., Chen, H., et al. (2004) NKX2-5 Pathways and Congenital Heart Disease: Loss of Ventricular Myocyte Lineage Specification Leads to Progressive Cardiomyopathy and Complete Heart Block. Cell, 117, 373- 386. http://dx.doi.org/10.1016/S0092-8674(04)00405-2
- 25. Kasahara, H., Ueyama, T., Wakimoto, H., et al. (2003) NKX2.5 Homeoprotein Regulates Expression of Gap Junction Protein Connexin 43 and Sarcomere Organization in Postnatal Cardiomyocytes. Journal of Molecular and Cellular Cardiology, 35, 243-256. http://dx.doi.org/10.1016/S0022-2828(03)00002-6
- 26. Toko, H., Zhu, W., Takimoto, E., et al. (2002) Csx/NKX2-5 Is Required for Homeostasis and Survival of Cardiac Myocytes in the Adult Heart. Journal of Biological Chemistry, 277, 24735-24743. http://dx.doi.org/10.1074/jbc.M107669200
- 27. D’Amico, M.A., Ghinassi, B., Izzicupo, P., et al. (2016) IL-6 Activates PI3K and PKCζ Signaling and Determines Cardiac Differentiation in Rat Embryonic H9c2 Cells. Journal of Cellular Physiology, 231, 576-586. http://dx.doi.org/10.1002/jcp.25101
- 28. Chen, M., Bi, L.-L., Wang, Z.-Q., et al. (2013) Time-Dependent Regulation of Neuregulin-1β/ErbB/ERK Pathways in Cardiac Differentiation of Mouse Embryonic Stem Cells. Molecular and Cellular Biochemistry, 380, 67-72. http://dx.doi.org/10.1007/s11010-013-1658-y
- 29. Shiojima, I., Komuro, I., Oka, T., et al. (1999) Context-Dependent Transcriptional Cooperation Mediated by Cardiac Transcription Factors Csx/NKX-2.5 and GATA-4. Journal of Biological Chemistry, 274, 8231-8239. http://dx.doi.org/10.1074/jbc.274.12.8231
- 30. Mauritz, C., Schwanke, K., Reppel, M., et al. (2008) Generation of Functional Murine Cardiac Myocytes from Induced Pluripotent Stem Cells. Circulation, 118, 507-517. http://dx.doi.org/10.1161/CIRCULATIONAHA.108.778795