Advances in Microbiology
Vol.04 No.04(2015), Article ID:16490,7
pages
10.12677/AMB.2015.44008
The Study of Screening and Antagonism for Potato Late Blight Biocontrol
Xu Cao1,2,3, Yushuai Liu1,2,3, Jingyu Chen2,3, Shumei Zhang1,2,3, Liqiang Meng1,2,3, Jihua Hu2,3, Wei Jiang1,2,3, Jing Li1,2,3*
1Institute of Microbiology of Heilongjiang Academy of Sciences, Harbin Heilongjiang
2Heilongjiang Key Lab of Biological Engineering, Harbin Heilongjiang
3Institute of High Technology, Heilongjiang Academy of Sciences, Harbin Heilongjiang
Received: Nov. 20th, 2015; accepted: Dec. 6th, 2015; published: Dec. 9th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Aim: To screen biocontrol strains that with better control effect on potato late blight and then study the biocontrol strains antagonistic effect. Methods: Screening of biocontrol bacteria cultured by plate confrontation inhibition, the mechanism of antagonism was preliminarily explored by using gradient dilution method and co-culture method. Results: Screening 2 strains which had inhibitory effect on potato late blight pathogen biocontrol strains of PB12 and CZS, the antibacterial test showed that the inhibition rate of PB12 and CZS was 98%; and the change of biocontrol dilution degree in liquid culture had little effect on the antibacterial effect, while decreased slightly in the solid medium. Conclusion: We screen 2 strains with strong antagonistic effect on potato late blight pathogen biocontrol strains of PB12 and CZS, and achieve the antibacterial effect by inhibiting the growth of pathogenic bacteria.
Keywords:Potato Late Blight, Biocontrol Fungus, Screening

马铃薯晚疫病生防菌株的筛选及其拮抗作用的研究
曹旭1,2,3,刘宇帅1,2,3,陈静宇2,3,张淑梅1,2,3,孟利强1,2,3,胡基华2,3,姜威1,2,3,李晶1,2,3*
1黑龙江省科学院微生物研究所,黑龙江 哈尔滨
2黑龙江省生物工程重点实验室,黑龙江 哈尔滨
3黑龙江省科学院高技术研究院,黑龙江 哈尔滨

收稿日期:2015年11月20日;录用日期:2015年12月6日;发布日期:2015年12月9日

摘 要
目的:筛选获得对马铃薯晚疫病具有较好防治作用的生防菌株,并对其拮抗作用进行研究。方法:利用平板抑菌对峙培养法筛选生防菌,并采用梯度稀释法及共培养的方法对拮抗作用机制进行初步探索。结果:筛选出2株对马铃薯晚疫病菌具有抑制作用的生防菌株PB12、CZS;通过抑菌试验表明,菌株PB12和CZS的抑菌率可达98%,在液体培养时生防菌液稀释度的变化对抑菌效果没有明显影响,在固体培养时随着生防菌液稀释度的增加抑菌能力稍有下降。结论:筛选出2株对马铃薯晚疫病菌具有较强拮抗作用的生防菌株PB12和CZS,并通过抑制病原菌菌丝的生长达到抑菌效果。
关键词 :马铃薯晚疫病,生防菌,筛选

1. 引言
近年来马铃薯产业迅猛发展,种植面积不断扩大。目前我国正推进马铃薯主粮化发展战略,力争通过几年的努力,形成马铃薯与谷物协调发展的新格局,使其逐渐成为第四大主粮作物。但是由于生产者对于提供无病种薯的观念不强,常将非种薯做种薯应用,品种引进和调运过程中忽视检疫把关;有的种薯种植生产地区,忽视轮作倒茬;在种植过程中对病害的防治措施落实不认真等原因致使马铃薯病害日趋严重,马铃薯晚疫病就是其中之一,不仅发病普遍,危害程度也越来越重,影响了品质,已成为马铃薯产业发展的一大障碍[1] 。
晚疫病是由致病疫霉菌[Phytophtora infestans (Mont.) de Bary]引起的一种真菌病害,对马铃薯是毁灭性的真菌病害,可导致马铃薯茎叶死亡和块茎腐烂、造成植株提早枯死、从而降低产量,制约马铃薯生产,对加工型品种尤其危害更为严重 [2] 。在晚疫病流行年间,块茎可在贮藏期间可引起腐烂,给产业化生产马铃薯带来巨大的经济损失。据国际马铃薯中心统计,1996年全球每年因此病造成的直接经济损失达到170亿美元 [3] 。在我国,马铃薯生产也一直受到晚疫病的危害,尤其在50年代至60年代初,华北、东北和西北曾经多次发生晚疫病大流行,使马铃薯生产损失过半 [4] 。而我省每年7~8月正处于马铃薯生长结薯期,雨量充沛,气温适宜最适合晚疫病的发生和流行,因此马铃薯晚疫病作为黑龙江省马铃薯生产的主要病害之一,每年都有不同程度的发生和流行,在一般年份减产20%左右,发生重的年份减产50%以上,甚至绝产,因此,晚疫病已成为近年来黑龙江省马铃薯产业发展的制约因素 [1] 。
马铃薯晚疫病的传统防治方法主要有农业防治和化学防治。近年来,由于传统的农业防治方法不能从根本上控制病害的发生,防治效果往往不稳定;而化学农药的长期使用会使病原菌产生抗药性,过量使用农药还会破坏土壤的微生态环境,加重农药对环境的污染,造成有毒有害物质在农作物体内过多残留。因此,生物防治的方法研究越来越受到人们重视,利用微生物之间的拮抗作用,选择对农作物不造成危害的微生物来抑制病原菌的生长 [5] [6] 。为此笔者对马铃薯晚疫病害的生防菌进行筛选,并对筛选出菌株的拮抗作用机制进行初步研究。
2. 材料与方法
2.1. 材料
菌株:马铃薯晚疫病菌由黑龙江省农业科学院植物脱毒苗木研究所提供,供实验筛选所用生防细菌均为黑龙江省生物工程重点实验室筛选保藏。
培养基:NYD培养基(牛肉浸膏8 g,酵母膏5 g,葡萄糖10 g,蒸馏水1000 mL,pH 7.2~7.5);黑麦液体培养基(黑麦100 g,蔗糖15 g,碳酸钙1.4 g,蒸馏水1000 mL,pH自然)。
2.2. 生防菌株的筛选
2.2.1. 生防菌株的初筛
将实验室现有保藏的生防细菌菌株(CZS、LKS、WHS、PB12、B10、CZL、ZH2、B29、JK)挑取单菌落分别接于5 ml NYD试管中,于35℃、170 r/min振荡器中培养18 h待用。将保存在斜面上的马铃薯晚疫病菌接于黑麦培养基平板置于18℃培养箱中进行培养至菌丝长满培养皿。在黑麦培养基平板上划十字线分出4个区域,每个区域中心分别接入直径为8 mm的靶标病原菌菌饼,同时在平板十字线上划入待测生防菌液,设无生防菌液为对照,重复4次,于18℃培养,当对照真菌长至十字线位置时观察处理组抑菌效果。
2.2.2. 生防菌株的复筛
经过初次抑菌实验获得7株具有拮抗作用的细菌,采用与初筛同样的方法继续进行复筛,当对照真菌长至十字线位置时观察处理组抑菌效果。测量抑菌带宽,计算抑菌率。将抑菌效果大于50%的生防菌,进行纯化保藏。
抑菌率(%) = (对照菌丝直径 − 处理菌丝直径)/对照菌丝直径 × 100%。
2.3. 生防菌株的拮抗作用
将具有较强拮抗效果的两株生防细菌挑取单菌落分别接于5 ml NYD试管中,于30℃、150 r/min振荡器中培养24 h。再以2%的接种量分别接种于50 ml NYD三角瓶中,于30℃、150 r/min振荡器中培养45 h待用。
将保存的马铃薯晚疫病菌接于黑麦培养基平板置于18℃培养箱中进行培养,待菌丝长满培养皿。
2.3.1. 液体培养条件下的拮抗作用
将两株生防细菌分别进行梯度稀释(10倍、100倍),然后在50 ml的黑麦液体培养瓶中以3%的接种量分别加入各浓度的菌液1 ml (包括细菌原液及各稀释度菌液)。再于每瓶中分别接入直径为8 mm的靶标病原菌菌饼,设未接种生防菌液的为对照,重复3次,于26℃恒温摇床培养。每天对真菌生长情况进行观察,到第4 d停止培养,此时对照组真菌生长量明显多于实验组。将菌丝过滤,置于阴凉干燥处晾干后称其干重,并计算抑菌率。
抑菌率(%) = (对照菌丝重量 − 处理菌丝重量)/对照菌丝重量 × 100%。
2.3.2. 固体培养条件下的拮抗作用
将两株生防细菌分别进行梯度稀释(10倍、100倍),然后在黑麦培养基平板上均匀涂满各浓度的菌液100 µl (包括细菌原液及各稀释度菌液)。晾干后每平板分别接入直径为8 mm的靶标病原菌菌饼,设未涂生防菌液的为对照,重复3次,于18℃培养箱中培养。每天对真菌生长情况进行观察,测量菌丝直径,并计算抑菌率。
抑菌率(%) = (对照菌丝直径 − 处理菌丝直径)/对照菌丝直径 × 100%。
3. 结果与分析
3.1. 马铃薯晚疫病害生防菌的筛选
通过平板抑菌对峙实验,对实验室现有生防菌株的抑菌能力进行测定,筛选出7株抑菌能力不同的细菌。其中菌株PB12和菌株CZS抑菌效果较明显,通过对抑菌带宽度的测量表明这两株生防菌株的抑菌率大于70% (表1)。
3.2. 菌株PB12、CZS对晚疫病菌的拮抗作用
3.2.1. 液体培养条件下的拮抗作用
通过共培养的方法对菌株PB12、CZS的拮抗作用进行测定,结果表明在液体培养条件下,对照组中丝核菌菌丝迅速生长成团块,而加有生防菌株的培养瓶内菌丝生长缓慢。第4 d时停止培养,将各组菌丝进行过滤、晾干、称重。结果如图1所示,对照组菌丝团块明显大于各实验组菌丝团块,同时随着稀释度的增加,实验组团块的大小没有明显变化。通过计算各组菌丝团块的重量表明,菌株PB12和CZS均能够抑制马铃薯晚疫病菌菌丝的生长,抑菌率达到98%。不同浓度的生防菌液(原液、稀释10倍和100倍)对抑菌效果影响不大(表2)。
3.2.2. 固体培养条件下的拮抗作用
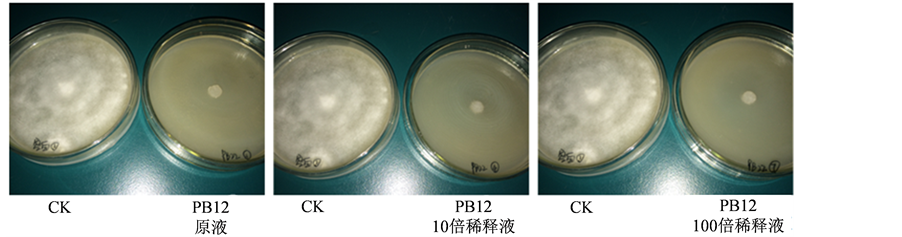
通过平板抑菌实验对菌株PB12、CZS的拮抗作用进行测定,结果表明在固体培养条件下,对照组中晚疫病菌菌丝逐渐生长且菌丝致密、健壮,而涂有生防菌株的培养皿内菌丝生长缓慢,当培养第八天时对照组菌丝长满整个平板,实验组各菌丝稀疏,长势明显弱于对照组,在培养中后期几乎不再生长(图2)。通过对菌丝直径计算表明菌株PB12和CZS对马铃薯晚疫病菌的抑菌率虽然没有液体条件下的抑菌率高,但几乎可达到90%以上,且随着培养时间的延长抑菌能力逐渐升高,其中菌株PB12的抑菌率可达到90.96%。不同浓度的生防菌液(原液、稀释10倍和100倍)对抑菌效果存在影响,随着稀释度的增加抑菌能力发生下降(表3)。
Table 1. All strains of potato late blight control effect
表1. 各供试菌株对晚疫病菌的防治效果
Table 2. Antagonistic effect of biocontrol strain PB12 and CZS to potato late blight when liquid culture
表2. 液体培养条件下晚疫病菌对生防菌株PB12与CZS的拮抗效果
Table 3. Antagonistic effect of biocontrol strain PB12 and CZS to potato late blight when solid culture
表3. 固体培养条件下晚疫病菌对生防菌株PB12与CZS的拮抗效果
 (a)
(a) (b)注:(a) 菌株PB12拮抗作用后的菌丝;(b) 菌株CZS拮抗作用后的菌丝
(b)注:(a) 菌株PB12拮抗作用后的菌丝;(b) 菌株CZS拮抗作用后的菌丝
Figure 1. Antagonism strains PB12 and CZS when liquid culture
图1. 液体培养时PB12与CZS菌株的拮抗作用
 (a)
(a)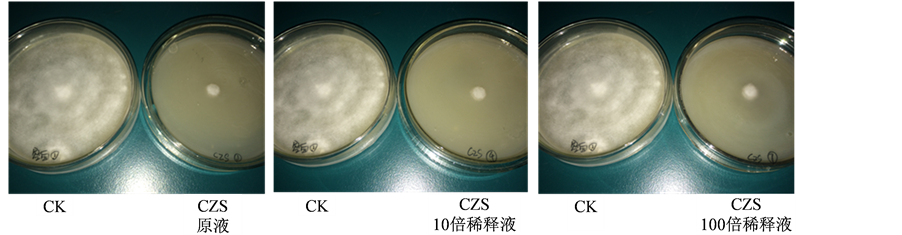 (b)注:(a) 菌株PB12的拮抗作用;(b) 菌株CZS的拮抗作用。
(b)注:(a) 菌株PB12的拮抗作用;(b) 菌株CZS的拮抗作用。
Figure 2. Antagonism strains PB12 and CZS when solid culture
图2. 固体培养时PB12与CZS菌株的拮抗作用
4. 讨论
本研究筛选出2株对马铃薯晚疫病菌抑菌率达98%的生防菌株PB12和CZS,通过抑菌试验表明,无论在液体还是固体培养条件下,菌株PB12和CZS对马铃薯晚疫病菌的拮抗作用都十分稳定,在液体培养时生防菌液稀释度的变化对抑菌效果没有明显影响,在固体培养时随着生防菌液稀释度的增加抑菌能力稍有下降,同时这两株生防菌均可以抑制丝核病菌菌核的形成,削弱丝核菌抵御外界不良环境的能力。
利用微生物之间的拮抗作用防治植物病害国内外已有较多的研究 [7] - [16] ,但目前国内对于马铃薯晚疫病害的报道多集中于病原菌的生物学特性、传播以及化学防治方面,对于该病原菌的生物防治报道很少。植物病害的防治受植物、病原物、拮抗菌、环境条件等多方面因素的影响 [8] 。有研究显示,病原菌晚疫病菌是一种全世界大量农作物和野生寄主的病原物,当该病菌侵染到马铃薯上,随着土壤湿度增大,新薯块上的菌核形成会加重。新块茎上形成的菌核,或在土壤里越冬的菌核,下一年根据环境条件,又可发生侵染。由此给防治带来很大困难 [3] 。
本研究筛选到的生防菌株PB12和CZS对马铃薯丝核病菌具有较强的拮抗作用,对病原菌菌丝存在抑制作用,更重要的是能够显著抑制马铃薯晚疫病菌菌核的形成,表现出防治菌核病的潜力,提高马铃薯产量及品质,具有进一步研究的价值。同时,针对这两株生防菌的抗菌机理、在马铃薯活体上是否具有相同的拮抗作用以及田间防效等内容将在后续研究中进行。
基金项目
“十二五”农村领域国家科技支撑课题。东北地区马铃薯标准化、机械化生产技术集成。项目编号2012BAD06B02。
文章引用
曹 旭,刘宇帅,陈静宇,张淑梅,孟利强,胡基华,姜 威,李 晶. 马铃薯晚疫病生防菌株的筛选及其拮抗作用的研究
The Study of Screening and Antagonism for Potato Late Blight Biocontrol[J]. 微生物前沿, 2015, 04(04): 55-61. http://dx.doi.org/10.12677/AMB.2015.44008
参考文献 (References)
- 1. Suwannarach, N., Kumla, J., Bussaban, B., et al. (2012) Biocontrol of Rhizoctoniasolani AG-2, the Causal Agent of Damping-Off by Muscodor cinnamomi CMU-Cib 461. World Journal of Microbiology & Biotechnology, 28, 3171- 3177. http://dx.doi.org/10.1007/s11274-012-1127-x
- 2. Hietala, A., Sen, M.R. and Lilja, A. (1994) Anamorphic and Teleomorphic Characteristics of a Uninucleate Rhizoctonia sp. Isolated from the Roots of Nursery Grown Conifer Seedlings. Mycological Research, 98, 1044-1050. http://dx.doi.org/10.1016/S0953-7562(09)80431-0
- 3. 王树桐, 曹克强, 胡同乐, 等. 知母提取物对马铃薯晚疫病菌的抑制作用及防病效果[J]. 植物病理学报, 2006(3): 267-272.
- 4. 郭梅, 闵凡祥, 王晓丹, 等. 生物源农药防治马铃薯晚疫病研究进展[J]. 中国马铃薯, 2007(4): 227-230.
- 5. 从心黎, 杨明挚, 李灿辉, 等. 拟青霉菌发酵液浓缩物对马铃薯晚疫病菌的离体抑制活性[J]. 西南农业学报, 2005(2): 153-156.
- 6. 周淑敏, 李晓云, 鲁丽. 枯草芽孢杆菌BS224菌株抑菌作用的初步研究[J]. 黑龙江医药, 2003(3): 205-206.
- 7. Whipps, J.M. (2003) Microbial Interactions and Biocontol in the Rhizosphere. Journal of Experimental Botany, 56, 487-451.
- 8. 冯金龙. 马铃薯病原真菌拮抗细菌鉴定及其生物学功能研究[D]. 兰州: 甘肃农业大学, 2013.
- 9. 王险峰, 辛明远, 张忠敏. 马铃薯晚疫病防治技术新进展[J]. 现代化农业, 2011(1): 20-22.
- 10. Lumsden, R.D. and Dow, R.L. (1937) Histopathology of Sclerotinia sclerotiorum Infection of Bean. Phytopathology, 63, 708-715.
- 11. Wang, S.T., Hu, T.L., Jiao, Y.L., et al. (2009) Isolation and Characterization of Bacillus subtilis EB-28, an Endophytic Bacterium Strain Displaying Biocontrol Activity against Botrytis cinerea Pers. Frontiers of Agriculture in China, 3, 247-252.
- 12. 林双喜, 丁志宽, 薛根祥, 等. 大棚马铃薯菌核病的发生与综合防治[J]. 长江蔬菜, 2004(3): 28.
- 13. 何迎春, 高必达. 立枯丝核菌的生物防治[J]. 中国生物防治, 2000(1): 31-34.
- 14. 李颖, 虞秀兰, 熊咏. 马铃薯晚疫病药剂防效初报[J]. 耕作与栽培, 2003(3): 59.
- 15. 郭志乾, 董风林, 马春花. 西吉县马铃薯病虫害调查及发病原因分析[J]. 中国马铃薯, 2001(1): 60-61.
- 16. 魏周全, 张廷义, 杜玺. 马铃薯块茎干腐病发生危害及防治[J]. 植物保护, 2006(2): 103-105.
*通讯作者。
