Advances in Microbiology
Vol.05 No.02(2016), Article ID:17766,10
pages
10.12677/AMB.2016.52002
Activity Analysis and Antibiotics Biosynthesis Potential Screening of an Endophytic Actinomycetes from Chenopodium album L.
Longzhan Gan, Xing Wang, Yang Liu, Yongqiang Tian*
Key Laboratory of Leather Chemistry and Engineering, Ministry of Education, College of Light Industry, Textile and Food Engineering, Sichuan University, Chengdu Sichuan

Received: May 18th, 2016; accepted: Jun. 6th, 2016; published: Jun. 9th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
An endophytic actinomycetes strain LCB-A236 isolated from medicinal plant Chenopodium album L. was identified systematically. The strain produced spiral sporotrichial and ellipsoidal spores according to microscopic observation. On the basis of morphological, physiological and biochemical characteristics, the strain was identified as a member of genus Streptomyces. Phylogenetic analysis indicated that the strain exhibited the highest similarity (99.71%) to Streptomyces violaceorubidus LMG 20319T (AJ781374). We confirmed it as Streptomyces sp. According to the results of activity measurements by plate method, SRB bacteriostasis and Lilian Sauma et al.’s test model of activation rate, it previously described that the strain demonstrated strong anticancer, antidiabetes activities and medium antimicrobial activity. PCR screening for the genes of five kinds of antibiotic synthetase showed that the strain possessed the genes of polyketides synthetase I, polypeptide synthetase II, and non-ribosome polypeptide synthetase simultaneously.
Keywords:Chenopodium album L., Endophytic Actinomycetes, Identification, Activity, Antibiotics Synthetase Genes

一株藜内生放线菌的活性分析及抗生素生物 合成潜力的筛查
甘龙站,王 幸,刘 杨,田永强*
四川大学轻纺与食品学院,皮革化学与工程教育部重点实验室,四川 成都

收稿日期:2016年5月18日;录用日期:2016年6月6日;发布日期:2016年6月9日

摘 要
对一株分离自药用植物藜的内生放线菌LCB-A236进行系统学鉴定。电镜扫描后观察到螺旋状的孢子丝和椭球形的孢子,通过其形态和生理生化特征初步确定为链霉菌。分子鉴定和系统发育分析结果显示,其与Streptomyces violaceorubidus LMG 20319T (AJ781374)进化地位最接近,相似度为99.71%,确定为Streptomyces sp.。通过平板法、SRB法和Lilian Sauma等人的激动率测试模型进行抗菌、抗癌及抗糖尿病活性测试,结果显示出较强的抗癌及抗糖尿病活性和中等的抗菌活性。菌株的5类抗生素合成酶基因PCR扩增筛查结果表明,该菌株含有I-型聚酮合成酶、II-型聚酮合成酶和非核糖体多肽合成酶的基因。
关键词 :藜,内生放线菌,鉴定,活性,抗生素合成酶基因

1. 引言
植物内生放线菌是指那些在其生活史的一定阶段或全部阶段存活于健康植物组织内部,而又不引发宿主植物表现出明显感染症状的放线菌 [1] 。研究资料表明,植物内生放线菌能产生一系列有生物活性的次级代谢物,如抗生素、抗肿瘤和抗感染药物、植物生长促进剂和酶 [2] 。随着大量内生放线菌新种的不断发现,从中寻找新型药物生物活性化合物显现出巨大潜力。Ezra等从龟背竹属植物中分离到1株能产生多肽类抗生素coronamycin的链霉菌属放线菌,对多种病原真菌均有抑制作用,特别是对腐霉菌表现出强烈的拮抗活性,可作为新一代杀真菌药物的候选菌株 [3] 。此外,Igarashi等从1株植物内生小单孢菌属新种的发酵液中成功分到两种新的蒽醌类化合物,对多种肿瘤细胞表现出了明显的拮抗活性 [4] 。从微生物基因组的角度出发,筛查抗生素生物合成酶基因,可以极大的减少候选菌株的筛选量;而且具有活性的抗生素合成酶基因的候选菌株,其产物结构类型可以作大致推测,便于进一步分离解析 [5] 。植物内生放线菌是一类开发程度相对较低的微生物资源,因此对植物内生放线菌的研究具有潜在的价值。本研究对1株分离自药用植物藜的内生放线菌LCB-A236进行鉴定及活性分析,初步考察此株内生放线菌的形态特征、生理生化特性及药用价值,以期为植物内生放线菌资源的开发与利用提供方法和理论参考。
2. 材料与方法
2.1. 材料
2.1.1. 实验材料
藜的根部组织由本实验室采自四川峨眉山。
2.1.2. 供试菌株
抗菌活性测试菌株:肺炎克雷伯氏菌(Klebsiella pneumoniae)、铜绿假单孢菌(Pseudomonas aeruginosa)、金黄色葡萄球菌(Staphylococcus aureus)、表皮葡萄球菌(Staphylococcus epidermidis)、枯草芽胞杆菌(Bacillus subtilis)、白色念珠菌(Candida albicans)、黑曲霉(Aspergillus niger),由四川抗菌素工业研究所微生物菌种资源中心提供。抗癌活性测试细胞株:人肝癌细胞株HepG2,由成都地奥集团药物筛选中心提供。抗糖尿病活性测试细胞株:稳定共转染pPPRE-Luc (PPAR反应元件萤火虫荧光素酶报告基因质粒)和phRL-TK (Renilla荧光素酶报告基因质粒)的HepG2细胞,由成都地奥集团药物研究所提供。
2.1.3. 主要培养基
抗菌测试培养基:LB用于抗细菌测试,PDA用于抗真菌测试;细胞培养培养基:低糖DEME培养基+10%小牛血清。
2.1.4. 主要试剂
PCR试剂购于北京天根生化科技有限公司;细菌DNA提取试剂盒及通用引物购于上海生工生物工程技术服务有限公司。
2.2. 方法
2.2.1. 内生放线菌的分离纯化
采用QIU Peng等的方法 [6] 。新鲜的藜根部组织,用大量清水洗净,70%EtOH浸泡1 min,10%NaClO浸泡6 min,再用无菌水反复漂洗4~6次,在无菌条件下用手术刀将其切成3~5 mm的小块,植入ISP-3平板中,置于28℃恒温培养7 d,用无菌竹签挑取单菌落,重新划线接种于ISP-3琼脂培养基中,经多次纯化后转接于斜面,置于4℃保存备用。
2.2.2. 菌落培养特征
将菌株LCB-A236划线接种于胰胨酵母琼脂、ISP-2、燕麦粉琼脂-1、无机盐淀粉琼脂、高氏合成一号琼脂、酵母-麦芽浸膏琼脂、酵母膏-葡萄糖琼脂、甘油-天门冬酰胺琼脂、PDA琼脂、葡萄糖-天门冬酰胺琼脂等10种鉴定培养基上,置于28℃恒温培养4~10 d,观察并记录生长情况,对照美国ISCC-NBS标准色卡分别记录气生菌丝、基内菌丝和可溶性色素的有无及其颜色。
2.2.3. 扫描电镜观察
采用插片法制备电镜样品。将菌株LCB-A236接种并插片于燕麦粉琼脂培养基上,于28℃下恒温培养7~14 d,取出插片并送样于四川大学分析测试中心。
2.2.4. 生理生化特性分析
对菌株LCBA236的生长温度、pH范围、NaCl耐受性、碳源利用、氮源利用、淀粉水解、牛奶凝固、黑色素产生、纤维素分解、硝酸盐还原、明胶液化、酯酶分解、甲基红实验、硫化氢产生等生理生化实验进行了考察,具体方法参照文献 [7] 。
2.2.5. 菌株发酵及产物抽提
将菌株LCB-A236接种于LB液体发酵培养基中,于28℃、200 r/min震荡培养7 d。用等体积甲醇震荡提取发酵液,离心移取有机相,采用旋转蒸发减压浓缩后转移至EP管中进行冷冻干燥至干品,置于−20℃保存备用。
2.2.6. 抑菌活性测试
抑菌活性测试采用平板法测定 [7] 。称取适量样品,以DMSO溶解,配制成100 mg/mL的使用液,再用超纯水依次梯度稀释得100 μg/mL的测定液。培养基制备先以水–琼脂作为下层,预先制备;再以LB、PDA培养基作为上层,将其灭菌后冷却至45℃左右,再将预先配制好的细菌、真菌孢子悬液分别以适量充分混入LB、PDA培养基中;待培养基凝固后等距放入滤纸片,取样品测试液10 μL滴于滤纸片上;LB、PDA平板分别置于37℃、28℃培养3d、7d,观察有无抑菌圈产生并测量记录其平均直径。
2.2.7. 抗癌活性测试
抗癌活性测试采用SBR法 [8] 。将人肝癌HepG2细胞接种于96孔板,培养12 h后,分别制备加样对照、不加样品对照和加药前对照。加药前对照的细胞毒每孔加入30 μL 50% TCA固定,于4℃放置60 min后,弃固定液,用蒸馏水洗涤5次,自然晾干备用,加样对照和不加样品对照的细胞继续培养48 h后再固定。所有固定好的细胞以0.4% SRB染液室温下染色20 min,游离的染料用1%醋酸溶液漂洗4遍以除去。空气干燥后按200 μL/孔加入10 mmol/L Tris-base,以振荡溶解蛋白结合染料,混匀后于490 nm测定OD值。根据OD值计算生长率GR,再用GR值判断样品的抗癌活性强度。
2.2.8. 抗糖尿病活性测试
采用成都地奥集团药物研究所提供的高通量筛选模型筛查样品对II型糖尿病的活性,其PPAR-γ转录激活系统的筛选模型依据Lilian Sauma等 [9] 的激动率测试模型。将含有PPRE报告基因的质粒和表达PPAR-γ的质粒共转染到细胞中,同时向转染细胞中加入罗格列酮阳性对照作为阳性对照,再通过化学发光法来检测报告基因表达产物的变化,从而建立基于PPAR-γ信号通路的筛选模型,并利用其进行高通量筛选。
2.2.9. 16S rRNA基因测序及系统发育分析
按文献 [10] 中所述的快速提取法抽提目的菌株基因组DNA。PCR扩增LCB-A236的16S rRNA基因序列,选择细菌通用引物。
27F(PA): 5’-AGAGTTTGATCCTGGCTCAG-3’, 1492R(PB): 5’-TACGGCTACCTTGTTACGACTT-3’。25 μL PCR反应体系包括:14 μL dd H2O ,2.5 μL 10 × Taq酶缓冲液,1 μL DNA模板,2.5 μL 25 mmol/L MgCl2,2.5 μL 10 μmol/L引物,0.75 μL 2.5 mmol/L dNTP,0.25 μL 2.5 U/μL Taq酶。扩增条件为94℃预变性3 min,94℃变性30 s,55℃退火30s;72℃延伸1.5 min,循环30次,最后72℃延伸10 min。反应结束后取出电泳检查,合格PCR产物送上海生工生物工程股份有限公司进行双向测序。根据测序结果,将菌株的16S rRNA基因序列提交至EzBioCloud (http://www.ezbiocloud.net/)中的EzTaxon在线比对服务进行相关标准菌株的相似性搜索,确定菌株的分类学地位,并调出相关模式菌种的16S rRNA基因序列,采用Clustal W进行序列比对,并通过软件MEGA5.2以 N-J法构建系统发育树。
2.2.10. 抗生素合成酶基因的PCR筛查
PCR扩增筛查5类抗生素合成关键酶的基因,具体方法依据文献 [11] - [13] 。I型聚酮合成酶(PKS-I)、非核糖体多肽合成酶(NRPS)和II型聚酮合成酶(PKS-II)的基因分别使用引物对K1F/M6R、A3F/A7R、ARO-PKS-F/ARO-PKS-R;安莎类抗生素关键酶3,5-AHBA合酶基因rifK(ANSA)和糖肽类抗生素合成关键酶P450单加氧酶基因(oxyB)分别使用引物对ANSA-F/ANSA-R和Foxy/Roxy。所用引物及其扩增片段见表1。
3. 结果与分析
3.1. 内生放线菌的分离
从藜根部组织分离纯化获得9株内生放线菌,将其编号为LCB-A231~LCB-A239。
3.2. 抗菌、抗癌及抗糖尿病活性筛查
通过抗菌、抗癌及抗糖尿病活性测试筛选出一株具有较好活性的菌株LCB-A236。其发酵粗提物的活性测试结果见表2。该菌株对肺炎克雷伯氏菌和枯草芽胞杆菌表现出较强的抑菌活性,对金黄色葡萄
球菌的抑菌活性较弱,对铜绿假单孢菌、表皮葡萄球菌、白色念珠菌、黑曲霉则无抑菌活性。该菌株人肝癌细胞株HepG2具有较强的细胞毒活性,对HepG2-pPPRE-Luc亦表现出了极强的活性。
3.3. 培养特征
菌株LCB-A236在胰胨酵母琼脂、ISP-2琼脂、燕麦粉琼脂-1等9种培养基上生长良好,在甘油-天门冬酰胺琼脂培养基上生长中等,在10种培养基上均无可溶性色素产生,且在各种培养基上气生菌丝和基内菌丝的颜色特征各不相同(见表3)。
3.4. 形态特征
在扫描电镜下观察,可见丰富的高度分枝菌丝,孢子丝呈螺旋状,孢子丝成熟后形成串珠状的孢子链;单个孢子表现为椭球状,表面褶皱,直径0.67~0.94 μm (见图1)。
3.5. 生理生化特性
对菌株LCB-A236的生长温度、pH值、NaCl耐受能力进行了初步测定,结果表明:该菌株生长的温
Table 1. Primers and relvent biosynthesis genes for PCR screening
表1. PCR筛查所用引物及其匹配生物合成基因
Table 2. Antimicrobial, anticancer and antidiabetes activity of strain LCB-A236
表2. 菌株LCB-A236的抗菌、抗癌及抗糖尿病活性
注:“−”代表无活性;“++”代表抑菌圈直径为5.0~6.5 mm;“+++”代表抑菌圈直径为6.5~10.0 mm或抗癌活性生长率(GR)为70~80 mm;“+++++”代表抗糖尿病活性激动率(ER)大于100。
Table 3. Cultural characteristics of strain LCB-A236 on all kinds of medium
表3. 菌株LCB-A236在各种培养基上的培养特征
注:“—”表示无气生菌丝生长或不产可溶性色素。
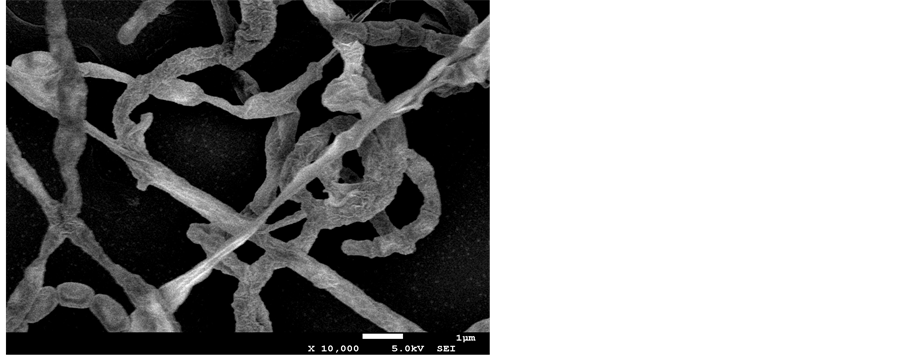
Figure 1. Morphological characteristics of strain LCB-A236
图1. 菌株LCB-A236的扫描电镜照片
度范围在10℃~40℃之间,且最适生长温度在28℃附近;菌株适宜生长的pH范围在6.5~8.5之间,最适pH为为7.5,能耐受6~12的pH范围;NaCl的耐受范围在0%~6%之间。菌株LCB-A236可利用D-阿拉伯糖、肌醇、D-果糖、D-甘露醇、葡萄糖、鼠李糖、甘油、胶醛糖、α-半乳糖、D-木糖作为碳源生长,不能利用山梨醇和山梨糖;可利用L-色氨酸、L-缬氨酸、L-赖氨酸、L-谷氨酸、尿素、甘氨酸、L-组氨酸、L-酪氨酸作为氮源生长;能使牛奶凝固而不胨化,能产生黑色素和水解淀粉,但不能使酯酶分解、硝酸盐还原、纤维素分解、色氨酸分解和明胶液化,也不能产生H2S,甲基红实验为阳性反应(表4)。
3.6. 16S rRNA基因序列分析
经测序分析菌株LCB-A236扩增的16S rRNA基因序列长度为1374 bp,提交至NCBI GenBank,获得注册号为JF261620。EzTaxon在线比对搜索结果表明,与菌株LCB-A236的16S rRNA基因序列相似度较高的标准菌株均为链霉菌属,将菌株16S rRNA基因序列与所选取的18株相近模式菌的序列用Clustal X进行比对,构建N-J系统发育树。发育树上显示菌株LCB-A236与Streptomyces violaceorubidus LMG 20319T (AJ781374)聚于同一分支中,具有较高的同源性,且其16S rRNA基因序列相似度高达99.71%,确定为Streptomyces sp.。系统发育树见图2。
3.7. 抗生素合成酶基因的PCR筛查
菌株LCB-A236的抗生素生物合成途径的5种关键酶基因进行PCR筛查,结果见表5。
由表5筛查结果知:该菌株PKS-I、PKS-II和NRPS的基因PCR筛查结果呈阳性,而ANSA和oxyB的基因筛查结果为阴性;说明菌株LCB-A236含I型聚酮合成酶、II型聚酮合成酶和非核糖体多肽合成酶三种抗生素合成途径关键酶的基因,不含安莎类抗生素关键酶3,5-AHBA合酶基因rifK和糖肽类抗生素合成关键酶P450单加氧酶基因,表明该菌株具有产生相应抗生素的潜力。
4. 讨论
放线菌是寻找天然抗感染活性产物的出发菌,特殊生境中的放线菌,为适应生存环境,经过不断演
Table 4. Physiological and biochemical characters of strain LCB-A236
表4. 菌株LCB-A236的生理生化特征
注:“+”表示生长或反应阳性;“−”表示不生长或反应阴性。
Table 5. PCR screening of antibiotics synthetase genes
表5. 抗生素合成酶基因的PCR筛查
注:“+”表示筛查结果为阳性;“−”表示筛查结果为阴性。
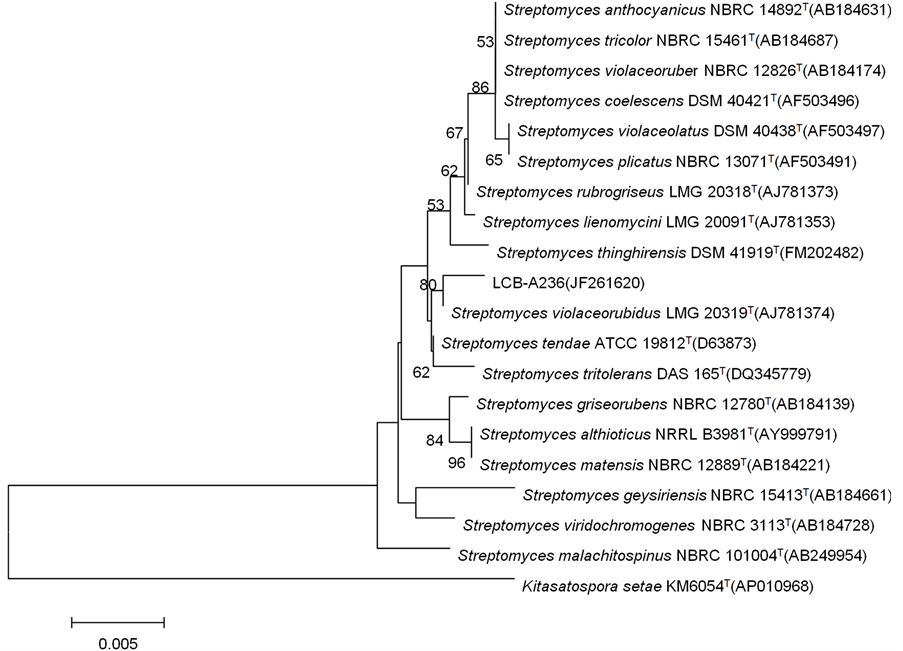
Figure 2. Phylogenetic tree based on 16S RNA gene sequences of strain LCB-A236
图2. 基于16S rRNA基因序列构建菌株LCB-A236系统发育树
化,逐渐产生了独特的代谢系统和防御系统,从特殊环境中发现产生新型抗生素的放线菌概率相对较高 [14] 。还有研究表明,宿主植物与内生菌常具有相同或相似的次生代谢产物合成途径,在长期协同进化的过程中,两者相互影响,使得内生菌可以产生抗生素和酶等代谢产物,具有促生、抗菌、抗虫和抗氧化等多种生物学作用 [15] - [18] 。植物内生放线菌因其具有独特的生存环境,且在与宿主长期的相互作用过程中,物种间基因发生交流,使其能够产生能产生与宿主相同或相似的结构新颖、功能特殊的活性物质,这是药物筛选的新途径。Stierle 等在1993年首次从短叶红豆杉分离到的内生真菌能产生抗肿瘤物质紫杉醇 [19] 。杨桂柳等从北仑河红树分离获得106株内生放线菌,其中有38株对至少一株细菌有抑菌作用,35株对至少一株白色念珠菌有抑菌作用 [20] 。姚晓玲等含有抗肿瘤活性喜树碱的喜树种子种分离到33株内生疑似放线菌,并且分离到的内生放线菌中42.42%以上对立枯丝核菌有很强的抑制菌核形成的作用,54.54%内生菌有较强抑制芽孢杆菌生长的作用 [21] 。郭泽经等从罗汉杉分离得到1株具有较强抗菌及抗肿瘤活性的内生放线菌 [5] 。藜(Chenopodium album L.)为藜科藜属的植物,广泛分布于全球温带及热带以及中国各地;性味甘平,微毒,具有清热利湿,治痢疾腹泻、湿疮痒疹、毒虫咬伤等功效。刘松艳等 [22] 和赵良忠等 [23] 研究发现藜乙醇提取物对金黄色葡萄球菌和大肠杆菌均具有明显的抑菌效果并从中分离到6个黄酮类化合物。综上所述,从药用植物藜中更有可能寻求到产新活性化合物的有价值的活性菌株和发现新的抗生素及其它活性先导化合物。
5. 结论
菌株LCB-A236分离自药用植物藜,通过对该菌株的培养特征、扫描电镜特征及生理生化特性的分析表现出典型链霉菌特征,并对16S rRNA基因序列进一步分析,确定菌株LCB-A236为Streptomyces sp.。目前关于此类微生物的分离与活性菌株筛选已成为抗癌、抗菌及生物防治等领域研究与开发的一项重要工作。本研究对菌株LCB-A236分别进行了抗菌、抗癌、抗糖尿病活性研究及抗生素合成酶基因的PCR筛查。菌株发酵粗提物的抗菌、抗癌及抗糖尿病活性测试结果表明,该菌株的抗菌活性中等,但其具有极强的抗癌及抗糖尿病活性。抗生素合成酶基因的PCR筛查显示,该菌株具有I型聚酮合成酶、II型聚酮合成酶和非核糖体多肽合成酶的基因,因此在筛选抗生素生产候选菌株方面具有较大潜力,然而对其产生的抗生素类物质化学结构与作用机理有待进一步研究。
基金项目
中央高校基本科研业务费专项资金资助(SCU2015D008),四川应用基础研究计划项目(2014JY0199)。
文章引用
甘龙站,王 幸,刘 杨,田永强. 一株藜内生放线菌的活性分析及抗生素生物合成潜力的筛查
Activity Analysis and Antibiotics Biosynthesis Potential Screening of an Endophytic Actinomycetes from Chenopodium album L.[J]. 微生物前沿, 2016, 05(02): 9-18. http://dx.doi.org/10.12677/AMB.2016.52002
参考文献 (References)
- 1. Herre, E.A., Mejia, L.C., Kyllo, D.A., Rojas, E., Maynard, Z., et al. (2007) Ecological Implications of Anti-Pathogen Effects of Tropical Fungal Endophytes and Mycorrhizae. Ecology, 88, 550-558. http://dx.doi.org/10.1890/05-1606
- 2. Qin, S., Xing, K., Jiang, J.H., Xu, L.H. and Li, W.J. (2010) Biodiversity, Bioactive Natural Products and Biotechnological Potential of Plant-Associated Endophytic Actinobacteria. Applied Microbiology and Biotechnology, 89, 457- 473. http://dx.doi.org/10.1007/s00253-010-2923-6
- 3. Ezra, D., Castillo, U., Strobel, G.A., Hess, W.M., Porter, H., et al. (2004) Coronamycins, Peptide Antibiotics Produced by Averticillate Streptomyces sp. (MSU-2110) Endophytic on Monstera sp. Microbiology, 150, 785-793. http://dx.doi.org/10.1099/mic.0.26645-0
- 4. Igarashi, Y., Trujillo, M.E., Martnez-Molina, E., Yanase, S., Miyanaga, S., et al. (2007) Antitumor Anthraquinones from an Endophytic Actinomycete Mieromonospora lupini sp. nov. Bioorganic & Medicinal Chemistry Letters, 17, 3702-3705. http://dx.doi.org/10.1016/j.bmcl.2007.04.039
- 5. 郭泽经, 冯治翔, 吴华动, 等. 1株罗汉杉内生放线菌的鉴定、活性分析及抗生素生物合成基因的筛查[J]. 微生物学杂志, 2011, 31(6): 23-25.
- 6. Qiu, P., Feng, Z.X., Tian, J.W., Lei, Z.C., Wang, L., et al. (2015) Diversity, Bioactivities, and Metabolic Potentials of Endophytic Actinomycetes Isolated from Traditional Medicinal Plants in Sichuan, China. Chinese Journal of Natural Medicines, 13, 942-953. http://dx.doi.org/10.1016/S1875-5364(15)30102-3
- 7. 徐丽华, 李文均, 刘志恒, 等. 放线菌系统学[M]. 北京: 科学出版社, 2007: 40-46.
- 8. Gauthier, M.J., Shewan, J.M., Gibson, D.M. and Lee, J.V. (1975) Taxonomic Position and Seasonal Variations in Marine Neritic Environment of Some Gram-Negative Antibiotic-Producing Bacteria. Journal of General Microbiology, 87, 211-218. http://dx.doi.org/10.1099/00221287-87-2-211
- 9. Skehan, P., Storeng, R., Scudiero, D., Monks, A., McMahon, J., et al. (1990) New Colorimetric Cytotoxicity Assay for Anticancer-Drug Screening. Journal of the National Cancer Institute, 82, 1107-1112. http://dx.doi.org/10.1093/jnci/82.13.1107
- 10. Sauma, L., Stenkula, K.G., Kjølhede, P., et al. (2006) PPAR-γ Response Element Activity in Intact Primary Human Adipocytes: Effects of Fatty Acids. Nutrition, 22, 60-68. http://dx.doi.org/10.1016/j.nut.2005.04.011
- 11. 徐平, 李文均, 张永光, 等. 产生大环聚酮类天然产物放线菌的分子筛选研究[J]. 中国抗生素杂志, 2003, 28(6): 321-375.
- 12. Ayuso-Sacido, A. and Genilloud, O. (2005) New PCR Primers for the Screening of NRPS and PKS-I Systems in Actinomycetes: Detection and Distribution of These Biosynthetic Gene Sequences in Major Taxonomic Groups. Microbial Ecology, 49, 10-24. http://dx.doi.org/10.1007/s00248-004-0249-6
- 13. Wood, S.A., Kirby, B.M., Goodwin, C.M., Strålfors, P., Söderström, M., et al. (2007) PCR Screening Reveals Unex- pected Antibiotic Biosynthetic Potential in Amycolatopsis sp. Strain UM16. Journal of Applied Microbiology, 102, 245-253. http://dx.doi.org/10.1111/j.1365-2672.2006.03043.x
- 14. 李文均, 徐平, 徐丽华, 等. 极端环境中的放线菌资源[J]. 微生物学通报, 2003(30): 125-127.
- 15. 杜慧娟, 王伯初, 米鹏程, 等. 药用植物内生菌的分离及抗菌活性的初步研究[J]. 氨基酸和生物资源, 2008, 30(1): 61-64.
- 16. 郭小炜, 冯俊涛, 易晓华, 等. 大花金挖耳内生菌的分离及抑菌活性筛选[J]. 西北植物学报, 2007, 27(2): 377- 383.
- 17. 陈文强, 彭浩, 邓百, 等. 药用植物虎杖内生放线菌的分离及抑菌活性的研究[J]. 陕西理工学院学报: 自然科学版, 2012(6): 61-67.
- 18. 冯天祥, 王玲, 陈海敏, 等. 植物内生放线菌功能及生物活性物质研究进展[J]. 中国生物工程杂志, 2015, 35(4): 98-106.
- 19. Stierle, A. and Strobel, G. (1993) Taxol and Taxane Production by Taxomyces Andreanae an Endophytic Fungus of Pacific yew. Science, 260, 214. http://dx.doi.org/10.1126/science.8097061
- 20. 杨桂柳, 杨立芳, 姜明国, 等. 北仑河红树林内生放线菌分离、鉴定及活性研究[J]. 农业生物技术学报, 2015, 23(6): 894-904.
- 21. 姚晓玲, 康前进, 熊顺子, 等. 喜树种子内生放线菌的分离鉴定及抗菌活性物质初分离[J]. 微生物学通报, 2014, 41(6): 1109-1120.
- 22. 刘松艳, 张沐新, 吴月红, 等. 藜中黄酮类化学成分及抑菌效果的研究[J]. 东北师大学报: 自然科学版, 2011, 43(1): 93-96.
- 23. 赵良忠, 王放银, 段林东. 灰灰菜抗菌物质提取及抗菌效果研究[J]. 生物技术, 2004, 14(4): 66-67.
