Hans Journal of Soil Science
Vol.1 No.3(2013), Article ID:12504,5 pages DOI:10.12677/HJSS.2013.13004
31-P Nuclear Magnetic Resonance (31P-NMR) in Environmental Phosphorus Analysis*
1China Institute of Water Conservancy and Hydropower Research, Beijing
2School of Chemical and Environmental Engineering, China University of Mining and Technology, Beijing
Email: #lujin@iwhr.com
Received: Jul. 17th, 2013; revised: Sep. 18th, 2013; accepted: Sep. 25th, 2013
Copyright © 2013 Jin Lu et al. This is an open access article distributed under the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
ABSTRACT:
Due to its advantages in improving our knowledge about the P fractions in environmental samples, the 31-P nuclear magnetic resonance (31P-NMR) technology has received extensive attention. This paper summarized the current studies on the characterization of P fractions in sediments by using this technology, and described the technical principles, sample preparation method and analytical procedures of this technology. The preparation procedures of environmental samples have a significant influence on the accuracy and precision of testing results, including determination of sample pretreatment, extraction time, sample to extraction ratio and concentration method. The specific application fields of this technology were also summarized in this paper. 31P-NMR technology has been applied in the field of Soil, Lake, Ocean, Wetland, and has made a number of achievements. Some future research focuses were expected in this paper in order to provide theoretic support for the development and application as well as standardization of 31P-NMR technology in the future.
Keywords: 31P-NMR; Phosphorus; Morphological Analysis; Environment
环境磷形态分析中的磷-31核磁共振技术*
陆 瑾1#,王海文2,郝 红1,高 博1,贾建丽2
1中国水利水电科学研究院,北京
2中国矿业大学(北京) 化学与环境工程学院,北京
Email: #lujin@iwhr.com
摘 要:
磷-31核磁共振(31P-NMR)技术因可以增强研究者对环境中磷素组分信息的认识而广受关注。本文综述了该技术在环境磷素形态表征方面的研究成果,对31P-NMR技术的原理、样品制备方法及分析流程进行了系统阐述。环境样品的制备过程(包括样品前处理方法、提取时间、提取剂比例、样品浓缩方法等)对检测结果的精密度和准确度具有显著影响。论文同时综述了该技术在土壤、湖泊、海洋及湿地磷循环等研究领域的研究成果,并对该技术未来的研究及应用重点进行了展望,旨在为环境磷形态分析中的核磁共振技术的发展应用以及标准化研究提供借鉴。
收稿日期:2013年7月17日;修回日期:2013年9月18日;录用日期:2013年9月25日
关键词:31P-NMR;磷;形态分析;环境
1. 引言
磷(P)是构成许多生物大分子的关键元素,在能量贮存、迁移和转化过程中起关键性的作用[1]。以有机磷为参与主体的湖库磷循环过程在很大程度上决定了水体初级生产力的水平[2],研究有机磷的组成及转化特征是深入了解这一过程及其对富营养化贡献的重要环节。然而,因为技术手段等因素的限制,对环境中磷的研究多集中在无机磷上,有机磷的研究则相对有限[3,4]。
环境样品中P化合物研究的传统方法或过于繁琐,或不甚精确,尤其是对于有机磷化合物的研究,基本是根据总磷与无机磷的差值获得,或被处理为连续提取程序中可以统一被最强提取剂分离的含磷组分[5]。相对其它分析技术而言,31P-NMR技术对各种含P化合物的破坏性最小,具有样品前处理相对简单、组分分析完全等优点[6-9]。
本文将通过总结国内外学者近30年来的研究报道,对样品制备这一影响该技术精密度和准确度的关键环节进行全面阐述,总结该技术在土壤、湖泊、海洋及湿地磷循环等研究领域的研究成果,旨在为环境磷形态分析中的核磁共振技术的发展应用以及标准化研究提供借鉴。
2. 31P-NMR技术简介
31P是P元素唯一的天然稳定同位素,自然丰度为100%,31P-NMR(Nuclear Magnetic Resonance),是研究处于强磁场中的31P原子核对射频辐射的吸收,进而解决含P化合物分子结构信息的分析方法,可通过图谱上不同的位移值判断各种含磷化合物[10]。31P-NMR技术分为固相和液相两种,由于环境样品有机磷含量相对较低,金属矿物质含量较高,固相31P-NMR法由于灵敏度和分辨率低而不能检测到土壤或沉积物中的有机磷[11],因而环境样品形态分析通常选用液相31P-NMR技术。环境样品中通过液相31PNMR技术可检测到的含磷化合物包括正磷酸盐(orthophosphate)、磷酸单酯(orthophosphate monoesters)、磷酸二酯(orthophosphate diesters)、焦磷酸盐(pyrophosphate)、多聚磷酸盐(polyphosphate)、膦酸脂(phosphonates),典型图谱如图1所示。
3. 31P-NMR样品制备方法
31P-NMR技术在环境磷形态分析中的应用常常受环境样品制备方法的制约。31P-NMR的样品制备可概括为样品的前处理(干燥、研磨),提取条件(提取剂的选择、提取时间及温度、提取剂的比例)、提取液的处理三个部分,这几个部分都将对结果产生影响。
3.1. 样品的前处理
样品的前处理包括样品的干燥、研磨。一般来说样品的干燥方式包括烘干、自然风干、冷冻风干,或直接使用未经风干的新鲜样品。2005年Barbara J. Cade-Menun等人[13]通过具体分析不同储存条件下
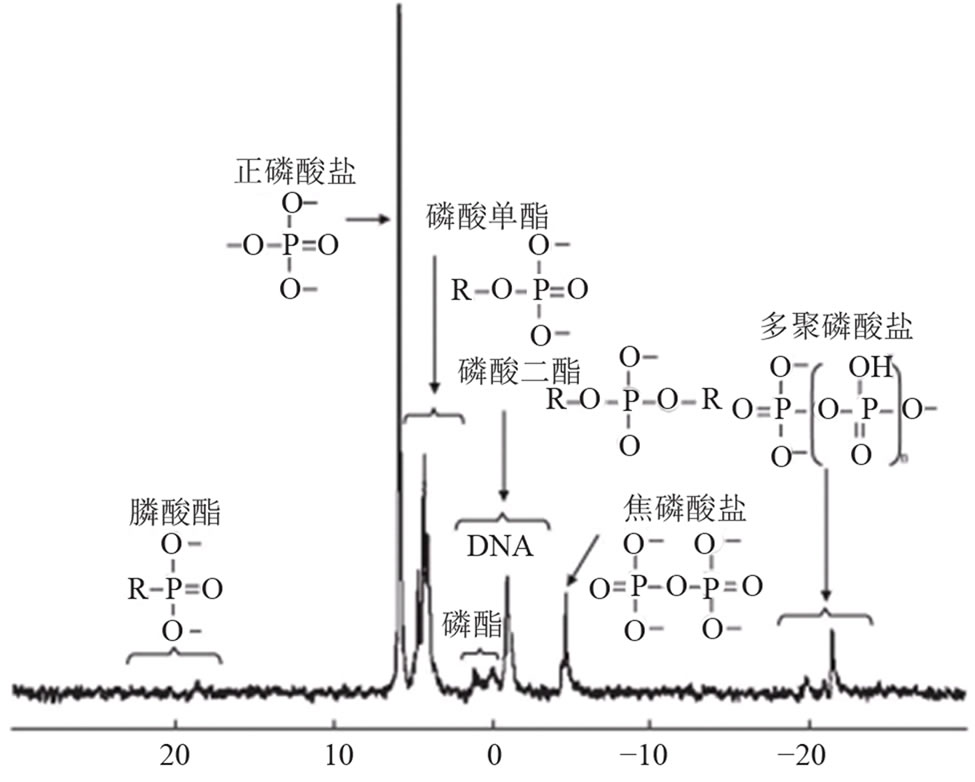
Figure 1. A solution 31P-NMR spectrum of phosphorus environmental standard samples (extracted with NaOH-EDTA)
图1. 磷的环境标准样品液相31P-NMR图谱(NaOH-EDTA提取)[12]
海洋沉积物的31P-NMR检测发现,自然风干会高估样品中的磷,正磷酸盐和磷酸单酯都会增加,磷酸二酯则会降低,而冷冻储存的样品则更接近原样品中的磷组分含量。2011年白秀玲等人也通过对我国43个湖泊的表层沉积物的研究证明[14]:风干样品较新鲜样品磷的提取率更高,样品的风干可促进有机磷的水解,较高温度的风干也会低估有机磷的含量,而直接使用新鲜样品则在一定程度上低估了有机磷组分;另外该研究还表明,风干样品经充分研磨可破坏沉积物结构,尤其是对含矿物质多的沉积物,可促进磷的释放,所以研磨作用也非常重要。因此建议31P-NMR样品前处理方法为:冷冻干燥,充分研磨后冷冻储存。
3.2. 提取剂的选择
自1980年该技术得到应用开始,早期研究者们最常使用的主提取剂为NaOH,但往往会选择一些其它的试剂作为联用试剂[15-20],如EDTA、CDB、NaF、稀酸、阳离子交换树脂等。这是因为环境土壤或沉积物中往往含有较多的Ca、Fe、Al、Mn金属矿物质等,与含磷化合物形成金属结合态磷,使得磷难以被释放,因此单独使用NaOH提取(一些生物样品除外[21])并不能取得很好的效果。而阳离子交换树脂、CBD等均可以达到去除或封闭金属离子的作用,从而释放磷,提高提取效率。但研究发现,阳离子交换树脂在去除阳离子的过程中还可能带走多聚磷[13],而CDB与NaF均具有针对性,CDB主要是将固相的三价铁转化为可溶性的二价铁离子[17],NaF则主要针对Al,对沉积物中含量较多的含Ca化合物则效果甚微。
相对而言,EDTA作为金属螯合剂不仅适用于更广泛的阳离子(对Ca、Fe、Al、Mn等均可发挥作用),而且对有机磷组分的破坏性更小[22]。在提取过程中EDTA的螯合作用可破坏含磷金属配合物,同时还可以阻止与微生物生长代谢密切相关的多聚磷的水解[23]。因此近些年31P-NMR技术应用的研究中,EDTA逐渐成为了最常用的金属螯合剂[24-26]。但同时研究者们发现EDTA作为螯合剂也存在一定的缺陷,因为EDTA的络合作用,提取液中的会存在很多的金属络合物,干扰核磁共振波谱,即EDTA提取液并不适合31P-NMR扫描分析。所以EDTA的用法及配比问题成了31P-NMR技术的另一个研究重点与热点。2007年Ahlgren, J.等人[27]研究发现单独使用NaOH主提取,或EDTA预提取NaOH主提取,对总磷的提取率都比NaOH-EDTA混合液主提取要小。因此认为EDTA应与NaOH混合使用。但在2011年时又提出EDTA提取液并不适合NMR扫描分析,因此应将EDTA作为预提取剂处理1 h后,再以NaOH进行主提取[28]。白秀玲等人[29]也通过研究不同浓度NaOH及不同配比NaOH-EDTA对沉积物有机磷的提取及组成分析的影响证明NaOH-EDTA提取率更高,同时在综合考虑EDTA络合作用及pH的影响下确定0.25 M NaOH- 0.05 M EDTA为沉积物有机磷提取剂的最佳选择。目前关于EDTA的用法并未产生统一定论,但考虑到磷提取率及操作方便的因素,多数研究者选择将其与NaOH联合作为主提取剂。
在NMR扫描时发现,无机正磷酸盐往往会占极大比例,这不仅会使得扫描时间大大增加,同时会压缩其它含量较少的有机磷组分的出峰,甚至出现噪音。因此如何去除环境样品中无机磷酸盐从而提高扫描效果是另一个研究重点,一般会选择稀酸进行预处理以达到去除的效果[30],但此方法也会带走样品中的部分有机磷[31],目前这仍是学术界尚未解决的一个难题。
3.3. 提取剂的比例
提取液中磷的浓度会直接影响到31P-NMR检测的灵敏度。相同情况下,提取剂比例越高,各组分的浓度就越低,被检测出来的可能性也越小;同时浓缩的时间也会越长,以致有机磷水解或与金属离子沉淀的几率越大。但如果提取剂比例过低,首先会影响提取效果,其次无机磷酸盐的比例会相应增加,从而加大扫描难度。因此虽然提取剂比例的变化并不影响提取剂对磷的选择,但选用适当的提取剂比例,对提取效果以及检测灵敏度都非常重要。应根据待测样品的具体情况(主要可依据样品的总磷含量)设置适当的提取剂比例,对于总磷含量较高(如,>1.0 g/kg干)的样品,可选择8:1~20:1或更高的比例[32];而对于总磷含量较低(≤0.8 g/kg干)的样品,则可设为5:1或4:1等较低的比例[33]。表1列出了几种不同提取剂比例下的扫描结果(省略了均检测到了的正磷酸盐及磷酸单酯)。
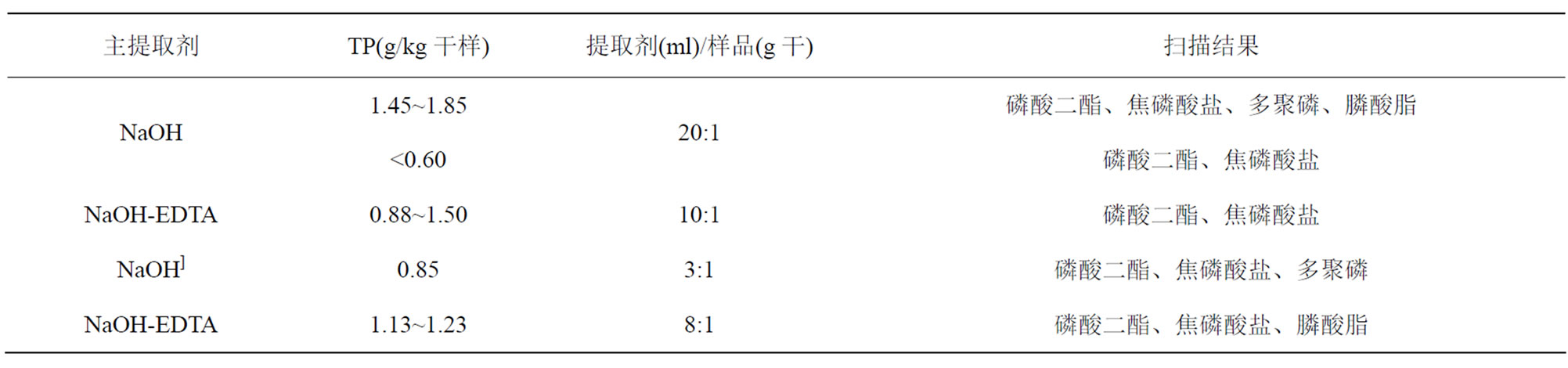
Table 1. The results of different extracting ratio and NMR scans
表1. 不同提取剂比例及NMR扫描结果
3.4. 其他参数的选择
在选择好提取剂及比例后,为了尽可能完整地提取出样品中的含磷组分,同时保证某些化合物不致水解,应把握好提取时间,研究表明常温下振荡提取12~ 16 h是合适的[14]。除提取时间外,环境条件如温度、pH等因素也会在一定程度上影响提取液中最终的磷组分及NMR检测结果。伴随着温度的升高,有机磷的矿化率以及无机磷的释放都会增加[28]。相对来说,含氧量对磷组分的影响最大,氧气充足的情况下磷酸二酯更容易发生降解;而缺氧或厌氧条件可导致更多磷的释放[34]。所以提取完成后,可在4℃,10,000 r/min下离心获得提取液,然后经冷冻干燥浓缩成粉末样品,−20℃保存直至检测前。需要补充的是一般来说pH为6~7的情况下,PO4-P更加稳定,多聚磷不易降解,因此在冷冻干燥前可使用少量稀酸调节提取液的pH[35,36]。
3.5. 31P-NMR分析
样品制备完成后,冷冻储存直至分析,但应在两天之内进行核磁共振分析。31P-NMR分析前,取出冷冻浓缩样品,重新溶解,然后在4℃,10,000 r/min下离心10 min,加入适量D2O锁定信号。然后将样品转移至5 mm NMR管中进行31P-NMR检测。
4. 31P-NMR技术在环境有机磷 分析中的应用
4.1. 土壤学
土壤学家比较早地认识到了有机磷的重要性,1980年Newman[6]首次将31P-NMR技术应用到土壤有机磷的研究中,突破性地获得了有机磷的具体成分,此后该技术逐渐成为有机磷研究的有力武器。自Newman等第一次开创性的将31P-NMR用于土壤学研究至今逾三十年,该技术得到了迅速的发展,俨然已成为当今对有机和无机磷化合物结构分析的最重要的工具之一,极大地推动了土壤有机磷及土壤磷循环研究的发展。研究表明:①土壤中的有机磷除了与有机质螯合的无机磷酸盐以外,主要为大分子有机生物磷,包括磷脂、核酸、肌醇磷酸(酯)、葡萄糖-6-磷酸(酯)、甘油磷脂、磷蛋白以及多聚态有机磷等[37,38];②聚磷酸脂含量、磷酸二酯与磷酸单脂比值、DNA和非DNA 类物质比值等则可作为有机磷来源的多元示踪“生物标志”[39];③不同种类或不同赋存状态的有机磷在土壤中的稳定性和循环特征存在明显差异,在土壤剖面上不同稳定性(如磷酸单酯与磷酸二酯)的比例变化,反映了土壤中磷埋藏的改造强度和磷转化稳态反应的某种质量上的平衡关系[40,41]。
4.2. 湖泊、海洋学
利用31P-NMR技术研究湖沼及海洋沉积物中有机磷的工作相对起步较晚,其分析方法也完全建立在土壤学研究的基础上。但近些年的研究工作表明了31P-NMR技术在湖沼学和海洋学研究工作方面存在的重大意义与前景。研究表明[17,28,35]:控制条件实验发现含氧量、温度、有机质、抑制剂等都会对湖泊沉积物磷组分产生影响,尤其是含氧量。厌氧条件下不仅会促使更多磷的释放,同时在释放的过程中会促使Fe-P系络合物溶解,伴随磷酸盐的释放,部分磷酸盐会导致多聚磷的矿化。自然湖泊沉积物中有机磷成分包括磷酸单酯、磷脂、DNA-P、膦酸脂、有机多聚磷等,但人工景观湖中检测不到膦酸脂和有机多聚磷,且其中生物磷的含量排序为单酯磷 > DNA-P > 焦磷酸盐 > 脂质磷,提示人类活动对水体-沉积物系统磷素的组成具有重要影响,应重新考量景观湖对水体的净化能力;缺氧且含有更多金属离子的海洋中没有检测到湖泊沉积物中出现的焦磷酸盐和多聚磷,提示氧化还原反应及阳离子强度变化是影响焦磷酸盐和多聚磷的关键因子;磷酸二酯在低氧或厌氧区含量更高,且明显高于磷酸单酯,有氧条件下则相反,符合聚磷菌厌氧释磷,好氧聚磷的特征,提示溶解氧对水体-沉积物系统磷素的迁移转化具有较大影响。
4.3. 湿地学
尽管湿地中磷持留和磷去除的主要过程都涉及有机态磷的转化,且成熟湿地中50%以上的总磷累积为有机态磷,但目前关于湿地中有机态磷的赋存形态、环境行为等基本问题的认知仍存在很大缺位,严重限制了湿地生态工程的运用和管理。有机磷研究正成为国际环境科学界的热点,随着31P-NMR技术在湿地磷研究中的逐步应用,国内外湿地有机磷研究逐渐起步[42]。2007年Benjamin L. Turner等[39]就在原有技术的基础上研究了不同的前处理方式对湿地有机磷提取的影响,研究发现冷冻干燥、0.25 M NaOH~0.05 M EDTA仍然是较好的处理方法。2013年Min Li等人[43]研究指出HCl的预提取作用可以去除大部分的无机磷,从而提高提取液中有机磷的比例。该研究还指出,有机磷是湿地植物潜在的磷素来源;湿地表层土壤中的有机磷成分包括磷酸单酯、磷酸二酯等,单酯占着主导地位;随着湿地表层土壤深度的增加,有机磷逐渐减少,这要归功于湿地植物残体的堆积作用,以及土壤成岩作用;说明在湿地土壤中,有机磷主要富集在表层土壤,且主要是稳定性的磷酸单酯;浅层土壤中的细菌可以摄取大量的磷素形成多聚磷酸铵,进而转化为无机磷,深层土壤的有机磷被细菌降解的过程则是漫长的,说明细菌的生长代谢对于湿地表层土壤中的磷素组成及迁移转化具有重要意义。此外2005年Turner[44]也发表过研究报告表明了磷酸二酯在湿地磷循环中的重要性。
4.4. 小结
环境中磷化合物的种类包括无机磷酸盐、有机磷酸单酯、磷酸二酯、膦酸盐、有机多聚磷等,不同种类有机磷在环境中的稳定性和循环特征存在明显差异,不同种类有机磷化合物的比值可作为磷来源的多元示踪“生物标志”。随着水体富营养化问题的日益突出,磷在环境中的形态及迁移转化规律成为了研究热点,31P-NMR分析技术因具备传统磷化合物研究方法所不具有的样品前处理相对简单、破坏性小、组分分析完全等优点,不仅可以得到环境磷的具体形态,还可据此分析磷的组成结构及空间分布等信息。该技术的应用极大推动了环境磷特别是有机磷循环研究的发展,尤其是在水体富营养化严重的今天,31P-NMR技术对于湖泊、湿地等系统磷的内循环的研究具有重要的推动作用,对于进一步深化磷在环境中的迁移转化以及动力学研究具有重要的意义,同时,可望为新型生态污水处理系统——湿地系统的设计、运行和管理等的发展与优化提供理论支撑。
5. 展望
1) 样品制备技术是影响该技术在环境磷形态分析及迁移转化规律研究中应用的关键因素。关于31PNMR技术的环境样品制备方法目前尚无统一的标准方法,未来的研究工作可尝试将试验方法及参数标准化,尽可能的改进并完善统一样品制备方法。
2) 不同种类有机磷在环境中的稳定性和循环特征存在明显差异,含氧量、温度、有机质、细菌等因素都会对环境中磷素的组成及迁移转化产生显著影响。因此在方法标准化研究的同时,尝试将31P-NMR技术应用到更多的领域,并结合其它生物物理化学方法等,开展反应动力学等的研究。
参考文献 (References)
[1] 徐进, 张奇. 表流湖滨湿地磷素汇-源功能研究[J]. 环境科学学报, 2007, 27(10): 1617-1622.
[2] 梁海清, 王圣瑞, 金相灿等. 不同污染程度沉积物不同粒级有机磷形态及其分布[J]. 农业资源与环境科学, 2007, 23(3): 380-385.
[3] 李海宗, 潘梅. 富营养化水体底泥磷释放的研究进展[J]. 安徽农业科学, 2012, 40(21): 11008-11010, 11013.
[4] J. Hu, L. Liu and Y. You. Phosphorus fraction and phosphate adsorption characteristics analysis of Xuanwu Lake sediments. 2009.
[5] R. A. Bowman, C. V. Cole. Transformations of organic phosphorus substrates in soils as evaluated by NaHCO3 extraction. Soil Sciences, 1978, 125(2): 95-101.
[6] N. Majed, Y. Y. Li and A. Z. Gu. Advances in techniques for phosphorus analysis in biological sources. Current Opinion in Biotechnology, 2012, 23(6): 852-859.
[7] R. H. Newman, K. R. Tate. Soil phosphorus characterization by 31P NMR. Communications in Soil Science and Plant Analysis, 1980, 11: 835-842.
[8] 彭喜玲, 方海兰, 占新华等. 利用31P核磁共振技术研究污泥中磷在土壤中的形态转换[J]. 农业环境科学学报, 2009, 28(10): 2104-2110
[9] J. Lehmann, Z. D. Lan, C. Hyland, et al. Long-term dynamics of phosphorus forms and retention in manure-amended soils. Environmental Science & Technology, 2005, 39(17): 6672-6680.
[10] 王晓钧, 丁士明, 蒋海青等. 湖泊磷核磁共振(NMR)分析——1环境标准样品的31P-NMR[J]. 湖泊科学, 2008, 20(1): 45-50.
[11] B. J. Cade-Menun. Characterizing phosphorus in environmental and agricultural samples by 31P nuclear magnetic resonance spectroscopy. Talanta, 2005, 66(2): 359-371.
[12] 钱轶超, 陈英旭, 楼莉萍等. 核磁共振技术在沉积物磷素组分及迁移转化规律研究中的应用[J]. 应用生态学报, 2010, 21(7): 1892-1898.
[13] B. J. Cade-Menun, C. R. Benitez-Nelson and P. Pellechia. Refining 31P nuclear magnetic resonance spectroscopy for marine particulate samples: Storage conditions and extraction recovery. Marine Chemistry, 2005, 97(3-4): 293-306.
[14] 白秀玲, 周云凯, 李斌等. 基于液相31P核磁共振分析的沉积物样品制备方法研究[J]. 环境科学, 2011, 32(7): 1980- 1985.
[15] B. L. Turner, B. J. Cade-Menun, L. M. Condron, et al. Extraction of soil organic phosphorus. Talanta, 2005, 66(2): 294-306.
[16] I. M. Cardoso, P. V. Meer, O. Oenema, et al. Analysis of phosphorus by 31PNMR in Oxisols under agro forestry and conventional coffee systems in Brazil. Geoderma, 2003, 112(1): 51-70.
[17] R. Carman, G. Edlund and C. Damberg. Distribution of organic and inorganic phosphorus compounds in marine and lacustrine sediments: A 31P-NMR study. Chemical Geology, 2000, 163(1-4): 101-114
[18] W. Amelung, A. Rodionov, I. S. Urusevskaja, et al. Forms of organic phosphorus in zonal steppe soils of Russia assessed by 31P NMR. Geoderma, 2001, 103(3): 335-350.
[19] G. Guggenberger, L. Haumaier, R. J. Thomas, et al. Assessing the organic phosphorus status of an Oxisol under tropical pastures following native savanna using 31P NMR spectroscopy. Biology and Fertility of Soils, 1996, 23(3): 332-339.
[20] M. B. Turrion, F. Lafuente and M.-J. Aroca. Characterization of soil phosphorus in a fire-affected forest Cambisol by chemical extractions and 31P-NMR spectroscopy analysis. Science of the Total Environment, 2010, 408(16): 3342-3348.
[21] M. I. Makarov, L. Haumaier, W. Zech, et al. Can 31P NMR spectroscopy be used to indicate the origins of soil organic phosphates? Soil Biology & Biochemistry, 2005, 37(1): 15-25.
[22] B. J. Cade-Menun, C. W. Liu, R. Nunlist and J. G. McColl. Soil and Litter Phosphorus-31 Nuclear Magnetic Resonance Spectroscopy. Journal of Environmental Quality, 2002, 31(2): 457-465.
[23] M. Hupfer, R. Gachter and H. Ruegger. Polyphosphate in lake sediments: 31PNMR spectroscopy as a tool for its identification. Limnology and Oceanography, 1995, 40(3): 610-617.
[24] R. W. McDowwell, G. F. Koopmans. Assessing the bioavailability of dissolved organic phosphorus in pasture and cultivated soils treated with different rates of nitrogen fertilizer. Soil Biology & Biochemistry, 2006, 38(1): 61-70.
[25] B. L. Turner, N. Mahieu and M. Leo. The phosphorus composition of temperate pasture soils determined by NaOH-EDTA extraction and solution 31P NMR spectroscopy. Condron. Organic Geochemistry, 2003, 34(8): 1199-1210.
[26] C.-Y. Chiu, C.-W. Pai and K.-L. Yang. Characterization of phosphorus in subalpine forest and adjacent grassland soils by chemical extraction and phosphorus-31 nuclear magnetic resonance spectroscopy. Pedobiologia, 2005, 49(6): 655-663.
[27] J. Ahlgren, H. De Brabandere, K. Reitzel, et al. Characterization of phosphorus in sub-al pine forest and adjacent grassland soils by chemical extraction and phosphorus-31 nuclear magnetic resonance spectroscopy. Journal of Environmental Quality, 2007, 36(3): 892-898.
[28] J. Ahlgren, K. Reitzel, H. De Brabandere, et al. Release of organic P forms from lake sediments. Water Research, 2011, 45(2): 565-572.
[29] 白秀玲, 周云凯, 李斌等. 利用31P核磁共振技术优化太湖沉积物有机磷的化学提取方法[J]. 环境科学学报, 2011, 31(5): 996-1003.
[30] C. N. Bedrock, M. V. Cheshire, J. A. Chudek, et al. Use of 31PNMR to study the forms of phosphorus in peat soils. Science of the Total Environment, 1994, 152(1): 1-8.
[31] B. L. Turner, S. Newman and K. R. Reddy. Overestimation of organic phosphorus in wetland soils by alkaline extraction and molybdate colorimetry. Environmental Science & Technology, 2006, 40(10): 3349-3354.
[32] R. W. McDowell, I. Stewart. An improved technique for the determination of organic phosphorus in sediments and soils by 31P nuclear magnetic resonance spectroscopy. Chemistry and Ecology, 2005, 21(1): 11-22.
[33] K. Reitzel, K. Ahlgren, H. DeBrabandere, et al. Degradation rates of organic phosphorus in lake sediment. Biogeochemistry, 2007, 82(1): 15-28.
[34] X. L. Bai, S. M. Ding, C. X. Fan, et al. Organic phosphorus species in surface sediments of a large,shallow, eutrophic lake, Lake Taihu, China. Environmental Pollution, 2009, 157(8-9): 2507- 2513.
[35] J. Y. Liu, H. Wang, H. J. Yang, et al. Detection of phosphorus species in sediments of artificial landscape lakes in China by fractionation and phosphorus-31 nuclear magnetic resonance spectroscopy. Environmental Pollution, 2009, 157(1): 49-56.
[36] J. P. Gustafsson, L. B. Mwamila and K. Kergoat. The pH dependence of phosphate sorption and desorption in Swedish agricultural soils. Geoderma, 2012, 189-190: 304-311.
[37] R. W. McDowell, I. Stewart and B. J. Cade-Menun. An examination of spin-lattice relaxation times for analysis of soil and manure extracts by liquid state phosphorus-31 nuclear magnetic resonance spectroscopy. Journal of Environmental Quality, 2006, 35(1): 293-302.
[38] B. L. Turner, N. Mahier, and J. M. Condron. Phosporus-31 nuclear magnetic resonance spectral assignaments of phosphorus compounds in soil NaOH-EDTA Extracts. Soil Science Society of America Journal, 2003, 67(2): 497-510.
[39] D. Uhlmann, H. D. Bauer. A remark on microorganisms in lake sediments with emphasis on polyphosphate-accumulation bacteria. Gesamten Hydrobiologie, 1998, 73: 703-708.
[40] R. W. McDowell, T. I. Stewart. The phosphorus composition of contrasting soils in pastoral, native and forest management in Otago, New Zealand: Sequential extraction and 31P NMR. Geoderma, 2006, 130(1): 176-189.
[41] S. Backnäs, H. Laine-Kaulio and B. Kløve. Phosphorus forms and related soil chemistry in preferential flowpaths and the soil matrix of a forested podzolic till soil profile. Geoderma, 2012, 189-190: 50-64.
[42] B. L. Turner, S. Newman and W. Alexander. Sample pretreatment and phosphorus speciation in wetland soils. Soil Science Society of America Journal, 2007, 71(5): 1538-1546.
[43] M. Li, J. Zhang, G. Q. Wang, et al. Organic phosphorus fractionation in wetland soil profiles by chemical extraction and phosphorus-31 nuclear magnetic resonance spectroscopy. Applied Geochemistry, 2013, 33: 213-221.
[44] B. L. Turner, S. Newman. Phosphorus cycling in wetland soils: The importance of phosphate diesters. Journal of Environmental Quality, 2005, 34(5): 1921-1929.
NOTES
*基金项目:国家自然科学基金资助项目(No. 50909102),公益性行业专项资助项目(200901055)。
#通讯作者。