Studies in Synthetic Chemistry
Vol.04 No.04(2016), Article ID:19312,9
pages
10.12677/SSC.2016.44004
Research Progress of Preparation and the Photocatalysis Properties of Nanoparticle CeO2
Linfeng Su, Jinfeng Gong, Fanming Meng*
School of Physics & Material Science, Anhui University, Hefei Anhui

Received: Dec. 2nd, 2016; accepted: Dec. 16th, 2016; published: Dec. 21st, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
As the photodegradation method was gradually applied to every aspect of our life, the CeO2 became the favoured material for its excellent photocatalytic performance. The research achievements of domestic and overseas scholars in recent years about the origins of the photocatalysis performance of CeO2 were discussed in this paper briefly, mainly including method of precipitation, sol-gel method and hydrothermal method. The essay introduces the photocatalytic mechanism and the influence factor of the CeO2, and also briefly introduces the application status of the CeO2. Meanwhile this article looked into the distance in the research about the photocatalytic performance of CeO2.
Keywords:Nanoparticle CeO2, Synthesis, Photocatalysis

纳米CeO2的合成及其光催化性质的研究进展
苏琳峰,巩金峰,孟凡明*
安徽大学物理与材料科学学院,安徽 合肥

收稿日期:2016年12月2日;录用日期:2016年12月16日;发布日期:2016年12月21日

摘 要
随着光降解方法逐渐应用于生活中的方方面面,CeO2以其优异的光催化性能备受科学家青睐。本文简述了近几年来国内外科学家对CeO2的合成以及光催化性质的研究成果;主要介绍了沉淀法,溶胶–凝胶法,水热法。介绍了CeO2的光催化机理以及影响因素,并对CeO2光催化性能的应用进行了简要阐述。同时,对CeO2的光催化的研究工作进行了展望。
关键词 :纳米CeO2,合成,光催化

1. 引言
1972年由日本科学家Fujishima和Honda首次在《Nature》杂志上报道了利用TiO2电极进行光电分解水制氢的实验 [1] ,自此之后光催化技术受到了科学界的极大关注。光催化是指:在光催化剂受到大于禁带宽度能量的光子照射后,在其表面产生光生空穴和光生电子,光生空穴与表面的OH−反应生成-OH强氧化自由基,可将多种有害气体(如CO、HC、NOX)氧化分解成无害的CO2、H2O、 等无机物,光生电子则与氧气反应生成超氧根离子-
等无机物,光生电子则与氧气反应生成超氧根离子- ,可将很多难分解的有机物分解成CO2和H2O等无机物 [2] ,在众多具有光催化效应的光催化剂中,TiO2以其无毒,催化活性高,稳定性好以及抗氧化能力强等优点而成为如今利用率最广的光催化剂。但TiO2的禁带较宽,太阳能的利用率低,利用的太阳能只占总太阳能的3%。为了提高光催化效率而引进了CeO2。CeO2相对TiO2而言,其催化活性高,稳定性强,普适性好,对人体无害,可在常温常压下工作,最重要的一点,是其适用于低浓度污染物的治理,且廉价易得因此备受重视。本文就近年来有关纳米CeO2的制备及其光催化性能方面的研究进行了评述。
,可将很多难分解的有机物分解成CO2和H2O等无机物 [2] ,在众多具有光催化效应的光催化剂中,TiO2以其无毒,催化活性高,稳定性好以及抗氧化能力强等优点而成为如今利用率最广的光催化剂。但TiO2的禁带较宽,太阳能的利用率低,利用的太阳能只占总太阳能的3%。为了提高光催化效率而引进了CeO2。CeO2相对TiO2而言,其催化活性高,稳定性强,普适性好,对人体无害,可在常温常压下工作,最重要的一点,是其适用于低浓度污染物的治理,且廉价易得因此备受重视。本文就近年来有关纳米CeO2的制备及其光催化性能方面的研究进行了评述。
2. 纳米CeO2的制备
纳米CeO2的制备方法常用的有沉淀法、溶胶–凝胶法、水热法等。
2.1. 沉淀法
沉淀法是制备纳米CeO2以及其他纳米粒子最常用的方法。其具体过程是:在金属盐溶液中加入沉淀剂,或在一定的温度下使溶液发生水解,形成沉淀从溶液中析出,再将沉淀物过滤、洗涤、干燥和焙烧,最终产物即为纳米氧化物粉末 [3] - [12] 。而沉淀法也可细分为直接沉淀法,化学共沉淀法,均相沉淀法,水解沉淀法等 [11] 。
沉淀法的优点是:其反应过程使用的设备简单,工艺过程容易控制,并且其产物纯度高,易于商业化。但在过滤和洗涤的步骤中比较困难,且在整个工艺过程中粒子的团聚现象比较容易出现。
近年来,有众多科学家对沉淀法进行了研究。其中Chen [13] 对在沉淀法制备纳米CeO2的过程中,温度和压力对粒子结构和性能的影响进行了深入的研究。发现其对粒子大小、形貌和晶体结构有较大影响。肖楚民、潘湛昌等 [14] 采用碳酸氢铵作为沉淀剂制备了二氧化铈超细粉体,试验中发现,当反应物浓度为0.25~0.3 mol/L,沉淀剂浓度为0.2~0.4 mol/L,pH值为7~8,沉淀温度为60℃~80℃,焙烧温度为600℃时,可制得平均晶粒度小于20 nm,分散性好的二氧化铈超细粉体。韦薇、杨东霞等 [15] 用Ce(NO3)3·6H2O溶解在去离子水中,加入H2O2、聚乙二醇等试剂,用正向、反向化学共沉淀法制备得CeO2粉末。实验发现由反向化学沉淀法制得的CeO2粉体在400℃焙烧后,比由正向法制得的CeO2粉体在同样的温度焙烧后,具有更高的比表面积、总孔体积和平均孔径。其粒径在20 nm左右,且分散性良好,但仍有团聚现象。除此之外,还有许多使用不同试剂通过沉淀法制备纳米CeO2的例子,如用过氧化氢--氨水制备CeO2超微粉末 [3] ;用硝酸铈为原料,草酸作为沉淀剂制备CeO2粉末 [8] ;用硝酸铈、酒石酸铵为原料制备CeO2纳米晶体 [7] 等等。
2.2. 溶胶–凝胶法
溶胶–凝胶法的首次应用是由L·科斯塔,G·宝拉,A·鲁克曼在涉及制备大块玻璃整料时提出的。溶胶–凝胶法,也称作SSG法 [16] 基本原理为前驱物溶于溶剂中成为均匀的溶液,溶质与溶剂产生水解或醇解反应,反应生成物聚集成1 nm左右的粒子并组成溶胶,后者经过蒸发干燥成为凝胶 [17] - [22] 。
溶胶–凝胶法与传统烧结法比较来说,其具有制品均匀度高,纯度高,比表面积大,反应过程易于控制等优点。但同时,此方法也具有成本高,处理时间较长,制品易产生开裂等缺点。上述缺点除了过程太长的缺点以外,其他的缺点都正在或已经解决 [23] 。
张环华等人 [24] 以硝酸铈和柠檬酸为原料,采用溶胶–凝胶法制备了CeO2纳米晶。并通过XRD和TEM测试发现所制得的CeO2粒子为立方精细结构,且呈球形。硝酸铈和柠檬酸的摩尔比为1:3,在65℃水浴中反应成胶,100℃下烘干,500℃焙烧,可得到平均粒径为7 nm的CeO2纳米晶。董相廷,洪广言 [25] 利用草酸铈,柠檬酸,运用溶胶–凝胶法制得CeO2纳米晶。并通过实验测验发现低温合成的不同粒径CeO2纳米晶均属于立方晶系,且随着焙烧温度的增加,粒径增大;CeO2纳米粒子越小,晶格畸变越大,晶粒发育越不完整,衍射强度越低;热失重率主要受焙烧温度的影响,焙烧时间的影响很小;并且纳米CeO2比多晶CeO2具有更高的表面活性。Ji Yuan [26] 运用改进了的溶胶–凝胶法制得了掺杂了钐的CeO2粉体。改进的溶胶–凝胶法相对传统溶胶–凝胶法,用辛醇和乙醇来取代凝胶中的水,有效减少了团聚概率。除此之外,溶胶–凝胶法还可以使用六水硝酸铈和聚乙二醇 [18] 、硬脂酸 [20] 、硝酸铈铵 [22] 作为原料等等。
2.3. 水热法
水热法可简单描述为在密封的压力容器中,以水或者其他液体为介质,使用高温、高压制备氧化物或者化合物粉体的方法 [27] - [40] 。
水热法相比其他方法不需要高温焙烧,避免了在此过程可能产生的颗粒间的硬团聚,制得的粉体纯度高,晶粒发育完整,分散性好,粒径小,分布范围窄,从而使比表面积增大,活性中心增多,其光催化活性大大提高。但由于反应是在高温条件下进行,对实验设备要求较严格,成本高,不安全,所以目前较少使用此法制备CeO2 [11] [27] 。
李占双,尤佳等人 [41] 以Ce(NO3)3·6H2O为原料,乙二醇为分散剂,运用水热法制得纳米CeO2粉末。通过XRD分析发现随着水热温度的升高,CeO2平均晶粒尺寸逐渐增大;通过红外光谱分析发现随着粒径的减小,比表面积增大,界面原子所占比例增大;通过透射电镜分析发现,CeO2纳米粒子呈球形,粒度小,颗粒尺寸约为10~20 nm,粒径分布较均匀,有较好的单分散性;并且发现CeO2纳米晶在285~385 nm的范围间有1个强烈的吸收峰,有较强的紫外吸收性能,具有良好的光催化性能。Masui等 [42] 以Ce(SO4)2、Ce(NH4)4(SO4)2、(NH4)2Ce(NO3)6为原料,运用水热法制备了纳米CeO2粉末,其粒径 < 5 nm。
此外,纳米CeO2的制备方法还可以采用燃烧法和微波法。李秀萍等人 [43] 用一种新型具有还原性的抗坏血酸为燃烧剂运用燃烧法合成氧化铈,实验发现当硝酸铈:抗坏血酸 = 1:2时产物性质最佳,可以不加助溶剂,不经洗涤,煅烧即可得到乳白色、质量轻、颗粒细的氧化铈。潘漮昌等 [44] 用硝酸铈为原料,碳酸氢铵为沉淀剂,运用微波法,用微波加热合成了平均晶度8 nm的纳米CeO2。
3. CeO2光催化反应及应用
3.1. 光催化反应机理
当CeO2纳米晶受到紫外灯的照射后,处于价带的电子就会被激发到导带,价带便生成空穴(h+),空穴(h+)本身是强氧化剂,将吸附在CeO2颗粒表面的OH−和H2O分子氧化成OH自由基,缔合在CeO2表面的OH自由基为强氧化剂,可以氧化相邻的有机物,而且可以扩散到液相氧化有机物,把各种有机物通过一系列的氧化过程,最终氧化成CO2,从而完成对有机物的降解。
3.2. 光催化活性的影响
3.2.1. 粒径的影响
在水热法制取CeO2的实验中,我们发现了随着水热温度的升高,CeO2的平均晶粒尺寸逐渐增大,而通过红外光谱分析发现当CeO2微粒尺寸缩小,比表面积增大,界面原子所占比例增大,由于界面原子与内层原子的差异使吸收峰趋于宽化。并且在低温下合成的纳米CeO2粒径越小,由于纳米粒子的尺寸量子效应,其能隙越宽,导带电位更负,价带电位更正,因而获得更强的氧化还原能力。而纳米CeO2粒子中光致电荷分离的效率很高,粒径越小,光生电荷分离效率越高,则电子/空穴对复合越少,这也有利于CeO2光催化活性的提高 [41] 。而且,通过张环华 [24] 等人的实验分析可以得出一部分影响CeO2光催化的因素是通过影响其的粒径大小来间接影响CeO2的光催化活性的结论。下面将简要说明张环华等人的实验过程与结论:
1) 焙烧温度对粒径大小的影响。
从图1中可以看出,随着温度的升高,其衍射峰的强度增大,而由Scherrer公式:Dhk1 = Kλ/(βcosθ),其中K = 0.89,λ = 0.1541 nm,为衍射峰的半高峰宽(弧度),θ为布拉格衍射角,计算垂直于(111)晶面的平均晶粒度D111,计算结果如图2。
从图2中我们可以看出,当焙烧温度低时其平均粒径较小,即通过影响粒径大小来间接影响CeO2的光催化活性。
2) 反应物配比对粒径的影响。
通过改变试验中硝酸铈和柠檬酸的摩尔配比,分别实验得出下面数据:
从图3我们可以看出随着柠檬酸量的增加,平均粒径也逐渐减小。
3) 反应温度对粒径大小的影响。
在其他条件相同的条件下,通过改变反应温度来考察反应温度对产物的影响。通过实验发现,低温时,反应不易成胶,但制备所得的CeO2粒子的平均粒径小且均匀分散;而高温时虽然反应相对于低温时更易于成胶,但产物粒子粒径大,不均匀。
4) 凝胶烘干温度对粒径大小的影响。
通过实验发现随着烘干温度的升高,所需要的时间减短,所得凝胶的结构也变得疏松,但最终的产物粒子粒径却逐渐增大,也对CeO2的光催化活性产生影响。
3.2.2. 光源波长的影响
田志茗 [45] 等通过对照模拟实验,分别以氙气模拟日光中的可见光,用汞灯模拟日光中的紫外光照射溶液,得到数据(如图4)。
实验发现,由于催化剂CeO2为N型半导体材料,禁带宽度(Eg)为2.94 eV,当用波长小于420 nm的

Figure 1. XRD patterns of the CeO2 prepared at different temperatures (According to Huanhua Zhang et al. Preparation of nanocrystalline CeO2 by sol-gel method)
图1. 在不同温度下制备的CeO2的XRD图(据文献 [24] )

Figure 2. Different calcination temperature on the influence of particle size and specific area (According to Huanhua Zhang et al. Preparation of nanocrystalline CeO2 by sol-gel method)
图2. 不同的焙烧温度对粒径和比表面积的影响(据文献 [24] )
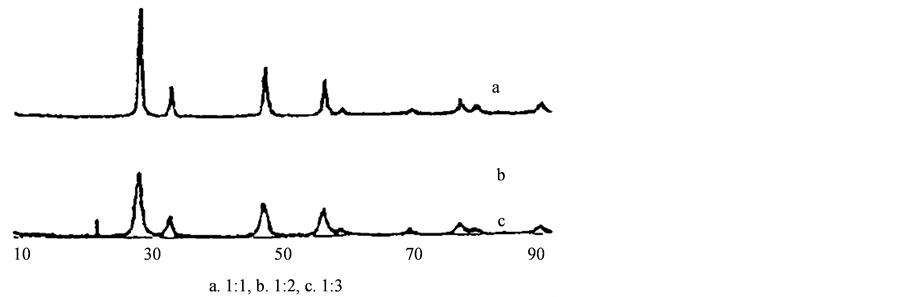
Figure 3. XRD patterns of the CeO2’s prepared under different ratio of the reactants (According to Huanhua Zhang et al. Preparation of nanocrystalline CeO2 by sol-gel method)
图3. 不同反应物配比所制备的XRD图(据文献 [24] )
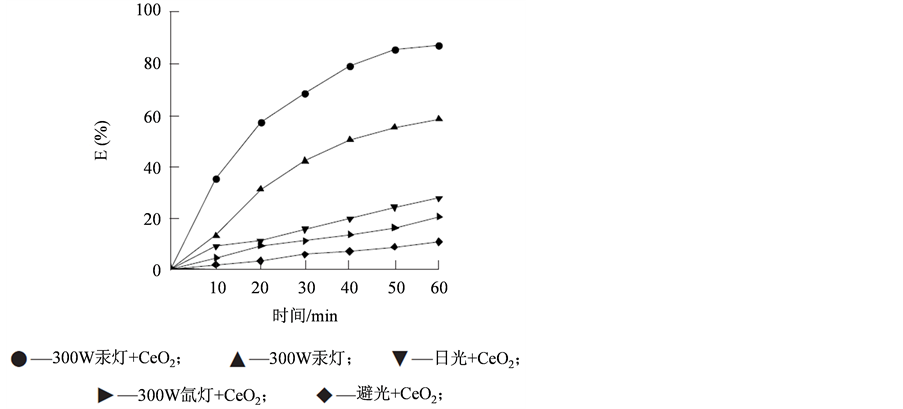
Figure 4. The rate of the degradation of methylene blue under different light conditions (According to Zhiming Tian et al. Study on methylene blue photodegradation using CeO2 nanoparticle as catalysts)
图4. 不同光照条件下亚甲基蓝的降解率(据文献 [45] )
紫外光照射时,由于光子的能量大于禁带宽度,其价带上的电子被激发,越过禁区带进入导带,同时在价带上形成相应的空穴:CeO2 + hλ → e+ + h+。光致空穴具有很强的电子捕获能力,而导带上的光致电子又具有很强的活性,在CeO2表面形成氧化还原体系。紫外光提高了光生电子与空穴分离的效率,从而提高了纳米CeO2的催化活性。
3.2.3. 有机物浓度以及溶液PH的影响
李小忠等人 [46] 通过实验分析得出有机物浓度与溶液PH值对光降解效率的影响。实验以苯酚的降解为例,通过实验发现,苯酚的光催化降解速率随苯酚浓度的增加而降低,这是因为苯酚浓度的增多导致其吸光增多,使催化剂表面的有效光强减小。并且发现苯酚的降解速率随着光降解时间的延长而不断降低,这是因为随着时间的延长,中间产物不断积累,其消耗的自由基增多,氧化苯酚的速率减小。通过另一个改变PH值的实验表明,当PH值较低时,CeO2会发生酸侵蚀现象,使苯酚的离解受到抑制,不利于CeO2的吸附;当PH值较高时,虽然对苯酚的吸附能力有所增强,但溶液中的H+浓度较低时,不利于催化剂表面的Ce4+—O2−与水中的H+反应生成Ce4+—O2H,也不利于催化剂上的O2−与水中的H+反应,最终导致·OH总量的减少。
3.3. 应用
3.3.1. 汽车尾气净化
汽车尾气现如今已经成为大气污染的主要因素,而CeO2以其优异的性质成为解决汽车尾气污染的主力军。CeO2对汽车尾气的作用主要分为两个方面,一个是作为助催化剂 [47] ,另一个是自身的光催化降解 [2] 。
作为助催化剂主要起到的也是两个作用 [48] ,一是可以在氧气过多时储存氧气,在氧气不足时释放氧气,另一个作用是可以控制贵金属颗粒的大小,以此来保证高温环境中催化剂的高比表面,提高催化性能。鞠文鹏等人 [49] 通过实验发现,在温度700~800 K的环境下,纳米CeO2的储氧能力大大提高,可以提高其催化活性和催化效率。
而CeO2自身的光催化效应也可以对汽车尾气的净化起直接作用,当其受到大于禁带宽度能量的光子照射后,在其表面产生的光生空穴与表面的OH−反应生成·OH强氧化自由基,可将汽车尾气中的多种有害气体如CO、HC、NOX氧化分解成无害的CO2、H2O、NO3等无机物。耿九光等人 [2] 通过实验测量表明,CeO2粉末对尾气中的有害气体具有光催化降解能力,其中对HC、NOX的降解率可分别达到12%和90%。
3.3.2. 对水污染物的光催化应用
现如今,对利用CeO2的光催化性质进行水污染治理的方案主要分为两个方面,一是对染料废水的降解,另一个是对水中有机污染物的光降解。
在对染料废水降解方面,田志茗等人 [48] 通过进行CeO2对亚甲基蓝的光降解实验发现当溶液初始PH = 11,染料初始质量浓度为5.0 mg/L,催化剂用量为1.0 g/L时,用300 w汞灯模拟紫外光照射条件下降解率可达87.05%。
而在降解水中有机污染物方面,现如今的大部分研究,都是关于TiO2的光催化性能对有机污染物光降解作用的研究,但由于CeO2与TiO2具有相似的性质,利用CeO2更加优异的光催化性质,对水中有机物进行光降解作用的研究前景还是很光明的。
4. 结论与展望
多相光催化是光化学反应的一个前沿领域,很多通常难以实现的反应在多相光催化的帮助下都能实现。为了进一步有效地利用多相光催化技术,光催化剂的研究与生产就不得不加快步伐。开发新的,有效地光催化剂也成为实现各种化学反应的关键技术之一。TiO2以其优异的光催化性能首先进入科学家的视线。但由于TiO2存在一定的不足,与TiO2具有相似性质的CeO2也就进入科学家的视线,CeO2以其相对TiO2更加优异的光催化性能,和其更低的成本,逐渐成为光催化降解污染物的大军中的一员。但目前对于CeO2光催化性质的研究还处于起步阶段,大部分方向都偏向于在TiO2的制备中掺杂一定量的CeO2来起到增强光催化性能的作用,但主体依旧是TiO2。现阶段,我们的研究方向应该着力于研究单独CeO2的光催化性能,以及对以CeO2为主体的、掺杂其他化学元素的化合物的光催化性能的研究。虽然如今的国内外的科学家,对于CeO2的研究还不足以让CeO2完全取代TiO2在应用方面的地位,但我们可以相信通过不断的探索研究,CeO2的光催化应用将迎来一个十分广泛的,有希望的未来。
基金项目
安徽大学2016年大学生创新训练计划项目(201610357004)。
文章引用
苏琳峰,巩金峰,孟凡明. 纳米CeO2的合成及其光催化性质的研究进展
Research Progress of Preparation and the Photocatalysis Properties of Nanoparticle CeO2[J]. 合成化学研究, 2016, 04(04): 29-37. http://dx.doi.org/10.12677/SSC.2016.44004
参考文献 (References)
- 1. Fujishima, A. and Honda, K. (1972) Electrochemical Photolysis of Water at a Semiconductor Electrode. Nature, 238, 37-38. https://doi.org/10.1038/238037a0
- 2. 耿九光, 臧文杰, 李毅, 等. 纳米二氧化铈的制备及光催化性能[J]. 化工进展, 2014, 33(3): 720-723.
- 3. 胡莉茵. 沉淀法制备CeO2超微粉末[J]. 中国稀土学报, 1996(4): 372-375.
- 4. 杨振华, 宋晓岚. 利用沉淀法制备CeO2纳米粉体[J]. 郑州大学学报(工学版), 2006, 27(1): 82-85.
- 5. 田久英, 卢菊生, 沐来龙, 等. 共沉淀法制备CeO2-ZrO2纳米固体的研究[J]. 精细化工中间体, 2006, 36(3): 46-48.
- 6. 潘漮昌, 张环华, 肖楚明, 等. 微波液相沉淀法制备纳米CeO2纳米晶[J]. 中国稀土学报, 2004, 22(z1): 539-541.
- 7. 双喜, 丽丽, 照日格图, 嘎日迪. 酒石酸铵络合沉淀法制备CeO2纳米晶与表征[J]. 稀土, 2006, 27(2): 5-7.
- 8. 郭峰, 王晓东, 宫继成. 草酸盐沉淀法制备纳米CeO2研究[J]. 内蒙古工业大学学报: 自然科学版, 2008, 27(1): 25-29.
- 9. 龙志奇, 朱兆武, 崔大力, 等. 碳酸氢铵沉淀法制备超细CeO2粉体工艺条件研究[J]. 稀土, 2005, 26(5): 4-8.
- 10. 胡艳宏, LI Mei, 柳召刚, 等. 碳酸氢铵沉淀法制备大颗粒CeO2的研究[J]. 稀土, 2008, 29(4): 12-17.
- 11. 胡有地, 管涛, 武学东, 等. 纳米CeO2的制备技术和研究进展[J]. 凝聚态物理学进展, 2015, 4(4): 113-118.
- 12. 韩业斌, 海燕, 聂祚仁. 沉淀法制备纳米CeO2粒子的化学原理及影响因素研究[J]. 材料导报, 2006, 20(s1): 156-158.
- 13. Chen, H.I. and Chang, H.Y. (2005) Synthesis of Nanocrystalline Cerium Oxide Particles by the Precipitation Method. Ceramics International, 31, 795-802. https://doi.org/10.1016/j.ceramint.2004.09.006
- 14. 肖楚民, 潘湛昌, 张环华. 碳酸氢铵沉淀法制备二氧化铈超细粉体[J]. 矿冶工程, 2003, 23(1): 41-43.
- 15. 韦薇, 杨冬霞, 杨申明, 等. 化学共沉淀法制备纳米二氧化铈的研究[J]. 稀土, 2009, 30(5): 19-21.
- 16. Roy, R. (1987) Ceramics by the Solution-Sol-Gel Route. Science, 238, 1664-1669.
- 17. 郑修成, 黄唯平, 张守民, 等. 溶胶–凝胶法制备CeO2负载CuO低温CO氧化催化剂[J]. 催化学报, 2003, 24(12): 887-888.
- 18. 樊小伟, 梁小平, 王荣涛. 溶胶–凝胶法制备纳米CeO2晶体[J]. 化工新型材料, 2008, 36(9): 79-81.
- 19. 侯文华, 徐林, 邱金恒, 等. 采用不同方法制备CeO2超细粒子——I.溶胶–凝胶法[J]. 南京大学学报(自然科学), 1999(4): 486-490.
- 20. 董相廷, 麦世坚, 张伟, 等. 硬脂酸凝胶法制备CeO2纳米粉体[J]. 材料科学与工程学报, 2001, 19(1): 99-101.
- 21. Verma, A., Karar, N., Bakhshi, A.K., et al. (2007) Structural, Morphological and Photoluminescence Characteristics of Sol-Gel Derived Nano Phase CeO2 Films Deposited Using Citric Acid. Journal of Nanoparticle Research, 9, 317-322. https://doi.org/10.1007/s11051-006-9085-6
- 22. Ansari, A.A. (2010) Semiconductor Materials: Optical and Structural Properties of Sol-Gel Derived Nanostructured CeO2 Film. Journal of Semiconductors, 31, Article ID: 053001.
- 23. 杨南如, 余桂郁. 溶胶–凝胶法的基本原理与过程[J]. 硅酸盐通报, 1993(2): 56-63.
- 24. 张环华, 李秀珍, 潘湛昌, 等. 溶胶–凝胶法制备纳米CeO2[J]. 精细化工中间体, 2002, 32(5): 30-31.
- 25. 董相廷, 洪广言. 溶胶–凝胶法合成二氧化铈纳米晶[J]. 长春理工大学学报(自然科学版), 2002, 25(2): 43-46.
- 26. Ji, Y., Liu, J., He, T., Wang, J. and Su, W. (2005) The Effect of Pr-Co-Dopant on the Performance of Solid Oxide Fuel Cells with Sm-Doped Ceria Electrolyte. Journal of Alloys & Compounds, 389, 317-322. https://doi.org/10.1016/j.jallcom.2004.08.018
- 27. 崔丽, 胡雅琴, 孟凡明. 纳米CeO2的制备研究进展[J]. 凝聚态物理学进展, 2014, 3: 28-32.
- 28. 王成云, 苏庆德, 钱逸泰. 非水溶剂水热法制备CeO2纳米粉[J]. 化学研究与应用, 2001, 13(4): 402-405.
- 29. 薄乾红. 水热法制备正八面体CeO2纳米颗粒的光学性能和磁学性能研究[D]: [硕士学位论文]. 合肥: 安徽大学, 2015.
- 30. 鲁飞. 形貌可控CeO2纳米结构的水热法合成和光学性能[D]: [硕士学位论文]. 合肥: 安徽大学, 2012.
- 31. 陈丰, 陈志刚, 马娟宁, 等. 水热法合成棒束状纳米CeO2粉体及其催化性能[J]. 机械工程材料, 2014, 38(6): 89-94.
- 32. 陆晓旺, 李霞章, 陈丰, 等. 水热法合成可控形貌纳米CeO2研究进展[J]. 硅酸盐通报, 2008(4): 766-771.
- 33. 王雷妮. CeO2纳米材料水热合成的性能研究[D]: [硕士学位论文]. 合肥: 安徽大学, 2014.
- 34. 栾宝平, 余锡宾, 刘洁, 等. 不同形貌的CeO2的水热法制备及表征[J]. 上海师范大学学报(自然科学版), 2011, 40(2): 157-162.
- 35. Zhang, D., Li, F., Gu, J. and Lu, F. (2012) Controlled Synthesis of Ce(OH)CO3 Flowers by a Hydrothermal Method and Their Thermal Conversion to CeO2 Flowers. Particuology, 10, 771-776. https://doi.org/10.1016/j.partic.2012.01.004
- 36. Zhang, Y., Hu, Q., Fang, Z., et al. (2006) Self-Assemblage of Single/Multiwall Hollow CeO2 Microspheres through Hydrothermal Method. Chemistry Letters, 35, 944-945. https://doi.org/10.1246/cl.2006.944
- 37. Wang, L., Meng, F., Li, K., et al. (2013) Characterization and Optical Properties of Pole-Like Nano-CeO2 Synthesized by a Facile Hydrothermal Method. Applied Surface Science, 286, 269-274. https://doi.org/10.1016/j.apsusc.2013.09.067
- 38. Riccardi, C.S., Lima, R.C., Santos, M.L.D., et al. (2009) Preparation of CeO2 by a Simple Microwave-Hydrothermal Method. Soild State Ionics, 180, 288-291. https://doi.org/10.1016/j.ssi.2008.11.016
- 39. Zdravković, J., Simović, B., Golubović, A., et al. (2015) Comparative Study of CeO2 Nanopowders Obtained by the Hydrothermal Method from Various Precursors. Ceramics International, 41, 1970-1979. https://doi.org/10.1016/j.ceramint.2014.08.122
- 40. Gao, K., Zhu, Y.Y., Tong, D.Q., et al. (2014) Hydrothermal Synthesis of Single-Crystal CeCO3OH and Their Thermal Conversion to CeO2. Chinese Chemical Letters, 25, 383-386. https://doi.org/10.1016/j.cclet.2013.11.047
- 41. 李占双, 闫慧君, 尤佳, 等. 水热法合成纳米CeO2及其光催化性质研究[J]. 化学试剂, 2008, 30(4): 262-264.
- 42. Masui, T., Hirai, H., Imanaka, N., et al. (2002) Synthesis of Cerium Nanoparticles by Hythermal Crystallization with Citric Acid. Journal of Material Science Letters, 21, 489-491. https://doi.org/10.1023/A:1015342925372
- 43. 李秀萍, 赵荣祥. 燃烧法快速合成黄色可控轻质纳米氧化铈[J]. 化工科技, 2012, 20(3): 14-17.
- 44. 潘漮昌, 张环华, 肖楚明, 等. 微波液相沉淀法制备纳米CeO2 纳米晶[J]. 中国稀土学报, 2004, 22(z1): 539-541.
- 45. 田志茗, 苟金玲, 黄伟. 纳米CeO2粒子光催化降解亚甲基蓝的研究[J]. 印染助剂, 2016, 33(5): 21-24.
- 46. 李小忠, 王连军. 纳米CeO2晶体的制备及其光催化性能的研究[J]. 环境化学, 2006, 25(2): 149-153.
- 47. 张梅, 魏志峰, 杜雪岩, 等. CeO2包覆对TiO2传感器材料的氧敏性能的影响[J]. 稀有金属, 2001, 25(1): 71-74.
- 48. 乔立, 周丽英. 汽车尾气净化器[J]. 稀土, 1999, 20(5): 74-77.
- 49. 鞠文鹏, 陈楠, 王林江, 等. 纳米氧化铈的制备及其催化性能[J]. 无机盐工业, 2007, 39(10): 8-11.
*通讯作者。