Botanical Research
Vol.06 No.03(2017), Article ID:20697,9
pages
10.12677/BR.2017.63021
Using the SCAR and CAPS Markers Assisted Selection Pepper Restorer Research
Hongyuan Zhang, Min Zhang, Jie Tan, Shuping Huang, Chunli Wang, Xia Chen, Taiming Tan*
Institute of Vegetable, Wuhan Academy of Agriculture Science and Technology, Wuhan Hubei
Received: May 6th, 2017; accepted: May 23rd, 2017; published: May 26th, 2017

ABSTRACT
Pepper (Capsicum annuum L.) tender leaves were used as the research object in this present study. Three pairs of dominant SCAR markers and a pair of co-dominant CAPS markers were applied to detect sixteenth known sterility pepper materials for verifying the feasibility of these primers. Then, the four pairs of primers were used to identify restorer genes in one hundred and twelve unknown pepper materials. The result showed that SCAR and CAPS displayed completely consistent in the sixteenth pepper materials, which were known contain or uncertain restorer gene peppers. In the one hundred and twelve unknown restorer genes pepper resources, one hundred and four materials were identical in the four pairs of primers detection results, including fifty-one had dominant restorer genes, accounted for 49.04%, and twenty-two materials had homozygous restoring genes. SCAR and CAPS molecular markers were combined and established a restorer gene PCR detection method in this present study, which can be used in marker-assisted selection restoring genes and alleles homozygous state.
Keywords:Pepper (Capsicum annuum L.), Rf Gene, Sequence-Characterized Amplified Regions (SCAR), Cleaved Amplified Polymorphic Sequence (CAPS), Molecular Maker
运用SCAR和CAPS分子标记辅助筛选 辣椒恢复系研究
张洪源,张敏,谈杰,黄树苹,王春丽,陈霞,谈太明*
武汉市农业科学技术研究院蔬菜科学研究所,湖北 武汉
收稿日期:2017年5月6日;录用日期:2017年5月23日;发布日期:2017年5月26日

摘 要
以辣椒(Capsicum annuum L.)幼嫩叶片为研究材料,利用3对显性SCAR标记和1对共显性CAPS标记对16份已知育性的辣椒材料进行引物可行性验证,再利用这4对引物对112份未知恢复基因资源的辣椒材料进行恢复基因鉴定。结果表明:SCAR和CAPS在16份辣椒材料中的结果完全一致,112份未知恢复基因辣椒资源鉴定中有104份材料在4对引物检测结果完全一致,其中51份具有恢复基因连锁的特异带型,占比49.04%,且22份具有纯合的恢复基因。本研究将SCAR和CAPS分子标记结合起来建立了与恢复基因Rf有关的PCR检测方法,可对辣椒恢复基因及其等位基因纯合状态进行分子标记辅助筛选。
关键词 :辣椒,恢复基因,SCAR,CAPS,分子标记

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
辣椒(Capsicum annuum L.)属于茄科辣椒属一年生或有限多年生草本作物,原产地墨西哥,明代末年传入我国。辣椒中维生素含量丰富,其果皮一般含有辣椒素而有辛辣,能增进食欲,深受消费者喜爱。1952年Martin等首次报道了辣椒细胞质雄性不育(CMS)现象,其后Peterson等在1958年发现CMS辣椒育性恢复主要1个主效恢复基因Rf的控制 [1] [2] 。辣椒具有明显的杂种优势,利用细胞质雄性不育系、保持系和恢复系三系配套制备杂交种可较好解决生产上花药去雄不彻底的问题,确保了杂交种子纯度,降低了制种风险 [3] 。自上个世纪90年代以来,辣椒CMS三系配套已被广泛应用于辣椒杂种一代的生产,并取得了较好的经济效益 [4] 。传统的辣椒育种技术主要根据杂交组合的育性来判断是否具有恢复基因,配组数较多,且耗时耗力,存在一定盲目性。
DNA分子标记辅助筛选通过对恢复基因紧密连锁的分子标记进行检测,可有效加快恢复系的筛选进程。徐小万等 [5] 利用已公布的SCAR标记引物CRF-SCAR对359份未知育性的辣椒进行恢复基因的鉴定,CRF-SCAR与Rf基因的遗传距离为5.3 cM,结果显示有35份材料有恢复基因特异条带,占比9.75%。杨娟等 [6] 利用175对均匀分布在辣椒染色体上的SSR引物对辣椒不育系113A、恢复系139及其F2代群体进行筛选,发现AF208834引物和Rf基因连锁,遗传距离为20.8 cM,并且利用CRF-SCAR标记对 36 份恢复系材料进行分子标记辅助选择验证,结果表明,30份恢复系有特异条带,正确率为83.33%,并从108份未知育性材料中,检测到41份有恢复基因的材料。先前报道的细胞质不育基因主要有两个 [7] [8] ,即线粒体嵌合基因orf507和假基因Ψatp6-2。最新报道,Jo等 [9] 利用DNA分子标记图位克隆和生物信息学方法将Rf基因确定在821 Kb区间,初步确定一个PPR基因CaPPR6为其主要候选基因,并且认为CaPPR6与嵌合基因orf507和假基因Ψatp6-2均存在较强的核质互作关系。
本研究利用CaPPR6候选基因定位的研究结果,选取与Rf基因遗传距离和物理距离接近的3对SCAR引物,对112份未知恢复基因资源的辣椒材料进行恢复基因鉴定,并利用1对CAPS标记引物来检测恢复基因等位位点的纯合度,可明显提高恢复系筛选效率,为育种中辣椒恢复系筛选提供了良好的理论指导。
2. 材料与方法
2.1. 供试材料
供试的128份辣椒材料由武汉市农科院蔬菜科学研究所茄果室团队提供,其中已知育性材料16份,包含6份CMS不育系材料、8份保持系材料和2份恢复系材料;其余112份辣椒为未知恢复基因材料。试验材料田间编号及其园艺学类型见表1。
Table 1. Selected pepper materials and horticulture type
表1. 供试辣椒材料及其园艺学类型
4对检测引物委托南京金斯瑞公司合成,PCR mix试剂购于武汉擎科生物科技有限公司,DNA核酸染液购于北京天根公司,Bgl II限制性内切酶购于北京NEB公司。主要仪器有PCR仪(Bio-RAD公司)和凝胶成像系统(天根公司)。
2.2. 试验方法
选取辣椒幼嫩叶片,采用CTAB法提取DNA,4对检测引物信息见表2。先利用4对引物对16份已知恢复基因的辣椒材料进行PCR检测,验证检测是否具有一致性,然后再将这4对引物对112份未知恢复基因的材料进行PCR鉴定。
SCAR和CAPS引物的PCR扩增体系统一采用12 μL反应体系,包括6 μL 2 × PCR mix (含Taq酶、dNTP和溴酚蓝染液)、2.5 μM正向引物和反向引物各1.5 μL,1 μL DNA溶液(浓度50 ng/μL)和2 μL ddH2O。PCR扩增程序:94℃预变性5 min (分);94℃,30 sec (秒),60℃,60 sec,72℃延伸50 sec,30个循环; 72℃延伸5 min;12℃,hold (终止反应)。
CAPS引物PCR扩增后,向12 μL PCR反应体系中加入2 × Cutsmart buffer (NEB, USA) 2 μL,Bgl II限制性内切酶0.2 μL(5 U),ddH2O补充至20 μL酶切反应体系。酶切反应条件:37℃孵育6 h或者过夜(无星火效应)。分别从PCR反应体系和酶切反应体系中取6 μL扩增产物用于1.5%琼脂糖电泳,最后进行紫外凝胶成像和拍照记录。
3. 结果与分析
3.1. SCAR和CAPS引物适用性验证
已有的研究报道 [5] [9] [10] 认为CRF-SCAR、3336-last2-SCAR、120K-end-SCAR为显性标记,在恢复系材料中分别能扩增出890 bp、1639 bp和1026 bp特异带;Co1Mod1-CAPS为共显性标记 [10] ,在辣椒中扩增特异片段长度为1177 bp,恢复系特异扩增片段经Bgl II限制性内切酶酶切后可产生601 bp和576 bp两条片段。根据2016年Jo等 [10] 的遗传连锁图谱和物理图谱结果,Rf基因定位于一个821 kb的区间,其中3336-last2-SCAR、120K-end-SCAR和Co1Mod1-CAPS与Rf候选基因的物理距离分别为246 kb、32 kb和2 kb。
将SCAR和CAPS引物对已知育性的16份辣椒材料进行引物适用性验证(图1),结果发现在不育系(CMS line)和保持系(Maintainer line)中CRF-SCAR、3336-last2-SCAR、120K-end-SCAR均无恢复系特异性条带,而在恢复系(Restores line)中均含有恢复系特异性条带;Co1Mod1-CAPS引物经PCR扩增和Bgl II限制性内切酶酶切后在恢复系中可产生恢复系特异性带型。说明这4对引物在鉴定是否含有恢复基因的辣椒材料中具有较强的一致性。
Table 2. Information of SCAR and CAPS primers
表2. SCAR引物和CAPS引物信息
3.2. SCAR和CAPS标记辅助筛选辣椒恢复系材料
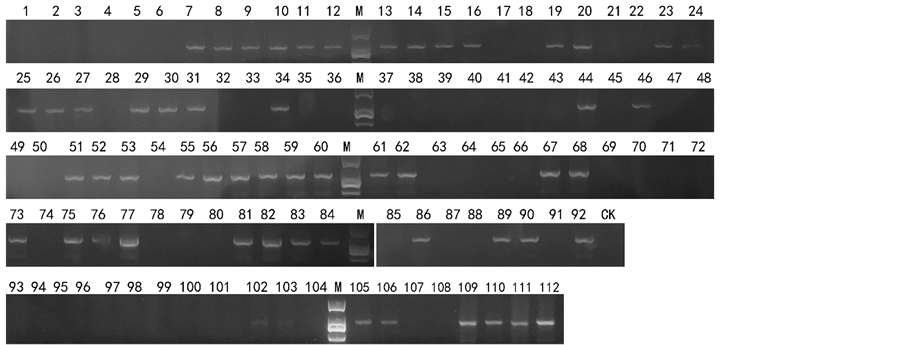
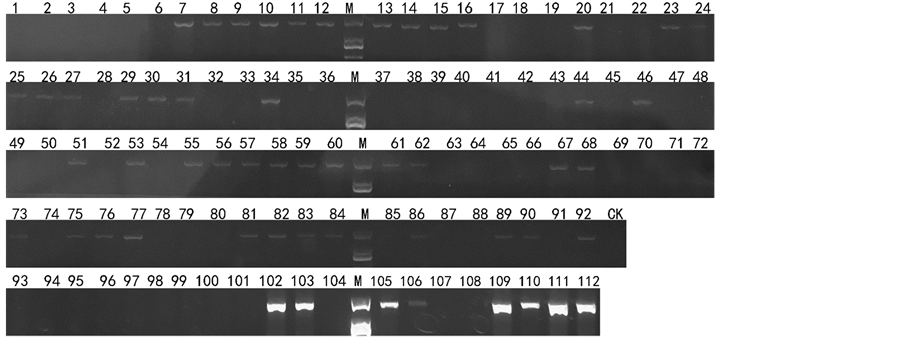
上述结果显示,这4对引物在已知育性的辣椒材料中表现了较强的一致性。因此,利用这些引物对112份未知恢复基因辣椒材料开展恢复系筛选。CRF-SCAR检测结果显示,55份辣椒材料含有恢复基因,见图2;3336-last2-SCAR检测结果显示,56份辣椒材料含有恢复基因,见图3;120K-end-SCAR检测结果显示,58份辣椒材料含有恢复基因,见图4;Co1Mod1-CAPS引物经PCR扩增和Bgl II限制性内切酶酶切后显示,57份辣椒材料含有恢复基因,其中有22份为纯合恢复基因位点的材料,见图5。
将以上PCR检测结果进行整合与分析(见表3),4对引物检测结果中,有104份辣椒材料在这4对标记中的检测结果一致,占比92.86%,仅有8份材料的结果不一致,占比7.14%。8份检查结果不一致的材料编号分别为C132、C174、C179、C180、C210、C210-1、C220和C414,其中C132和C174仅在120K-end-SCAR标记中出现不一致;C179、C180、C210、C210-1和C414在CRF-SCAR标记中出现不一致;C85在Co1Mod1-CAPS标记中出现不一致。不同标记之间检查结果的差异可能是由于不同的标记与Rf基因遗传连锁关系强弱导致。检查的结果表明,联用三对显性SCAR标记和一对共显性CAPS标记检测结果仍具有较高的一致性,其检测方便、重复性好、实验成本低,并且能区别恢复基因的杂合度,因此具有广泛的实用性。
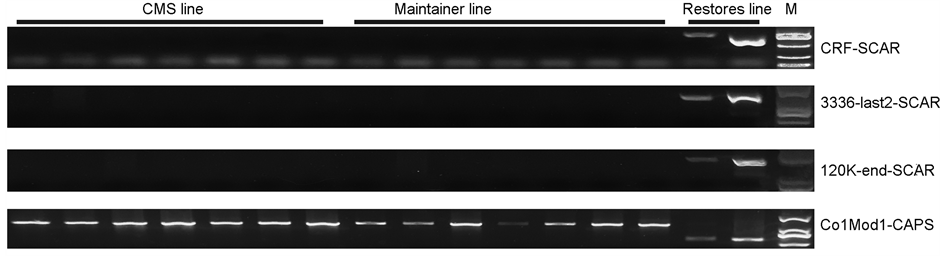 注:CMS line代表辣椒不育系材料,Maintainer line代表辣椒保持系材料,Restores line代表辣椒恢复系材料;M为DL2000 maker。
注:CMS line代表辣椒不育系材料,Maintainer line代表辣椒保持系材料,Restores line代表辣椒恢复系材料;M为DL2000 maker。
Figure 1. The result of SCAR and CAPS molecular marker detection
图1. SCAR和CAPS分子标记检测结果
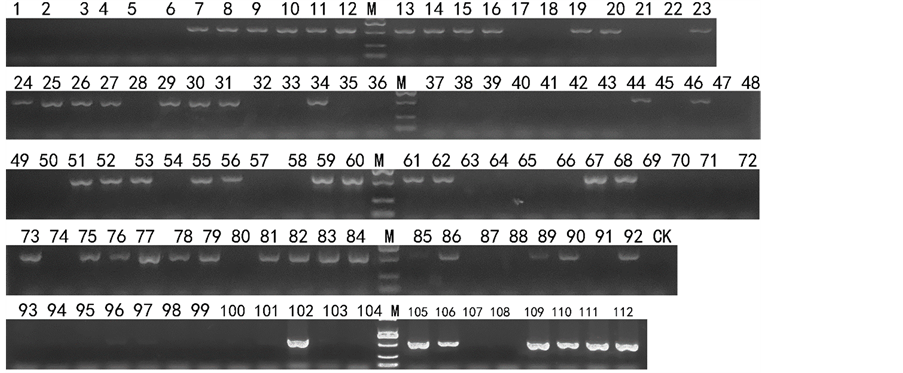 注:1-112为实验编号,M为DL2000 marker。
注:1-112为实验编号,M为DL2000 marker。
Figure 2. CRF-SCAR primer detection result
图2. CRF-SCAR引物检测结果
 注:1-112为实验编号,M为DL2000 marker。
注:1-112为实验编号,M为DL2000 marker。
Figure 3. 3336-last2-SCAR primer detection result
图3. 3336-last2-SCAR引物检测结果
 注:1-112为实验编号,M为DL2000 marker。
注:1-112为实验编号,M为DL2000 marker。
Figure 4. 120K-end-SCAR primer detection result
图4. 120K-end-SCAR引物检测结果
 注:1-112为实验编号,M为DL2000 marker。
注:1-112为实验编号,M为DL2000 marker。
Figure 5. Co1Mod1-CAPS primer detection result
图5. Co1Mod1-CAPS引物检测结果
Table 3. The test results of four molecular marker
表3. 4对分子标记引物检测结果
注:R为显性Rf基因缩写;r为隐形rf基因缩写。A、B、C和D对应编号分别为CRF-SCAR、3336-last2-SCAR、120K-end-SCAR和Co1Mod1-CAPS引物。
Table 4. Four molecular markers detection result in the 104 pepper materials
表4. 4对分子标记在104份材料中的鉴定结果
3.3. 恢复基因与辣椒园艺学性状关联分析
综合表2和表3辣椒园艺学性状和恢复基因筛选结果,4对引物检测结果一致的104份辣椒材料中有51份含有恢复基因,占比49.04%。Co1Mod1-CAPS检测结果表明,22份为纯合恢复基因辣椒材料。羊角椒、炮椒、线椒、牛角椒、朝天椒、螺丝椒和甜椒有恢复基因的材料所占数量和比例分别为21 (20.19%)、14 (13.46%)、7 (6.73%)、5 (4.81%)、3 (2.88%)、1 (0.96%)和0 (0%) (表4)。说明恢复基因在短果形的羊角椒和小果形炮椒中均有较高分布。先前的研究表明 [5] [11] ,小果型辣椒较为原始,不育恢复基因在相对原始的类型中分别较多,本研究结果与前人的结果基本一致。但随着辣椒的近缘种杂交及人工选育,不育恢复基因出现了向多种类型分布扩大的趋势。
4. 讨论
CMS雄性不育恢复系筛选是辣椒“三系”配套的关键环节,使用恢复系可将恢复不育系子代育性,由于不用进行人工去雄,简化了制种程序、降低了人力成本,而且可以提高种子纯度,具有明显的优越性。有研究表明 [5] [11] ,在辣椒三系选育中不育系资源非常丰富,而恢复系资源相对较少,且核质互作的恢复系源多数是小果形辣椒。因此,筛选出恢复力强的恢复系对辣椒CMS“三系”配套及其应用推广具有重要意义。
本研究通过DNA分子标记技术及Rf恢复基因的精细定位结果,利用三对SCAR标记和一对CAPS标记对已知育性的12份辣椒材料进行引物适用性检测,并对112份辣椒材料进行恢复基因筛选。3对SCAR显性标记筛选出含有Rf基因的辣椒材料,再用共显性的特性CAPS标记来判断等位基因是否纯合。结果显示这4对引物在已知育性的辣椒材料中检测一致,采用这4对标记引物筛选出了104份检测一致的辣椒材料,其中恢复基因资源的辣椒材料51份,22份含有纯合位点的恢复基因。恢复基因主要分布于长果形的羊角椒和小果形炮椒中,随着辣椒的近缘种杂交及人工选育,不育恢复基因出现了向多种类型分布扩大的趋势。
结合这4对辣椒恢复基因紧密连锁的分子标记,可快速地对苗期含恢复基因辣椒的材料进行检测,提高了恢复系筛选的正确率,可防止恢复基因流失,减少育种上盲目的测交工作,对育种实践具有较强的理论参考价值。
基金项目
本课题得到湖北省科技支撑计划项目(2015BBA202)和武汉市农科院创新项目(CX201606-05, 2017)资助。
文章引用
张洪源,张敏,谈杰,黄树苹,王春丽,陈霞,谈太明. 运用SCAR和CAPS分子标记辅助筛选辣椒恢复系研究
Using the SCAR and CAPS Markers Assisted Selection Pepper Restorer Research[J]. 植物学研究, 2017, 06(03): 158-166. http://dx.doi.org/10.12677/BR.2017.63021
参考文献 (References)
- 1. Martin, J. and Crawford, J.H. (1951) Several Types of Sterility I Capsicum Frutescens. Proceedings of the American Society of Horticultural Science, 57, 335-338.
- 2. Peterson, P.A. (1958) Cytoplasmically Inherited Male Sterility in Capsicum. American Naturalist, 92, 111-119. https://doi.org/10.1086/282017
- 3. Chen, S. (1997) Male Sterility in Pepper (Capsicum annuum L.). Euphytica, 93, 83-88. https://doi.org/10.1023/A:1002947907046
- 4. 马越, 黄炜, 吉姣姣, 巩振辉, 尹川川. 几个辣椒核质互作雄性不育材料的育性调查[J]. 北方园艺, 2012(11): 5-7.
- 5. 徐小万, 黄旺平, 吴智明, 李涛, 李颖, 王恒明. 应用分子标记筛选辣椒雄性不育恢复系研究[J]. 广东农业科学, 2015, 42(23): 139-144.
- 6. 杨娟, 王雯, 沈火林. 辣椒恢复基因SSR标记定位及分子标记辅助选择育种[J]. 中国瓜菜, 2010, 23(5): 1-5.
- 7. Kim, H.J., Baek, K.H., Lee, S.W., Kim, J., Lee, B.W., Cho, H.S., Kim, W.T., Choi, D. and Hur, C.G. (2008) Pepper EST Database: Comprehensive in Silico Tool for Analyzing the Chili Pepper (Capsicum annuum) Transcriptome. BMC Plant Biology, 8, 101. https://doi.org/10.1186/1471-2229-8-101
- 8. Li, J., Pandeya, D., Jo, Y.D., Liu, W.Y. and Kang, B.C. (2013) Reduced Activity of ATP Synthase in Mitochondria Causes Cytoplasmic Male Sterility in Chili Pepper. Planta, 237, 1097-1109. https://doi.org/10.1007/s00425-012-1824-6
- 9. Jo, Y.D., Ha, Y., Lee, J.H., Park, M., Bergsma, A.C., Choi, H., et al. (2016) Fine Mapping of Restorer-of-Fertility in Pepper (Capsicum L.) Identified a Candidate Gene Encoding a Pentatricopept Repeat (PPR)-Containing Protein. Theoretical and Applied Genetics, 129, 2003-2017. https://doi.org/10.1007/s00122-016-2755-6
- 10. Jo, Y.D., Kim, Y.M., Park, M.N., Yoo, J.H., Park, M.K., Kim, B.D. and Kang, B.C. (2010) Development and Evaluation of Broadly Applicable Markers for Restorer-of-Fertility in Pepper. Molecular Breeding, 25, 187-201. https://doi.org/10.1007/s11032-009-9318-3
- 11. 沈火林, 蒋健箴, 王志源, 等. 辣椒雄性不育系选育及遗传研究[J]. 北京农业大学学报, 1994, 20(1): 25-30.
