Material Sciences
Vol.3 No.4(2013), Article ID:12016,7 pages DOI:10.12677/MS.2013.34030
Recent Advances in Polyanion Type Orthosilicate Cathode Materials for Lithium Ion Battery*
1School of Microelectronics and Solid State Electronics, University of Electronic Science and Technology of China, Chengdu
2State Key Laboratory of Electronic Thin Film and Integrated Devices, Chengdu
Email: #lxquan@uestc.edu.cn
Received: May 8th, 2013; revised: May 10th, 2013; accepted: Jun. 4th, 2013
Copyright © 2013 Zheng Zhang et al. This is an open access article distributed under the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
ABSTRACT:
Recent progress on the polyanion type orthosilicate cathode materials for lithium ion battery is reviewed. The relationship between the structures and properties of orthosilicate cathode materials is discussed, and the phase transformation mechanisms and possible lithium ion channels are analyzed. The synthesis methods and improving measures of electrochemical performance for electrode materials are summarized and prospected, respectively.
Keywords: Li-Ion Batteries; Orthosilicate; Cathode Materials; Polyanion
聚阴离子型正硅酸盐锂离子电池正极材料的研究进展*
张 峥1,刘兴泉2#,马慎思1,赵红远1
1电子科技大学微电子与固体电子学院,成都
2电子薄膜与集成器件国家重点实验室,成都
Email: #lxquan@uestc.edu.cn
摘 要:
综述了各种聚阴离子型正硅酸盐锂离子电池正极材料的研究现状,讨论了该类材料的结构与性能之间的关系,分析了其相变机制与可能的锂离子通道,并与其他聚阴离子体系材料进行了比较。同时对该类材料的合成方法和改善材料电化学性能的措施分别进行了总结和评述。
收稿日期:2013年5月8日;修回日期:2013年5月10日;录用日期:2013年6月4日
关键词:锂离子电池;正硅酸盐;正极材料;聚阴离子
1. 引言
锂离子电池具有电压高、重量轻、能量密度大、寿命长、对环境污染小等优点,在便携式电子设备领域得到广泛的应用[1]。并且逐步扩展到动力电池[2]和储能电池领域[3]。但是,目前锂离子动力电池存在价格偏高,存在安全隐患等问题,并始终成为制约着锂离子动力电池发展的瓶颈[4]。聚阴离子型正极材料正好克服了这些瓶颈。
聚阴离子化合物是含有四面体或八面体聚阴离子结构单元(XOm)n−化合物的总称,有别于层状结构的LiMO2 (M = Co,Ni,Mn等)和尖晶石结构的LiMn2O4正极材料。聚阴离子化合物离子之间通过较强的共价键形成稳定的三维骨架网络[5],充放电过程中形变较小[6];同时因为O2−被聚阴离子中心的金属离子束缚,因此材料具有较好的热稳定性和耐过充过放的能力[6-8];可以掺杂进入聚阴离子化合物晶格的离子很多,通过调节M-O-X键中离子的种类,灵活的调控材料的充放电电位和其他电化学参数[5,8,9]。2005年,厦门大学施志聪等[10]对当时发现的聚阴离子型锂离子电池材料进行了系统的总结。
2005年,Anton Nytén等[11]首次报道了一种新型的正硅酸盐聚阴离子型正极材料Li2FeSiO4。随后,R. Dominko[12,13]和Z. L. Gong[14,15]又先后报道了Li2MnSiO4,Li2MnxFe1 − xSiO4以及Li2CoSiO4三种聚阴离子正硅酸盐正极材料。与其他聚阴离子正极材料相比,理论上正硅酸盐正极材料的每个晶格可以实现两个Li+的脱嵌[16],理论比容量均大于320 mAh/g,远高于广泛应用的LiFePO4材料[17],而且Si的电负性比P要低,故硅酸盐的电子能带间隙要低于相应的磷酸盐,这有助于电子电导率的提高[18]。此外,Si是地壳中丰度第二位的元素,正硅酸盐正极材料制备成本低、对环境友好,同时又具有聚阴离子材料的寿命长、安全性好、耐过充过放等优点,因此成为近几年正极材料研究的热点。本文综述了正硅酸盐聚阴离子正极材料Li2MSiO4 (M = Fe, Co, Ni, Mn)的研究现状,分类讨论了该类材料的结构和性能特点以及制备方法和发展趋势。
2. 正硅酸盐正极材料的结构
聚阴离子材料的结构是非常复杂多样的[19]。其中有一类基于Li3PO4结构类型的无机锂离子导体LISICONS,具有较高的离子电导率,例如Li4GeO4[20],Li2ZnGeO4等[21]。正硅酸盐Li2MSiO4 (M = Fe, Mn, Fe/Mn, Co, Ni)的晶格结构与LISICONS类似,所有的阳离子都与O2−离子组成四面体配位的聚阴离子结构,各个聚阴离子之间通过O2−共顶角连接,因每个四面体的空间朝向不同,故而正硅酸盐正极材料的结构非常多样,在充放电过程中也会发生不同晶型之间的转化。不同晶型的电化学性能存在差异,主要体现在电压平台,比容量和结构稳定性等方面[22]。Anton Nytén[11]首先测得Li2FeSiO4属于正交晶系,空间群为Pmn21,具有与β-Li3PO4类似的结构(见图1)。该结构可以认为由硅氧四面体和铁氧四面体共点连接组成的瓦楞型的[SiFeO4]∞层沿着晶体的ac面无限扩展而成,锂氧四面体沿着b轴方向位于两个[SiFeO4]∞层平面之间,每个组成锂氧四面体的三个O2−来自同一个[SiFeO4]∞层,第四个O2−来自与之毗连的另一个 [SiFeO4]∞层。ME Arroyo-de Dompablo[23]在此结构基础上分别计算了四种正硅酸盐正极材料的晶体常数,见表1。以及该结构下分别脱嵌一个和两个锂离子的脱嵌锂电压。之后,Politaev, V. V等[24]在分析Li2MnSiO4的样品后提出Li2MnSiO4可能属于单斜晶系,空间群P21/n,γII-Li2ZnSiO4结构,XRD图谱与该结构可以很好的吻合。Shin-ichi Nishimura等[25]利用高分辨率同步加速XRD分析(HR-XRD)对Li2FeSiO4样品进行了分析,在比较各种可能的结构后认为单斜晶系空间群为P21的超晶胞结构与衍射谱吻合的最好。G. H. Zhong等[26]构建空间群为P21的Li2MSiO4 (M = Fe, Mn, Co)晶格,利用第一性原理计算正硅酸盐的脱嵌电压。并认为该结构的正硅酸盐Li2MSiO4中M3+/M4+对应的电压平台要低于空间群为Pmn21的正硅酸盐化合物。S.Q. Wu[16]利用广义梯度近似分析不同正硅酸盐

Table 1. Lattice parameters for Li2MSiO4 compounds (unit: Å), space group Pmn21[23]
表1. Li2MSiO4的晶胞参数(单位:Å),空间群Pmn21[23]
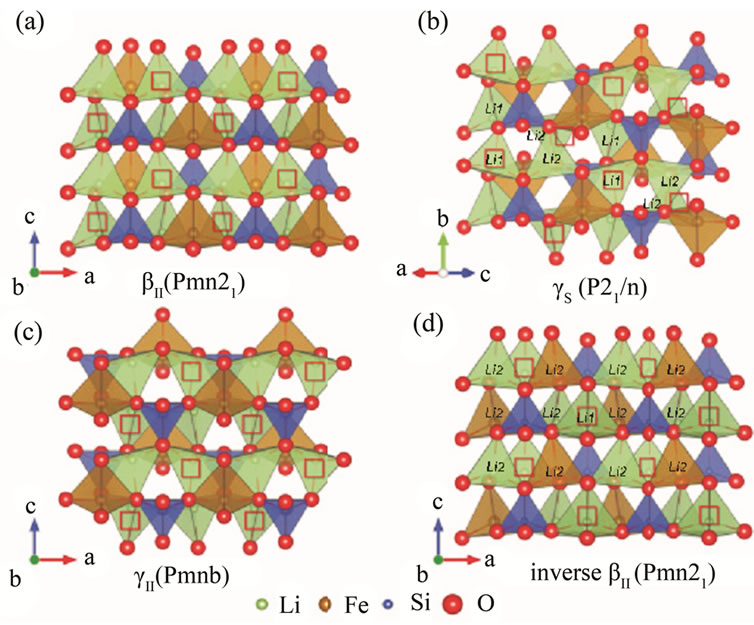
Figure 1. The structures of four polymorphs of Li2FeSiO4[22]. (a) The βII polymorph; (b) the γS polymorph; (c) the γII polymorph, and (d) the inverse βII polymorph. The □ represents the unoccupied Li sites of the ground-state structures of delithiated LiFeSiO4. Li1 and Li2 represent the crystallographic different Li sites of the γS and the inverse βII polymorph
图1. Li2FeSiO4的四种晶体结构[22]。(a) βII;(b) γS;(c) γII;(d) 反向βII。□ 显示的是脱锂态LiFeSiO4的Li空位,Li1和Li2显示的是γS和反向βII相不同的Li位
化合物脱嵌锂过程中的平均电压和体积效应,发现第二个Li+脱嵌时的体积变化均大于脱嵌第一个Li+时的变化。D. H. Seo等[22]认为脱嵌锂过程中存在复杂的可逆与不可逆的相变过程,不同晶型具有不同的电压平台与锂离子迁移路径。
对于Li2FeSiO4的结构与相变研究是比较深入的,除了Anton Nytén[11]和Shin-Ichi Nishimura[25]报道的正交和单斜两种晶型外,C. Sirisopanaporn等[27]在900℃下发现Li2FeSiO4存在一种正交晶系空间群Pmnb的结构,并认为Li2FeSiO4的晶型与退火温度存在一定关系,O. Kamon-in等[28]报道了正交晶系空间群为Pmna的Li2FeSiO4样品,并分析其脱锂态中没有Fe4+的存在。Seo D.-H等[22]通过第一性原理计算Li2FeSiO4不同结构间的稳定性及脱嵌锂过程中的相变过程,他认为各种空间群的Li2FeSiO4样品均可实现Li+的脱出,但在脱锂态即LiFeSiO4时将发生相变,引起空间群的改变,最稳定的状态为所有氧四面体朝向一致的Pmn21 (即反向的βII-Li2FeSiO4)相[29],此时的嵌锂电位为2.823 V,如图2所示。C. Eames等[32]计算Li2FeSiO4材料循环过程中的结构相变后发现,晶格的改变主要发生在嵌锂的过程中,在相变过程中Si-O键的伸缩小于Fe-O键的伸缩,并认为相变的驱动力是晶格中阳离子的库伦排斥力引起的。
Li2FeSiO4的Li+迁移路径与晶体构型有关,Dawei Su等[33]发现空间群为P21的Li2FeSiO4中沿着ac面的迁移阻力是最低的,并认为Li2FeSiO4为二维扩散Li+导体。A. Robert Armstrong[29]等在计算逆-βII Li2FeSiO4相(即空间群Pmn21)的Li+迁移路径后认为最佳的迁移路径是沿着c轴方向,其次为b轴方向。Anti Liivat等[34]计算了空间群为Pmn21的Li2FeSiO4和贫锂态的
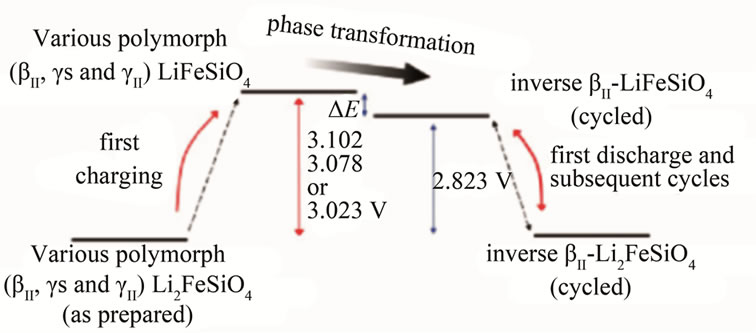
Figure 2. The schematic of the phase transformation of Li2−xFeSiO4 during charge/discharge. Space group P21/n (phase γs), Pmnb (phase γII) and Pmn21 (phaseβII)
图2. 在脱嵌锂过程中Li2−xFeSiO4相变过程原理图[22]:空间群为P21/n (即γs)相[30]、Pmnb (即γII)相[31]以及Pmn21 (即βII)相[11]
Li1.94FeSiO4 (空间群Pbn21)的可能的Li+迁移路径变化后认为在Li+脱出的过程中存在结构的转变,由二维的迁移路径转变为三维的离子通道,降低了迁移势垒。这也解释了晶格转变虽然增加了迁移路径和路径的曲折度,但却没有恶化Li2FeSiO4电化学性能。
Li2MnSiO4的结构主要有P21/n相[13]、Pmn21相[35]以及Pmnb相[36]。N. Kuganathan和M. S. Islam[37]通过第一性原理计算后认为在循环过程中Li2MnSiO4的结构有非晶化的趋势,这较好的解释了Li2MnSiO4循环性能较差。循环过程中锂锰离子间的重排现象较明显,当Mn处于Li位时,Li+的迁移能力将下降。并预测如果将部分Al3+取代Si,则有利于脱嵌更多的Li+,提高比容量。Anton Kokalj等[38]考察循环过程中Li2MnSiO4的结构变化认为:首次循环时,由于Li0.5MnSiO4可以稳定存在,因而脱出一个锂离子后的LiMnSiO4可以再实现0.5个Li+的稳定脱嵌。但此时材料的晶胞体积变化迅速增大,因而造成结构坍塌,出现Li2MnSiO4相、LiMnSiO4相和MnSiO4相分离。这就解释了Li2MnSiO4具有较大的首次不可逆容量损失的原因。
因为Mn2+和Fe2+具有相似的离子半径,Li2FeSiO4和Li2MnSiO4可以形成一系列的固熔体。Z. L. Gong等[39]合成了一系列Li2MnxFe1−xSiO4材料(0 < x < 0.9),并测得所有样品空间群均为Pmn21。随着x的变化Li2FexMn1−xSiO4材料的晶胞参数没有显著的改变。当x = 0.5时电化学性能最好。Peter Larsson等[40]通过第一性原理计算,系统考察了LixFe0.875Mn0.125SiO4材料的晶格结构,认为该体系在脱出Li+的过程中晶胞参数只发生非常小的变化,但同时认为Mn的加入增加了材料的晶格畸变,使晶格变得不稳定,但他们没有考察不同Fe/Mn比的Li2FexMn1−xSiO4体系。Anton Kokalj等[38]进一步考察了不同Fe/Mn比的正硅酸盐材料,认为当Fe/Mn比高于1时,晶格常数变化都非常小,在Fe/Mn比为1时,结构最稳定。在脱嵌1.5个Li+以下不会出现结构的坍塌。Marcella Bini等[41]利用XRD分析了Li2Fe0.5Mn0.5SiO4样品的晶体结构与Li/Mn的混排情况,认为该材料的空间群为Pmnb,在退火温度升高到400℃以上时Li/Mn的混排情况加重。
Z. L. Gong等[15]首先合成了空间群为Pmn21的Li2CoSiO4样品。之后D. Santamaria-Perez等[42]先合成空间群为P21/n的Li2CoSiO4样品,并观察到80 kbar/900℃下晶体结构的空间群变为Pmn21。A. Robert Armstrong等[43]通过不同热处理过程得到空间群分别为Pmn21,Pbn21和P21/n的三种Li2CoSiO4样品。目前尚没有Li2NiSiO4合成方面的报道,S. Q. Wu等[16]基于广义梯度近似方法推算出空间群为Pmn21的Li2NiSiO4的稳定性较低,在室温下有相分离的倾向。脱锂态化合物稳定性较差。
3. 正硅酸盐正极材料的合成与分析
目前文献报道的合成正硅酸盐锂离子电池正极材料的方法有固相法[11,44],Sol-Gel法[45-48],水热法[15,49-51],微波法[52],喷雾干燥法[53]等。该类材料在电解液中的稳定性[49,54],存储特性[55]也有相关报道。
Anton Nytén等[11]首先利用固相法合成了Li2FeSiO4。他们采用Li2SiO3和FeC2O4∙2H2O为原料,添加10%wt的碳凝胶包覆,于750℃烧结24 h得到Li2FeSiO4/C样品。在60℃时C/16倍率下的首次充电比容量达到165 mAh/g,首次放电比容量约130 mAh/g。并观察到第一次充放循环后充电平台由3.1 V下降到2.8 V,并认为是晶格中的离子发生了重排导致的充电平台变化。之后Anton Nytén等[54]又将该方法制备的样品利用光电扫描(PES)和光电子能谱(XPS)技术检验其电化学循环过程中的表面成分变化,选用二(三氟甲基磺酰)亚胺锂(LiTFSI)为电解质,碳酸丙烯酯(propylene carbonate,简称PC)和碳酸乙烯酯(ethylene carbonate,简称EC)为溶剂配成电解液。结果表明材料在该电解液的电化学循环过程中表面没有LiF和碳酸盐成分。说明电解液与材料间没有副反应发生。Christian Dippel等[49]以LiOH∙H2O,FeCl2∙4H2O和SiO2为原料水热合成Li2FeSiO4/C复合材料,初始放电容量为150 mAh/g。在对样品进行了含氟电解液的老化测试后发现:在60℃下保温40天,电解质LiPF6可与Li2FeSiO4反应生成Li2SiF6,造成Fe的溶出。选择玻璃纤维的隔膜可以延缓这一反应的进程。Zipeng Yan等[48]利用聚乙二醇为表面活性剂,抗坏血酸为还原剂和碳源,采用Sol-Gel法合成了Li2FeSiO4材料。在C/16的倍率下首次放电容量为138.2 mAh/g,经过40次循环后容量保持率为94.4%。Zongmin Zheng等[45]利用酒石酸为螯合剂,采用Sol-Gel法制备多孔的Li2FeSiO4材料。在0.5 C的倍率下初始容量为176.8 mAh/g,并显示了良好的循环性能。Muraliganth,T等[52]以四甘醇为溶剂,利用微波溶剂热法合成了Li2FeSiO4材料,在C/20倍率下室温的首次放电容量为148 mAh/g。55℃时放电容量达到了204 mAh/g,实现了Fe3+/Fe4+电对的反应。用相同方法制备的Li2MnSiO4材料首次放电容量达到了250 mAh/g。Zhongxue Chen等[51]利用聚氧乙烯-聚氧丙烯-聚氧乙烯(PEO-PPO-PEO)三嵌段共聚物F127作为模板剂,在溶液中自组装成三维网状前驱体,在450℃和600℃下热处理得到多孔的Li2FeSiO4样品。在C/16倍率下放电比容量达到254.8 mAh/g。同样也实现了第二个Li+的部分脱嵌。Dinesh Rangappa等[50]则采用超临界水热合成法合成了Li2FeSiO4和Li2MnSiO4纳米片,在45℃下C/50倍率时首次放电比容量分别为340 mAh/g和350 mAh/g,远高于其他方法制备的正硅酸盐材料,基本上实现了第二个Li+的全部脱嵌。
Zhenbo Peng等[44]以聚乙二醇为碳源,利用固相法合成了Li2MnSiO4材料,在C/20倍率下初始容量达到204 mAh/g。同时随着聚乙二醇的添加量的增加,材料的颗粒尺寸和表面形貌也逐步得到改善。V. Aravindan等[46]利用己二酸为胶凝剂,选用Li (CH3COO)·2H2O,Mn (CH3COO)2·4H2O、Si (OC2H5)4为原料利用Sol-Gel法合成Li2MnSiO4材料,其放电容量在40个循环以后保持在125 mAh/g。C. Deng等[47]采用Sol-Gel法,以Li (CH3COO)·2H2O,FeC6H5O7,C6H8O7,Mn (CH3COO)2、Si (OC2H5)4为原料,合成一系列Li2 (Fe1−xMnx)SiO4化合物,发现随着x的增加,材料的初始比容量增加,但是循环性能下降,见图3、图4。其中Li2FeSiO4的初始比容量约为145 mAh/g,50次循环后容量保持率高达98%,但是x = 0.3, 0.5, 0.7和1的样品容量保持率只有61.4%,50.3%,32%,和29%。之后C. Deng等[55]又将Li2FeSiO4的样品暴露在空气中一年,发现材料表面严重氧化,但是在Ar气氛中退火处理后该材料的电化学性能还能够得到有效的恢复。Bin Shao等[53]利用喷雾干燥法烧结合成了Li2FexMn1−xSiO4/C (0 ≤ x ≤ 0.8)样品,其中Li2MnSiO4样品在0.05 C倍率下的首次放电容量为197 mAh/g。相比之下,Li2Fe0.5Mn0.5SiO4的0.05C倍
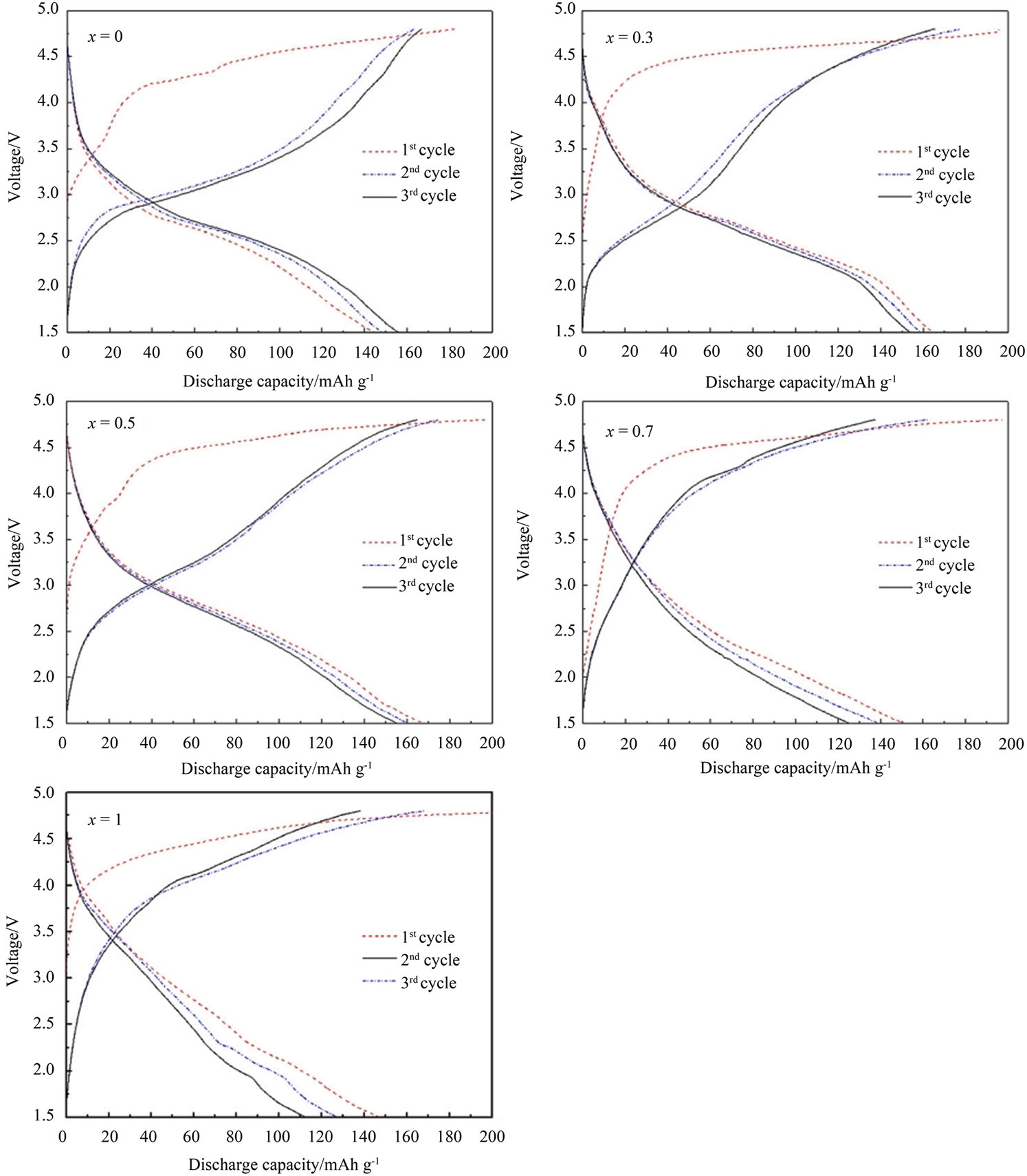
Figure 3. The initial three charge-discharge curves of the Li2(Fe1−xMnx)SiO4 sample[47]
图3. Li2(Fe1−xMnx)SiO4样品的最初三次充放电曲线[47]
率下初始放电容量为149 mAh/g,但显示了更好的循环性能。
Z. L. Gong等[15]以乙醇为溶剂,采用溶剂热法合成了Li2CoSiO4材料,放电过程中只有0.46个Li+进入晶格中(相当于放电容量为75 mAh/g)。比容量和循环性能均较低,可能是因为Li2CoSiO4的放电平台过高,电解液与材料发生副反应,降低了Li2CoSiO4的库伦效率。Li2NiSiO4的电压平台最高,但在室温下其结晶相不稳定,目前没有相关的合成方面的报道。
4. 正硅酸盐正极材料的改性
正硅酸盐材料的电子电导率和离子电导率较低,

Figure 4. The cycling performance of the Li2(Fe1−xMnx)SiO4 [47]
图4. Li2(Fe1−xMnx)SiO4的循环性能[47]
在很大程度上制约了该类材料的大规模应用。改善该类材料电化学性能的方法主要有两种:一种方法是减小材料的颗粒尺寸,缩短Li+的迁移路径[44,45,50];另一种方法是通过表面包覆导电物质[56,57]和体相掺杂其他原子[58-65]的方法提高材料的电导率。
Xiaobing Huang等[56]将多壁碳纳米管(multiwalled carbon nanotubes,简称MWCNTS)引入Li2FeSiO4材料中,制备出Li2FeSiO4/C/MWCNTS复合材料,在0.2C倍率下首次放电比容量为142 mAh/g。并显示出良好的倍率性能,由于碳纳米管的加入,颗粒之间形成了三维的导电网络,提高了材料的电子电导率。之后,Xiaobing Huang等[58]改变Li的含量制备出Li1.95FeSiO4/C/MWCNTS复合材料,在相同倍率下放电比容量达到148 mAh/g。同时认为Li空位和碳纳米管的共同作用是提高材料电导率的关键。V. Aravindan等[57]使用己二酸为碳源合成了Li2MnSiO4/C样品,在C/20倍率下循环40周,材料比容量一直保持在140 mAh/g,显示了十分优异的循环性能,有效的解决了Li2MnSiO4材料衰减快的问题。
Jingyu Bai等[59]通过改变Fe/Si比合成了0.8Li2FeSiO4/0.4Li2SiO3/C复合材料。因为Li2SiO3的离子电导率较高[66,67],可在Li2FeSiO4颗粒之间形成Li+通道,在电流密度为10 mA/g时,初始放电比容量达到240 mAh/g。S. Zhang等[60,61]在Li2FeSiO4中分别掺入3%的Mg和Cr,得到的Li2Fe0.97Mg0.03SiO4材料和Li2Fe0.97Cr0.03SiO4材料在电流密度为10 mA/g时的初始比容量为153.2 mAh/g和160 mAh/g。其循环性和比容量均高于不掺杂的样品。兰建云等[62]利用Sol-Gel法在Li2FeSiO4中掺杂Al3+后发现,当掺杂量为3%时,C/10倍率下材料的首次放电比容量为127 mAh/g,并显示良好的循环性能。刘文刚[63]等利用固相法合成了Li2Mn0.9Ti0.1SiO4材料,首次充电比容量达到284.3 mAh/g。样品的比容量和循环性能均高于不掺杂的样品。Hao等[64]将V掺入Li2FeSiO4中得到Li2Fe0.9V0.1SiO4材料,放电比容量达到159 mAh/g,并显示出了良好的循环性能,因为V具有多变价态,与Li2FeSiO4相比Li2Fe0.9V0.1SiO4具有更大的晶格常数和更好的离子电导率。马慎思等[68]采用液相预处理和固相反应相结合的方法合成了Li2Fe1−xVxSiO4/C (x = 0, 0.1, 0.3, 0.5)复合材料,发现钒掺杂量x = 0.1时材料的微观结构呈C轴拉长的立方体。所有样品的粒径均为纳米至亚微米级,且随着钒掺杂量的升高,粒径逐渐增大,说明V离子掺杂有促进晶体生长的作用。C. Deng等[65]合成了一系列的Li2Fe0.97M0.03SiO4 (M = Zn2+, Cu2+, Ni2+)材料,在考察电化学性能后发现掺杂Zn有利于提高材料的电化学性能,而Cu和Ni会导致材料性能的恶化,C. Deng经过XRD分析后认为,掺杂Zn有利于稳定晶格结构,而Cu和Ni在材料中形成杂质相,将恶化材料的电化学性能。
总之,聚阴离子正硅酸盐系锂离子电池正极材料目前还有许多基础的科学问题有待进一步研究,这也是该种材料逐渐成为研究热点的主要原因。相信在不久的将来,这种材料的许多基础科学问题就将得到解决,那时大规模应用这种材料的时候就真正到来了。
5. 结论和展望
1) 聚阴离子正硅酸盐锂离子电池正极材料具有较强的Si-O键,在高温和过充过放的条件下不释放氧。具有较好的安全性,聚阴离子结构单元的空间占有率低,可以掺杂的离子种类多,有利于Li+的脱嵌
和对材料性能的调整。该类材料每个晶胞中有两个Li+,理论比容量高。并具有原料来源广泛,成本低等特点,在动力电池和储能电池领域有广阔的发展前景。
2) 在正硅酸盐体系的材料中,电子在金属离子间的传递被聚阴离子所阻隔,电导率较低,目前该类材料的电压平台范围均不理想,在充放电过程中的晶型转变过程较复杂。在满充电的状态下易发生相分离过程或与电解液发生不可逆反应,降低材料的比容量和安全性。同时该类材料的合成条件较为苛刻,合成的样品中的杂质较多。这些因素都影响了正硅酸盐正极材料的大规模应用。
3) 聚阴离子正硅酸盐锂离子电池正极材料的研究还处于起步阶段,关于晶体构型与晶型转变,合成工艺与改性方法方面还有很多问题没有解决,Li2FeSiO4材料具有较好的循环性能,但是第二个Li+难以脱嵌;Li2MnSiO4材料容量较高但晶格不稳定,在循环过程中易发生相分离;Li2CoSiO4成本较高,在实用化方面不占优势;Li2NiSiO4的充放电平台高于目前电解液的承受范围,同时Li2NiSiO4的晶体结构在室温下不稳定。未来的研究方向应着重在以下方面进行:探索新的离子配比,找到具有电压平台适中、结构稳定的正硅酸盐系正极材料,实现多个Li+的可逆脱嵌,提高材料的比容量和循环性能;同时优化合成制备工艺,开发配套的负极和电解液体系,实现正硅酸盐系正极材料的实用化和市场化。
参考文献 (References)
[1] B. Scrosati. Challenge of portable power. Nature, 1995, 373(6515): 557-558.
[2] J. M Tarascon, M. Armand. Issues and challenges facing rechargeable lithium batteries. Nature, 2001, 414(6861): 359-367.
[3] B. Dunn, H. Kamath, J. M. Tarascon. Electrical energy storage for the grid: A battery of choices. Science, 2011, 334(6058): 928-935.
[4] J. Li, C. Daniel and D. Wood. Materials processing for lithiumion batteries. Journal of Power Sources, 2010, 196(9): 2452- 2460.
[5] A. K Padhi, V Manivannan and J. B Goodenough. Tuning the position of the redox couples in materials with NASICON structure by anionic substitution. Journal of the Electrochemical Society, 1998, 145(5): 1518-1520.
[6] A. K. Padhi, K. S. Nanjundaswamy and J. B. Goodenough. Phospho-olivines as positive-electrode materials for rechargeable lithium batteries. Journal of the Electrochemical Society, 1997, 144(4): 1188-1194.
[7] A. K. Padhi, K. S. Nanjundaswamy, C. Masquelier, et al. Mapping of transition metal redox energies in phosphates with NASICON structure by lithium intercalation. Journal of the Electrochemical Society, 1997, 144(8): 2581-2586.
[8] A. K. Padhi, K. S. Nanjundaswamy, C. Masquelier, et al. Effect of structure on the Fe3+/Fe2+ redox couple in iron phosphates. Journal of the Electrochemical Society, 1997, 144(5): 1609- 1613.
[9] J. B. Goodenough, Y. Kim. Challenges for Rechargeable Li Batteries. Chemistry of Materials, 2009, 22(3): 587-603.
[10] 施志聪, 杨勇, 聚阴离子型锂离子电池正极材料研究进展[J]. 化学进展, 2005, 17(4): 604-613.
[11] A. Nyten, A. Abouimrane, M. Armand, et al. Electrochemical performance of Li2FeSiO4 as a new Li-battery cathode material. Electrochemistry Communications, 2005, 7(2): 156-160.
[12] R. Dominko, M. Bele, M. Gaberscek, et al. Structure and electrochemical performance of Li2MnSiO4 and Li2FeSiO4 as potential Li-battery cathode materials. Electrochemistry Communications, 2006, 8(2): 217-222.
[13] R. Dominko, M. Bele, A. Kokalj, et al. Li2MnSiO4 as a potential Li-battery cathode material. Journal of Power Sources, 2007, 174(2): 457-461.
[14] Z. L. Gong, Y. X. Li and Y. Yang. Synthesis and characterization of Li2MnxFe1-xSiO4 as a cathode material for lithium-ion batteries. Electrochemical and Solid-State Letters, 2006, 9(12): A542- A544.
[15] Z. L. Gong, Y. X. Li and Y. Yang. Synthesis and electrochemical performance of Li2CoSiO4 as cathode material for lithium ion batteries. Journal of Power Sources, 2007, 174(2): 524-527.
[16] S. Q. Wu, Z. Z. Zhu, Y. Yang, et al. Structural stabilities, electronic structures and lithium deintercalation in LixMSiO4(M = Mn, Fe, Co, Ni): A GGA and GGA plus U study. Computational Materials Science, 2009, 44(4): 1243-1251.
[17] A. Yamada, S. C. Chung and K. Hinokuma. Optimized LiFePO4 for lithium battery cathodes. Journal of the Electrochemical Society, 2001, 148(3): A224-A229.
[18] A. Nyten, S. Kamali, L. Haggstrom, et al. The lithium extraction/insertion mechanism in Li2FeSiO4. Journal of Materials Chemistry, 2006, 16(23): 2266-2272.
[19] A. R. West, P. G. Bruce. Tetragonal-packed crystal structures. Acta Crystallographica Section B: Structural Crystallography and Crystal Chemistry 1982, 38(7): 1891-1896.
[20] P. G. Bruce, A. R. West. Phase diagram of the LISICON, solid electrolyte system, Li4GeO4Zn2GeO4. Materials Research Bulletin, 1980, 15(3): 379-385.
[21] 陈立泉, 王昌庆, 王连忠等. LISICON(锗酸锌锂) 单晶的 Li+离子电导[J]. 物理学报, 1980, 29(5): 661-666.
[22] D. H. Seo, H. Kim, I. Park, et al. Polymorphism and phase transformations of Li2-x FeSiO4(0 < x < 2) from first principles. Physical Review B, 2011, 84(22): 220106(1-5).
[23] M. E. Arroyo-de Dompablo, M. Armand, J. M. Tarascon, et al. On-demand design of polyoxianionic cathode materials based on electronegativity correlations: An exploration of the Li2MSiO4 system(M = Fe, Mn, Co, Ni). Electrochemistry Communications, 2006, 8(8): 1292-1298.
[24] V. V. Politaev, A. A. Petrenko, V. B. Nalbandyan, et al. Crystal structure, phase relations and electrochemical properties of monoclinic Li2MnSiO4. Journal of Solid State Chemistry, 2007, 180(3): 1045-1050.
[25] S. I. Nishimura, S. Hayase, R. Kanno, et al. Structure of Li2FeSiO4. Journal of the American Chemical Society, 2008, 130(40): 13212- 13213.
[26] G. H. Zhong, Y. L. Li, P. Yan, et al. Structural electronic and electrochemical properties of cathode materials Li2MSiO4(M = Mn, Fe, and Co): Density functional calculations. The Journal of Physical Chemistry C, 2010, 114(8): 3693-3700.
[27] C. Sirisopanaporn, A. Boulineau, D. Hanzel, et al. Crystal structure of a new polymorph of Li2FeSiO4. Inorganic Chemistry, 2010, 49(16): 7446-7451.
[28] O. Kamon-In, W. Klysubun, W. Limphirat, et al. An Insight into crystal, electronic, and local structures of lithium iron silicate (Li2FeSiO4) materials upon lithium extraction. Physica B: Condensed Matter, 2013, 416(0): 69-75.
[29] A. R. Armstrong, N. Kuganathan, M. S. Islam, et al. Structure and lithium transport pathways in Li2FeSiO4 cathodes for lithium batteries. Journal of the American Chemical Society, 2011, 133(33): 13031-13035.
[30] A. Kojima, T. Kojima, M. Tabuchi, et al. Crystal structure and electrochemical performance of a new lithium trivalent iron silicate. Journal of the Electrochemical Society, 2012, 159(6): A725-A729.
[31] C. Sirisopanaporn, C. Masquelier, P. G. Bruce, et al. Dependence of Li2FeSiO4 electrochemistry on structure. Journal of the American Chemical Society, 2011, 133(5): 1263-1265.
[32] C. Eames, A. R. Armstrong, P. G. Bruce, et al. Insights into changes in voltage and structure of Li2FeSiO4 polymorphs for lithium-ion batteries. Chemistry of Materials, 2012, 24(11): 2155- 2161.
[33] D. Su, H. Ahn and G. X. Wang. Ab initio calculations on Li-ion migration in Li2FeSiO4 cathode material with a P21 symmetry structure. Applied Physics Letters, 2011, 99(14): Article ID: 141909.
[34] A. Liivat, J. O. Thomas. Li-ion migration in Li2FeSiO4-related cathode materials: A DFT study. Solid State Ionics, 2009, 192(1): 58-64.
[35] I. Belharouak, A. Abouimrane and K. Amine. Structural and electrochemical characterization of Li2MnSiO4 cathode material. The Journal of Physical Chemistry C, 2009, 113(48): 20733- 20737.
[36] R. J. Gummow, N. Sharma, V. K. Peterson et al. Crystal chemistry of the Pmnb polymorph of Li2MnSiO4. Journal of Solid State Chemistry, 2012, 188: 32-37.
[37] N. Kuganathan, M. S. Islam. Li2MnSiO4 lithium battery material: atomic-scale study of defects, lithium mobility, and trivalent dopants. Chemistry of Materials, 2009, 21(21): 5196-5202.
[38] A. Kokalj, R. Dominko, G. Mali, et al. Beyond one-electron reaction in Li cathode materials: Designing Li2MnxFe1-xSiO4. Chemistry of Materials, 2007, 19(15): 3633-3640.
[39] Y. X. Li, Z. L. Gong and Y. Yang. Synthesis and characterization of Li2MnSiO4/C nanocomposite cathode material for lithium ion batteries. Journal of Power Sources, 2007, 174(2): 528-532.
[40] P. Larsson, R. Ahuja, A. Liivat, et al. Structural and electrochemical aspects of Mn substitution into Li2FeSiO4 from DFT calculations. Computational Materials Science, 2010, 47(3): 678- 684.
[41] M. Bini, S. Ferrari, D. Capsoni, et al. Insight into cation disorder of Li2Fe0.5Mn0.5SiO4. Journal of Solid State Chemistry, 2013, 200: 70-75.
[42] D. Santamaria-Perez, U. Amador, J. Tortajada, et al. HighPressure Investigation of Li2MnSiO4 and Li2CoSiO4 Electrode Materials for Lithium-Ion Batteries. Inorganic Chemistry, 2012, 51(10): 5779-5786.
[43] A. R. Armstrong, C. Lyness, M. Ménétrier, et al. Structural Polymorphism in Li2CoSiO4 Intercalation Electrodes: A Combined Diffraction and NMR Study. Chemistry of Materials, 2010, 22(5): 1892-1900.
[44] Z. Peng, H. Miao, H. F. Yin, et al. PEG-assisted solid state synthesis and characterization of carbon-coated Li2MnSiO4 cathode materials for lithium ion battery. International Journal of Electrochemical Science, 2013, 8: 903-913.
[45] Z. M. Zheng, Y. Wang, A. Zhang, et al. Porous Li2FeSiO4/C nanocomposite as the cathode material of lithium-ion batteries. Journal of Power Sources, 2012, 198: 229-235.
[46] V. Aravindan, K. Karthikeyan, S. Ravi, et al. Adipic acid assisted sol-gel synthesis of Li2MnSiO4 nanoparticles with improved lithium storage properties. Journal of Materials Chemistry, 2010, 20(35): 7340-7343.
[47] C. Deng, S. Zhang and S. Y. Yang. Effect of Mn substitution on the structural, morphological and electrochemical behaviors of Li2Fe1-xMnxSiO4 synthesized via citric acid assisted sol-gel method. Journal of Alloys and Compounds, 2009, 487(1-2): L18-L23.
[48] Z. P. Yan, S. Cai, L. J. Miao, et al. Synthesis and characterization of in situ carbon-coated Li2FeSiO4 cathode materials for lithium ion battery. Journal of Alloys and Compounds, 2012, 511(1): 101-106.
[49] C. Dippel, S. Krueger, R. Kloepsch, et al. Aging of Li2FeSiO4 cathode material in fluorine containing organic electrolytes for lithium-ion batteries. Electrochimica Acta, 2012, 85: 66-71.
[50] D. Rangappa, K. D. Murukanahally, T. Tomai, et al. Ultrathin nanosheets of Li2MSiO4(M = Fe, Mn) as high-capacity Li-ion battery electrode. Nano Letters, 2012, 12(3): 1146-1151.
[51] Z. X. Chen, S. Qiu, Y. L. Cao, et al. Hierarchical porous Li2FeSiO4/C Composite with 2 Li storage capacity and long cycle stability for advanced Li-ion batteries. Journal of Electroanalytical Chemistry, 2013, 1(16): 4988-4992.
[52] T. Muraliganth, K. R. Stroukoff and A. Manthiram. Microwave-solvothermal synthesis of nanostructured Li2MSiO4/C(M = Mn and Fe) cathodes for lithium-ion batteries. Chemistry of Materials, 2010, 22(20): 5754-5761.
[53] B. Shao, Y. Abe and I. Taniguchi. Synthesis and electrochemical characterization of Li2FexMn1−xSiO4/C(0 ≤ x ≤ 0.8) nanocomposite cathode for lithium-ion batteries. Powder Technology, 2013, 235: 1-8.
[54] A. Nyten, M. Stjerndahl, H. Rensmo, et al. Surface characterization and stability phenomena in Li2FeSiO4 studied by PES/XPS. Journal of Materials Chemistry, 2006, 16(34): 3483- 3488.
[55] C. Deng, S. Zhang, Y. Gao, et al. Regeneration and characterization of air-exposed Li2FeSiO4. Electrochimica Acta, 2011, 56(21): 7327-7333.
[56] X. B. Huang, X. Li, H. Y. Wang, et al. Synthesis and electrochemical performance of Li2FeSiO4/carbon/carbon nano-tubes for lithium ion batteryo-tubes for lithium ion battery. Electrochimica Acta, 2010, 55(24): 7362-7366.
[57] V. Aravindan, K. Karthikeyan, S. Amaresh, et al. Superior Lithium storage properties of carbon coated Li2MnSiO4 cathodes. Electrochemical and Solid-State Letters, 2011, 14(4): A33-A35.
[58] X. B. Huang, H. H. Chen, S. B. Zhou, et al. Synthesis and characterization of nano-Li1.95FeSiO4/C composite as cathode material for lithium-ion batteries. Electrochimica Acta, 2012, 60, 239-243.
[59] J. Y. Bai, Z. L. Gong, D. P. Lv, et al. Nanostructured 0.8Li2FeSiO4/ 0.4Li2SiO3/C composite cathode material with enhanced electrochemical performance for lithium-ion batteries. Journal of Materials Chemistry, 2012, 22(24): 12128-12132.
[60] S. Zhang, C. Deng, B. L. Fu, et al. Effects of Cr doping on the electrochemical properties of Li2FeSiO4 cathode material for lithium-ion batteries. Electrochimica Acta, 2010, 55(28): 8482- 8489.
[61] S. Zhang, C. Deng, B. L. Fu, et al. Doping effects of magnesium on the electrochemical performance of Li2FeSiO4 for lithium ion batteries. Journal of Electroanalytical Chemistry, 2010, 644(2): 150-154.
[62] 兰建云, 赵敏寿, 王艳芝等. Al3+掺杂对Li2FeSiO4结构和电化学性能影响的研究[J]. 无机化学学报, 2011, 27(8): 1497- 1502.
[63] 刘文刚, 许云华, 杨蓉等. Li2Mn0.9Ti0.1SiO4锂离子电池正极材料的合成及其性能[J]. 热加工工艺, 2009, 38(16): 25-28.
[64] H. Hao, J. B. Wang, J. L. Liu, et al. Synthesis, characterization and electrochemical performance of Li2FeSiO4/C cathode materials doped by vanadium at Fe/Si sites for lithium ion batteries. Journal of Power Sources, 2012, 210, 397-401.
[65] C. Deng, S. Zhang, S. Y. Yang, et al. Synthesis and characterization of Li2Fe0.97M0.03SiO4(M = Zn2+, Cu2+, Ni2+) cathode materials for lithium ion batteries. Journal of Power Sources, 2011, 196(1): 386-392.
[66] S. I. Furusawa, A. Kamiyama and T. Tsurui. Fabrication and ionic conductivity of amorphous lithium meta-silicate thin film. Solid State Ionics, 2008, 179(15): 536-542.
[67] S. I. Furusawa, T. Kasahara and A. Kamiyama. Fabrication and ionic conductivity of Li2SiO3 thin film. Solid State Ionics, 2009, 180(6): 649-653.
[68] 马慎思, 张峥, 刘兴泉等. 锂离子电池Li2Fe1-xVxSiO4复合正极材料的合成[J]. 化工科技, 2013, 21(3): 84-89.
NOTES
*资助信息:国家自然科学基金资助项目(21071026);电子科技大学杰出人才引进项目(08JC00303)。
#通讯作者。