Pharmacy Information
Vol.04 No.01(2015), Article ID:14799,6
pages
10.12677/PI.2015.41002
The Study on the Synthesis of PGs Key Intermediate—Corey Lactone
Tao Deng, Wei Mao, Chun Tao, Qingeng Li*
Chongqing Medical University, Chongqing
Email: dengtao19900128@163.com, *liqingeng@vip.163.com
Received: Jan. 20th, 2015; accepted: Jan. 31st, 2015; published: Feb. 5th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Corey lactone is the key intermediate of synthetizing the prostaglandin analogues. In this paper, we use the norbornadiene as the raw material to synthetize the Corey lactone. Through Prins reaction, Baeyer-Villiger oxidation, splitting the chiral intermediate and a series of reaction successfully, the structure has been confirmed by the LC-MS and the NMR. The reagent and the solvent which are used in this method are so common and inexpensive that they can be suitable for industrialized production.
Keywords:Prostaglandin Drug, Corey Lactone, Chiral Separation

前列腺素类药物关键中间体Corey Lactone的合成工艺研究
邓涛,毛伟,陶春,李勤耕*
重庆医科大学,重庆
Email: dengtao19900128@163.com, *liqingeng@vip.163.com
收稿日期:2015年1月20日;录用日期:2015年1月31日;发布日期:2015年2月5日

摘 要
目前市场上已开发出的前列腺素类似物药物,主要是以Corey lactone关键中间体法进行人工合成。本文以降冰片二烯为原料,经Prins反应,Baeyer-Villiger氧化等一系列反应,成功制成了Corey lactone,并经LC-MS, NMR结构确认;在反应过程中对关键手性中间体进行拆分工艺的研究,最终确认路线中所用到的拆分试剂以及溶剂较其他报道常见且价格低廉,易于工业化生产。
关键词 :前列腺素类药物,科里内酯,手性拆分

1. 引言
前列腺素(prostaglandin,简称PGs)(图1)是一类重要的内源性生理物质,在人体内具有重要的生物活性,参与人体的分娩[1] [2] ,视网膜调节[3] ,炎症反应[4] [5] 以及免疫调节[6] 等,并影响人体的胃酸分泌,血小板凝血等功能。其生物活性高并参与多种生理过程,在医药上引起了广泛的研究。
PGs具有功能化的五元环以及α-侧链和β-侧链。根据侧链的不同,天然前列腺素分为PGA, PGB, PGC, PGD, PGE, PGF;该类化合物具有复杂的立体构型,α侧链和β侧链互为反式,使其化学合成极为不便,工业上主要应用五元内酯法(Corey lactone关键中间体法)进行PGs类药物的生产。Corey lactone(以下简称CL)(图2)关键中间体由化学家Corey与1969年首次提出,并提出采用CL合成PGs类药物,可以很好的控制其立体构型,而不需刻意在反应过程中进行手性筛选;并且不需根据目标产物的不同而刻意寻找五元功能环,大大简化了PGs的合成。1969年至1971年间,Corey等人先后以环戊二烯盐(2)为起始原料成功的合成了具有特定构型的手性化合物CL(图3) [7] [8] ,但由于5位烷基取代的环戊二烯很容易发生H原子的[1] [5] Sigmatropic Shift重排而影响收率;并且Corey lactone同样存在手性,在其合成过程中,拆分关键中间体(5)为整个合成路线的关键,Corey等人采用到易制毒类试剂右旋麻黄碱对其进行拆分,使其工业生产受到制约。因此,对其合成工艺研究具有较强的实用意义。
本课题组通过查阅文献[9] [10] ,最终选择以降冰片二烯(3)为原料,对Corey lactone进行合成(图4),
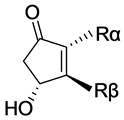
Figure 1. The natural prostaglandin
图1. 天然前列腺素

Figure 2. Corey lactone (CL)
图2. 科里内酯
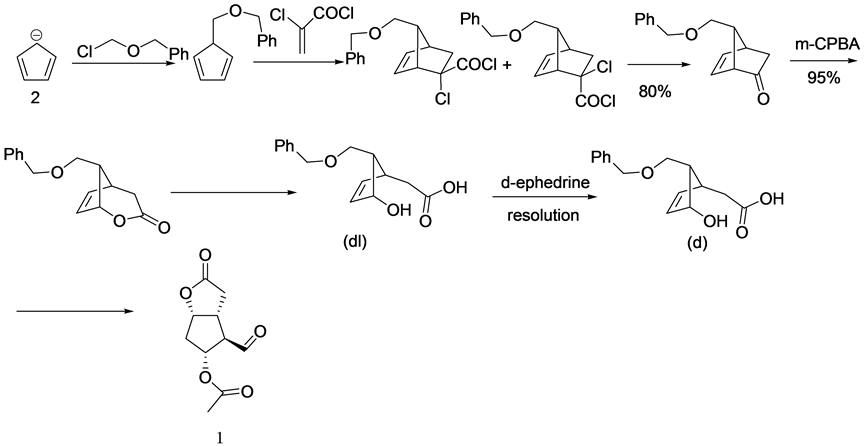
Figure 3. Cyclopentadiene salt for synthesis of CL
图3. 以环戊二烯盐为原料合成CL

Figure 4. Norbornadiene for the synthesis of CL
图4. 以降冰片二烯为原料合成CL
并在合成过程中对关键手性中间体(5)进行拆分工艺的研究,确定了一条便于工业生产的工艺路线。
2. 实验部分
2.1. 试剂与仪器
JT302N型电子天平(上海精天电子仪器有限公司);YRT-3型熔点仪(南京旭析仪器有限公司);SHZ-D(Ⅲ)型循环水式真空泵(巩义市英峪予华仪器厂);SHIMADZU SPD
降冰片二烯(化学纯,百灵威试剂);甲酸(分析纯,阿拉丁试剂);乙醚(分析纯,川东化工有限公司);多聚甲醛(分析纯,阿拉丁试剂);S-(-)-α-苯乙胺(分析纯,阿拉丁试剂);溴化氢(40%,阿拉丁试剂);冰醋酸(分析纯,川东化工有限公司);过氧乙酸(30%,阿拉丁试剂);氯甲酸乙酯(阿拉丁试剂);三乙胺(分析纯,川东化工有限公司);对甲苯磺酸(分析纯,川东化工有限公司);无水乙醇(分析纯,川东化工有限公司);苯甲酰氯(分析纯,阿拉丁试剂)。
2.2. 实验过程
2.2.1. 3-羟甲基三环-[
将甲酸(180 mL, 4771.8 mmol)和多聚甲醛(17.6 g, 586.3 mmol)置于250 mL三颈瓶中,冰盐浴降温至5℃时开始将浓硫酸4 mL滴加入反应瓶;搅拌均匀,将降冰片二烯(39.3 g, 426.7 mmol)和100 mL甲酸混合于恒压滴液漏斗中,置换氮气,待内温降至0℃,滴加上述混合物,维持内温0℃,1 h滴毕,缓慢升温至室温反应过夜;减压旋去甲酸,残留物加200 mL冰水,冰浴下用NaHCO3调pH = 6;用乙醚萃取,合并有机层,饱和食盐水洗涤后,收集有机层,无水硫酸钠干燥,过滤,滤液减压旋干得粗品95.59 g;油泵减压蒸馏收集82℃~96℃馏分,得到无色透明油状物63.40 g,收率:75.73%。1H NMR (400 MHz, CDCl3) δ 7.99 (s, 1H), 7.90 (s, 1H), 4.58 - 4.42 (m, 2H), 4.31 - 4.20 (m, 1H), 2.14 (td, J = 10.6, 2.0 Hz, 1H), 1.98 (td, J = 10.7, 3.3 Hz, 1H), 1.93 (q, J = 1.9 Hz, 2H), 1.39 (tt, J = 10.4, 2.5 Hz, 1H), 1.29 (dt, J = 12.3, 2.5 Hz, 1H), 1.19 (dt, J = 12.3, 2.6 Hz, 1H). MS(ESI), m/z(%): 195.07(M + H, 100)。
2.2.2. 3-氧代三环-[
取化合物4(56.40 g, 287.46 mmol)溶于1200 ml丙酮中,冰盐浴降温−5℃;滴加琼斯试剂500 mL,维持反应温度0℃以下,4 h滴毕,维持冰盐浴1 h,缓慢升至室温过夜;加入异丙醇200 mL,淬灭反应,减压蒸干反应液,得到油状物与固体混合物;向混合物中加入200 mL饱和食盐水,10 ml浓盐酸搅拌均匀,用乙酸乙酯萃取,合并有机层,用饱和食盐水洗涤有机层,收集有机层,无水硫酸钠干燥;过滤,滤液旋干得淡黄色固体41.87 g,收率95.77%。1H NMR (400 MHz, CDCl3) δ 3.93 (t, J = 10.5 Hz, 1H), 2.67 - 2.59 (m, 2H), 2.53 (dd, J = 2.6, 1.9 Hz, 1H), 2.31 (tt, J = 10.4, 2.4 Hz, 1H), 1.73 (dt, J = 12.5, 2.3 Hz, 1H), 1.63 (dt, J = 12.3, 2.3 Hz, 1H). MS(ESI), m/z(%): 151.14(M + H, 100)。
2.2.3. 3-氧代三环-[
将化合物5(10 g, 60.57 mmol)溶于丙酮中,室温搅拌;室温下滴加S-(-)-α-苯乙胺,搅拌过夜,进行初始结晶;0℃以下,静置析晶;过滤,滤饼溶于水后,用浓HCl调至pH = 2后,EA萃取,无水硫酸钠干燥,得2.21 g,收率44.20%,HPLC(HEX/IPA = 80:20, CHIRALPAKAD-H, t1 = 16.23 min, t2 = 18.57 min)测定ee. ≥ 99%。
2.2.4. 2-外型-溴代-5-氧代-降莰烷-7-顺式-羧酸(6)
取化合物5(1 g, 6.57 mmol)溶于HBr 5 mL后,加入HAc 5 mL搅拌溶清,80℃反应3 h;减压旋去HAc和氢溴酸,得到油状物和固体混合物,加入乙酸乙酯30 mL,饱和食盐水30 mL,萃取分离有机层,水层用乙酸乙酯萃取,合并有机层,无水硫酸钠干燥;过滤,滤液减压旋干得到浅黄色固体1.41 g,收率92.61%。1H NMR (400 MHz, CDCl3) δ 3.71 (td, J = 7.1, 1.2 Hz, 1H), 2.69 (t, J = 2.4 Hz, 1H), 2.65 (tt, J = 4.3, 2.3 Hz, 1H), 2.44 (ddd, J = 12.4, 7.1, 3.4 Hz, 1H), 2.36 (dd, J = 12.5, 3.1 Hz, 1H), 2.28 (dd, J = 6.0, 3.3 Hz, 1H), 2.18 (ddd, J = 12.4, 7.1, 3.5 Hz, 1H), 2.09 (dd, J = 12.4, 3.0 Hz, 1H), MS(ESI), m/z(%): 231.03(M + H, 100), 233.24(M + H, 100)。
2.2.5. 6-外型-溴代-3-氧-2-氧杂双环[3,2,1]辛烷-8-反式-羧酸(7)
将化合物6(1.41 g, 6.05 mmol)溶于10 mL二氯甲烷,加入Na2CO3(1.27 g, 11.98 mmol)搅拌澄清;滴加40%过氧乙酸(1.83g, 12.04 mmol),室温反应3 h;冰浴下,用浓盐酸调pH = 3后,用Na2SO3淬灭反应至淀粉碘化钾试纸不变色。减压旋去二氯甲烷,得到白色混浊物,用乙酸乙酯萃取,合并有机层,无水硫酸钠干燥;过滤,滤液旋干得到乳白色固体1.39 g,收率:92.06%。1H NMR (400 MHz, CDCl3) δ 3.71 (dt, J = 7.0, 3.5 Hz, 1H), 2.87 (q, J = 3.0 Hz, 2H), 2.46 (dd, J = 12.4, 3.4 Hz, 1H), 2.34 (ddd, J = 12.4, 6.8, 3.4 Hz, 1H), 2.21 (dd, J = 12.4, 3.4 Hz, 1H), 2.09 (ddd, J = 12.4, 6.8, 3.4 Hz, 1H), m/z(%): 247.21(M + H, 100), 249.24(M + H, 100)。
2.2.6. 6-外型-溴代- 8-反式-羟甲基-3-氧代-2-氧杂双环[3,2,1]辛烷(8)
取化合物7(1 g, 4.01 mmol)加入三颈瓶,三乙胺(0.49g, 4.41 mmol)的四氢呋喃稀释液加入恒压滴液漏斗中备用,置换氮气,将5 mL四氢呋喃注射加入反应瓶,冰浴条件下,加入氯甲酸乙酯(0.44 g, 4.05 mmol),搅拌30 min后冷过滤,收集滤液;再次置换氮气后,向滤液中滴加Zn(BH4)2(0.272 g, 2.86 mmol)的四氢呋喃稀释液,冰水浴反应3 h;用饱和NH4Cl溶液20 ml淬灭反应,二氯甲烷萃取,收集有机层,依次用饱和NaHCO3溶液,酸水,饱和NaHCO3溶液洗涤,收集有机层,无水硫酸钠干燥;过滤,减压旋干得到油状物1.01 g,过柱得0.62 g油状物,收率66.25%。1H NMR (400 MHz, CDCl3) δ 4.58 (td, J = 3.1, 2.0 Hz, 1H), 3.71 (td, J = 7.5, 0.6 Hz, 1H), 3.58 (dd, J = 12.4, 7.8 Hz, 1H), 3.33 (dd, J = 12.4, 7.8 Hz, 1H), 2.50 - 2.41 (m, 2H), 2.34 (ddd, J = 12.4, 7.5, 3.1 Hz, 1H), 2.09 (ddd, J = 12.4, 7.5, 3.0 Hz, 1H), 2.03 - 1.96 (m, 1H), 1.16 (s, 1H), MS(ESI), m/z(%): 233.04(M + H, 100), 234.98(M + H, 100)。
2.2.7. (3aR, 5R, 6aS)-5-羟基-4-((四氢-2H-吡喃-2-氧基)甲基)-六氢并[b]呋喃-2-酮(9)
取化合物8(0.4 g, 1.72 mmol)溶于10 mL干燥DCM中,加入催化量对甲苯磺酸,搅拌溶清;加入DHP(0.29 g, 3.44 mmol)室温反应5 h后,反应完全;加入饱和NaHCO3 20mL淬灭反应,分取有机层,水层用DCM萃取,合并有机层,用饱和食盐水洗涤,收集有机层,无水硫酸钠干燥;过滤,减压旋干得到黄色油状物,用四氢呋喃溶清,依次加入30% H2O2 4.314 mL,水4.314 ml, LiOH·H2O(45.8 mg, 1.09 mmol),室温反应5 h;反应液加入50 mL乙酸乙酯,收集有机层后用饱和Na2SO3洗涤,无水硫酸钠干燥;过滤,滤液减压旋干得到淡黄色油状物0.43 g;硅胶柱纯化得到目标物化合物(9)0.34 g,收率70.58%;1H NMR (400 MHz, CDCl3) δ 4.86 (t, J = 6.3 Hz, 1H), 4.10 (dt, J = 9.0, 5.0 Hz, 1H), 3.79~3.71 (m, 1H), 3.66 (dq, J = 11.8, 4.8 Hz, 1H), 3.54 (dd, J = 12.3, 9.3 Hz, 1H), 3.42 (dd, J = 12.5, 1.8 Hz, 1H), 3.29 (dd, J = 6.3, 3.4 Hz, 1H), 3.17 (dd, J = 12.5, 1.8 Hz, 1H), 2.02 (ddd, J = 12.5, 5.1, 3.4 Hz, 1H), 1.96 - 1.86 (m, 2H), 1.85 - 1.57 (m, 8H). MS(ESI), m/z(%): 256.21(M + H, 100)。
2.2.8. (3aR, 5R, 6aS)-4-(羟甲基)-2-氧代-六氢-2H-环戊二烯并[b]呋喃-5-基苯甲酸(CL)
取化合物9(0.25 g, 0.98 mmol)用二氯甲烷溶清后,加入DMAP(0.2375 g, 1.95 mmol),搅拌溶清;冰浴下,加入苯甲酰氯(0.275 g, 1.96 mmol),室温反应2 h,TLC监测反应完全;用饱和Na2CO3淬灭反应,收集有机层,无水硫酸钠干燥;过滤减压旋干得淡黄色油状物,用甲醇溶清后,加入10% p-TsOH调pH5,室温搅拌3 h;减压旋干反应液,硅胶柱纯化,得白色固体0.18 g,收率 77.15%。1H NMR (400 MHz, CDCl3) δ 8.00 (dd, J = 7.5, 1.3 Hz, 2H), 7.63 - 7.57 (m, 1H), 7.51 (t, J = 7.4 Hz, 2H), 4.58 (td, J = 8.2, 6.3 Hz, 1H), 4.10 (q, J = 6.6 Hz, 1H), 3.63 (dd, J = 12.5, 7.1 Hz, 1H), 3.38 (dd, J = 12.5, 7.1 Hz, 1H), 3.10 (dd, J = 12.5, 4.6 Hz, 1H), 2.38 (dd, J = 12.5, 4.6 Hz, 1H), 2.29 (ddd, J = 12.5, 8.3, 6.8 Hz, 1H), 2.02 (ddt, J = 26.6, 13.4, 7.1 Hz, 2H), 1.80 (ddt, J = 7.0, 6.3, 4.6 Hz, 1H), 1.16 (s, 1H). MS(ESI), m/z(%): 239.20(M + H, 100)
3. 实验结果与讨论
在CL合成过程工艺中,关键手性中间体(5)的拆分是该过程的关键步骤。目前,对该化合物的拆分主要有两种方法:一是采用酶解法进行拆分,二为化学拆分。
对关键手性中间体(5)进行化学拆分,国内少有报道,龚彦春等人[11] 应用(S)-(-)-N-苄基-α-甲基苄胺为拆分剂、乙酸异丙酯为溶剂,对消旋体5进行拆分,并成功合成了CL。但在该法中,其用到的拆分剂(S)-(-)-N-苄基-α-甲基苄胺以及结晶溶剂乙酸异丙酯都比较昂贵,不适合于工业大生产。本课题组通过对拆分剂的筛选,拆分剂的用量,溶剂的筛选以及结晶条件的摸索(表1),最终选择比较常见且经济易得的S-(-)-α-苯乙胺以及丙酮对消旋化合物5进行拆分,得到了一个比较适合工业生产的条件,即以0.5 N的S-(-)-α-苯乙胺为拆分剂在梯度降温的条件下成盐结晶,最终手性拆分收率44.20%,HPLC(HEX/IPA = 80:20, CHIRALPAKAD-H)测定ee. ≥ 99%。
3.1. 拆分试剂的选择
以相同的结晶溶剂,不同的拆分剂,在相同的条件下,对关键中间体(5)进行拆分(表1),考虑到S-(-)-α-苯乙胺较(S)-(-)-N-苄基-α-甲基苄胺常见且便宜,最终选择以S-(-)-α-苯乙胺作为拆分剂进行拆分。
3.2. 拆分试剂用量的选择
在相同的溶剂中,不同的拆分剂比例,对ee值的存在一定的影响(表2),最终选择以0.5N的S-(-)-α-苯乙胺进行拆分。
Table 1. The resolution reagent selection
表1. 拆分试剂筛选
Table 2. The dosage of resolution reagent
表2. 拆分试剂用量筛选
Table 3. The solvent of split
表3. 拆分条件筛选
3.3. 溶剂的筛选
不同的溶剂以及不同的结晶条件,是拆分ee值的关键影响因素,本课题组重点对其进行了研究(表3),最终确定了以丙酮为拆分溶剂,梯度降温的方式对关键中间体(5)进行拆分。
4. 结论
本文成功的以降冰片二烯为原料完成了对CL的合成,并对合成路线中产生的关键手性中间体(5)拆分进行了工艺研究,通过筛选,选择的拆分试剂和结晶溶剂,最终得到了一条相对于其他文献报道更加价廉易得,符合工业化生产的工艺路线。
文章引用
邓 涛,毛 伟,陶 春,李勤耕, (2015) 前列腺素类药物关键中间体Corey Lactone的合成工艺研究
The Study on the Synthesis of PGs Ke Intermediate—Corey Lactone. 药物资讯,01,15-21. doi: 10.12677/PI.2015.41002
参考文献 (References)
- 1. Cheung, C.Y., Beardall, M.K., Anderson, D.F. and Brace, R.A. (2014) Prostaglandin E2 regulation of amnion cell vascular endothelial growth factor expression: relationship with intramembranous absorption rate in fetal sheep. Brace American Journal of Physiology—Regulatory, Integrative and Comparative Physiology, 307, 354-360.
- 2. Maddipati, K.R., Romero, R., Chaiworapongsa, T., Zhou, S.L., Xu, Z., Tarca, A.L., Kusanovic, J.P., Munoz, H. and Honn, K.V. (2014) Eicosanomic profiling reveals dominance of the epoxygenase pathway in human amniotic fluid at term in spon-taneous labor. The FASEB Journal, 28, 4835-4846.
- 3. Noonan, J.E., Dusting, G.J., Nguyen, T.T., Jenkins, A., Man, R.E., Best, W.J., Dias, D.A., Jayasinghe, N.S., Roessner, U. and Lamoureux, E.L. (2014) Flicker light-induced retinal vasodilation is unaffected by inhibition of epoxyeicosatrienoic acids and prostaglandins in humans. Investigative Oph-thalmology & Visual Science, 55, 7007-7013.
- 4. Shewchuk, B.M. (2014) Prostaglandins and n-3 polyunsaturated fatty acids in the regulation of the hypothalamic-pi- tuitary axis. Prostaglandins, Leukotrienes and Essential Fatty Acids, 91, 277-287.
- 5. Kim, S.F. (2014) The nitric oxide-mediated regulation of prostaglandin signaling in medicine. Vitamins & Hormones, 96, 211-245.
- 6. Banks, W.A. (2014) The blood-brain barrier in neuroimmunology: Tales of separation and assimilation. Brain, Behavior, and Immunity, 44C, 1-8.
- 7. Corey, E.J., Weinshenker, N.M. and Schaaf, T.K. (1969) Willy Huber. Stereo-controlled synthesis of prostaglandins F2α and E2 (dl). Journal of the American Chemical Society, 91, 5675-5677.
- 8. Corey, E.J., Albonico, S.M., Koelliker, U., et al. (1971) New reagents for stereoselective carbonyl reduction. An im- proved synthetic route to primany prostaglandins. Journal of the American Chemical Society, 93, 1491-1493.
- 9. Bindra, J.S., Grodski, A., Schaaf, T.K., et al. (1973) New extensions of the bicyclo [2.2.1] heptane route to prostaglan- dins. Journal of the American Chemical Society, 95, 7522-7523.
- 10. Corey (1971) Novel prostaglandin intermediates. US3992438, 180, 24.
- 11. 龚彦春, 徐红, 谢涓等 (2012) Corey内酯中间体2-氧代三环 [2.2.1.0](3,5)] 庚烷-7-羧酸的新拆分方法. 中国药科大学学报, 5, 385-389.
