World Journal of Cancer Research
Vol.07 No.01(2017), Article ID:19541,5
pages
10.12677/WJCR.2017.71002
Study of Pleural Effusion after Radiofrequency Ablation for Primary Hepatocellular Carcinoma
Song Wang*, Jian Feng, Kai Jiang#
PLA Medical School, Department of Hepatobiliary Surgery, PLA General Hospital, Beijing
Received: Dec. 28th, 2016; accepted: Jan. 14th, 2017; published: Jan. 17th, 2017
Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Objective: To investigate the factors influencing the formation of pleural effusion in patients with primary liver cancer after radiofrequency ablation, and to evaluate the safety of RFA. Methods: We retrospectively reviewed 45 primary hepatic carcinoma patients who accepted one-off complete radiofrequency ablation (RFA). According to the tumor location, they were divided into group A (close to the diaphragm, less than 10 mm) and group B (away from the diaphragm, more than 10 mm). Then we observed whether pleural effusion occurred or not in each case. The outcomes were analyzed statistically to determine whether the location of the tumor affects the occurrence of pleural effusion after RFA or not. Results: There was a significant difference in the incidence of pleural effusion between group A and group B. Conclusion: The location of tumor is an important factor that affects the occurrence of pleural effusion after RFA for liver cancer.
Keywords:Radiofrequency Ablation (RFA), Pleural Effusion, Carcinoma, Hepatocellular

原发性肝癌射频消融术后胸腔积液的研究
王松*,冯健,姜凯#
解放军医学院、解放军总医院肝胆外科,北京

收稿日期:2016年12月28日;录用日期:2017年1月14日;发布日期:2017年1月17日

摘 要
目的:探讨原发性肝癌射频消融术后胸腔积液形成的影响因素,从而更好的评估射频消融的安全性。方法:对45例采用一次性完全射频消融治疗的肝癌患者进行回顾性分析,根据肿瘤位置不同分为(靠近膈肌组,≤10 mm)A组和(远离膈肌组,>10 mm)B组,观察是否出现胸腔积液并进行统计学分析,从而判定肿瘤位置是否是影响射频消融术后胸腔积液出现与否的因素。结果:A组和B组射频术后胸腔积液的发生率有显著差异。结论:肿瘤位置是影响肝癌射频消融术后是否出现胸腔积液的重要因素。
关键词 :射频消融,胸腔积液,癌,肝细胞

1. 引言
射频消融目前已成为肝癌的一线治疗方法,并被证实是安全有效的 [1] 。据报道,对于小肝癌的治疗,射频消融已取得同手术相近的疗效,并且具有微创、花费少的优势 [2] 。对于直径较大、高危部位肝癌射频消融治疗,如今也不乏很多成功的例子 [3] [4] 。虽然射频消融具有微创的优势,但是有时也会引起诸多的并发症,例如出血、胆系损伤、感染、胸膜损伤、气胸、胸腔积液、血管损伤、肝功能不全、肾功能损伤等。对于射频消融术后的胸腔积液,一般认为是射频消融术后的严重并发症,然而,专门对此的文献研究较少,反映出其并未引起足够重视。膈顶部肝癌被认为是射频消融的特殊位置,经皮射频消融治疗时存在定位困难、并发症高等问题,为此,有学者报道CT引导下经肺射频消融治疗膈顶部肝癌 [5] [6] [7] 、腹腔镜引导下经胸廓经膈肌射频消融膈顶部肝癌 [8] [9] 以及借助人工胸水或腹水射频消融 [10] [11] 等不同方式,虽然都在一定程度上解决了上述问题,但或多或少也存在创伤大、并发症多、操作困难等缺点。我中心肝胆外科总结多年来肝癌射频消融的治疗经验,采用腹腔镜辅助超声引导下射频消融治疗近膈顶部肝癌,取得较好疗效。但在射频消融的临床工作中,我们观察到靠近膈肌的肝癌射频消融时似乎更容易出现胸腔积液,为了探讨原发性肝癌射频消融术后胸腔积液形成的影响因素,从而更好的评估射频消融的安全性,本文进行如下研究。
2. 资料与方法
2.1. 一般资料
2014年9月~2016年6月期间收治的经临床诊断为肝癌的新发、单发肝癌(肿瘤最大径 ≤ 5 cm)患者45例,其中男36例,女9例,年龄26~79岁,中位年龄54岁。术前1例肿瘤血供丰富者行TACE治疗,所有患者术前肝功能为Child-Pugh A级或B级(见表1)。
射频消融仪为Cool-tipTM RF ablation system (Valleylab, USA),射频消融针根据肿瘤大小选择单集或集束射频消融针。
Table 1. Patient demographics and tumor characteristics
表1. 病人及肿瘤特征
2.2. 纳入标准
所有患者为新发、单发肝癌患者,肿瘤最大径 ≤ 5 cm;心肺功能可耐受手术;术前未行手术、消融、介入等治疗;术前肝功能为Child-Pugh A级或B级;患者自愿选择射频消融为肝癌治疗方式。
2.3. 排除标准
肝功能为Child-Pugh C级;出现门静脉癌栓;出现远处转移。
2.4. 方法
所有患者术前检查评估后无明显手术禁忌症,对肝功能较差患者常规保肝、利尿等治疗。完善术前准备后,均于外科手术室取平卧位,全身麻醉后气管插管。我们采用腹腔镜辅助超声引导下进行射频消融。首先常规超声探查肝脏,确认肿瘤位置、大小,以及有无其他病灶、肝脏质地等,选择合适的射频消融针穿刺路径,将射频消融针准确置入病灶中,进行射频消融。为了更好的显示肿瘤或选择穿刺路径,必要时需麻醉师辅助暂时控制呼吸。消融完毕逐渐拔除射频消融针,建立Trocar置入腹腔镜,检查有无出血、胆瘘等并发症,必要时给予冲洗、压迫止血等处理。对于肝癌位于肝脏表面位置且腔镜易于直视的患者,建立Trocar置入腹腔镜,在腹腔镜直视下射频消融,确保病灶完全坏死,消融完毕后检查有无出血、胆瘘等并发症,必要时给予冲洗、压迫止血等处理。检查完毕后逐层缝合腹壁。病人麻醉清醒后返回病房继续观察、补液、营养支持、保肝等治疗。所有患者手术后第2天左右行肝脏CT扫,重点观察消融情况,同时也可准确的诊断是否存在胸腔积液及胸腔积液量多少。将胸腔积液深度大于1 cm诊断为有胸腔积液,否则诊断为无胸腔积液。手术后1月常规消融术后复查。
3. 结果
3.1. 一般情况
45例患者均成功完成射频消融治疗,所有患者术中情况平稳,无严重出血、胆瘘等并发症发生,术后患者出现轻到中等程度的转氨酶升高,经保肝等治疗后有所缓解,手术后1月复查转氨酶恢复正常。所有患者术后CT检查均见消融范围完全覆盖肿瘤所在区域。手术后1月随访患者均未见肿瘤复发。
3.2. 统计学分析
所得数据以均数 ± 标准差(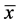 ± s)表示,采用SPSS 20.0统计学软件进行数据处理及统计学分析。计量资料组间比较用t检验,计数资料采用X2检验。P < 0.05为差异有统计学意义。
± s)表示,采用SPSS 20.0统计学软件进行数据处理及统计学分析。计量资料组间比较用t检验,计数资料采用X2检验。P < 0.05为差异有统计学意义。
一般情况比较:两组患者的年龄、体重、性别、肿瘤大小、术前术后血清白蛋白等比较,差异无统计学意义(见表1)。所有患者术前影像学检查均未见胸腔积液。45例患者中17例靠近膈肌(A组),28例远离膈肌(B组),A组有11例发生胸腔积液,其中1例为中等量胸腔积液,B组有4例发生胸腔积液,两组胸腔积液发生率具有统计学差异(P < 0.05)。手术后1月复查结果:所有患者胸腔积液均自行吸收好转。
4. 讨论
肝癌射频消融治疗具有微创、花费低的优势,其应用受限的最大因素即是较高的复发率,尤其是与手术相比,其局部复发率较高。一次性完全射频消融旨在通过控制局部复发率来减少肝癌的总体复发率,从而改善患者的预后。在实现一次性完全的同时,同时要注意控制并发症的发生率,从而使病人获得最大收益。
胸腔积液是射频消融术后的常见并发症,其可通过临床表现、胸片、CT检查、超声检查等多种手段进行诊断。以往的研究报道的胸腔积液多为中至重度胸腔积液,往往需要穿刺抽液或胸腔闭式引流等治疗手段才能治愈,此种情况多为病人出现呼吸困难等临床症状时行进一步检查明确诊断,因此文献报道的胸腔积液发生率相对较低 [6] 。本研究选择针对所有患者术后第2天左右行CT检查,且CT检查是一种对胸腔积液敏感度较高的检查,即便是胸腔积液的量不足以引起临床症状时,也能被检测出来,目的是更好的研究胸腔积液的影响因素,因此可以看到本研究中纳入的患者胸腔积液发生率较高。本研究选择的患者均为单发小肝癌患者,射频消融后引起的胸腔积液多为少量,但是,当对多发、大肝癌进行射频消融时,势必会引起相对更多量的胸腔积液,从而对病人尤其是老年或者危重病人产生更大的不良影响,因此,本研究对评估肝癌射频消融术后胸腔积液的发生具有一定的临床指导意义。
众所周知,射频消融时伴随着热沉降效应。理论上讲,只要有血管的存在,就会有热沉降效应的存在,只是热沉降效应大小有所区别。对靠近主要肝动脉、门静脉、肝静脉的肿瘤进行消融时都会受到热沉降效应的影响。当肝癌靠近膈肌时,势必也靠近膈肌的血管,因此我们推测对膈顶肝癌进行消融时也会由于膈肌血管的存在而产生热沉降效应。热沉降效应的存在带走了部分消融时的热量,易使肿瘤消融不完全,从而使局部复发率升高。这可能解释了膈顶部肝癌射频消融时局部复发率高、生存率低的事实 [12] 。因此要确保膈顶部肝癌的消融,就需要增加射频消融的功率与时间。RFA在局麻下进行时,患者术中疼痛不适,一定程度上影响了治疗效果,尤其是对膈顶部肿瘤进行消融时,射频对膈肌的刺激引起患者疼痛尤为剧烈,往往难以耐受甚至中止治疗 [13] 。为了实现一次性完全射频消融,我们在准确定位的基础上采用大功率、长时间射频消融。全身麻醉的实施打破了局麻的局限性,为一次性完全消融提供麻醉保证。局麻下由于热对膈肌的刺激而使病人难以耐受,并大大增加病人的心理负担,因此我们采用全麻下一次性完全射频消融。
对于位置靠近膈肌的肝癌进行射频消融时,一方面,射频消融时产生的热量直接作用于膈肌,对膈肌产生热损伤,同时,由于膈肌血管热灌溉效应,而对相应血管的引流区域膈肌产生热损伤,这些热作用于胸膜引起反应性渗出,从而产生胸腔积液;另一方面,在针道选择不当时,射频消融针容易穿过肺组织,或者进针过深时穿透膈肌,这可能是大量胸腔积液甚至血性胸腔积液产生的主要原因。在本研究中纳入的患者均为单发小肝癌,因此射频时对膈肌的热损伤有限,故导致的胸腔积液多为少量,可自行吸收。在临床工作中,我们同时观察到,当肝癌数目较多时,相比于单发肝癌,产生胸腔积液的几率更大,胸腔积液的量更多;当肝癌的体积更大时,相比于体积更小的肝癌,产生胸腔积液的几率更大,胸腔积液的量更多。另外,从研究的结果可以看出,靠近膈肌组并非都发生胸腔积液,与此同时,远离膈肌组也有胸腔积液发生,因此胸腔积液的发生还受其他因素的影响。
综上所述,肿瘤位置是影响肝癌射频消融术后是否出现胸腔积液的重要因素,靠近膈肌的肝癌射频消融时更容易发生胸腔积液。但总体而言,射频消融导致的胸腔积液量少,且可以通过自行吸收好转,对病人的影响不大。射频消融针对肺或膈肌的直接损伤可能是大量胸腔积液甚至血胸发生的主要原因,因此,避免射频消融针对肺或膈肌的直接损伤尤为关键。
基金项目
首都市民健康项目培育(课题编号:Z151100003915131)。
文章引用
王 松,冯 健,姜 凯. 原发性肝癌射频消融术后胸腔积液的研究
Study of Pleural Effusion after Radiofrequency Ablation for Primary Hepatocellular Carcinoma[J]. 世界肿瘤研究, 2017, 07(01): 6-10. http://dx.doi.org/10.12677/WJCR.2017.71002
参考文献 (References)
- 1. European Association for the Study of the Liver, European Organisation for Research and Treatment of Cancer (2012) EASL-EORTC Clinical Practice Guidelines: Management of Hepatocellular Carcinoma. Journal of Hepatology, 56, 908-943. https://doi.org/10.1016/j.jhep.2011.12.001
- 2. Dong, W., Zhang, T., Wang, Z.-G., et al. (2014) Clinical Outcome of Small Hepatocellular Carcinoma after Different Treatments: A Meta-Analysis. World Journal of Gastroenterology, 20, 10174-10182. https://doi.org/10.3748/wjg.v20.i29.10174
- 3. Jiang, K., Zhang, W.-Z., Liu, Y., et al. (2014) “One-Off” Complete Radiofrequency Ablation for Hepatocellular Carcinoma in a “High-Risk Location” Adjacent to the Major Bile Duct and Hepatic Blood Vessel. Cell Biochemistry and Biophysics, 69, 605-617. https://doi.org/10.1007/s12013-014-9840-8
- 4. Jiang, K., Zhang, W., Su, M., et al. (2013) Laparoscopic Radiofrequency Ablation of Solitary Small Hepatocellular Carcinoma in the Caudate Lobe. The Journal of Cancer Surgery, 39, 1236-1242. https://doi.org/10.1016/j.ejso.2013.08.002
- 5. Miura, H., Yamagami, T., Terayama, K., et al. (2010) Pneumothorax Induced by Radiofrequency Ablation for Hepatocellular Carcinoma Beneath the Diaphragm under Real-Time Computed Tomogra-phy-Fluoroscopic Guidance. Acta Radiologica, 51, 613-618. https://doi.org/10.3109/02841851003786001
- 6. Iguchi, T., Inoue, D., Yabushita, K., et al. (2012) Effect of CT Fluoroscopy-Guided Transpulmonary Radiofrequency Ablation of Liver Tumours on the Lung. The British Journal of Radiology, 85, e373-e377. https://doi.org/10.1259/bjr/34646739
- 7. Zhang, Q., Li, X., Pan, J., et al. (2015) Transpulmonary Computed Tomography-Guided Radiofrequency Ablation of Liver Neoplasms Abutting the Diaphragm with Multiple Bipolar Electrodes. Indian Journal of Cancer, 52, e64-e68. https://doi.org/10.4103/0019-509X.172516
- 8. Abe, E. and Abe, M. (2007) Pneumothorax during Laparoscopic Percutaneous Transthoracic Radiofrequency Ablation for Liver Tumors of the Hepatic Dome: A Case Report. Masui, 56, 1190-1192.
- 9. Tanaka, K., Kojima, T., Hiraguchi, E., et al. (2016) Laparoscopy-Guided Transthoracic Transdiaphragmatic Radiofrequency Ablation for Hepatic Tumors Located Beneath the Diaphragm. Journal of Laparoendoscopic and Advanced Surgical Techniques: Part A, 26, 180-184. https://doi.org/10.1089/lap.2015.0380
- 10. Uehara, T., Hirooka, M., Ishida, K., et al. (2007) Percutaneous Ultrasound-Guided Radiofrequency Ablation of Hepatocellular Carcinoma with Artificially Induced Pleural Effusion and Ascites. Journal of Gastroenterology, 42, 306-311. https://doi.org/10.1007/s00535-006-1949-0
- 11. Wang, C.C. and Kao, J.H. (2015) Artificial Ascites Is Feasible and Effective for Difficult-to-Ablate Hepatocellular Carcinoma. Hepatology International, 9, 514-519. https://doi.org/10.1007/s12072-015-9639-8
- 12. Chen, M.H., Yang, W., Yan, K., et al. (2008) Radiofrequency Ablation of Problematically Located Hepatocellular Carcinoma: Tailored Approach. Abdominal Imaging, 33, 428-4236. https://doi.org/10.1007/s00261-007-9283-4
- 13. 张晓霞, 孙文兵, 李明颖, 等. 不同方式全麻在肝癌经皮射频消融时的麻醉效果比较. 中国临床医生, 2011, 39(12), 36-38.
*第一作者。
#通讯作者。
