Hans Journal of Agricultural Sciences
Vol.2 No.3(2012), Article ID:2933,6 pages DOI:10.4236/HJAS.2012.23008
Study on Factors Influencing Callus Induction, Proliferation and Bud Differentiation of Anthurium scherzerinum
1Guangzhou Flower Research Center, Guangzhou
2Guangdong Provincial Key Laboratory of Plant Molecular Breeding, South China Agricultural University, Guangzhou
Email: baoguidu@126.com
Received: May 28th, 2012; revised: Jun. 1st, 2012; accepted: Jun. 11th, 2012
ABSTRACT:
In order to provide reference to the mass seedling production, the factors influencing the callus induction, proliferation and bud differentiation of Anthurium scherzerinum were studied by using the steriled seedling of 3 varieties such as Graffity as materials. Result: The results showed that the callus inducing rates of the 3 varieties were not obvious. 6-BA is the main influencing factor in the process of callus induction and bud differentiation. The inducing rate by using 2,4-D only was low, 20.84%. In the process of bud differentiation, the differentiation of combination of 6-BA + NAA is higher than that of combination of 6-BA + 2,4-D. The inducing rate and browning rate of callus were not obvious between different explants, in which the inducing rate of petiole was the highest, 97.22%, followed by leaf, the induction rate of root tip was the lowest, 93.06%. The related technical system of tissue culture of Anthurium scherzerinum was obtained from the test, which providing a basis to the large-scale production.
Keywords: Anthurium scherzerinum; Callus Induction; Proliferation; Bud Differentiation
影响火鹤愈伤组织诱导、增殖和芽分化的因素研究
杜宝贵1,梁彩红1,黎扬辉1,易懋升1,张志胜2
1广州花卉研究中心,广州
2华南农业大学广东省植物分子育种重点实验室,广州
Email: baoguidu@126.com
摘 要:
本研究旨在通过研究影响火鹤组培快繁的因素,以其为大规模种苗生产提供参考。试验以Graffity等3个火鹤品种的组培苗为材料,研究了影响火鹤愈伤组织诱导、增殖和芽分化的因素。研究结果表明,3个品种的组培苗叶片愈伤组织诱导率差异不明显;6-BA在无菌苗叶片愈伤组织诱导和分化过程中,是主要影响因素;单独使用2,4-D的愈伤诱导率低,仅为20.84%。在愈伤组织块分化过程中,6-BA + NAA组合的分化率比6-BA + 2,4-D组合的高;不同外植体的愈伤组织诱导率和褐变率差异不显著,叶柄的愈伤组织诱导率最高,为97.22%,叶片次之,根尖的愈伤组织诱导率最低,为93.06%。该试验初步获得了火鹤组培快繁的相关技术体系,为火鹤规模化生产提供了依据。
收稿日期:2012年5月28日;修回日期:2012年6月1日;录用日期:2012年6月11日
关键词:火鹤;愈伤组织诱导;增殖;芽分化
1. 引言
火鹤(Anthurium scherzerinum)又名席氏花烛、猪尾花烛,原产哥斯达黎加,为天南星科花烛属中的一种多年附生常绿草本植物。火鹤是作为高档盆花,具有广阔的开发前景。火鹤繁殖最早主要利用实生繁殖和分株繁殖,但存在种子不易得、周期长、后代生长一致性差、繁殖速度缓慢等缺点,不利于新品种的繁育和推广,组织培养是加快火鹤繁殖的有效途径。
自Pierik et al.于1974年对红掌进行组织培养以来,国内外学者在此基础上对花烛属进行了大量的研究,主要集中在红掌,而火鹤的研究比较少。火鹤的组培快繁主要通过愈伤组织发生途径[1,2]和体细胞胚胎发生途径[3]。前人研究表明影响火鹤愈伤组织诱导和不定芽再生的因素有品种、外植体、植物生长调节剂、基本培养基、光照和碳源等,但不同研究者的结论都有或大或小的差异。目前火鹤在国内已经建立了可用于工厂化繁殖的快繁技术,但仍然存在一些问题。因此,进一步研究影响火鹤组织培养快繁的因素,对建立高效的火鹤快繁技术体系,提高火鹤工厂化生产效率和效益具有重要的意义。
本研究以火鹤盆栽植株和组培苗为材料,系统地研究品种、外植体、植物生长调节剂、光照、基本培养基等因素对愈伤组织诱导、增殖和芽分化的影响,为建立高效便捷的火鹤快速繁殖技术体系提供依据。
2. 材料与方法
2.1. 材料
供试材料为二倍体火鹤“Graffity”、“Smaragd”和“Artus”的无菌组培苗。选取无菌苗的叶片、叶柄、根尖为外植体。
2.2. 方法
2.2.1. 无菌苗的愈伤组织诱导
将无菌苗叶片(0.2 cm × 0.5 cm)、叶柄(0.5 cm)、根尖(0.5 cm)分别接种到愈伤组织诱导培养基上。每瓶接8块,3瓶一个重复,设3次重复。于温度为25℃ ± 2℃培养室中暗培养,60 d后统计愈伤诱导率、褐变率和分化率。
诱导率(%) = 产生愈伤组织的外植体数(块)/接种外植体总数(块) × 100;
褐变率(%) = 褐变的外植体数(块)/接种外植体总数(块) × 100;
分化率(%) = 分化出芽的外植体数(块)/接种外植体总数(块) × 100。
2.2.2. 愈伤组织的继代增殖及芽分化
将愈伤组织切成0.5~1 cm2大小后接种到含有6-BA 0.5 mg/L + NAA 0.01 mg/L + 椰子汁10% + 蔗糖30 g/L + 卡拉粉7.8 g/L的三种不同基本培养基MS、Nitsch、1/3 MS中,每瓶接种3块,10瓶为1个重复,设2个重复。于恒温25℃,光照8 h,黑暗16 h的光照培养箱中培养。记录接种前每瓶愈伤组织的重量,40 d后再统计一次,按下列公式计算绝对生长速度和平均芽分化数(以高度大于2 cm的芽为有效芽)。
绝对生长速度(%) = [培养后重量(g) – 培养前的重量(g)]/培养前重量(g) × 100;
平均芽分化数(个/块) = [培养后的芽数(个) – 培养前的芽数(个)]/愈伤组织块数(块)。
2.2.3. 试管苗移栽
将愈伤组织块上的小苗切下,转到生根培养基1/2 MS + NAA 0.2 mg/L + 活性炭0.2 g/L + 白糖20 g/L + 卡拉粉7.8 g/L,40 d后苗的高度达到3~4 cm,根数为3~4条时移栽,无需炼苗。
2.2.4. 统计分析
统计分析用SPSS软件进行,平均数据以“平均数 ± 标准误(S.E.)”表示,多重比较采用邓肯氏新复极差检验法(Duncan’s Multiple Ranger Test, DMRT)。
3. 结果与分析
3.1. 影响火鹤无菌苗愈伤组织诱导的因素
3.1.1. 外植体对愈伤组织诱导率的影响
从表1可知,以无菌苗的叶片、叶柄和根尖的愈伤组织诱导率和褐变率差异不显著,且诱导率都高于93.00%。叶柄的愈伤组织诱导率最高,为97.22%(图1);叶片次之,但长出的愈伤组织块较大(图2);根尖的愈伤组织诱导率最低,为93.06%,且长出的愈伤组织也比较小(图3)。不同外植体的愈伤组织分化率差异显著(F = 57.80,P < 0.05),除了叶片和叶柄之间的愈伤组织分化率(图4、图5)差异不显著。根尖的愈伤组织分化率(图6)最低,仅有7.78%。

Table 1. Influence of explant on the callus induction of the aseptic seedling of “Graffity”*
表1. 外植体对火鹤“Graffity”无菌苗愈伤组织诱导的影响*

Figure 1. Callus from leaf
图1. 叶片诱导出的愈伤组织

Figure 2. Callus from petiole
图2. 叶柄诱导出的愈伤组织

图3. 根尖诱导出的愈伤组织

Figure 4. Callus differentiation from leaf
图4. 叶片愈伤组织分化

Figure 5. Callus differentiation from petiole
图5. 叶柄愈伤组织分化

Figure 6. Callus differentiation from root tip
图6. 根尖愈伤组织分化
3.1.2. 植物生长调节剂对火鹤愈伤组织诱导的影响
从表2可知,培养基L4上无菌苗叶片的愈伤组织诱导率显著低于其他处理,(F = 202.25,P < 0.05),而其他处理间并没有显著差异。在不同培养基上,愈伤组织的分化率除了L2和L3之间的分化率不显著,其它差异均显著(F = 222.25,P < 0.05)。培养基L3上的愈伤组织诱导率和分化率最高,为100.00%;培养基L4上的愈伤组织诱导率和分化率最低,分别为20.84%和15.56%。结果表明,在无菌苗叶片愈伤组织诱导和分化过程中,6-BA是主要影响因素;单独使用2,4-D的愈伤诱导率低,仅为20.84%(图7)。在愈伤组织块分化过程中,6-BA + NAA组合的分化率比6-BA + 2,4-D组合的高。
3.1.3. 基因型对火鹤愈伤组织诱导的影响
由表3可知,“Graffity”、“Smaragd”和“Artus”的无菌苗叶片的愈伤组织诱导率(F = 1.63,P > 0.05)和褐变率(F = 1.50,P > 0.05)差异不显著。在三个品种的愈伤
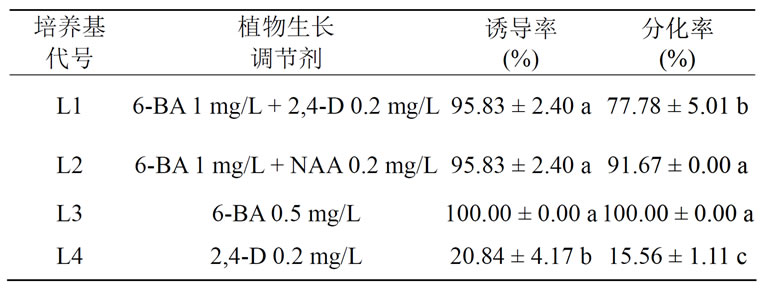
Table 2. Influence of plant growth regulator on the callus induction of the aseptic seedling of “Graffity”*
表2. 植物生长调节剂对火鹤“Graffity”无菌苗愈伤组织诱 导的影响*

Figure 7. Callus induction effect used 2,4-D only
图7. 单独使用2,4-D时愈伤组织的诱导效果
组织诱导试验中,“Graffity”的无菌苗叶片的愈伤组织诱导率最高,达95.83%。可见,基因型不是影响火鹤无菌苗愈伤组织诱导的因素,原因可能是无菌苗叶片极幼嫩,其分化能力特别强。
3.1.4. 光照
由表4可知,不同的光照模式对火鹤无菌苗叶片愈伤组织的诱导率、分化率和褐变率均无显著差异。暗培养下的组织块呈苍白,略带淡黄,分化出的芽发白(图8);散光和光照培养下的愈伤组织和分化出的芽呈绿色(图9、图10)。
3.2. 影响火鹤愈伤组织增殖和苗分化的因素
3.2.1. 基本培养基
以“Smaragd”、“Artus”的愈伤组织块为材料,选用MS、Nitsch、1/3 MS为基本培养基,研究基本培养基对愈伤组织增殖的影响。从表5可知,两个火鹤品种的愈伤组织在不同基本培养基上,其绝对生长速度差异分别达到显著水平(F = 945.33,P < 0.05;F = 137.22,P < 0.05)。结果表明,Nitsch为最佳的基本培养基,其愈伤组织绝对生长速度最高,分别为264.34%和267.52%,MS次之,而1/3 MS培养基上的愈伤组织绝对生长速度最低,仅为189.25%和191.23%。
3.2.2. 植物生长调节剂
细胞分裂素与生长素的浓度配比对愈伤组织的增殖和芽分化有很大的影响,从表6可知,火鹤愈伤组织在含有不同激素组合的培养基中培养,其绝对生长速度(F = 2297.69,P < 0.05)和平均芽分化数(F = 672.23,P < 0.05)差异达显著水平。结果表明,6-BA 0.5 mg/L + NAA 0.2 mg/L组合中,愈伤组织的绝对生长速度和平均芽分化数达到最高,分别为365.63%和5.37,有利于同时促进愈伤组织的增殖和芽分化。

Table3. Influence of varieties on the callus induction of the aseptic seedling*
表3品种对火鹤无菌苗愈伤组织诱导的影响*
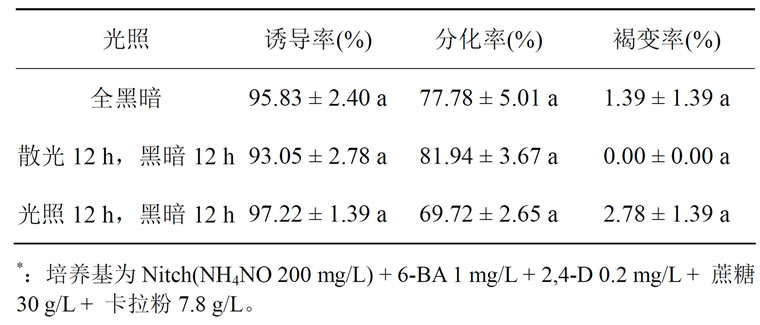
Table 4. Influence of plant growth regulator on the callus induction of the aseptic seedling of ‘Graffity’*
表4. 光照对火鹤“Graffity”无菌苗愈伤组织诱导的影响*
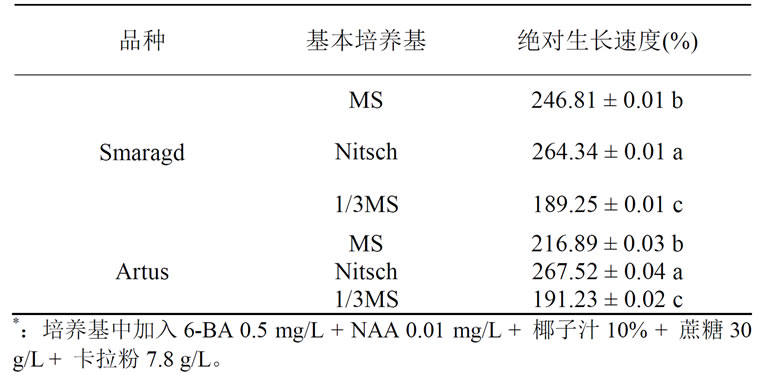
Table 5. Influence of basic culture medium on the callus proliferation*
表5. 基本培养基对火鹤愈伤组织增殖的影响*

Figure 8. Callus cultured without light
图8. 暗培养下的愈伤组织

Figure 9. Callus cultured with scattering light
图9. 散光条件下的愈伤组织

Figure 10. Callus cultured with normal light
图10. 光照条件下的愈伤组织
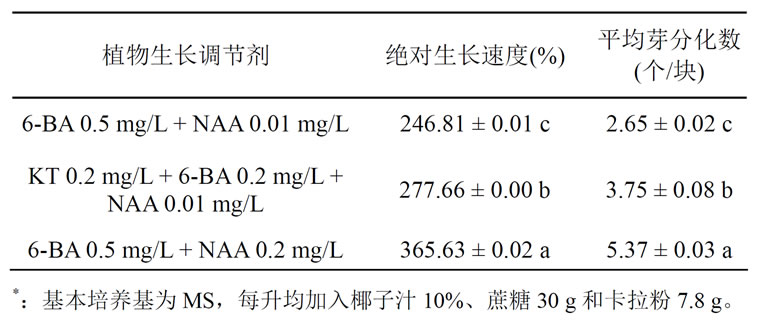
Table 6. Influence of plant growth regulator on the callus proliferation and bud differentiation of “Smaragd”*
表6. 植物生长调节剂对火鹤“Smaragd”愈伤组织增殖和 芽分化的影响*
4. 讨论与结论
火鹤愈伤组织诱导是进行快速繁殖的前提和基础。前人研究表明,品种是影响火鹤愈伤组织诱导的重要因素[4-6]。本研究也发现,不同火鹤品种愈伤组织诱导率差异显著。
不同的外植体或者同一外植体不同的部位、年龄对愈伤组织的诱导也有一定的影响。赵云鹏[7]发现红掌初展叶和刚成熟的叶片是产生愈伤组织较适宜的取材时期。周辉明[8]、江如兰[9]认为红掌愈伤组织的诱导难易顺序为茎、叶柄、叶片。本实验中发现适度成熟的幼嫩叶片具有较强的离体形态发生能力,是较佳诱导愈伤组织的材料,同时本研究还发现组培苗的不同外植体对愈伤组织诱导率并无显著差异,且诱导率达90%以上。植物生长调节剂是影响火鹤愈伤组织诱导的重要因素。陈华等[10]认为红掌叶片愈伤组织诱导的关键是细胞分裂激素。Botanik et al.[4]认为1 mg/L BA + 0.1 mg/L 2,4-D是火鹤叶片诱导效果最好的激素组合;潘学峰等[11]认为在红掌叶片愈伤组织诱导过程中2,4-D与BA配合诱导效果较好,NAA次之,IBA最差。本试验中BA配合2,4-D的诱导率比NAA的高。说明在愈伤组织诱导过程中,不同外植体所需的外源激素存在一定差异。本研究发现,利用组培苗进行愈伤组织诱导,单独使用6-BA或者与2,4-D、NAA相结合,诱导率都很高,达90%以上,而单独使用2,4-D则诱导率很低。说明6-BA是组培苗愈伤组织诱导的主要因素,这与李景[12]在哥伦比亚花烛上的研究结果相似。
对于光照对愈伤组织诱导的影响,不同研究者的研究结果不同。兰芹英等[5]认为光照对红掌愈伤组织有促进作用;陈华林[13]指出,光照强度超过3000 Lux不利于愈伤组织的诱导,在弱光800~1500 Lux条件下诱导率最高;王进茂[14]则认为光照对花烛愈伤组织的形成有抑制作用。岑益群等[15]认为在安祖花组培苗的培养中,昼长夜短可诱导愈伤组织生长。本研究发现,光照对组培苗的愈伤组织诱导率无显著差异,但在光照12 h培养下,其诱导率最高,长势比较好。
愈伤组织增殖和芽分化是影响火鹤快繁效率的主要因素。培养基中的无机盐含量对愈伤组织的增殖、芽和根的分化都有一定的影响。郭维明等[16]指出,适当降低基本培养基浓度(1/2 MS)有利于花烛再生芽的分化和生长。本研究表明在无机盐含量较低的Nitsch培养基上,愈伤组织的绝对生长速度比MS、1/3 MS的快。植物生长调节剂是影响愈伤组织增殖和芽分化的主要因素。夏时云等[17]研究发现,BA是影响红掌愈伤组织芽分化最重要的激素,但也有许多研究表明,红掌愈伤组织芽分化往往是多种激素相互平衡机协同作用的结果,激素的比例尤为重要[10-13,16-19]。本研究表明,6-BA 0.5 mg/L + NAA 0.2 mg/L有利于同时促进愈伤组织的增殖和芽的分化。
影响工厂化快繁的因素有很多,其中愈伤组织的年龄是重要因素之一。郭维明等[16]指出减少继代次数有利花烛芽的分化和生长。崔月羚[20]发现花烛愈伤组织继代次数对不定芽分化和芽质量影响很大,试验证明花烛无菌苗继代次数以4~6代为宜。我们在研究中也发现随着继代次数的增加,火鹤愈伤组织出现严重退化,表现为芽分化能力降低,生长减弱,繁殖系数减小,出现变异苗的几率增加、栽培性状也出现退化等。因此为了保持较高的繁殖系数和原品种的遗传稳定性,在试管繁育过程中应不断进行外植体的初始诱导分化。
在培养体系更新的过程中,重新从盆栽苗中取材存在一些问题,如培养周期长,在外植体消毒过程中耗费药剂,同时也存在一定的污染率等。本研究中发现,利用无菌苗为外植体,具有无污染、诱导率高、培养周期短等优点,而且诱导的愈伤组织经增殖分化后,分化的芽的生长势好。但是否与盆栽苗诱导的有无差异,还需移栽后等植株开花后观察才能证实。
参考文献 (References)
[1] R. L. M. Pierik. Anthurium andraeanum plantlets produced from cultivated in vitro. Plant Physiology, 1976, 37(1): 80-82.
[2] T. Geier. Morphogenesis and plant regeneration from spadix fragments of Anthurium scherzerianum. In: A. Fujiwara, Ed., Plant Tissue Culture. Tokyo: Proceedings of the 5th International Cong Plant Tissue and Cell Culture, 1982: 137-139.
[3] M. Hamidah, A. G. A. Karim and P. Debergh. Somatic embryogenesis and plant regeneration in Athurium scherzerianum. Plant Cell, Tissue and Organ Culture, 1997, 48: 189-193.
[4] T. Geier, et al. Factors affecting plant regeneration from leaf segments of Anthurium scherzerianum schott (Araceae) cultured in vitro. Plant Cell, Tissue and Organ Culture, 1986, 6(2): 115- 125.
[5] 兰芹英, 仇玉萍, 张远辉等. 不同红掌品种的叶片、叶柄和茎段愈伤组织的诱导及植株再生[J]. 西北植物学报, 2003, 23(6): 1006-1009.
[6] 姜蕾, 兰天维, 黎扬辉等. 影响红掌愈伤组织诱导、增殖和芽分化的因素[J]. 种子, 2006, 25(11): 26-30.
[7] 赵云鹏. 红掌人工诱变与遗传学分析[D]. 长沙: 湖南农业大学, 2002: 12-18.
[8] 周辉明, 尚伟, 陈燕等. 外植体、基本培养基和生长调节剂对红掌愈伤组织诱导影响的研究[J]. 江西农业学报, 2010, 22(1): 64-65.
[9] 江如燕, 张施君, 郑迎东. 红掌的组织培养和快速繁殖[J]. 仲恺农业技术学院, 2002, 15(4): 47-53.
[10] 陈华, 吴子平. 粉女郎红掌组培快繁技术研究[J]. 安徽农学通报, 2010, 16(21): 55-57.
[11] 潘学峰, 潘梅, 洪世军. 红掌叶片愈伤组织的诱导与植株再生[J]. 海南大学学报自然科学版, 2000, 18(2): 144-149.
[12] 李景. 哥伦比亚花烛的组织培养研究[D]. 武汉: 华中农业大学, 2001: 28-30.
[13] 陈华林. 不同培养条件和外植体处理对红掌品种组培效果的影响[J]. 园林花卉, 2003, l31(4): 35-37.
[14] 王进茂, 郑均宝, 高秀丽等.花烛组织培养的研究[J]. 河北林果研究, 2000, 15(1): 69-74.
[15] 岑益群, 蒋如敏, 邓志龙. 安祖花离体增殖的形态发生与理化因子效应[J]. 园艺学报, 1993, 20(2): 187-192.
[16] 郭维明, 赵云鹏, 文方德. 花烛愈伤组织不同继代培养的再分化差异[J]. 园艺学报, 2004, 31(1): 69-72.
[17] 夏时云, 麦瑜玲, 许继勇等. 提高红掌叶片愈伤组织诱导和植株分化及壮苗律的技术研究[J]. 中国农学通报, 2005, 21(2): 45-48.
[18] 刘玉东, 刘艳军, 杨静慧. 巨型红掌茎尖组织培养及快繁技术的研究[J]. 安徽农业科学, 2009, 37(12): 5358-5359.
[19] 李冰, 陈丽, 王梅等. 不同激素浓度对红掌品种组培效果的影响[J]. 现代农业科技, 2010, 8: 220-221.
[20] 崔月羚. 花烛离体培养与快速繁殖技术研究[D]. 南京: 南京农业大学, 2006: 45-48.