Hans Journal of Agricultural Sciences
Vol.3 No.4(2013), Article ID:12500,7 pages DOI:10.12677/HJAS.2013.34017
The Characteristics of Spatial Distribution of Soil Urease Activities in Dianchi Lake Watershed*
Institute of Environmental Sciences and Ecological Restoration & Key Laboratory for Conservation and Utilization of Bio-Resource of Yunnan, Yunnan University, Kunming
Email: change@ynu.edu.cn
Received: Jul. 8th, 2013; revised: Jul. 15th, 2013; accepted: Aug. 17th, 2013
Copyright © 2013 Chang’e Liu et al. This is an open access article distributed under the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
ABSTRACT:
In this paper, the soils were collected from Dounan town in Chenggong county, Shangsuan town in Jinning county, Songhua dam in Panlong district and Ma Jinpu in high-tech district as the objects of study. This research surveyed and evaluated soil urease activity of different sampling points and different regions by phenol-sodium hypochlorite colorimetric and made focuses on analyzing the directional distribution characteristics of soil urease activities in Dianchi lake watershed. Results were as follows: overall variation range of the soil urease activity in Dianchi lake watershed was: 5.30 - 28.70 mg/kg·h−1, different regions and different terrain have significant effect on soil urease activity. The sequence of soil urease activity level of these four areas in Dianchi Lake watershed is Chenggong county > high-tech district > Panlong district > Jinning county; and the average soil ureases of these four areas are 17.1 mg/kg·h−1, 12.41 mg/kg·h−1, 11.66 mg/kg·h−1 and 9.5 mg/kg·h−1, respectively. In addition, due to the big difference of vegetation coverage on different terrain soil, root system, the content of soil organic matter and soil physical and chemical properties, the directional distribution characteristics of soil urease activity of different terrain in Dianchi lake watershed was: dam flat ground > sloping cultivated land > woodland.
Keywords: Soil Urease Activities; Spatial Distribution; Dianchi Lake Watershed
滇池流域土壤脲酶活性的空间差异性研究*
刘嫦娥,杨 尹,段昌群,和树庄,彭 星,任晓娇
云南大学生命科学学院环境科学与生态修复研究所暨生物资源保护与利用重点实验室,昆明
Email: change@ynu.edu.cn
摘 要:
选取滇池流域呈贡县斗南镇、晋宁县上蒜镇、盘龙区松花坝、高新区马金铺四个区域的土壤为研究对象,通过苯酚–次氯酸钠比色法,测定不同区域采样点土壤脲酶活性。结果表明,滇池流域土壤脲酶活性总体变化范围为:5.30-28.70 mg/kg∙h−1,不同区域、不同地形的土壤脲酶活性差异显著。四地区土壤脲酶活性平均值分别为:呈贡地区17.1 mg/kg∙h−1,高新区12.41 mg/kg∙h−1,盘龙区11.66 mg/kg∙h−1,晋宁区9.5 mg/kg∙h−1,其土壤脲酶活性高低顺序为:呈贡县 > 高新区 > 盘龙区 > 晋宁县。研究发现,土壤有机质含量越高,其土壤脲酶活性越高;滇池流域不同土地利用方式土壤脲酶活性空间分布特征为:坝平地 > 坡耕地 > 林地。该文为土壤脲酶活性作为判断滇池流域不同区域不同土地利用方式的土壤肥力指标提供数据支持和科学依据。
收稿日期:2013年7月8日;修回日期:2013年7月15日;录用日期:2013年8月17日
关键词:土壤脲酶活性;空间分布;滇池流域
1. 引言
脲酶为尿素胺基水解酶的通称,是一种作用于线型酰胺的C-N键(非肽)的水解酶,可以催化尿素水解成二氧化碳和氨,是土壤中唯一对重要矿质肥料——尿素有重大影响的酶[1]。土壤脲酶作为土壤中重要的酶之一,在土壤系统氮素循环过程中起着重要作用[2],特别是在植物尿素利用率方面发挥着关键作用。刘建新研究表明土壤脲酶反映了土壤肥力在自然条件和人为作用下的微变化,是敏感的土壤质量指标,可以用来表示土壤肥力的高低,土壤主成分分析能较为客观地评价土壤肥力水平[2]。脲酶作为一种重要的土壤酶,能够促进土壤中含氮有机物尿素分子酰胺肽键的水解,生成植物根系可吸收利用的氨[3],人们常用土壤脲酶活性表征土壤的氮素状况。土壤脲酶还可以加速土壤中潜在养分的有效化。因而检测土壤中脲酶活性可以作为衡量土壤肥力的指标之一,并能部分反映土壤生产力[4]。
土壤酶学在环境领域中的应用是新近才被人们注目的课题,而土壤脲酶活性作为土壤肥力指标的研究,受到国内外学者的重视。英国、匈牙利等国的专家对脲酶活性进行了大量研究,初步探明了脲酶与土壤肥力的关系[5]。对茶园土壤和森林土壤脲酶活性进行了研究,得出土壤脲酶活性可作为评价土壤肥力的指标之一的结论[6,7]。但对滇池流域土壤脲酶活性空间分布方面的研究更少。对此,本文对滇池流域不同区域土壤脲酶活性进行了初步探讨,通过对不同区域、不同土地利用类型的土壤脲酶活性的研究分析,旨在了解滇池流域土壤脲酶活性的空间分布特征,进而为土壤脲酶活性作为判断土壤肥力的指标提供数据支持和科学依据。
2. 样地与方法
2.1. 样地概况
滇池流域内55个乡(镇、街道办),由于地形地貌、农业耕作方式具有多样化的特点且对面源污染的贡献率差异显著,且流域的农业主要集中在呈贡县、晋宁县、盘龙区和高新区,因此选择这四个农业典型区域进行调查,并辅以综合耕作方式的影响因子来探讨。连续1年采集滇池流域呈贡县斗南镇、晋宁县上蒜镇、盘龙区松花坝高新区马金铺四个不同区域土壤样品,共48个样品,具体采样位置详见表1。
2.2. 实验方法
土壤脲酶活性采用经典成熟的苯酚–次氯酸钠比色法测定[8,21]。称取5 g过1 mm筛的土样于50 mL容量瓶中,用1 mL甲苯处理15 min后,加入10 mL 10%尿素液和20 mL pH 6.7的柠檬酸盐缓冲液。摇匀后将容量瓶放入37℃恒温箱中培养24 h。培养结束后,用热至38℃的蒸馏水稀释至刻度(甲苯应浮在刻度以上),仔细摇荡,并将悬液用致密滤纸过滤于三角瓶中备用。然后,吸取3 mL滤液于50 mL容量瓶中,加蒸馏水至20 mL,再加入4 mL苯酚钠溶液和3 mL次氯酸钠溶液,随加随摇匀。放置20 min后,定容,1 h内在分光光度计上于波长578 nm处比色。每个土样在设置3次重复的同时,又设置了1个无基质对照。另外,对总试验设置无土壤对照。土壤脲酶活性以24 h后1 g土壤中NH3-N的mg数表示。
2.3. 数据处理
试验数据采用Microsoft Excel 2003处理,并利用SPSS17.0进行LSD显著性差异检验。
3. 结果与讨论
3.1. 滇池流域不同区域土壤脲酶活性的 空间分布
3.1.1. 呈贡县土壤脲酶空间分布
在呈贡县斗南村、梅子村、回龙村、王官村四个村采集25个土壤样品,了解土壤脲酶活性的空间分布
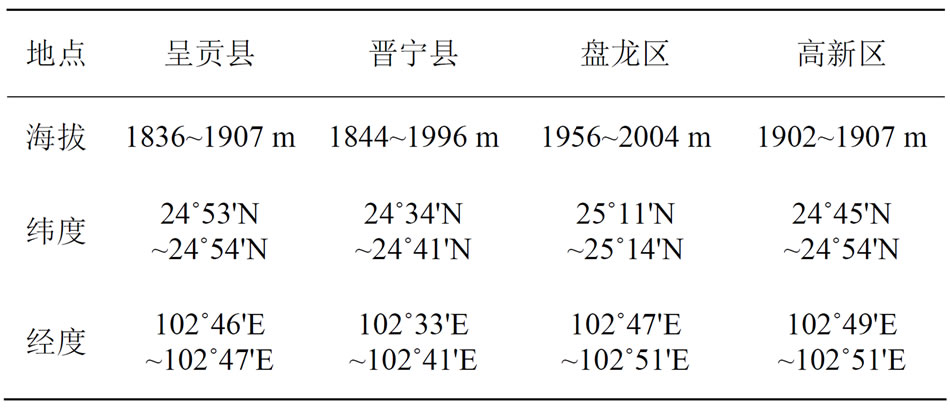
Table 1. GPS data of sampling area
表1. 采样区GPS数据
特征。采样点1至采样点19表示斗南村所采土样,采样点20至采样点22表示梅子村所采土样,采样点23和24表示回龙村所采土样,采样点25表示王关村所采土样。对所采土样分别测定土壤脲酶活性,详见图1。
从图1可见,呈贡地区土壤脲酶活性变化范围大致为8.58~23.17 mg/kg∙h−1。该地区所采土样脲酶活性经LSD差异性检验,不同村庄的采样点之间土壤脲酶活性均无显著差异(P < 0.05),即不同村庄的采样点之间对土壤脲酶活性均无影响差异。可能因呈贡斗南地区土地大都种植花卉,土壤理化性质整体差异不大,故在该地区土壤脲酶活性分布差异性不显著。但从图1可以看出,采样点1为该地区所采土样中土壤脲酶最大值,为23.17 mg/kg∙h−1,所种植物为芹菜;采样点24为该地区所采土样中土壤脲酶最小值,为8.58 mg/kg∙h−1,所种植物为康乃馨,且两种作物均为大棚种植。芹菜和康乃馨均为喜肥植物,在生长期施肥均可增加产量,但在此次研究结果中,种植芹菜和种植康乃馨的土壤脲酶活性差异较大,可能因为康乃馨在温室里几乎可以连续不断开花,这使得连作成为康乃馨种植生产中普遍存在的问题。而连作种植对土壤理化性质影响较大,有研究表明:连作使得土壤碱性磷酸酶活性随着连作年限的延长而增加,过氧化氢酶、蔗糖酶和脲酶活性则下降,其中过氧化氢酶活性和脲酶的下降幅度较大,蔗糖酶活性下降幅度较小;土壤微生物随着连作年限的延长,土壤中的细菌和放线菌数量减少,真菌数量增加[8]。可能因为此原因,种植康乃馨的土壤相比种植芹菜的土壤脲酶活性较低。
3.1.2. 晋宁县上蒜镇土壤脲酶空间分布
在晋宁地区共采集了13个土样,了解该地区土壤脲酶的分布情况。对所采土样分别测定土壤脲酶活性,经LSD差异性检验,该地区不同采样点对土壤脲酶活性的影响达到0.05,即该地区采样点的不同对土壤脲酶活性的影响显著。详见表2。
从表2可见,晋宁地区土壤脲酶活性变化范围大致为5.30~28.70 mg/kg∙h−1,除两个采样点5和6土壤脲酶活性相对较高以外,其余采样点土壤脲酶活性均在9.5 mg/kg∙h−1上下波动。总体土壤脲酶活性偏低。可能因在该地区所采土样大都来自传统种植的土壤,传统种植方式对植物生长所需的水、气、热等条件不能较好的保持,导致土壤环境不稳定,进而所采土样土壤脲酶活性总体偏低。另外,由表2可将,采样点6为该地区所采土样中土壤脲酶最大值,为mg/kg∙h−1,所种植物为白菜;采样点3为该地区所采土样中土壤脲酶最小值,为5.30 mg/kg∙h−1,为林地土壤。可能因种植白菜过程通过施用农药和化肥来提高白菜的产量,而施用和使用农药化肥可对土壤脲酶活性有一定影响[9]。农药化肥可以激活酶分子,农药的加入导致细胞壁渗透性显著增强或使细胞分解,从而释放出胞内酶,使总体酶活性表现为增强,从而使种植白菜的土壤脲酶活性较高。而林地土壤,因地表植被单一, 虽然看起来物种量较多,但由于仅草地为密植形式,树木种植密度不高,实际拥有的根系系统较低,不利于地表温度的保持和土壤微生物和动物数量和种类的增加,进而影响土壤脲酶活性[10]。基于此原因,林地土壤脲酶活性相对较低。
3.1.3. 高新区土壤脲酶空间分布
在高新区马金铺采集4个土壤样品,了解该地区土壤脲酶活性的空间分布特征,对所采土样分别测定土壤脲酶活性。详见图2。
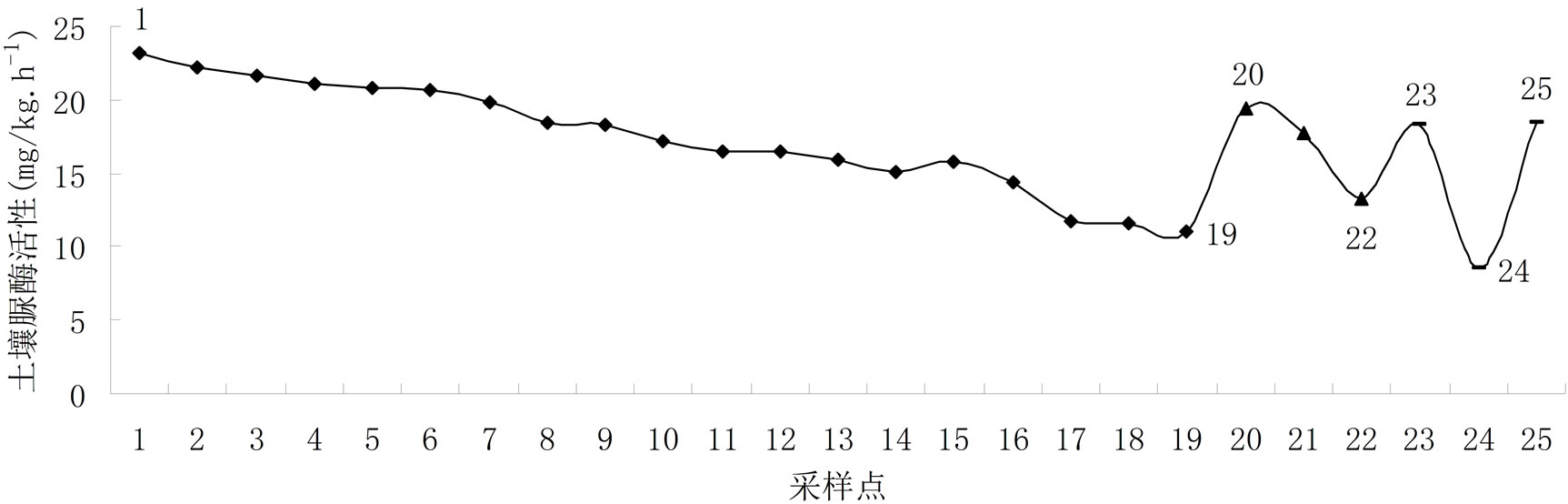
Figure 1. Soil urease activity of different sampling points in Chenggong
图1. 呈贡县不同采样点土壤脲酶活性
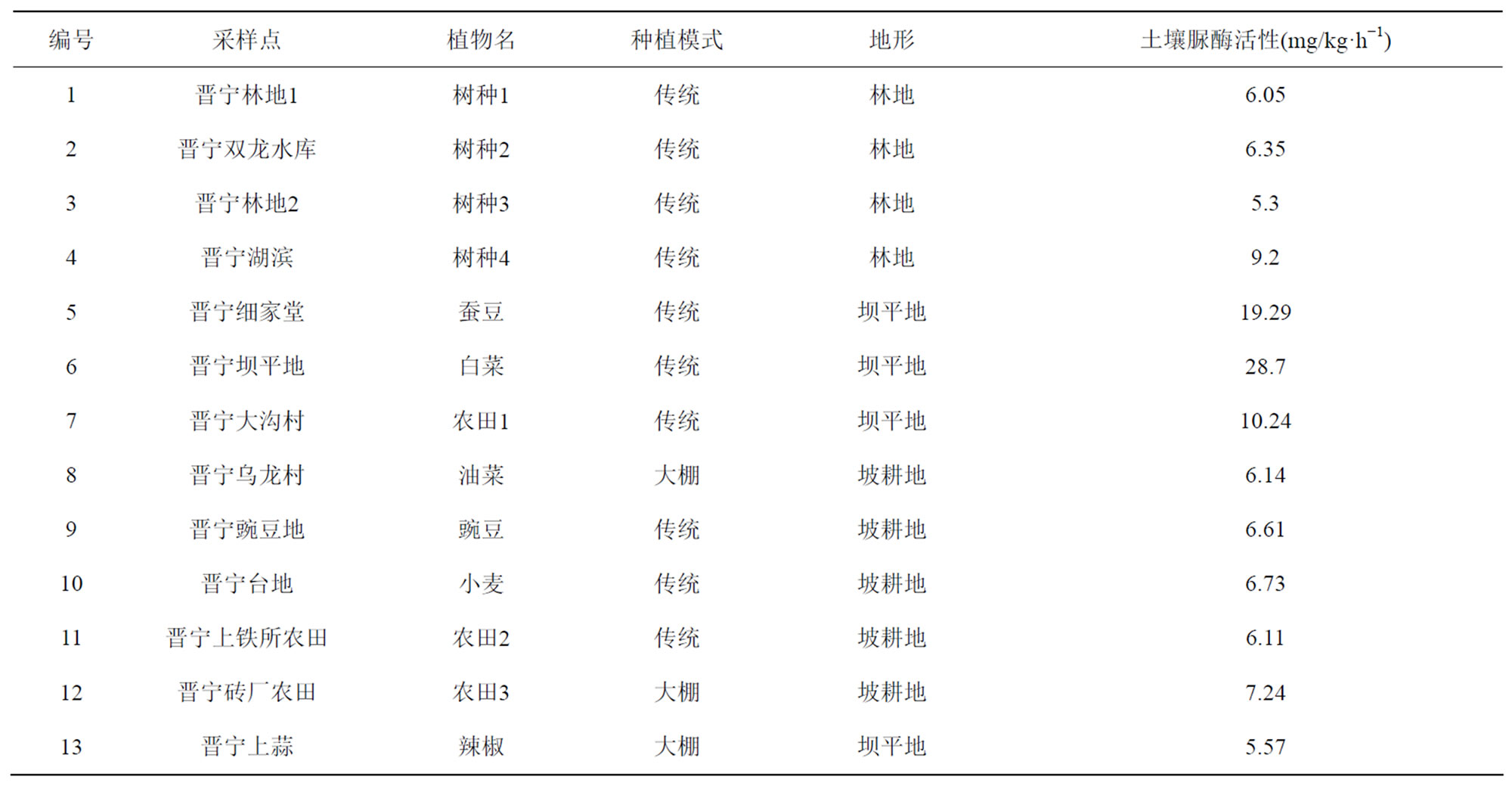
Table 2. Soil urease activity of different sampling points in Jinning
表2. 晋宁地区不同采样点土壤脲酶活性
从图2可见,高新区土壤脲酶活性变化范围大致为:7.95~14.83 mg/kg∙h−1,采样点3为该地区所采土样中土壤脲酶最大值,为14.83 mg/kg∙h−1,所种植物为莴笋,为大棚种植;采样点2为该地区所采土样中土壤脲酶最小值,为7.95 mg/kg∙h−1,所种植物为绿笋,为传统种植。土壤脲酶活性高,跟在该土壤上作物的种植模式有一定的相关性。可能是因为莴笋为大棚种植,作物生长期因由大棚覆盖,农田土壤水、气、热等条件相对稳定,土层中温度显著升高,水分含量增加,较高的温度和水分状况有利于土壤微生物的繁殖生长,为作物生长提供相对稳定的环境条件,进而使土壤脲酶活性增加。而传统耕作条件下这些环境因子有较大变异,导致传统耕作的土壤其环境不稳定,使其土壤脲酶活性相对较低。
3.1.4. 盘龙区土壤脲酶空间分布
在盘龙区松花坝中和村、储家村两个村子采集6个土壤样品,了解该地区土壤脲酶活性的空间分布特征。采样点1至采样点3表示中和村所采土样,采样点4至采样点6表示储家村所采土样。对所采土样分别测定土壤脲酶活性,详见表3。
从表3可见,盘龙区土壤脲酶活性变化范围大致为:7.54~17.12 mg/kg∙h−1,采样点1为该地区所采土样中土壤脲酶最大值,为17.12 mg/kg∙h−1,所种植物为青菜,采样点5为该地区所采土样中土壤脲酶最小值,为7.54 mg/kg∙h−1,所种植物为小麦,且均为传统种植。蔬菜对重金属的积累与土壤中重金属的浓度、土壤理化性质等有直接的关系,许多研究结果表明,不同种类蔬菜对重金属的吸收也存在差异,一般叶菜类的吸收大于根茎类和果类蔬菜[11]。在此次研究中,种植青菜的土壤脲酶活性较高可能因为青菜为叶菜类植物,对土壤中重金属的吸收能力较强,使土壤重金属浓度降低,影响土壤的理化性质,进而土壤脲酶活性相对较高。而种植小麦的土壤脲酶活性相对较低,可能因土壤有基质含量影响土壤脲酶活性,有研究表明,土体中水溶性有机质的含量随着小麦的生长呈明显下降的趋势,特别是在小麦拔节期以前这种下降趋势更为明显[12],而土壤中水溶性有机质主要来源于枯枝落叶、根系分泌物和土壤有机质,可能基于此原因,种植小麦的土壤有机质含量较低,脲酶活性也相对较低;另外也可能是由于种植小麦区存在作物竞争吸收的情况,消耗大量氮磷,在一定程度上影响了该土壤中微生物的繁殖,从而对土壤脲酶活性产生抑制作用,使其土壤脲酶活性降低。
3.1.5. 滇池流域四区域土壤脲酶空间分布综合分析
将滇池流域四个不同区域(呈贡县、晋宁县、高新区、盘龙区)不同采样点土壤汇总进行LSD差异性
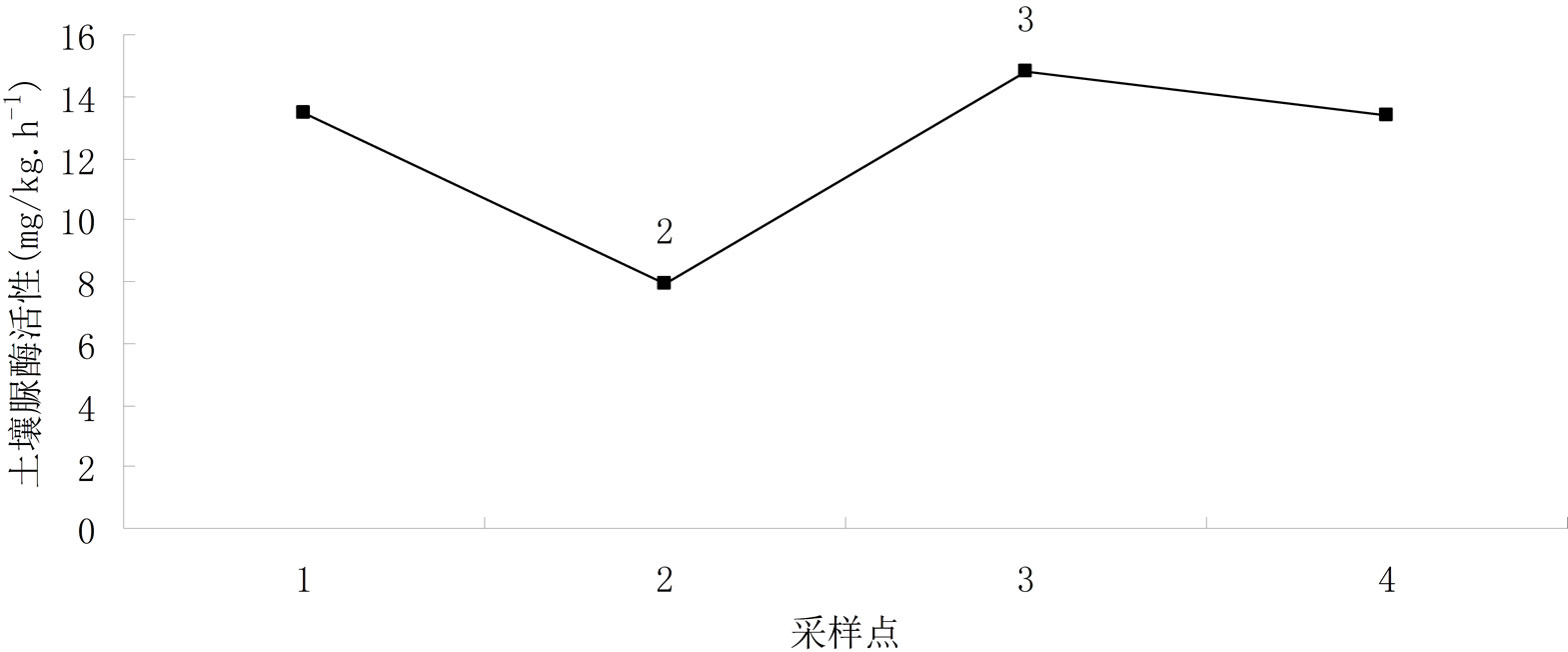
Figure 2. Soil urease activity of different sampling points in High-tech district
图2. 高新区不同采样点土壤脲酶空间分布
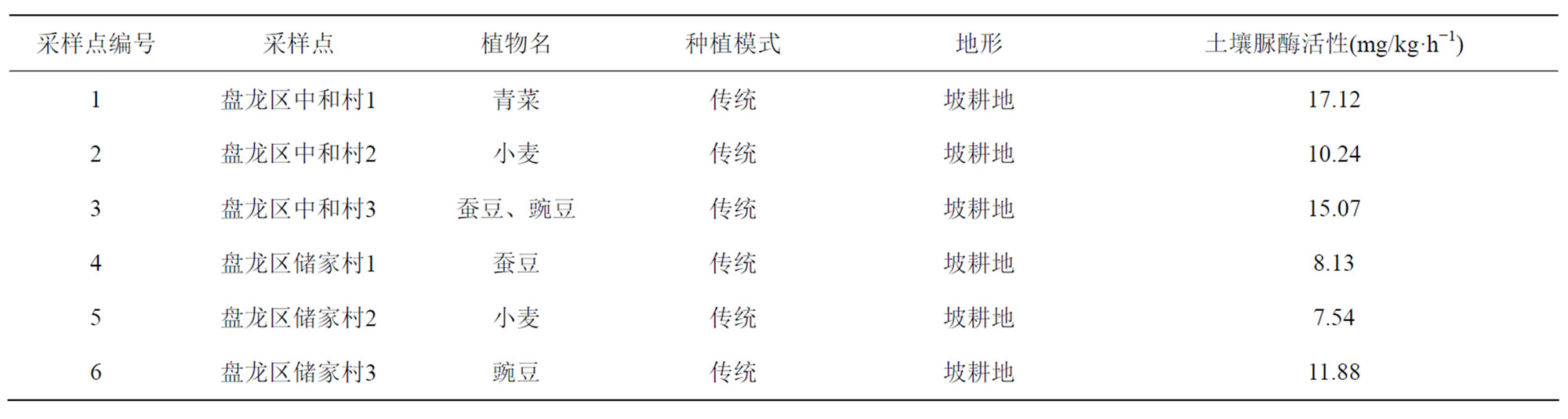
Table 3. Soil urease activity of different sampling points in Panlong district
表3. 盘龙区不同采样点土壤脲酶活性
分析,结果表明不同区域采样点土壤脲酶活性差异都达到0.01极显著水平,说明采样区域的不同对土壤脲酶活性的影响极其显著。详见图3,采样点1至25表示呈贡县所采土样,采样点26至38表示晋宁所采土样,采样点39至44表示盘龙区所采土样,采样点45至48表示高新区所采土样。
从图3可见,不同区域土壤脲酶活性空间分布特征为:呈贡地区 > 高新区 > 盘龙区 > 晋宁地区,且四个区域土壤脲酶活性平均值为:呈贡地区17.1 mg/kg∙h−1,高新区12.41 mg/kg∙h−1,盘龙区11.66 mg/kg∙h−1,晋宁区9.5 mg/kg∙h−1。
植物根系分泌物是土壤酶的重要来源。研究表明,有近90%的土壤酶活性可能是通过植物根系分泌物提供的,同时,植物根系分泌物还可为根际生物提供氨基酸、糖类及维生素等养料改善根际微生态环境,间接提高土壤酶的活性。因此,丰富的植物根系会提高土壤酶的活性[10,13]。另外植物群落的物种多样性和物种组成也可影响土壤中微生物和动物的数量和种类,从而间接的影响土壤酶活性。从该研究的结果看,呈贡地区土壤脲酶活性最高,可能是因为呈贡斗南镇是亚洲最大鲜花交易市场——斗南花卉交易市场所在地,有耕地种植面积18,570亩,其中花卉种植面积已达15,405亩,其余全部种植蔬菜,种植密度较高,且植物群落相对丰富,较晋宁、盘龙区和高新区拥有的根系系统最为庞大,鉴于植物根系分泌物和生物群落对根际微生态环境和土壤脲酶活性的影响, 呈贡地区相比其他三个地区土壤脲酶活性相对较高。
另外,施用和使用农药化肥可对土壤脲酶活性有一定影响[9]。农药化肥可以激活酶分子,农药的加入导致细胞壁渗透性显著增强或使细胞分解,从而释放出胞内酶,使总体酶活性表现为增强。土壤有机质、全氮、碱解氮、速效磷、速效钾、全磷、全钾、PH值等因素均可影响土壤脲酶活性[14]。为增加经济收益,通过施肥和使用农药提高花卉产量。因此通过化肥的施用,在一定程度上增加呈贡斗南地区土壤有机质、全氮、全磷等的含量,进而增加土壤脲酶的活性,使其活性值最高;对于高新区,土壤脲酶活性低于呈贡地区。可能因为是高新技术产业开发区,在发展
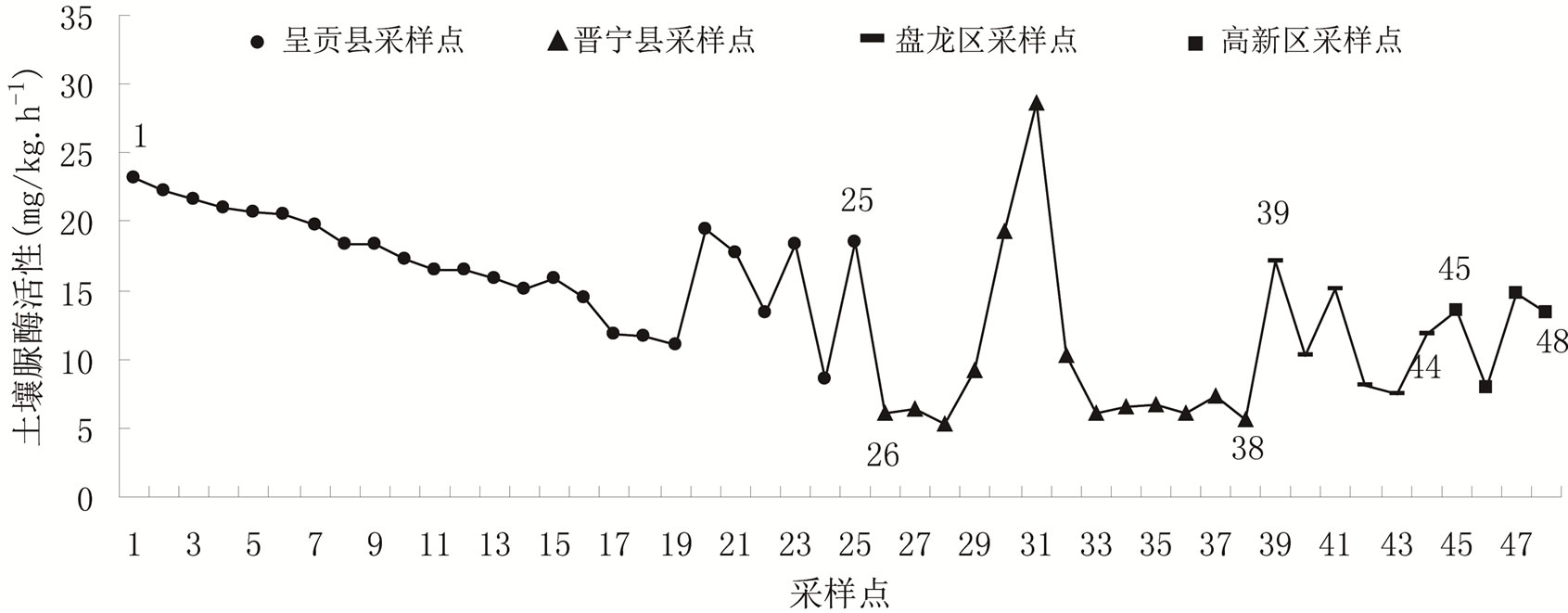
Figure 3. Soil urease activity of different sampling points of different regions in Dianchi lake watershed
图3. 滇池流域不同区域不同采样点土壤脲酶活性
的过程中不免对土壤造成不同程度的重金属污染,进而造成土壤脲酶活性的降低。另外,高新区植被及绿化覆盖较好,在一定程度上可以缓解污染,保证土壤脲酶活性不至过低。因此,该地区土壤脲酶活性在四区域中居中;对于盘龙区松花坝地区,本研究土壤均选自中和村和储家村,中和村总面积8000亩,耕地面积6118亩,其中坝外洪泛地1565亩,占耕地面积的25%,地势低洼,洪涝灾害严重,弃耕洪泛地多,由于连续多年遭灾,多次遭到洪水袭击,村民无能力种植,因此洪泛地既不种粮,也不能退耕还草,导致土壤质量相对很差;而储家村土壤环境虽比中和村好,但因所采土样取自相对荒废的土壤,导致土样脲酶活性也很低,因此,可能基于以上这些原因使得盘龙区松花坝所采土样土壤脲酶活性的总体水平偏低。对于晋宁地区,可能因为林地总面积177,111亩,占总面积的比例较大,虽然林地地区看起来物种数量较多,但可能由于地表覆盖物草地仅为密植形式,而树木种植密度低,因此实际拥有的根系系统较低,土壤脲酶活性也相对较低[15]。另外,晋宁县磷矿资源主要集中在二街乡、上蒜乡。磷矿露天开采对生态环境影响较大,主要表现在矿山建设和开采过程破坏地表植被和土壤;产生的固体废弃物也占用了较多的土地;加剧水土流失,甚至诱发滑坡、泥石流、地面塌陷等地质灾害。这些因素均不同程度的降低土壤质量,使该区土壤脲酶活性属四区域中最低。
3.2. 滇池流域不同地形土壤脲酶活性的 空间分布
因本研究在滇池流域不同地形所采土壤样品数差异较大,故该研究根据采样点地形的不同,在所采土壤样品中每类地形随机抽取5个土样作为研究分析对象,如图4所示。经LSD显著性差异检验,不同地形土壤脲酶活性差异达到0.05显著水平,说明采样点的地形特点,对土壤脲酶活性影响显著。
从图4可见,滇池流域不同地形土壤脲酶空间分布特征为:坝平地 > 坡耕地 > 林地,且三种土地利用类型土壤脲酶活性平均值分别为:坝平地18.32 mg/kg∙h−1,坡耕地9.43 mg/kg∙h−1,林地6.73 mg/kg∙h−1。
研究表明,地温是影响土壤酶活性的重要因素,因为热是酶催化反应进行的热力学条件,在一定的范围内温度增加了酶与底物的亲和力,从而增加了酶的活性[16]。坝平地地势平坦,利于耕作,本次试验所采自坝平地的土样大都取自呈贡和晋宁人工耕种的土地,且种植模式大都为设施大棚种植,其地表植被丰富,有利于地表温度的保持,因此大棚保温效果较植被显著。另外,化肥施入土壤后有三种去向:被植物吸收利用;残留在土壤中;损失,未被作物利用也未留在土壤中,即进入环境。坝平地优势的地形地貌条件,对于化肥施用后有较好的保持作用[16],很大程度上减缓了化肥的流失,可增加土壤有机质含量,可见土壤有机质的含量与土壤脲酶活性呈正相关,土壤有机质含量越高,土壤脲酶活性越强[17]。加之丰富的植被使根系统庞大,进而也会增强土壤脲酶活性。
对于坡耕地,坡耕地是指分布在山坡上地面平整差,作物产量低的旱地。一般指6˚~25˚之间的地貌类型(开垦后多称为坡耕地)。该研究结果表明,坡耕地土壤脲酶活性低于坝平地,可能因为坡耕地的存
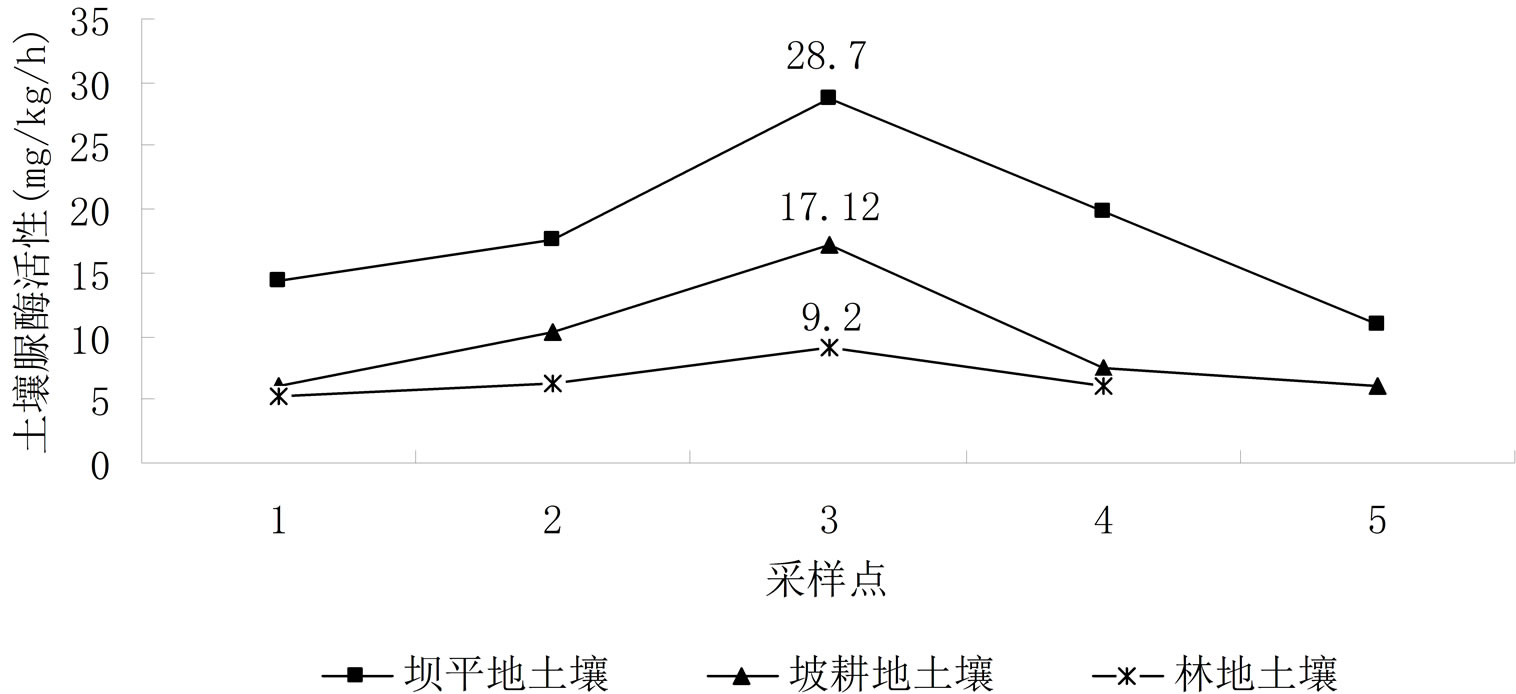
Figure 4. Soil urease activity of different terrain in Dianchi lake watershed
图4. 滇池流域不用地形土壤脲酶活性
在严重制约旱地作物产量的大幅度提高。坡耕地虽也有地表植被覆盖,但相比坝平地较少,加之坡度的存在,根系对土壤的固定程度相对较弱,水土保持能力弱。
对于林地,此次试验林地土壤大都取自晋宁,该研究结果表明,林地土壤脲酶活性在三种地形中最低,可能因为林地土壤地表植被单一,虽然看起来物种量较多,但由于仅草地为密植形式,树木种植密度不高,实际拥有的根系系统较低,不利于地表温度的保持,以及土壤微生物和动物数量和种类的增加,因此土壤脲酶活性也较低。
4. 结论
1) 滇池流域土壤脲酶活性总体变化范围为:5.30~28.70 mg/kg∙h−1,不同区域、不同地形对土壤脲酶活性均具有显著影响,且由于采样点地形地貌以及土壤理化性质的不同,滇池流域不同区域土壤脲酶活性空间分布特征为地表植被越丰富,地表温度保持性越好,土壤受污染程度越小,土壤有机质含量越高,其土壤脲酶活性越高。
2) 滇池流域四区域土壤脲酶活性平均值分别为:呈贡地区17.1 mg/kg∙h−1,高新区12.41 mg/kg∙h−1,盘龙区11.66 mg/kg∙h−1,晋宁区9.5 mg/kg∙h−1,高低顺序为:呈贡地区 > 高新区 > 盘龙区 > 晋宁地区。
3) 由于不同地形土壤植被覆盖差异较大,造成根系系统、土壤有机质含量以及土壤理化性质等存在差异,滇池流域不同地形土壤脲酶活分别为:坝平地18.32 mg/kg∙h−1,坡耕地9.43 mg/kg∙h−1,林地6.73 mg/kg∙h−1,高低顺序为:坝平地 > 坡耕地 > 林地。
参考文献 (References)
[1] 姜英范.粮草轮作中土壤酶活性与土壤肥力关系的初步研究[J]. 吉林农业大学学报, 1983, 5(4): 65-68.
[2] 陈恩风. 土壤酶的生物学意义(代序)[A]. 全国土壤酶学研究文集[C]. 沈阳: 辽宁科学出版社, 1988: 1-4.
[3] 王菊兰, 何文寿. 宁夏引黄灌区温室土壤脲酶、过氧化氢酶活性与土壤肥力因素的关系[J]. 宁夏大学学报, 2007, 28(2): 173-176.
[4] 邱莉萍, 刘军, 王益权等. 土壤酶活性与土壤肥力的关系研究[J]. 植物营养与肥料学报, 2004, 10: 277-280.
[5] 刘旭辉, 曾艳兰, 覃勇荣. 长坡尾矿坝植物修复过程中土壤脲酶活性变化[J]. 河南农业科学, 2009, 5: 65-69.
[6] 关松荫. 土壤酶及其研究法[M]. 北京:农业出版社, 1986.
[7] 吴全, 陆锦时. 四川茶园土壤中脲酶活性研究[J]. 土壤肥料, 1999(1): 30-32.
[8] 关松荫. 土壤酶及其研究方法[M]. 北京: 农业出版社, 1986: 294-297.
[9] 杨春璐, 孙铁珩, 和文祥等. 农药对土壤脲酶活性的影响[J]. 应用生态学报, 2006, 17(7): 1354-135.
[10] G. Gramss, D. Voigtk and B. Kirsche. Oxidoreductase enzymes liberated by plant roots and their efects on soil humic material. Chmosphere, 1999, 38: 1482-1494.
[11] 陈碧华, 杨和连, 周俊国等. 大棚菜田种植年限对土壤重金属含量及酶活性的影响[J]. 农业工程学报, 2012, 28(1): 213-218.
[12] 潘逸, 周立祥. 小麦地土壤水溶性有机物动态及对土壤铜镉活性的影响[J]. 环境科学, 2007, 28(4): 859-865
[13] J. Garclagil, C. C. Plaza, R. P. Soler, et a1. Long-term effects of municipal solid waste compost application On soil erlzylrle activities and microbialbiomass. Soil Biology & Biochemistry, 2000, 32: 1907-1913.
[14] 朱辉娟, 李新平, 魏迎春等. 大棚栽培土壤脲酶活性与养分因子的通径分析[J]. 西北农林科技大学学报, 2009, 18(4): 167-170.
[15] 胡卫萱, 丁峰, 宋文华. 绿化配置对土壤脲酶活性和有机质含量的影响[J]. 安徽农业科学, 2009, 37(8): 3617-3618.
[16] 刘春生, 曹正梅, 李红光等. 不同培肥措施对潮土酶活性影响的研究[J]. 山东农业大学学报, 1998, 29(3): 365-369.
[17] 焦晓光, 隋跃字, 张兴义. 土壤有机质含量与土壤脲酶活性关系的研究[J]. 农业系统科学与综合研究, 2008, 24(4): 494-496.
[18] F. Hagedorn, R. Kaiser, H. Feyen, et al. Effect of redox conditions and flow processes on the mobility of dissolved organic carbon and ni2trogen in a forest soil. Journal of Environmental Quality, 2000, 29: 288-297.
[19] 杨春璐, 孙铁珩, 和文祥. 农药对土壤脲酶活性的影响[J]. 应用生态学报, 2006, 17(4): 1354-1356.
[20] 俞静文, 彭静霜. 红壤酶活性与土壤肥力[J]. 土壤肥料, 1985, 3: 4-8.
[21] 张俊丽, 高明博, 温晓霞, 陈月星, 杨生婷, 李露, 廖允成. 不同施氮措施对旱作玉米地土壤酶活性及CO2排放量的影响. 生态学报, 2012, 32(19): 6147-6154.
[22] 周礼恺. 土壤酶学[M]. 北京: 科学出版社, 1989.
NOTES
*基金项目:国家重大科技水专项滇池项目第三课题(2012ZX07102-003)。