Hans Journal of Agricultural Sciences
Vol.08 No.02(2018), Article ID:23837,14
pages
10.12677/HJAS.2018.82018
Study on Microtuber Induction of Purple Yam
Guole Qin1, Canming Wu1, Chenyu Shi1*, Tao Yu2
1College of Chemistry and Bioengineering, Hechi University, Yizhou Guangxi
2Agriculture Bureau of Luocheng County, Luocheng Guangxi

Received: Feb. 5th, 2018; accepted: Feb. 20th, 2018; published: Feb. 27th, 2018

ABSTRACT
With the purple yam stem segments as explants, we explore the purple yam from aseptic germination to bud induction, the induction of sterile plants rooting and microtuber induction. So, preliminary purple yam rapid propagation system was established. The experimental results show that the germination method of purple yam was hidden in river sand. Firstly the stem segments were sprayed by 0.001 mg/L iprodione 1 h and then taking them as explants; explants was disinfected with 75% alcohol for 30 s, treated with 0.1% HgCl2 for 5~7 mins, and washed by sterile water for 3~5 times. The initial culture medium was MS + 2.0 mg/L 6-BA + 0.2 mg/LNAA. The best bud induction culture medium was MS + 0.5 mg/L PP333; the best rooting culture medium was MS + 0.2 mg/L 6-BA + 0.4 mg/L NAA; the best induction of microtuber culture medium was MS + 0.5 mg/L NAA +0.2 mg/L 6-BA +50 mg/L coumarin and the producing microtuber rate was up to 55.32%; we initially explored the purple yam bulbil (Pearl bud) culture medium and the producing bulbil rate was up to 45%, but it also needs to be further explored. In this paper, the medium is used 30 mg/L sucrose + 5.2 g/L agar + 0.5 g/L activated carbon, pH 6.8.
Keywords:Purple Yam, Tissue Culture, Microtuber, Induction
紫玉淮山试管微薯诱导研究
覃国乐1,伍灿明1,史沉鱼1*,玉涛2
1河池学院化学与生物工程学院,广西 宜州
2罗城县农业局,广西 罗城

收稿日期:2018年2月5日;录用日期:2018年2月20日;发布日期:2018年2月27日

摘 要
以紫玉淮山的茎段为外植体,探究紫玉淮山从无菌萌发到丛生芽诱导、无菌苗生根诱导和试管薯诱导的技术途径,初步建立了紫玉淮山快速繁殖体系。实验结果表明:用沙藏法对紫玉淮山薯进行催芽萌发:先用0.001 mg/L浓度的扑海因对茎段喷雾1 h后,取茎段作外植体;接着用75%的酒精消毒30 s,再用0.1% HgCl2处理外植体5~7 min,最后用无菌水清洗3~5次,以MS + 6-BA 2.0 mg/L + NAA 0.2 mg/L为初始培养基,诱导丛生芽培养基MS + PP333 0.5 mg/L为最佳;诱导生根培养基以MS + 6-BA 0.2 mg/L + NAA 0.5 mg/L为最佳;诱导试管薯培养基以MS + NAA 0.5 mg/L + 6-BA 0.2 mg/L + 香豆素 50 mg/L结薯率最高为55.32%;初步探索出诱导零余子的培养基配方,零余子(珠芽)率为45%,还需要进一步探究。本文中所用培养基均蔗糖30 mg/L + 琼脂粉 5.2 g/L + 活性炭 0.5 g/L,pH 6.8。
关键词 :紫玉淮山,组织培养,试管微薯,诱导

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 前言
1.1. 概况
淮山薯(Dioscorea polystachya Turcz)又名薯蓣,俗称“怀山药”、“淮山药”、简称“淮山”,为薯蓣科薯蓣属的一种缠绕草本、攀援性的肉质根状茎植物 [1] [2] ,淮山与怀地黄、怀牛膝和怀菊花合称为“四大怀药” [3] 。《本草纲目》中记载:紫山药有着非常高的药用价值 [4] ,以根状茎和珠芽(中药称为余零子俗称山药蛋)入药,具有益肾、健脾等多种功效,主治脾虚、糖尿病等病症 [5] 。因其药用价值高、品质好,故其产品畅销国内外 [6] 。紫玉淮山既可作美味佳肴,营养丰富,风味独特,还含有大量的花青素、粘液质、淀粉酶等不可多得的营养和保健成分,常食用可提高抵抗力,防氧化抗衰老,还能降血糖、血压 [7] 。
紫玉淮山与白色淮山相比,其肉质紫红色,口感好;根据相关统计,其紫玉淮山的花青素含量是白淮山的60倍,它还含有淀粉、多糖、皂苷等20种营养素和Fe、Mn、Ca、Mg、Zn、Se等多种矿物质 [8] [9] ,对人体提高免疫力有积极作用;此外,紫玉淮山中的皂苷还具有辅助治疗癌症的作用。
1.2. 国内外研究进展
目前国内外在紫玉淮山的栽培生产上,大多数采取块茎繁殖。块茎繁殖可以保留原种的优良特性,并世代相传,但块茎繁殖也存在一定弊端:连年留种种植容易导致紫玉淮山繁殖系数低,多代繁殖也会造成母种优良种性退化、抗逆性变差及产量降低,严重影响紫玉淮山的生产和发展。近几年来,逐渐有少数科研机构和单位开展了对紫玉淮山的组织培养研究,对茎尖、茎段、叶片、甚至零余子等不同外植体的培养进行了广泛并深入的研究 [10] ,通过器官发生途径成功地建立起了植株再生繁殖体系 [11] ,并取得了一定的进展。另外,实行统一供应优质种苗,统一耕种,统一配选农药、化肥,统一做好田间管理,统一销售,以达到高产、优质、高效的目的 [12] 。紫玉淮山传统栽培技术中已有一些报道 [13] ,但目前对紫玉淮山的试管微薯和零余子的诱导还未见报道。
1.3. 紫玉淮山的种植业的市场前景
紫玉淮山是集观赏、食用、药用、营养、保健于一身的新品种。近年来随着大健康产业发展,生活水平不断地提高,人们越来越关注保健和养生。紫玉淮山作为一种性价比高的养生食品,引起众多学者对紫玉淮山开展选育和推广工作,并使其形成了具有一定知名度的高级营养品。从紫玉淮山的市场前景来看,其销售市场将越来越广阔,因此,紫玉淮山是一种具有广阔的市场前景和产业开发潜力的高效经济作物 [14] [15] 。
2. 材料与方法
2.1. 材料
紫玉淮山块茎:薯块均匀、表面粗糙,长圆柱形半径1.5 cm,长1 m,肉质深紫色,有许多芽眼,种薯来源于桂林市永福县罗锦镇淮山种植基地。
2.1.1. 实验试剂
硫酸铜、乙二胺四乙酸二钠、硝酸铵、磷酸二氢钾、硫酸锌、铝酸钠、硫酸亚铁、硫酸镁、硝酸钾、氯化钙、碘化钾、硼酸、硫酸锰、肌醇、甘氨酸、盐酸硫胺素、盐酸吡哆醇、烟酸、蔗糖、琼脂粉、多效唑、萘乙酸、6-苄基氨基嘌呤、苯并吡喃酮等,均为化学纯。
2.1.2. 主要试验器材
SW-CJ-JC型超净工作台(苏州安泰空气技术有限公司)、JZ-II接种器械灭菌器(济南普朗特生物科技有限公司)、YXQ-LS-75II型高压灭菌锅(上海博讯实业有限公司医疗设备厂)。
2.2. 方法
2.2.1. 薯种催芽
将紫玉淮山块茎置于经0.1 mg/L的高锰酸钾溶液消毒过的河沙中,放在大棚(温度约25℃~27℃)内催芽,定期浇水。待到的茎芽长到3~5 cm长时,剪取生长旺盛的约2 cm长的带节茎段作为启动培养的外植体。用软毛刷在自来水下轻轻刷洗茎尖,用清洁液轻轻洗3~4次,再将初步清洁的带节茎段置于流动的自来水下冲洗2 h。把处理后的茎段放到超净工作台中,备用。
2.2.2. 不同时间的0.1% HgCl2灭菌处理对外植体的影响
将催芽长出的茎段先用0.001 mg/L浓度的扑海因对茎段喷雾1小时后,取茎段作外植体,先用75%的酒精消毒30 s,再用0.1% HgCl2灭菌,时间分别为5 min、6 min、7 min,分别标记为A、B、C;消毒过程要不断摇动锥形瓶,接着用无菌水清洗3~5次,用镊子将上述方法消毒后的紫玉淮山茎段夹到装有无菌滤纸的培养皿,备用。
2.2.3. 培养基
① MS + 6-BA 2.0 mg/L + NAA 0.2 mg/L;
② MS + 6-BA 2.0 mg/L + NAA 0.5 mg/L + 5% 马铃薯;
③ MS + PP333 (0.1~0.6) mg/L;
④ MS + 6-BA 0.2 mg/L + NAA (0.1~0.6) mg/L;
⑤ MS + 6-BA 0.2 mg/L + NAA 0.4 mg/L;
⑥ MS + 6-BA 0.2 mg/L + NAA 0.5 mg/L + 香豆素(10~60) mg/L;
⑦ MS + 6-BA 0.2 mg/L + NAA 0.4 mg/L + 香豆素(50~300) mg/L。
所有培养基中均加入30 g/L蔗糖 + 活性炭1 g/L + 5.2 g/L琼脂粉,pH 6.8 (下同)。
2.2.4. 有关指标的计算
1) 污染率 = (污染材料数量/接种材料总数量) × 100%;
2) 成活率 = (成活材料数量/接种材料总数量) × 100%;
3) 愈伤组织诱导率 = (产生愈伤组织材料数量/接种材料总数量) × 100%;
4) 芽增殖数 = 增殖后芽的总数 − 增殖前芽的总数。
2.2.5. 培养条件
培养室温度25˚C ± 2˚C,湿度65%~70%,光照强度为2000~2500 Lx,光照时间为14 h/d (下同)。
2.2.6. 启动培养
将经过不同时间消毒的紫玉淮山茎段,放在装有无菌滤纸的无菌培养皿里,用解剖刀切掉茎段的伤口,去掉幼叶,直到露出光滑生长点,用解剖刀切下长0.5~1 cm的芽点,接种在①号培养基上培养,每瓶接3个芽,放在培养室培养。定期观察外植体生长情况,培养30 d后,统计顶芽的污染率和死亡率。
2.2.7. 继代培养
把在培养室启动培养所得无菌芽,剪成约1~1.5 cm长的带有一个腋芽的茎段,接到②号培养基上进行继代培养,每瓶接5个茎段,再放在培养室里继续培养,30 d后对紫玉淮山的生长状况进行观察、记录。
2.2.8. 不同浓度的PP333对芽增殖的影响
本实验主要研究单因子激素PP333对紫玉淮山芽增殖的影响。把在培养室继代无菌培养30 d后的无菌芽,剪成约1~1.5 cm长的带有一个腋芽茎段,接到添加不同浓度PP333 (0.1、0.2、0.3、0.4、0.5、0.6 mg/L)的MS培养基上,每瓶接5个茎段,每个实验重复10次,放在培养室里培养。30 d后,观察并记录每个实验芽的生长状况,统计芽增殖数,见表1。
2.2.9. 不同激素组合对生根的影响
把诱导生根的培养基配置成添加6-BA 0.2 mg/L和NAA (0.1、0.2、0.3、0.4、0.5、0.6 mg/L)浓度的组合MS培养基,在超净工作台,将继代培养所得到的健壮、没有生根的试管苗切成1.5 cm左右长的带
Table 1. Bud induction culture medium formula of different concentrations of PP333
表1. 不同PP333浓度的丛生芽培养基配方
注1:D1~D6分别表示0.1~0.6 mg/L的PP333浓度的诱导丛生芽培养基编号(下同). Note 1: D1~D6, respectively, indicates the number of the induced cluster buds of the PP333 concentration of 0.1~0.6mg/L, (the same below).
有一个腋芽的茎段,每瓶接5个茎段,每个实验重复10次,放在培养室里培养,30d后观察并记录生根数,见表2。
2.2.10. 不同浓度香豆素对试管薯诱导的影响
把诱导试管薯的培养基配置成添加6-BA 0.2 mg/L、NAA 0.5 mg/L和不同浓度的香豆素(10、20、30、40、50、60 mg/L)的MS培养基,将继代培养所得的长势良好、健壮的试管苗切成约2.5~3 cm的茎段,接到⑥号培养基上,在培养室内培养。30 d后观察并统计紫玉淮山的结薯数,见表3。
2.2.11. 不同浓度香豆素对零余子诱导的影响
淮山除地下长薯外,还有一个独特的繁殖生物学特性,即地上的藤蔓上也长有零余子;零余子就是珠芽着生于叶腋,呈球形或卵圆形不等。零余子不仅可食用,还具重大的医疗价值 [16] 。此外,零余子易成活,且易进行种质交换;繁殖系数高,是淮山重要的繁殖器官。因此,诱导紫玉淮山的零余子有很大研究意义。
在实验过程中把诱导试管薯的培养基配置成添加6-BA 0.2 mg/L、NAA 0.4 mg/L和不同浓度的香豆素(50、100、150、200、250、300 mg/L)的MS培养基,每个梯度设置8瓶,共48瓶。将继代培养所得的长势良好、健壮的试管苗切成约3 cm左右的茎段,每瓶转接5个茎段到各个梯度的⑦号培养基上,并放置培养室内培养,见表4。
Table 2. Root induction culture medium formula of different concentrations of NAA
表2. 不同NAA浓度的生根诱导培养基配方
注2:E1~E6分别表示0.2mg/L 6-BA和0.1~0.6 mg/L的NAA浓度组合的生根培养基编号(下同). Note 2: E1~E6, respectively, indicates the number of the rooting medium of the combination of NAA concentration of 0.2 mg/L 6-BA and 0.1~0.6 mg/L (the same below).
Table 3. Microtuber induction culture medium culture medium formula of different concentrations of coumarin
表3. 不同香豆素浓度的试管微薯诱导培养基配方
注3:F1 ~F6分别表示10~60 mg/L的香豆素浓度的诱导试管微薯培养基编号(下同). Note 3: F1~F6, respectively, indicates the number of the induced microtuber medium of the coumarin concentration of 10~60 mg/L, (the same below).
Table 4. Bulbil induction culture medium formula of different concentrations of hormone
表4. 不同激素浓度的试管零余子诱导培养基配方
注4:H1 ~H6分别表示50~300 mg/L的香豆素浓度的诱导试管零余子培养基编号(下同). Note 4: H1~H6, respectively, indicates the number of the induced Purple yam bulbil (Pearl bud) medium of the coumarin concentration of 50~300 mg/L, (the same below).
Table 5. Effect of 0.1%HgCl2 sterilization on explants at different times
表5. 不同时间的0.1%HgCl2灭菌处理对外植体的影响
注5:A(5)、B(6)、C(7)分别为0.1% HgCl2灭菌处理外植体5 min、6 min和7 min. Note 5: A (5), B (6), C (7) were sterilized with 0.1% HgCl2, respectively, 5 min, 6 min and 7 min.
3. 结果与分析
3.1. 不同时间的0.1% HgCl2灭菌处理对外植体的影响
大多数植物离体快繁培养多选用茎尖、带芽茎段作为外植体 [17] 。大棚沙埋生长的紫玉淮山茎尖具有较强的分化能力,且刚冒出2 cm左右的顶芽表面较光滑,所带的内生菌相对其他部位较少,因此采用紫玉淮山茎尖作为外植体。先用0.001 mg/L浓度的扑海因对茎段喷雾1小时后,取茎段作外植体,先用75%的酒精消毒30 s,再用0.1% HgCl2处理外植体5~7 min,接着用无菌水清洗3~5次,以MS + 6-BA 2.0 mg/L + NAA 0.2 mg/L + 活性炭0.5g/L为初始培养基,见表5。
从表5和图1可得出的结论:随着灭菌时间的增加,外植体的污染率逐渐降低,死亡率呈下降趋势,成活率逐渐递增。从污染率、死亡率和成活率这三个方面因素考虑,认为紫玉淮山的最佳灭菌时间为7 min。
3.2. 启动培养
把经过灭菌的紫玉淮山顶芽接种到启动培养基①中培养,经过20 d培养,紫玉淮山刚开始冒出新芽点,继续培养10 d,大多数紫玉淮山长出0~2 cm高、1~2片小叶的嫩苗。实验证明,紫玉淮山顶芽的启动培养以MS + 6-BA 2.0 mg/L + NAA 0.2 mg/L为培养基,可使紫玉淮山顶芽诱导出无菌苗,能作为紫玉淮山顶芽形成无菌苗的启动培养基。因此,此实验配方适合作为紫玉淮山组培苗的启动培养(附录一:图A)。
3.3. 继代培养
在超净工作台上,用剪刀剪取1.5~2 cm的无菌芽接入②继代培养基中,10 d后茎尖开始伸长,20 d后,长出2~3 cm高、1~2片小叶的嫩苗,腋芽处开始冒出紫色小芽点。30 d后无菌苗有3~7 cm高,叶片数目2~6 片,叶片变宽变长,颜色先变紫,后由紫变绿(附录一:图B)。
无菌材料继代培养的结果
在无菌材料继代培养的第10 d,茎段培养的每个节间长出1~2条根,材料平均长高0.3 cm,并且每个节间开始有小紫点。茎尖继代的材料下端也开始长出2~3条根,材料平均长高0.5 cm,新长的芽点呈深紫色。随着培养时间的增长,薯苗茎段、茎尖的生长也有了变化,结果详见表6。
3.4. 不同浓度的PP333对芽增殖的影响
PP333是一种生长延缓剂,能抑制多种作物的纵向生长 [18] [19] ,许多学者应用PP333于增殖培养,而应用于紫玉淮山却很少。本实验以继代培养的紫玉淮山组培苗为材料进行实验,探究不同浓度的PP333对紫玉淮山诱导丛生芽的影响(附录一:图C)。将继代培养得到的无菌苗,用剪刀剪成约2 cm长并且带有一个腋芽的茎段,转接至添加不同浓度的PP333 (0.1、0.2、0.3、0.4、0.5 mg/L)的MS培养基中,在培养室培养30 d后观察无菌苗生长状况,统计无菌芽增殖数,以每瓶的芽增值系数作为评价结果,实验结果均以平均数为基础。
实验结果表明(见表7和图2),在MS培养基中添加不同浓度的PP333 对紫玉淮山诱导丛生芽有促进
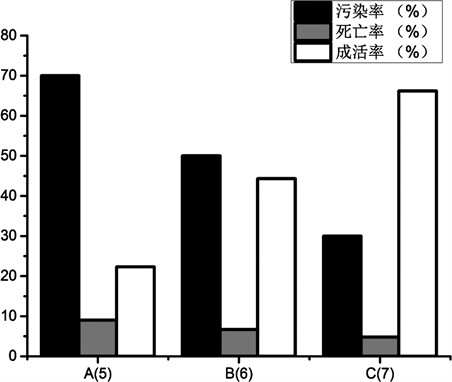
Figure 1. Influence of different sterilizing times on explants
图1. 不同灭菌时间对外植体的影响
Table 6. Different inoculation positions on the effects of subculture of purple yam
表6. 不同接种位置对紫玉淮山继代培养的影响
Table 7. Effect of different concentrations of PP333 on bud proliferation of purple yam
表7. 不同浓度的PP333对紫玉淮山芽增殖的影响
注4:芽增殖系数 = (芽增殖培养后分化出的芽总数 − 接种时芽总数)/接种植株总数. Note 4: the multiplication factor of bud = (total number of shoots differentiated after bud proliferation culture)/total number of inoculated plants.
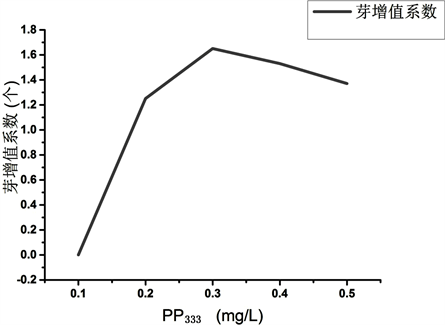
Figure 2. PP333 of different concentration on shoot proliferation results of purple yam
图2. 不同浓度PP333对紫玉淮山芽增殖的结果
的作用,但芽增殖系数低,芽增殖系数在0~2倍范围内,增殖不明显,无菌苗健壮、长势良好。当PP333浓度在0.1~0.5范围内,芽增殖数先升高后降低,当PP333浓度为0.3 mg/L,芽的增殖系数最高,增殖系数为1.66,无菌苗叶子宽大、紫色,植株茎秆较粗。当PP333浓度为0.4 mg/L,芽增殖系数降低,可能是实验操作或环境的影响甚至是由于PP333升高抑制了紫玉淮山芽的增值。
3.5. 不同激素组合对生根的影响
萘乙酸(NAA)能够诱导试管苗生根,在一定浓度NAA条件下,试管苗生根数随其浓度的增大而增加 [20] 。选取芽增殖阶段培养得到的叶子颜色呈紫色或深紫色,长势优良、较统一并且无根的丛生芽作为实验材料,探究不同激素组合对紫玉淮山生根的影响。在超净工作台上,将丛生芽剪成约2 cm长,转接至6-BA和不同浓度梯度的NAA组合的MS培养基中,30 d后,观察、拍照并记录紫玉淮山根增殖的变化,以每瓶的根增殖系数作为评价结果,实验结果均以平均数为基础。
从表8可以得出,由于控制了变量,紫玉淮山根增殖主要因素与NAA的浓度有关。随着NAA的浓度升高,芽的增长量先随浓度升高而增加,然后随着浓度增加而下降;随着NAA浓度升高,根的增长量先随浓度升高而增加,然后随着浓度增加而下降。实验表明,不同浓度梯度激素的组合对紫玉淮山根增殖培养影响大在6个处理中根增殖效果最佳的组合是处理E5的培养基,即为MS + NAA + 6-BA 0.2 mg/L,此时植株根粗短,生长于培养基中,个别植株有3~5条气生根生长在培养基表面,植株生长粗壮(附录一:图D)。
3.6. 不同浓度香豆素对试管薯诱导的影响
试管薯是试管苗在适宜条件下从根诱导出来的小薯,其体积小、重量轻,抗性强,栽种易成活,利于种质的运输、贮存和推广 [21] 。本实验以继代培养得到的健壮,长势良好的无菌苗作为材料,探究香豆素对紫玉淮山无菌苗诱导试管薯的影响。本实验参考了,韦莹在以MS、B5、White、N6分别对马铃薯诱导试管薯,诱导试验发现MS诱导效果最好,试管薯形成较早,诱导结薯率较高 [22] 的实验方法,确定了对紫玉淮山试管微薯诱导的研究的实验方案。诱导紫玉淮山试管微薯的研究(附录一:图E),借鉴了马铃薯试管微薯的诱导研究。把无菌苗剪切成约3 cm,转接到⑥号培养基,放在培养室中培养。经过30 d的培养,结薯数和结薯率见表9。
由表9和图3可以得出,随着香豆素浓度增加,试管薯的结薯率先升高后降低。当香豆素浓度为50 mg/L,结薯率最高为45%。由实验可得,香豆素低浓度(10 mg/L)促进结薯,以中上浓度(50 mg/L)结薯率最高,高浓度(60 mg/L)则开始抑制结薯。
Table 8. Effect of different hormone combinations on rooting of purple yam
表8. 不同激素组合对紫玉淮山生根的影响
Table 9. Effects of different concentrations of coumarin on induction of tube tubers
表9. 不同浓度香豆素对诱导试管薯的影响
注7:结薯率 = 结薯株数/成活株数 × 100%. Note 7: tuberization rate = tuber number/survival number * 100%.
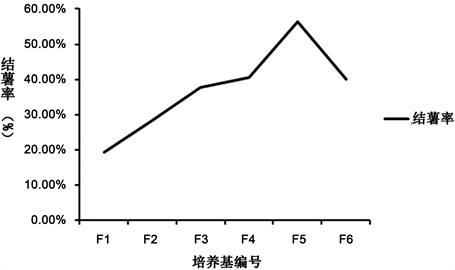
Figure 3. Results of different concentrations of coumarin on induction of microtuber
图 3. 不同浓度香豆素对诱导试管薯的结果
3.7. 不同浓度香豆素对试管零余子诱导的影响
长期以来,淮山都是利用地上零余子或地下薯段进行无性繁殖,通过自留种的栽培形式,像其它薯蓣属植物一样,这就极大地影响了其产量、品质。自学者成功诱导马铃薯试管薯以来,通过组织培养技术诱导试管薯、试管鳞茎、试管珠芽等离体繁殖器官的研究便引起了科研工作者更广泛的关注、有关薯蓣属植物试管薯的研究也有大量报道 [23] 。然而,有关紫玉淮山试管零余子的诱导研究,国内外还未见报道。因此,本研究以紫玉淮山为试验材料,进行紫玉淮山试管零余子的诱导研究(附录一:图F),为紫玉淮山的种质交换、良种繁育及零余子形成机理研究奠定基础。
由表10和图4可以得出,随着香豆素浓度增加,零余子的结薯率先升高后降低。当香豆素浓度为100 mg/L,结薯率最高为45%。由实验可得,香豆素低浓度(50 mg/L)促进结薯,以中上浓度(100 mg/L)结薯率最高,而高浓度(300 mg/L)则抑制结薯。
4. 结论与讨论
4.1. 不同时间的0.1% HgCl2处理对茎尖灭菌的最佳时间
在进行紫玉淮山外植体预处理时,本试验采用扑海因和酒精消毒、升汞浸泡结合无菌水冲洗的消毒方式,利用0.1%的升汞按不同时间分组进行消毒处理。0.1% HgCl2是组织培养实验室常用的外植体灭菌药品,0.1% HgCl2的处理时间是直接关系到灭菌是否彻底的重要因素,经0.1% HgCl2处理时间太短就会达不到理想的灭菌效果,处理时间过长就会使外植体活力降低,甚至失去活力而无法诱导得到愈伤组织。从表5可知,综合污染率与死亡率等因素,用0.1% HgCl2处理紫玉淮山茎段最佳时间为7 min,培养基配方为MS + 6-BA 2.0 mg/L + NAA 0.2 mg/L + 活性炭1.0 mg/L + 蔗糖30 g/L + 琼脂粉5.2 g/L,pH 6.8。
4.2. 无菌接种与初代培养
在超净工作台将紫玉淮山茎芽灭菌,然后接种在初代培养基中培养。实验结果表明,用MS + 6-BA 2.0 mg/L + NAA 0.2 mg/L + 活性炭1.0 mg/L + 蔗糖30 g/L + 琼脂粉5.2 g/L,pH 6.8作为紫玉淮山初代培养的培养基配方,适合用于诱导紫玉淮山芽的萌发。
4.3. 继代培养的培养基
在超净工作台中,将初代培养得到的无菌芽接种到继代培养基中培养,植株生长良好。通过实验证
Table 10. Effect of different concentrations of coumarin to test the bulbil induction
表10. 不同浓度香豆素对诱导试零余子的影响
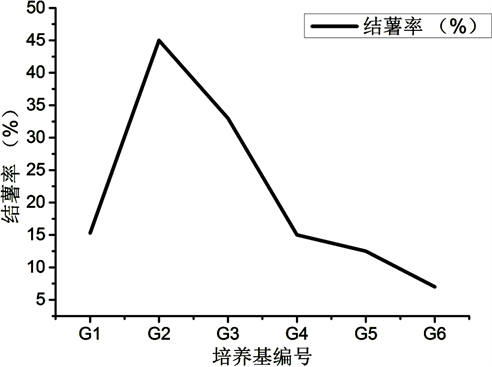
Figure 4. Results of different concentration of coumarin in vitro bulbil
图4. 不同浓度香豆素对诱导试管零余子的结果
实:MS + 6-BA 2.0 mg/L + NAA 0.2 mg/L + 5% 马铃薯汁,作为紫玉淮山继代培养的培养基配方,使紫玉淮山无菌芽快速、健壮生长,适合用于紫玉淮山继代培养基。
4.4. 丛生芽增值培养的的培养基
实验在对紫玉淮山诱导丛生芽培养,研究在MS培养基中分别添加NAA 0.2 mg/L + 0.4 mg/L 6-BA和(0.1~0.6 mg/L) PP333对紫玉淮山芽增殖的影响。实验表明,单因子实验PP333对芽增殖效果不明显,但对植株壮苗的效果明显。由此,我认为PP333与其他激素(如DA-6、KT)配合使用,对于紫玉淮山芽增殖或壮苗有更好的效果。由于时间影响,本人没有继续研究。在后期实验将继续探究不同浓度的DA-6和KT对芽增殖的影响、探究组合激素对紫玉淮山芽增殖的影响。
4.5. 不同激素组合对生根培养的影响
实验表明,不同浓度NAA和同浓度的6-BA组合对紫玉淮山根增殖影响较大,主要影响因素是NAA。通过不同激素组合,显示组合E5组合培养基对紫玉淮山生根的效果最佳,根多而粗,植株生长粗壮。实验发现部分植株有气生根,在以后的实验将研究如何抑制紫玉淮山气生根的形成。
4.6. 不同浓度香豆素对诱导试管薯的影响
实验表明,和马铃薯试管微薯诱导一样,香豆素对紫玉淮山试管薯诱导同样起作用。当香豆素浓度为50 mg/L时,试管薯结薯率最高,为55.32%;当香豆素浓度为60 mg/L时,试管薯的结薯率开始降低,表明低浓度的香豆素促进紫玉淮山结薯,高浓度的香豆素抑制紫玉淮山结薯;低浓度的香豆素使紫玉淮山结薯率升高,高浓度的香豆素使紫玉淮山结薯率降低。
4.7. 不同浓度香豆素对诱导零余子的影响
实验表明,和试管微薯诱导一样,香豆素对紫玉淮山零余子的诱导也起作用。此外,还和培养的时间有关,因为在自然界薯蓣科的植物同样遵循这个规律,首先在地下结薯,随着时间推移,才会在藤蔓上长零余子,如果零余子成熟了就会掉在地上,等到合适时间就会长出新的植株。因此,在摸索的配方下培养了四个月的时间,藤蔓长出气生根,然后在气生根的地方长出了零余子。也许由于该配方不太合适,所以诱导出来的零余子的时间比较长。在以后的时间,会继续探索诱导紫玉淮山零余子的最优配方,以便缩短时间和更好地对零余子做进一步的研究。
实验结果表明,当香豆素浓度为100 mg/L时,零余子结薯率最高,为45%;当香豆素浓度为300 mg/L时,零余子的结薯率降低,表明低浓度的香豆素促进紫玉淮山结零余子,高浓度的香豆素抑制紫玉淮山结零余子;低浓度的香豆素使紫玉淮山零余子结薯率升高,高浓度的香豆素使紫玉淮山零余子结薯率降低。
5. 展望
紫玉淮山不仅含有丰富的蛋白质、淀粉,还富含维生素A、维生素E、胡萝卜素等营养成分。此外,它还富含花青素,具有重要的营养价值和药用价值,将成为市场的新宠,在未来的市场中需求量会越来越大。而传统的留种无性繁殖方式,致使产量不断降低,品质下降,无法满足市场的需要 [24] 。
本文通过对紫玉淮山微薯和零余子组织培养展开研究,建立一个植株再生的快繁体系及微薯和零余子的诱导,从而有效解决病毒积累造成淮山减产的问题,提高紫玉淮山的品质,满足市场的要求。实验主要以探索紫玉淮山试管微薯和零余子的诱导最佳配方为出发点进行重点研究,打破传统栽培技术,可以用微薯和零余子作为种子的形式进行播种用于生产中,降低人力成本达到高效优质地生产。目前,富含花青素的紫玉淮山越来越受人们的青睐,紫玉淮山花青素含量高,将成为一种巨大潜在市场的天然色素食用品。因此,紫玉淮山的组织培养及快速繁殖具有很大的市场前景。
基金来源
1) “桂西北特色植物资源开发与功能研究中心”研究平台;河池学院开放课题(2015HL002)。
2) 课题名称:油菜素内酯影响气孔运动的机制研究项目编号:XJ2017KQ02。
文章引用
覃国乐,伍灿明,史沉鱼,玉 涛. 紫玉淮山试管微薯诱导研究
Study on Microtuber Induction of Purple Yam[J]. 农业科学, 2018, 08(02): 97-110. http://dx.doi.org/10.12677/HJAS.2018.82018
参考文献 (References)
- 1. 中国科学院中国植物编委会. 中国植物志(16卷)[M]. 北京: 科学出版社, 1985, 54.
- 2. 王长龙. 不同基质对淮山组培苗移植成活率的影响[J]. 农业与技术, 2006, 26(4): 82-83.
- 3. 严华兵, 杨丽涛, 李俊玲, 等. 不同蔗糖浓度对山薯组培苗形态发生途径的影响[J]. 热带作物学报, 2011, 32(7): 1325-1329.
- 4. 严华兵, 龚明霞, 董伟清, 等. 山薯组培苗继代培养基配方筛选[J]. 广西农业科学, 2010, 41(8): 758-761.
- 5. 江苏新医学院编. 中药大词典上册[M]. 上海: 上海科技出版社, 1977, 167.
- 6. 邱广伟, 夏平, 夏静波, 等. 紫色紫玉淮山茎尖培养基筛选试验[J]. 黑龙江农业科学, 2011(3): 24-25.
- 7. 周鑫. 淮山种质资源评价及快速繁殖的研究[D]: [硕士学位论文]. 海口: 海南大学, 2010.
- 8. 龙雯虹, 郭华春. 薯蓣零余子的研究进展[J]. 云南农业大学学报, 2006, 21(4): 486-489.
- 9. 丰锋, 王廷芹, 叶春海. 淮山薯绿色食品生产技术规程[J]. 广东农业科学, 2010, 37(10): 57-59.
- 10. 李明军, 杨建伟. 怀山药的茎段培养和快速繁殖[J]. 植物生理学报, 1997, 33(4): 275-276.
- 11. Lauzer, D., et al. (1992) Plant Cell Tissue and Orgen Culture. , 28, 215. https://doi.org/10.1007/BF00055520
- 12. 钟利萍, 丘志海, 张均祥. 紫玉淮山优质高效栽培技术[J]. 中国园艺文摘, 2013(6): 175-176.
- 13. 张宗勤, 撒文清. 叉蕊薯蓣的微繁殖及微型薯蓣的离体诱导[J]. 生物技术, 1998(1): 18-20.
- 14. 丰锋, 叶春海, 王耀辉, 等. 淮山的组织培养与快速繁殖[J]. 钟恺农业技术学院学报, 2007, 20(1): 24-28.
- 15. 韦本辉, 甘秀芹, 韦威泰, 等. 淮山品种“桂淮2号”的选育及栽培研究[J]. 广西农业生物科学, 2005, 24(1): 48-50.
- 16. 罗健芳. 紫玉淮山对农业经济发展的促进作用研究[J]. 北京农业, 2014, 24: 235-236.
- 17. 王家福. 花卉组织培养与快繁技术[M]. 北京: 中国林业出版社, 2006, 1.
- 18. 刘宝仁, 梅传生, 张金渝, 等. PP333对多种延缓生长的效应[J]. 植物生理学通讯, 1986, 4: 43-45.
- 19. 廖联安, 郭奇珍. 新型植物生长延缓和杀菌剂-氯丁唑[J]. 植物生理学通讯, 1985, 6: 56-58.
- 20. 刘秀莲, 吴月燕, 陈德恩. 吲哚丁酸对石楠组培苗多酚化酶的影响及其与生根的关系[J]. 浙江万里学院报, 2007, 9(5): 3-8.
- 21. 谢庆华, 吴毅歆, 张飞勇, 等. 固定物对马铃薯脱毒试管苗生长的影响[J]. 中国马铃薯, 2001,15(1): 20-21.
- 22. 韦莹. 马铃薯组织培养及试管薯形成的研究[D]: [硕士学位论文]. 南宁: 广西大学, 2007.
- 23. 彭晓英, 周朴华, 张良波, 等. 盾叶薯蓣试管株芽的诱导[J]. 热带亚热带植物学报, 2005, 13(4): 319-323.
- 24. 张淑梅. 紫玉淮山浅层优质高效栽培技术[J]. 吉林农业, 2015(10): 95.
附录一. 图版说明

知网检索的两种方式:
1. 打开知网页面http://kns.cnki.net/kns/brief/result.aspx?dbPrefix=WWJD
下拉列表框选择:[ISSN],输入期刊ISSN:2164-5507,即可查询
2. 打开知网首页http://cnki.net/
左侧“国际文献总库”进入,输入文章标题,即可查询
投稿请点击:http://www.hanspub.org/Submission.aspx
期刊邮箱:hjas@hanspub.org
NOTES
*通讯作者。
