World Journal of Forestry
Vol.2 No.3(2013), Article ID:12099,3 pages DOI:10.12677/WJF.2013.23005
Current Research Development of Polysaccharides from Salvia Species*
1Chenshan Plant Science Research Center, Chinese Academy of Sciences, Shanghai
2Shanghai Chenshan Botanical Garden, Shanghai
Email: nefuky@163.com
Received: Jun. 20th, 2013; revised: Jun. 27th, 2013; accepted: Jul. 4th, 2013
Copyright © 2013 Yu Kong. This is an open access article distributed under the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
ABSTRACT:
The polysaccharide from plants is considered as one of the main bioactive ingredients in natural medicinal plants. Polysaccharides extracted from Salvia species have shown various important bioactivities, such as immunomodulatory, hepatoprotective, antitumor, antioxidant, hyperglycemic etc, and these potential applications are wide. The purpose of this present work is to summarize the current development of polysaccharides from Salvia species in the past five years. The aspects of extraction and isolation processes, structural features and bioactivities are included.
Keywords: Salvia; Polysaccharides; Extraction and Isolation; Structural; Bioactivities
鼠尾草属植物多糖的研究进展*
孔 羽1,2
1中国科学院上海辰山植物科学研究中心,上海
2上海辰山植物园,上海
Email: nefuky@163.com
摘 要:
植物源的多糖类化合物被视为天然药用植物的主要生物活性成分之一。从鼠尾草属植物中提取的多糖具有免疫调节、保肝、抗肿瘤、抗氧化和降血糖等生物活性,应用前景广阔。本文就近五年来鼠尾草属植物多糖的提取、分离、结构分析及其生物活性研究的新进展进行了综述。
收稿日期:2013年6月20日;修回日期:2013年6月27日;录用日期:2013年7月4日
关键词:鼠尾草;多糖;提取分离;结构;生物活性
1. 引言
鼠尾草属(Salvia L.)隶属于唇形科(Labiatae),草本或木本,全球约有700~1050多种,主要分布在热带或温带地区,林下、田间均可见。鼠尾草的拉丁语意为“治愈”,说明其具有药用价值,人类几千年来将其作为调料和药物在世界范围内使用。《中国植物志》[1]记载我国的鼠尾草属植物有84种,分布于全国各地,以西南地区种类最多。该属植物中有资料记载的药用种达30多个,以根、根茎或全草入药[2]。其中,10几种的根或根茎在民间验方中作为传统活血化瘀中药丹参的代用品。鼠尾草属植物的药理功能很多,中医临床中广泛用于心脑血管疾病、肝肾疾病、妇科疾病、疮疡肿毒等的治疗[3]。
关于鼠尾草属植物化学成分的研究,始于上个世纪30年代,日本学者中尾万三等[4]首次从丹参(Salvia miltiorrhiza)中分得二萜丹参酮类化合物。自此,国内外学者对鼠尾草属植物中化学成分及生理活性进行了深入系统研究,证实了该属植物化学成分与活性的多样性,其主要的活性化学成分研究工作集中于水溶性多酚类化合物(以丹酚酸为代表,包括酚酸、黄酮等)和脂溶性萜类化合物(以丹参酮二萜为代表,包括单萜、倍半萜、二萜、三萜等)。鼠尾草属植物多糖类化学成分,是随着植物多糖生物学活性与功能的不断阐明而走进人们的视野。目前对鼠尾草属植物多糖研究的系统性综述,仅有1篇,孙运峰等[5]发表的关于2009年以前鼠尾草属中丹参(Salvia miltiorrhiza)、华鼠尾草(Salvia chinensis)、药鼠尾草(Salvia officinalis)3种药用鼠尾草多糖的制备、结构解析和药理作用的进展。2009年至今未见有鼠尾草属植物多糖研究的综述性报道。本文试图在孙运峰等[5]发表综述的基础上,查阅国内外相关文献就近五年来鼠尾草属植物多糖的提取、分离、结构分析和药理活性等方面进行总结,为鼠尾草属植物多糖类化学成分的研究与应用提供基础资料。
2. 鼠尾草属植物多糖的提取、分离
2.1. 提取
目前发现的鼠尾草属植物多糖在该属植物的根、根茎和叶中均有分布。不同药材组织纤维含量、木质化程度等对其中多糖的提取率均有影响。传统的提取方法是利用多糖易溶于水、稀碱、稀酸,不易溶于石油醚、乙醚、醇、丙酮等有机溶剂的特性,采用以水为主要组成体系的溶剂提取法进行提取。为了获得较高的提取效率,超声波、微波、纤维素酶等多种辅助提取技术应用于丹参(包括其紫花原型和白花变型)根及根茎、药鼠尾草茎叶、华鼠尾草全草等的多糖提取[5]。2011年祝元婷等[6]采用超声提取法对药鼠尾草叶多糖的提取工艺进行了优化,确定最佳工艺条件为提取时间7 min,提取次数2次,料液比1:40,在此条件下药鼠尾草叶多糖的提取率为3.27%。不同的提取方法不仅仅影响鼠尾草属植物多糖的提取效率,Wu等[7]依次采用热水提取、超声波提取、碱提取和酶解提取的方法从丹参中提取多糖,结果发现,所提取多糖的理化性质形似,但立体结构不同。
2.2. 分离
经过溶剂提取获得的鼠尾草属植物多糖提取物为粗多糖,需经过进一步的分离纯化。大孔吸附树脂、离子交换吸附树脂和葡聚糖凝胶是比较常用的分离填料。2011年,汤伟等[8]采用大孔吸附树脂及离子交换层析法对由水提醇沉法制得的丹参多糖进行了分离纯化,结果显示,AB-8、DB-301型大孔吸附树脂吸附多糖后,用水洗脱即可将粗多糖纯度由40.35%纯化至80%左右。进一步采用DEAE-52纤维素层析柱分离,水洗脱部位得到中性多糖组分SMP1、由0.05 mol/L NaCl和0.5 mol/L NaCl溶液洗脱组分分别得到酸性多糖组分SMP2和SMP3。Liu等[9]对丹参粗多糖Sevage除蛋白、95%乙醇沉淀除杂后经DEAE纤维素层析柱分离,其水洗脱组分进一步用葡聚糖凝胶Sephadex G-100纯化,得到多糖SMP-W1,其得率为8.26%。
3. 鼠尾草属植物多糖的结构分析
植物多糖的结构分析包括分子量、单糖组成、单糖的序列、糖苷键的位置、分支类型与和聚合度、空间构型等,分析过程可采用甲基化分析、酸水解、糖醛酸还原等化学分析方法以及柱色谱、红外光谱、质谱、核磁共振等光谱技术、扫描电镜等技术[10]。蔡亚平等[11]利用高效凝胶渗透色谱技术对丹参多糖相对分子质量的分布情况进行了分析,结果发现丹参多糖分为低相对分子质量(Mw < 1000)和高相对分子质量(Mw 106~104)两个明显部分,前者具有单向对分子质量的特征;后者相对分子质量分散性大。目前对鼠尾草属植物中多糖的研究主要以粗多糖为对象,或者对粗多糖初步富集的部位进行主要单糖组成的分析,如Capek等[12]对药鼠尾草地上部分的多糖提取物及五个组分段中鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖6种单糖的向对组成进行了分析。而在鼠尾草属植物多糖中,相对结构明确的仅有7种(表1)。
4. 鼠尾草属植物多糖的生物活性
4.1. 免疫调节
植物多糖最主要的生物活性是免疫调节作用,其通过激活T细胞和B细胞、网状内皮系统、补体、诱导肿瘤坏死因子以及激活巨噬细胞、干扰素生成等途径提高机体的特异性免疫和非特异性免疫[17]。Capek等[18]从药鼠尾草地上部分中提取制得了分别富含阿拉伯半乳聚糖、果胶以及葡糖醛酸木聚糖聚合物的3
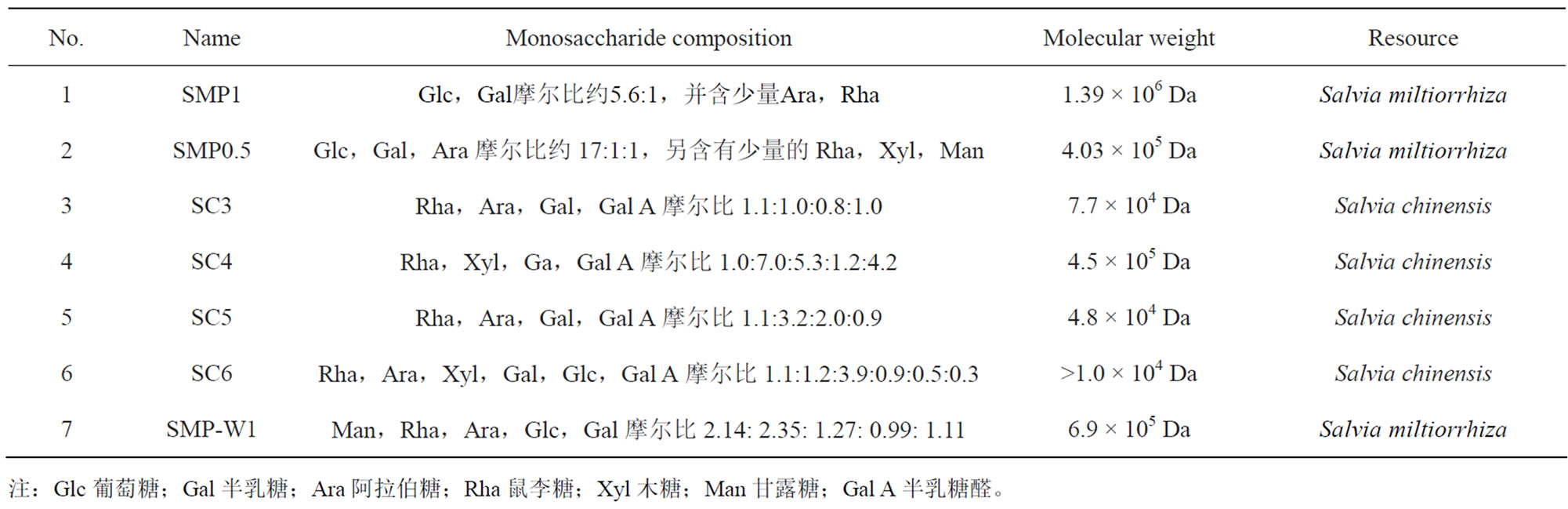
Table 1. The polysaccharides isolated from the Salvia species[9,13-16]
表1. 鼠尾草属植物中分离得到的多糖[9,13-16]
个粗多糖组分,采用小鼠胸腺细胞体外增殖法研究了他们的免疫调节活性,结果显示富含葡糖醛酸木聚糖聚合物的组分表现出显著的免疫调节活性,并对小鼠胸腺细胞的有丝分裂有促进作用。汤伟等[19]通过实验动物模型观察了丹参多糖(总多糖含量72.34%)对环磷酰胺所致的免疫功能底下小鼠肝、脾、胸腺及单核巨噬细胞吞噬廓清能力的影响,发现丹参多糖不仅可显著上调脾、胸腺的脏器指数,促进免疫器官的恢复,还能明显提高环磷酰胺致免疫抑制小鼠腹腔巨噬细胞的吞噬百分率和吞噬指数,激活巨噬细胞。张湘东等[20]研究了丹参粗多糖对脂多糖诱导小鼠脾淋巴细胞增殖反应的影响、对小鼠腹腔巨噬细胞吞噬鸡红细胞的影响和对二硝基氟苯(DNFB)诱发小鼠迟发超敏反应的影响,结果显示浓度为500 mg/L的丹参粗多糖可显著促进小鼠淋巴细胞增值反应,剂量为200 mg/kg的丹参粗多糖可以显著提高小鼠腹腔巨噬细胞的吞噬作用,此外,丹参粗多糖能显著的抑制DNFB所致的小鼠耳廓变应性接触性皮肤炎所致的耳肿胀以及血管通透性的增加。进一步对小鼠脾脏部分基因表达水平进行测定后发现,丹参粗多糖可以显著的抑制细胞因子iNOS、IFN-α、IL-1β mRNA的过量表达。
4.2. 保护肝、肾
众所周知,鼠尾草属植物中的典型代表——丹参,具有保护肝细胞和促进肝细胞再生等肝保护作用。早在1994年,一项由日本学者申请的一项专利中已阐明从丹参、南丹参、甘西鼠尾草或云南鼠尾草根及根茎中提取制得的水溶性多糖口服及肌肉注射剂对肝、肾的保护作用[21]。Song等[22]利用尾静脉注射脂多糖(LSP)诱导卡介苗免疫小鼠的肝损伤模型研究了丹参粗多糖的作用,结果显示90~360 mg/kg剂量范围的丹参粗多糖对免疫性肝损伤具有保护作用,能够减少血清ALT、天门冬氨酸转氨酶(AST)和一氧化氮(NO)的水平,并使肝组织匀浆中的肿瘤坏死因子-α和白介素-1β恢复至正常水平。此外,在LSP诱导的急性肝损伤模型小鼠实验中,剂量为3.90~15.60 g/kg的丹参多糖能够降低肝组织中的丙二醛(MDA)含量、剂量为7.80~15.60 g/kg的丹参多糖能够升高还原型谷胱甘肽(GSH)的含量[23]。
4.3. 抗肿瘤
Liu等[9]研究发现从丹参中分离得到的多糖SMP-W1在体外和小鼠体内实验中对小鼠肝癌细胞H22增殖均有抑制作用,200和400 µg/mL SMP-W1体外作用于H22细胞株48 h后,对其生长抑制率可达43%,在体内实验中,200 mg/kg剂量的SMP-W1对H22的抑制率为55.1%,与25 mg/kg剂量的常用代谢类抗癌药5-FU治疗组的抑制率(60.5%)接近,并且与5-FU相比,其在小鼠胸腺指数、脾脏指数和体重方面呈现正向的影响。这是继2008年郑海音等[24]关于华鼠尾草多糖抑制人肝癌细胞报道后,又一例鼠尾草属多糖抗肿瘤功效的文献资料。
4.4. 抗氧化
关于药鼠尾草多糖的抗氧化活性早有报道,其叶的超声波提取物对DPPH自由基清除能力IC50为112 μg/mL,并且当质量浓度为160 μg/mL时,清除率达到82%[6]。
4.5. 保护心肌
周凤华等[25]用H2O2干预体外培养乳鼠心肌细胞建立氧化应激心肌损伤模型,通过预先给予丹参多糖处理心肌细胞发现,丹参多糖能够从增加细胞活力与降低凋亡率两方面有效保护H2O2导致的心肌细胞损伤,初步机制研究显示丹参多糖可以明显增加心肌细胞中具有抗凋亡作用的prohibitin蛋白表达。这一结果提示丹参多糖在丹参治疗心血管疾病中可能具有重要功效。
4.6. 预防糖尿病
氧化应激和胰岛素抵抗与II型糖尿病的发展关系密切,Zhang等[26]通过叔丁基过氧化氢诱导大鼠胰岛素抵抗动物模型研究了丹参多糖(SMPW1)的作用。结果发现,剂量为50和100 mg/kg的SMPW1可通过增加过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GPX)活性保护叔丁基过氧化氢诱导的损伤。同时,降低血浆和肝脏中的丙二醛(MDA),改善胰岛素敏感性指数。在II型糖尿病治疗方面具有潜力。
5. 展望
鼠尾草属植物资源丰富,活性多样。鼠尾草属植物多糖作为生物医药产品具有广阔的市场前景。当前的化学研究较少,主要针对粗多糖进行的药理作用研究已显示出鼠尾草多糖的巨大医疗潜力,因此,进一步对该属植物多糖进行纯化、结构分析与深入的药理实验分析对该属植物资源的利用意义重大。
6. 致谢
诚挚感谢中国科学院上海生命科学院植物生理生态研究所陈晓亚研究员对本论文撰写的支持与帮助。
参考文献 (References)
[1] Salvia in Flora of China [URL]. Flora of China, 2013. http://efloras.org
[2] X. H. Xiao, Q. M. Fang, W. J. Xia, G. P. Yin, et al. Numerical taxonomy of medicinal Salvia L. and the genuineness of danshen. Journal of Plant Resources and Environment, 1997, 6(2): 17-21.
[3] 张正付, 陈鸿珊, 李卓荣. 鼠尾草属植物化学成分及活性研究新进展[J]. 中国新药杂志, 2007, 16(9): 665-672.
[4] 中尾万三, 福岛忠腾. 汉药丹参的成分研究(第一报)[J]. 药学杂志, 1934, 54(9): 844.
[5] 孙运峰, 李海娜, 周长征, 刘玉红. 鼠尾草属药用植物多糖的研究进展[J]. 食品与药品, 2010, 12(3): 138-141.
[6] 祝元婷, 吴文林, 张利, 刘琪. 超声提取鼠尾草叶多糖工艺优化及其DPPH自由基清除能力评价[J]. 食品科学, 2011, 32(16): 76-79.
[7] W. L. Wu, Y. T. Zhu, L. Zhang, et al. Extraction, preliminary structural characterization, and antioxidant activities of polysaccharides from Salvia miltiorrhiza Bunge. Carbohydrate Polymers, 2012, 87: 1348-1353.
[8] 汤伟, 彭求贤, 严愉妙, 莫志贤, 黄少慧, 李欣, 蔡红兵. 大孔吸附树脂法及离子交换层析柱法精制纯化丹参多糖的研究[J]. 中药材, 2010, 33(12): 1937-1941.
[9] L. Liu, J. Jia, G. Zeng, et al. Studies on immunoregulatory and anti-tumor activities of a polysaccharide from Salvia miltiorrhiza Bunge. Carbohydrate Polymers, 2013, 92: 479-483.
[10] S. P. Nie, M. Y. Xie. A review on the isolation and structure of tea polysaccharides and their bioactivities. Food Hydrocolloids, 2011, 25: 144-149.
[11] 蔡亚平, 赵蕊, 朱丹. 丹参多糖的组成分析[J]. 中国实验方剂学杂志, 2010, 16(18): 88-91.
[12] P. Capek, V. Hribalova, E. Svandova, et al. Characterization of immunomodulatory polysaccharides from Salvia officinalis L. International Journal of Biological Macromolecules, 2003, 33(1- 3): 113-119.
[13] 汪红, 王强, 王顺春等. 丹参多糖的提取分离及结构鉴定[J]. 中国中药杂志, 2006, 31(13): 1075-1077.
[14] 刘翠平, 王雪松, 方积年. 石见穿多糖SC3的化学研究[J]. 药学学报, 2002, 37(3): 189-193.
[15] C. P. Liu, J. N. Fang, X. Y. Li, et al. Structural characterization and biological activities of SC4, an acidic polysaccharide from Salvia chinensis. Acta Pharmacologica Sinica, 2002, 23(2): 162- 166.
[16] 刘翠平, 王雪松, 方积年. 石见穿两个酸性多糖的化学研究[J]. 中草药, 2004, 35(1): 8-12.
[17] 陈旋, 张翼, 张剑波. 植物多糖的研究进展[J]. 中国新药杂志, 2007, 16(13): 1000-1005.
[18] P. Capek, E. Machova and J. Turjan. Scavenging and antioxidant activities of immunomodulating polysaccharides isolated from Salvia officimalis L. International Journal of Biological Macromolecules, 2009, 44(1): 75-80.
[19] 汤伟, 彭求贤, 蔡红兵, 李欣, 莫志贤. 丹参多糖对免疫抑制小鼠单核吞噬细胞吞噬功能的影响[J]. 时珍国医国药, 2011, 22 (10): 2484-2485.
[20] 张湘东, 许定舟, 李金华, 汪涛, 葛发欢, 杨丽. 丹参多糖的免疫调节活性研究[J]. 中药材, 2012, 35(6): 949-953.
[21] JCR Pharmaceuticals Co. Ltd. Polyglucuronic acid as remitting agent for nephritic syndrome and hepatopathy symptoms. 1994.
[22] Y. H. Song, L. Qiang, Z. P. Lv, et al. Protection of a polysaccharide from Salvia miltiorrhiza, a Chinese medicinal herb against immumological liver injury in mice. International Journal of Biological Macromolecules, 2008, 43(2): 170-175.
[23] 姚莹华, 刘强, 陈育尧, 孙学刚, 吕志平. 丹参多糖对小鼠急性肝损伤的保护作用[J]. 中国实验方剂学, 2010, 16(6): 227- 230.
[24] 郑海音, 徐伟, 郑晓燕等. 石见穿多糖的提取及其对肝癌细胞增殖的抑制作用[J]. 中国中医药科技, 2008, 15(5): 360- 362.
[25] 周凤华, 李丽君, 李杰, 杨萍, 贾钰华, 孙学刚. 丹参多糖保护H2O2致心肌细胞损伤作用机制[J]. 时珍国医国药, 2011, 22 (12): 2289-2291.
NOTES
*基金项目:上海市绿化与市容管理局科技攻关项目(F122420)。