International Journal of Psychiatry and Neurology
Vol.1 No.3(2012), Article ID:926,5 pages DOI:10.12677/IJPN.2012.13006
The Progress of Chinese Traditional Medicine Hypericum perforatum L. for the Treatment of Depression
School of Pharmacy, Xinxiang Medical University, Xinxiang
Email: *liujuyuan@xxmu.edu.cn
Received: Jun. 29th, 2012; revised: Jul. 5th, 2012; accepted: Jul. 9th, 2012
ABSTRACT:
With the increased prevalence of depression and social burden every year, the development of antidepressant is becoming a hop priority. Hypericum perforatum L., also known as St. John’s Wort in Europe, has been used for the treatment of depression for thousands of years. It is the only herbal alternative to classic synthetic antidepressants in the therapy of mild to moderate depression. By analyzing the clinical antidepressant efficacy and mechanism of Hypericum perforatum L., it aims at providing some evidence for Hypericum perforatum L. as a safe and effective drug candidate, and also provides a reference for the research and development of our traditional antidepressant herb.
Keywords: Hypericum perforatum L.; Depression; Mechanism; Drug Interaction
中药贯叶金丝桃治疗抑郁症的进展
吕琼琼,刘巨源*,杨 俊,潘艳娟,路 璐
新乡医学院药学院,新乡
Email: *liujuyuan@xxmu.edu.cn
摘 要:
抑郁症患病率逐年上升,社会负担不断加重,开发抗抑郁症药物已是当务之急。贯叶金丝桃又名圣约翰草,用于抑郁症治疗已有上千年历史,是目前替代经典抗抑郁合成药物治疗轻度和中度抑郁症的唯一草药。本文通过分析贯叶金丝桃治疗抑郁症的临床疗效和作用机理,为其成为安全有效的候选药提供证据,也为我国传统抗抑郁中草药的研究和开发提供参考。
收稿日期:2012年6月29日;修回日期:2012年7月5日;录用日期:2012年7月9日
关键词:贯叶金丝桃;抑郁症;作用机理;药物相互作用
1. 引言
抑郁症作为高速发展的现代经济的“副产品”,已经越来越广泛地影响着人们的生活。全球约有3.5亿抑郁症患者,抑郁症已经成为世界第二大疾病。在中国,目前抑郁症的患病率约为3%~5%并呈逐年上升趋势,抑郁症患者估计有3600万人,世界卫生组织、世界银行和哈佛大学的一项联合研究表明,抑郁症已经成为中国负担第二大疾病,在我国造成的总经济负担达到621亿元[1,2]。所以,无论从疾病谱、患病率及社会负担来看,研究开发治疗抑郁症的药物都迫在眉睫。
现代病理学研究表明抑郁症发病机制甚为复杂,诱发因素较多。针对某单一环节的药物往往难以取得满意的疗效。合成抑郁药大多存在抗抑郁谱窄,毒副作用大,价格高和易复发等缺陷。故国内外在抗抑郁药的研制与开发方面越来越重视植物药资源的利用。其中贯叶金丝桃提取物因其显著的疗效和良好的安全性已成为治疗轻度和中度抑郁症的首选药,本文首先总结了国内外贯叶金丝桃的制剂开发情况,再从分子角度对贯叶金丝桃治疗抑郁症的机制及临床相关问题进行分析,旨在为其成为安全有效的候选药提供证据。
贯叶金丝桃又名贯叶连翘,欧洲名为St. John’s Wort,俗称圣约翰草,系藤黄科金丝桃属,是一种五瓣黄花多年生的草本植物,主产于北美、欧洲和亚洲,是我国传统的中药材之一,其药用历史悠久,最早被《本草纲目拾遗》收载。传统中医药学认为,其性平,味辛苦涩,具有清心明目、舒经活血、止血生肌、解毒消炎、利湿之功效[3]。
2. 贯叶金丝桃用于抑郁症治疗的前世今生
贯叶金丝桃药用历史悠久,早在2500年前的古希腊时代,就已经被用于治疗神经痛、烧伤及精神抑郁症。1618年贯叶金丝桃被收入伦敦药典,以后德、法、美、瑞典、前苏联等国都将其收入药典。1876年King的处方集中记述了圣约翰草可用于治疗抑郁、焦虑等精神疾患,这一点目前已得到医药界的肯定[4]。近两个世纪以来,有关贯叶金丝桃治疗抑郁症的研究仍在不断进行,其中德国对贯叶金丝桃提取物的制剂开发最早,临床应用最广泛,LI160(Jarsin 300)已被批准为标准贯叶金丝桃浸膏制剂。据报道,在德国所有的抗抑郁药物中,这一系列药物占了临床用药的40%[5]。
随着全世界抑郁症人群的逐步扩大和化学抗抑郁药的毒副作用日益凸显,中药抗抑郁药成新看点。20世纪90年代初St. John’s Wort提取物作为膳食补充剂进入美国,1997年上美国草药销售排行榜,1998年开始大流行,并迅速跃升为排行榜第二名(仅次于银杏),1998年的销售额为4亿美元,当年销售增长幅高达2800%[6]。2000年8月,我国国家食品药品监督管理局(SFDA)批准了德国威玛舒培博士大药厂的圣约翰草提取物片剂进入中国,商品名为“路优泰”。路优泰是第一个纯天然植物圣约翰草干提取物,它是以圣约翰草开花前不久或开花期所得到的植物地上部分作为提取原料精制而成,标准提取物的质控指标是金丝桃素汁的含量为0.4~2.7 mg[1]。路优泰的引入,推动了国内这一类药物的使用与研发进程。
贯叶金丝桃提取物及其制剂在我国属于中药5类药物,是当前的热门品类。国内关注这一药物的企业较多,而且经检索得知,贯叶连翘提取物其制备方法及药物组合物的中国有权专利已有21件[7]。据了解,湖北丽益科技有限公司、上海市中药研究所、北大维信的开发工作均有了实质性的进展。2008年10月国家食品药品监督管理局批准了成都康弘药业集团股份有限公司开发的国内第一个中药抗抑郁新药—舒肝解郁胶囊。该药由贯叶金丝桃和刺五加两味中药组成,通过抑制中枢5-HT、DA和NE等神经递质的再摄取,使突触间隙的单胺递质的浓度升高,同时作用于可溶性NSF蛋白及受体,促进单胺递质释放到突触间隙中,从而发挥抗抑郁作用。由北京大学精神卫生研究所牵头开展的Ⅱ、Ⅲ期临床试验结果显示:舒肝解郁胶囊治疗轻中度抑郁症疗效与盐酸氟西汀相当,不良反应发生率显著低于氟西汀;补充临床试验证实,舒肝解郁胶囊不良反应发生率与安慰剂相当,疗效显著优于安慰剂,在治疗轻中度抑郁症上,是疗效和安全性俱佳的纯中药制剂[8]。
3. 贯叶金丝桃抗抑郁成分及机制研究
目前贯叶金丝桃的抗抑郁机制还不是十分清楚,但近来人们普遍认为,贯叶金丝桃的抗抑郁作用是多种活性成分协同作用的结果,其中不同结构的化合物具有不同优势的抗抑郁机制。贯叶金丝桃中具有抗抑郁作用的次生代谢产物主要包括萘骈二蒽酮类化合物(naphtodianthrones)、黄酮类化合物(flavonol glycosides)和藤黄酚类衍生物(phloroglucinols derivatives)这三类。
3.1. 萘骈二蒽酮类化合物
萘骈二蒽酮类化合物是贯叶金丝桃的特征性成分,主要包括金丝桃素(hypericin简称HY)、伪金丝桃素(pseudo-hypericin简称PHY)、还有原金丝桃素(protohypericin)和原伪金丝桃素(protopseudohypericin),它们在光照下可分别转化为金丝桃素和伪金丝桃素,植物中还存在伪金丝桃素的氧化产物一环伪金丝桃素(cyclopseudohypericin),他们的分子结构式见图1。这类成分主要分布于花和芽中,含量约为0.05%~3%,其中花瓣中金丝桃素的含量最高,约为0.245%,伪金丝桃素的含量是金丝桃素的2~4倍。
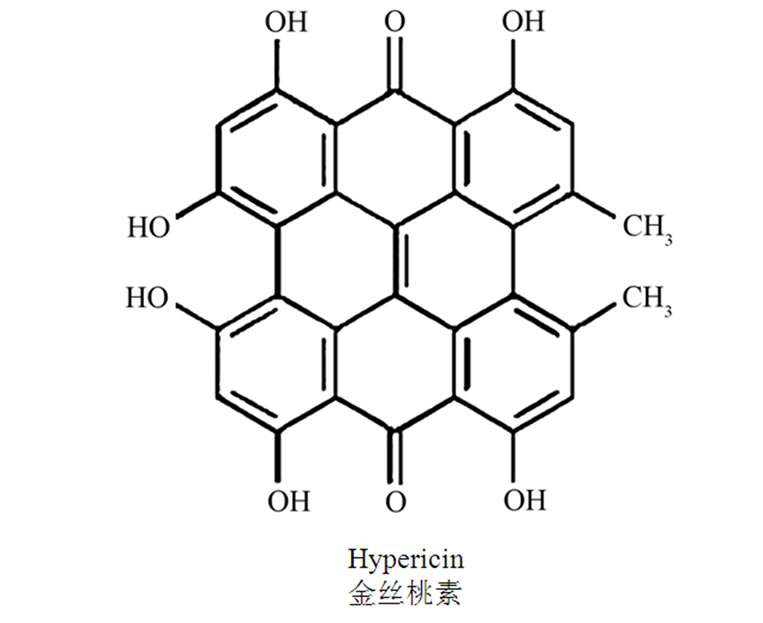

Figure 1. Molecular structure of hypericin and pseudohypericin
图1. 金丝桃素和伪金丝桃素的分子结构式
金丝桃素对MAO的抑制作用一直被认为是贯叶金丝桃抗抑郁作用的主要机制,但据德国的一项体外实验研究,金丝桃素对MAO不显示任何的抑制作用[9]。而Butterweck V.[10]等通过小鼠强迫游泳实验和悬尾实验发现HY和PHY均具有抗抑郁性,其作用能被多巴胺拮抗剂舒必利拮抗,认为多巴胺神经系统与其活性有关。而Kleber E.[11]等人对贯叶金丝桃提取物的生化活性研究发现HY有较高的抑制多巴胺,β-羟化酶的活性,其半抑制浓度(IC50)为3 umol/L。后来Raffa[12]等人又发现HY与毒蕈碱乙酰胆碱受体(mAChR)和σ受体有显著的亲和性,而mAChR和σ受体被认为与抗抑郁作用有关,这为HY的抗抑郁机制研究提供了新思路。
3.2. 黄酮类化合物
贯叶金丝桃中的黄酮类化合物主要包括金丝桃苷(hyperoside),槲皮苷(quercitrin),芦丁(rutin),槲皮素(quercetin)以及原花青素(procyanidin)等,它们的分子结构式见图2。这类化合物在贯叶金丝桃花中的含量约为11.7%,茎叶中约为7.4%。研究表明贯叶连翘总黄酮能够显著降低小鼠强迫游泳模型(FST)和小鼠悬尾模型(TST)的不动时间,具有一定的抗抑郁活性[13]。其中相关的抗抑郁活性成分筛选实验也证明了金丝桃苷,槲皮苷,芦丁,原花青素等单一的黄酮类化合物均具有一定的抗抑郁活性[14,15]。
目前对贯叶金丝桃中黄酮类化合物的抗抑郁机制研究主要集中在以下两个方面:一是分子药理学因素,此类化合物通过抑制单胺氧化酶(MAO)活性及突触体对单胺类神经递质的重吸收,增加脑垂体和脑干中去甲肾上腺素(NE)、5-羟色胺(5-HT)、多巴胺(DA)的浓度,从而产生抗抑郁作用[16-18]。二是神经药理学因素,黄酮类化合物通过对下丘脑–垂体–肾上腺轴(HPA)的调节,降低抑郁症患者体内促肾上腺皮质激素和皮质醇的水平。还有研究表明金丝桃苷和槲皮素是神经元刺激因子,可改善神经营养和可塑性,从而达到抗抑郁的效果。
3.3. 藤黄酚类衍生物
该类化合物主要有贯叶金丝桃素(hyperforin简称HF)和加贯时金丝桃素(adhyperforin),它们的分子结构式见图3。其中HF被认为是贯叶金丝桃抗抑郁的主要活性成分,主要分布于花和未成熟的蒴果中,其中含量分别约为2%,4.5%。
与一般的直接阻断单胺类神经递质重吸收的合成抗抑郁药不同,HF能够非选择性地抑制突触体对
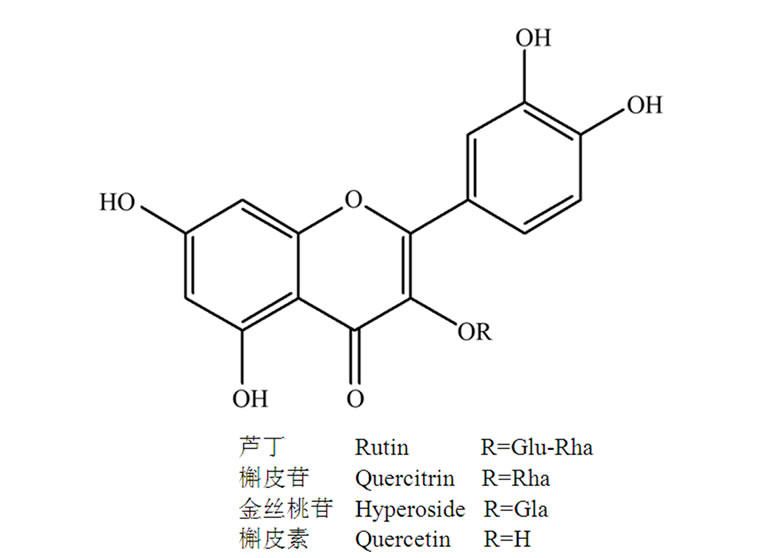
Figure 2. Molecular structure of flavonoids in Hypericum perforatum L.
图2. 贯叶金丝桃中黄酮类化合物的分子结构式
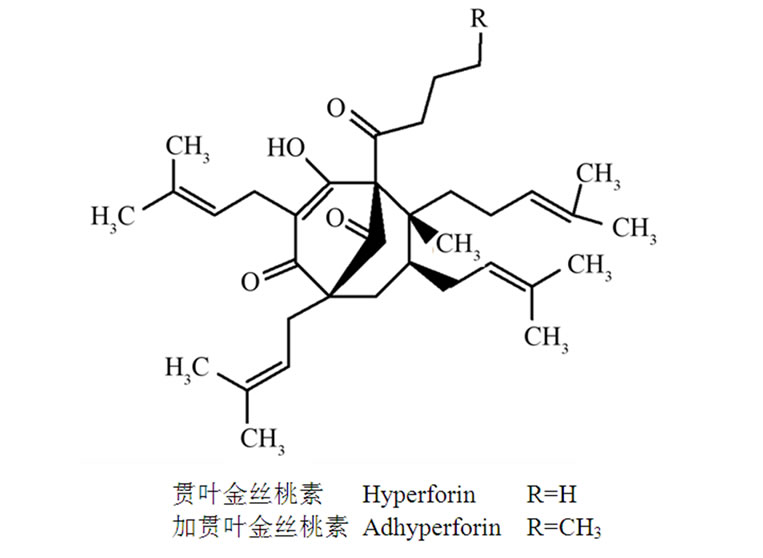
Figure 3. Molecular structure of hyperforin and adhyperforin
图3. 贯叶金丝桃素和加贯叶金丝桃素的分子结构式
5-HT,DA,NE等神经递质以及对γ氨基丁酸(GABA),L-谷氨酸的重吸收。这种抑制机制还不明确,研究表明可能与HF能升高突触细胞内钠离子浓度,开放突触前钙通道,降低突触小泡的跨膜pH梯度有关[19],从而在阻断单胺类递质重吸收的同时又促进神经递质释放,Eckert等还认为与HF可改变神经元细胞膜的流动性有关。Kristina Leuner等进一步研究证实HF对诱导阳离子([Na+]i、[Ca2+]i)进入突触体细胞内具有高度的特异性且与非选择性阳离子通道TRPC6有关,TRPC6通道可提高细胞内[Na+]i从而降低细胞内外的浓度梯度,消除神经递质转运蛋白运作的驱动力,进而抑制神经递质的转运。另外,HF还可通过酪氨酸激酶相关的磷脂酶C-γ信号通路激活TRPC6通道[20],诱导神经生长因子的产生,Yanlin Wang等人也发现HF能提高线粒体的功能,促进少突神经胶质细胞的发育,促进神经轴突的生长,改善抑郁症患者神经元突起萎缩的症状[21]。
2010年,Birgit Kraus[22]的体外实验研究表明HF是小神经胶质细胞和吞噬细胞中诱生型NO合酶和吞噬作用的调节器,可诱导细胞信号转导通路的变化防止NO等炎症因子的过量生成。有证据表明,一旦脑内小胶质细胞和具免疫活性的细胞被激活,就会发挥强大的吞噬作用并释放NO等炎症因子,而过量NO的产生和异常炎症反应是导致神经退行性疾病(包括抑郁症)的关键。但由于HF对光和氧的敏感性及在水溶液中的不稳定性,虽然24小时后HF改变了细胞的炎症反应但却无法检测到HF的存在,所以具体调节机制仍需进一步研究,猜测有以下两种可能:一、HF即使在短时间暴露后仍可诱导细胞信号和转录途径的长期变化;二、HF虽然不存在,但其产生了活跃的代谢产物继续调节炎症反应。
4. 贯叶金丝桃的药物相互作用
近年来,贯叶金丝桃的药代动力学和药效学研究为贯叶金丝桃的临床应用提供可靠依据的同时,也推动了临床另一焦点问题的发展—贯叶金丝桃的药物相互作用。在过去的5年里,有近80篇关于贯叶金丝桃和一些处方药相互作用的报道,这些药物与贯叶金丝桃联合使用后会导致其血药浓度下降(AUC降低30%~80%),药效降低,不良反应也会增加。例如贯叶金丝桃与5-HT再摄取抑制剂(如帕罗西汀)及5-HT受体激动剂(如舒马曲坦)联合使用会出现5-HT症候群[23]。故贯叶金丝桃的药物相互作用研究对于指导临床合理安全用药至关重要。
目前,有足够的药物相互作用实验及临床病例报告[23-28]证明,贯叶金丝桃能够诱导细胞色素P450酶(CYP)(尤其是CYP3A4,CYP2C19)的表达,同时提高肠道P糖蛋白的活性,改变药物在体内的代谢过程。故经过CYP和P糖蛋白代谢的药物与贯叶金丝桃合用时都会出现药物相互作用。被报道的药物主要包括以下几类:免疫抑制剂如环孢菌素、他克莫司等,蛋白酶抑制剂如沙奎那韦、茚地那韦等,非核苷类逆转录酶抑制剂如奈韦拉平、地拉韦啶等,口服避孕药如炔雌醇、炔诺酮等,三环类抗抑郁药以及苯二氮卓类药如阿米替林,咪达唑仑等,抗肿瘤药如伊立替康,他汀类降血脂药如辛伐他汀、阿托伐他汀,还有地高辛,华法林,维拉帕米等。
进一步了解到贯叶金丝桃的主要抗抑郁成分HF是孕甾烷X受体(PXR)最强大的配体,通过激活PXR,主要诱导CYP亚型CYP3A4,CYP2C19,CYP2E1的表达,对CYP1A2,CYP2C9等亚型无作用。Rajanikanth Madabushi[29]等人还证实这种诱导作用与HF的含量有关,HF含量小于1%的贯叶金丝桃提取物在治疗轻中度抑郁症方面明显优于安慰剂,与米帕明、氟西汀等效且不显示药物相互作用。贯叶金丝桃对P糖蛋白的诱导活性可能还与其他活性成分有关,有实验证明无HF的贯叶金丝桃提取物仍可诱导P糖蛋白的表达活性,0.03~3 μmol·L-1的HY会诱导P糖蛋白3~7倍的表达,槲皮素长期给药能提高肠道P糖蛋白的活性,但具体机制还需要做进一步研究。
5. 新药研发思路
综上所述,贯叶金丝桃在治疗抑郁症的同时还需要考虑其临床应用的禁忌症及注意事项,以免发生药物相互作用。同时,进一步探明贯叶金丝桃的抗抑郁作用及药物相互作用的分子机制对植物替代疗法的评估和优化提供了思路。我们可以从以下几个方面对贯叶金丝桃制剂进行优化和研发:一、通过考察提取物中金丝桃素,贯叶金丝桃素及黄酮类成分含量及比例对药物相互作用的影响,完善贯叶金丝桃的质量标准,保证贯叶金丝桃及其制剂的安全有效使用;二、对贯叶金丝桃素进行结构改造,减少其药物副作用。体外研究发现,贯叶金丝桃素的烯醇式环己二酮结构经修饰后所得的衍生物抑制神经递质重吸收的作用明显[29];三、开发贯叶金丝桃复方制剂,有报道称,贯叶金丝桃与一些中药联用可使其药物相互作用发生率降低。
6. 致谢
感谢我的导师刘巨源和杨俊教授,本文是在他们的亲切关怀和悉心指导下完成的。他们严肃的科学态度和一丝不苟、精益求精的工作作风一直是我工作、学习中的榜样,深深的激励着我。他们严谨的指导方式和创新的思路理念给予我无尽的启迪。还要感谢一起帮助我完成本文的同学和朋友,正是因为你们的支持,我才能克服困难直至本文顺利完成。
参考文献 (References)
[1] 丁香园. 2010年抗抑郁药市场研究报告[URL], 2012. http://d.dxy.cn/preview/2359551
[2] 米内网. 首届抗抑郁药物论坛在沪举行[URL], 2012. http://www.menet.com.cn/Articles/IEconomy/201110/20111013092308238_56373.html
[3] 中科院西北植物研究所. 秦岭植物志(第一卷, 第三册)[M]. 北京: 科学出版社, 1981: 303.
[4] 孙秋红. 抗抑郁良药——路优泰[J]. 河南实用神经疾病杂志, 2002, 5(2): 67.
[5] 中国医药经济信息网. 190亿美元: 抗抑郁药的豪门盛宴[URL], 2012. http://www.meinet.com.cn:8080/LocaleCompanyDynamic/showLocalCompanyDynamicDetailsAction.action?imId=98564599C 5314F42A332BAB3B1AB36F6.
[6] Nutrition Business Journal Chapter: Nutrition Business International. San Diego, 1998.
[7] 国家知识产权局. 中国知识产权网[URL]. http://www.cninfo.com.
[8] 成都康弘药业集团. 舒肝解郁胶囊前生今世[J]. 中国医院院长, 2011, 8: 76.
[9] K. Linde, G. Ramirez, C. D. Mulrow, et al. St John’s wort for depression—An overview and meta-analysis of randomised clinical trials. BMJ, 1996, 313(7052): 253-258.
[10] V. Butterweck, A. Wall, U. Lieflander-Wulf, et al. Effects of the total extract and fractions of Hypericum perforatum in animal assays for antidepressant activity. Pharmacopsychiatry, 1997, 30 (Suppl. 2): 117-124.
[11] E. Kleber, T. Obry, S. Hippeli, et al. Biochemical activities of extracts from Hypericum perforatum L. 1st communication: Inhibition of dopamine-beta-hydroxylase. Arzneimittelforschung, 1999, 49(2): 106-109.
[12] R. B. Raffa. Screen of receptor and uptake-site activity of hypericin component of St. John’s wort reveals sigma receptor binding. Life Science, 1998, 62(16): 265-270.
[13] 石永平, 汪海. 高度富集黄酮类成分的贯叶连翘提取物抗抑郁作用[J]. 中药新药与临床药理, 2006, 17(1): 4-7.
[14] V. Butterweck, G. Jurgenliemk, A. Nahrstedt, et al. Flavonoids from Hypericum perforatum show antidepressant activity in the forced swimming test. Planta Medica, 2000, 66(1): 3-6.
[15] M. Noldner, K. Schotz. Rutin is essential for the antidepressant activity of Hypericum perforatum extracts in the forced swimming test. Planta Medica, 2002, 68(7): 577-580.
[16] 张庆建, 赵毅民, 杨明等. 黄酮类化合物对中枢神经系统的作用 [J]. 中国中药杂志, 2001, 26(8): 511-513.
[17] G. Calapai1, A. Crupi, F. Firenzuoli, et al. Serotonin, norepinephrine and dopamine involvement in the antidepressant action of Hypericum perforatum. Pharmacopsychiatry, 2001, 34(2): 45- 49.
[18] 徐立, 魏翠娥, 赵明波等. 贯叶金丝桃总黄酮对小鼠抑郁症模型的实验研究[J]. 中国中药杂志, 2005, 30(15): 1184-1188.
[19] N. Roz, M. Rehavi. Hyperforin inhibits vesicular uptake of monoamines by dissipating pH gradient across synaptic vesicle membrane. Life Science, 2003, 73(4): 461-470.
[20] K. Treiber, A. Singer, B. Henke, et al. Hyperforin activates nonselective cation channels (NSCCs). British Journal of Pharmacology, 2005, 145(1): 75-83.
[21] Y. Wang, Y. Zhang, J. He, et al. Hyperforin promotes mitochondrial function and development of oligodendrocytes. Journal of Neurochemistry, 2011, 119(3): 555-568.
[22] B. Kraus, H. Wolff, E. F. Elstner, et al. Hyperforin is a modulator of inducible nitric oxide synthase and phagocytosis in microglia and macrophages. Naunyn-Schmiedeberg’s Archives of Pharmacology, 2010, 381(6): 541-553.
[23] F. Borrelli, A. A. Izzo. Herb-drug interactions with St John’s wort (Hypericum perforatum): An update on clinical observations. AAPS Journal, 2009, 11(4): 710-727.
[24] R. Groning, J. Breitkreutz and R. S. Muller. Physico-chemical interactions between extracts of Hypericum perforatum L. and drugs. European Journal of Pharmaceutics and Biopharmaceutics, 2003, 56(2): 231-236.
[25] L. Henderson, Q. Y. Yue, C. Bergquist, et al. St John’s wort (Hypericum perforatum): Drug interactions and clinical outcomes. British Journal of Clinical Pharmacology, 2002, 54(4): 349-356.
[26] A. A. Izzo. Drug interactions with St. John’s Wort (Hypericum perforatum): A review of the clinical evidence. International Journal of Clinical Pharmacology and Therapeutics, 2004, 42(3): 139-148.
[27] R. Madabushi, B. Frank, B. Drewelow, et al. Hyperforin in St. John’s wort drug interactions. European Journal of Clinical Pharmacology, 2006, 62(3): 225-233.
[28] R. S. Muller, J. Breitkreutz and R. Groning. Interactions between aqueous Hypericum perforatum extracts and drugs: In vitro studies. Phytotherapy Research, 2004, 18(12): 1019-1023.
[29] L. Verotta, G. Appendino, E. Belloro, et al. Synthesis and biological evaluation of hyperforin analogues. Part I. Modification of the Enolized Cyclohexanedione Moiety, 2002, 65(4): 433-438.
NOTES
*通讯作者。