Hans Journal of Surgery
Vol.07 No.01(2018), Article ID:23355,10
pages
10.12677/HJS.2018.71002
Effects of Recombinant Adenovirus-Mediated Co-Transfection of CEA Gene and EPO Geneon Promoting Hematopoietic Stem Cell Directly Producing Erythrocyte Vaccine against Colon Cancer
Huawen Sun, Houlai Yang, Qiushuang Wang
The Gastrointestinal Department of Renmin Hospital of Wuhan University, Wuhan Hubei

Received: Dec. 16th, 2017; accepted: Dec. 30th, 2017; published: Jan. 8th, 2018

ABSTRACT
Objective: To investigate the effects of recombinant adenovirus-mediated co-transfection of CEA gene and EPO gene on promoting hematopoietic stem cell directly producing erythrocyte vaccine against colon cancer. Method: The expression adenovirus vectors carrying CEA and EPO or green fluorescent protein (GFP) gene were constructed respectively, and recombinant adenovirus carrying CEA, EPO or GFP were packaged and produced respectively. The bone marrow-derived MSCs of mice were isolated and cultured in vitro by anti-CD117magnetic bead separation, and were transfected with CEA (CEA group), EPO (EPO group) or GFP(GFP group), co-transfected with CEA and EPO (CEA and EPO group), or transfected with no virus (controlgroup). The expression of CEA and EPO gene and protein after transfection in supernatant fluid of culture was detected by RT-PCR and western blot in each group. We have checked and obtained the vaccine with co-transfection of CEA gene and EPO gene by cell red line marker antibody CD71 and GPA, then we carried on experiments with the vaccine in vitro and in vivo. Result: We have successfully gathered the hematopoietic stem cells; flow cytometry analysis result showed that there were significant differences before and after purification (P < 0.05). The expression of double genes (CEA-EPO gene) and protein shows CEA-EPO gene were successfully transfected into the hematopoietic stem cells. We have confirmed erythrocyte vaccine with co-transfection of CEA and EPO gene by antibody CD71 and GPA with flow cytometry. The monocytes cytotoxicity on colon cancer cell line CT26 showed that CEA-EPO group was 57.34 ± 1.13% in proportion of 40:1. Compared with CEAg group and EPO group, there was significant difference between them (P < 0.05). In the experimentation of neoplasma format, the size of murine growth of tumor was 0.29 ± 0.11 cm3 differently in the group of CEA-EPO group; the number of murine live time on day was 69 ± 6.91 days. Compared with the group of CEA and plasmid, EPO, the group of CEA-EPO was significant differences in size and live time (P < 0.05). Conclusion: The erythrocyte vaccine with co-transfection of CEA gene and EPO gene has efficient anti-tumor effects on colon cancer. It not only can promote hematopoietic stem cell directly producing erythrocyte vaccine, but also can produce tumor Antigen vaccine against stomach cancer.
Keywords:cDNA, CEA and EPO, Transfection, Erythrocyte Vaccine, Colon Cancer
CEA-EPO质粒的构建及诱导造血干细胞 定向生成红细胞疫苗抗结肠癌的研究
孙华文,杨厚来,王秋爽
武汉大学人民医院胃肠外科,湖北 武汉
收稿日期:2017年12月16日;录用日期:2017年12月30日;发布日期:2018年1月8日

摘 要
目的:研究CEA-EPO质粒的构建及诱导造血干细胞定向生成红细胞疫苗抗结肠癌的研究。方法:将EPO-cDNA插入pcDNA3.1质粒的多克隆位点,用CEA基因启动子替代pcDNA3.1质粒的CMV启动子,构建成CEA-EPO重组质粒。用含抗体CD117磁珠分离纯化和收集小鼠骨髓造血干细胞,用重组腺病毒法将CEA-EPO基因体外转染CEA-EPOmRNA基因到造血干细胞内,检测CEA-EPO基因和蛋白表达,将疫苗注入小鼠体内,进行扩增,使造血干细胞定向生成携带CEA-EPO双基因红细胞,经过提取和纯化获得CEA-EPO基因共转染红细胞疫苗,再进行双基因共转染红细胞疫苗的体外和体内实验。结果:成功收集造血干细胞,流式细胞仪分析结果表明:纯化前后有明显差异(P < 0.05);检测CEA-EPOmRNA和蛋白表达的结果表明:造血干细胞体外转染CEA-EPOmRNA基因成功,获得CEA-EPO双基因共转染红细胞疫苗;应用细胞红系相关标志抗体GPA和CD71标记,利用流式细胞证实红细胞疫苗培养成功;研究相关疫苗激活的单核细胞对结肠癌细胞株CT26细胞杀伤作用表明:在比例为40:1时,CEA-EPO疫苗组杀伤作用为57.34 ± 1.13,高于空载组、CEA疫苗组和EPO疫苗组(P < 0.05),体内试验的成瘤性研究表明:CEA-EPO疫苗组肿瘤的生长的大小为0.29 ± 0.11 (cm3);高于其他各组的大小(P < 0.05),CEA-EPO疫苗组的成活期分别为:69 ± 6.91天,高于其他各组的大小(P < 0.05);CEA-EPO疫苗组在肿瘤大小和小鼠的生存时间上,与空载组、CEA疫苗组,EPO疫苗组之间差异有统计学意义(P < 0.05)。结论:携带CEA-EPO双基因肿瘤抗原的红细胞疫苗对结肠癌有明显的抗肿瘤作用,既可以诱导造血干细胞定向分化成红细胞疫苗,又可以合成肿瘤抗原的红细胞疫苗,是临床治疗结肠的重要疫苗。
关键词 :cDNA,CEA-EPO基因,转染,红细胞疫苗,结肠癌

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
癌胚抗原(eareinoembryonic antigen, CEA),主要表达于结肠等消化道肿瘤中而不表达于成人正常组织,目前,在应用于临床的结直肠癌肿瘤标志物中,血清癌胚抗原是最重要的一种,血清CEA水平能预测结直肠癌的预后及复发,文献表明它能诱发结肠癌机体特异性免疫反应,因此,CEA启动子可用作肿瘤靶向治疗的工具,启动下游杀伤基因特异性表达于肿瘤细胞,从而避免损伤正常细胞 [1] 。造血干细胞(Hematopoietic stem cell, HSC)具有自我更新和分化为血液及免疫系统中各种成熟细胞的能力因而成为基因治疗理想的细胞疫苗;红细胞生成素(erythropoietin, EPO)是造血分化中的主要刺激因子,能促进造血干细胞向原始红细胞分化,加速幼红细胞的分裂、增殖,促进血红蛋白的合成,在红细胞疫苗诱导分化研究中发挥重要的作用 [2] 。本研究建立了转CEA及EPO双基因的造血干细胞,既可以诱导造血干细胞定向分化成红细胞疫苗,又可以合成肿瘤抗原的红细胞疫苗,有望合成一种多功能的红细胞疫苗,在抗结肠癌治疗中发挥重要的作用。
2. 材料和方法
实验动物及主要试剂、C57和ICR小鼠和BALB/C小鼠,(20 ± 1) g,雌雄随机,购自武汉大学实验动物中心,结肠癌细胞株CT26为本科保存,BSA购自武汉四季青生物工程材料研究所,荧光标记小鼠抗体CD117-PE磁珠和CEA-PE抗体的免疫磁珠试剂盒、抗生物素,磁珠、MiniMACS分离器及MS分离柱,均购自武汉中山试剂公司,T4 DNA连接酶、各种限制性内切酶、双荧光检测系统均购自美国Promega公司,HeLa细胞和测序鉴定正确的小鼠RAN基因为本实验室保存,总RNA提取试剂盒购自德国Qiagen公司;逆转录聚合酶链反应(RT-PCR)试剂盒购自Sigma公司;PCR回收试剂盒(Sigma公司)、pGEM-Teasy载体连接试剂盒、pGL3-Basic载体、pGI3-promoter载体均为Promega公司产品。流式细胞仪(FACSCalibur)购自BD公司。基因共表达载体pIRES1neo、重组质粒pcDNA-CEA、重组质粒pMD18T-EPO、绿色荧光蛋白、BCA蛋白定量试剂盒、DMEM培养基、FBS、胰蛋白酶、I型胶原酶(GIBCO 公司,美国);感受态细胞DH5α和免疫磁珠分选系统(MACS)购自武汉博士德公司PCR仪、全自动生化分析仪、倒置相差显微镜、荧光显微镜(Olympus公司,日本)。
2.1. 小鼠骨髓胚胎干细胞收集
颈椎脱臼处死小鼠,取小鼠股骨、胫骨,放在盛有缓冲液中,去除骨上的肌肉组织及骨膜,用注射器插入股骨膝盖端、胫骨骨端,用缓冲液反复冲洗骨腔,进行细胞计数,加入生物素化抗体混合物10 μl/107个细胞,混匀。
2.2. 造血干细胞的磁珠纯化和收集
含抗体CD117磁珠分离造血干细胞:用缓冲液按40 μl/107个细胞重悬小鼠骨髓细胞。加入生物素化抗体混合物10 μl/107个细胞,混匀,4℃~8℃孵育10 min。加入缓冲液30 μl/107个细胞,20 μl抗生物素微珠,混匀,4℃~8℃孵育15 min。加入5 ml缓冲液洗涤细胞,1500 r/min离心10 min,完全去除上清液。加入CD117微珠20 μl/107个细胞,混匀;所得细胞悬液加入MS分选柱中,收集先行流出的未标记细胞组分,并用1500 μl缓冲液冲洗MS柱,此为CD117阴性细胞。将分选柱移出磁场,1 ml缓冲液快速将分选柱上滞留的细胞洗脱下来,这些细胞是磁性标记的CD117阳性细胞,将分选前的标本、对照管、分选后阴性管标本及分选后阳性管标本进行流式细胞仪分析。
2.3. CEA启动子引物设计PCR的扩增
根据GenBank中CEA序列以及pEGFP质粒中CMV启动子序列设计引物,并分别在各上下游引物5'端引入Bgl II和Hind III酶切位点。CEA启动子的引物序列:上游:上游5’-GAATTCCCCGGGACCCTGCTGGG-3’,下游5’-GCTTGAGTTCCAGGAACGTTTTGGGATCC-3’,产物386 bp,CMV启动子的引物序列:上游:
2.4. 增强型绿色荧光蛋白(EGFP)标记的CEA-EPO重组腺病毒载体的构建、纯化和滴度测定
用KpnI和Xho I双酶切取DNA片段,插入穿梭质粒中的相同位点,将EPO-cDNA插入pcDNA3.1质粒的多克隆位点,用CEA基因启动子替代pcDNA3.1质粒的CMV启动子,构建成CEA-EPO重组质粒。产生重组腺病毒pAd-GFP/CEA-EPO,克隆筛选出阳性重组穿梭质粒pAdTrack/CEA-EPO,取1.0 μg质粒经内切酶Pme I线性化后与0.1 μg腺病毒骨架质粒pAdEasy-1混合,导入E.coliBJ5183菌,发生同源重组后的重组腺病毒质粒pAd-EGFP-CEA-EPO获得卡那霉素(50 μg/ml)抗性,小量提取质粒以1%琼脂糖凝胶电泳初步鉴定,最终经PacI酶切分析和PCR扩增CEA-EPO片段鉴定重组腺病毒质粒,用CEA-EPO基因启动子中的Sma I单一酶切位点进行初步酶切鉴定。用T4DNA连接酶将PCR纯化产物与pGEM-Teasy载体相连,将连接好的载体转化Jm109感受态大肠杆菌,蓝白筛选,取阳性克隆接种于含5 ml Amp的LB培养液中,37℃振摇过夜。取800 μl液送武汉中山生物技术有限公司测序,荧光显微镜下观察或根据细胞病变效应判断病毒的产生。大量扩增病毒,并经CsCl超速离心纯化。纯化病毒颗粒用PBS稀释后−80℃冻存备用,病毒滴度根据空斑形成试验测定。由此包装、生产出携带CEA-EPO及和GFP基因的重组腺病毒,对表达GFP的细胞计数,观察感染效率。
2.5. 造血干细胞体外转染CEA及EPOmRNA基因
实验分组及方法:根据处理方法不同,将造血干细胞分为4组:A组为空载GFP质粒转染组,B组为单纯CEA转染组,C组为单纯EPO转染组,D组为CEA-EPO共转染组。取第3代血干细胞,以5 × 104个/cm2密度接种于10孔板,待细胞达90%贴壁时,根据分组进行相应处理。其中A组加入DMEM培养基,B组采用不添加目的基因的空质粒转染,C、D组分别加入最佳MOI的CEA重组腺病毒和EPO重组腺病毒,D组同时加入最佳MOI的CEA-EPO重组腺病毒。于37℃、5%CO2培养箱中培养24 h后更换新鲜培养液。
2.6. 检测CEA及EPO基因和蛋白表达
转染细胞的CEA及EPO mRNA基因表达的半定量RT-PCR方法:检测分别取各组的造血干细胞,分选后表达强绿色荧光细胞,提取细胞总RNA后,用RT-PCR方法检测CEA及EPOmRNA基因在mRNA水平的表达。用Wesernblot法检测CEA及EPO蛋白表达,以β-actin作为内参照。
2.7. 病毒转染效率检测
培养7 d后倒置相差显微镜下观察细胞生长情况,培养10填后各组细胞用0.25%胰蛋白酶消化,吹打形成单个细胞,PBS清洗5 min后弃上清,再用PBS重新清洗2次,荧光显微镜下观察。成功转染细胞呈绿色表达。培养48 h时取各组细胞于100倍镜下随机取10个视野,计数荧光表达细胞数,并计算转染效率 = 荧光表达细胞数 ÷ 同视野下细胞总数 × 100%。
2.8. CEA及EPO双基因共转染红细胞疫苗的获得
在4组的小鼠尾静脉分别注射相关的疫苗,其中D组注射携带CEA及EPO干细胞,饲养1~3周后,处死小鼠,从小鼠外周血和脾脏收集外周血,再用表达CEA及EPO抗体的免疫磁珠分离转CEA及EPO基因的红细胞疫苗,即可大量获得双基因共转染CEA-EPO红细胞疫苗,同时设对照组。
2.9. 应用细胞红系相关标志抗体GPA 和 CD71标记,流式细胞证实红细胞疫苗培养成功
收集诱导的细胞,胰酶消化制成细胞悬液,取3 × 106个细胞,PBS洗涤一遍,分别置于1.5 ml的EP管中,分别加入小鼠抗人GPA-PE、CD71-FITC抗体,阴性对照加小鼠IgG-PE和小鼠IgG-FITC,流式细胞仪分析所有细胞中各表面标志物阳性细胞的比率.
2.10. 转染红细胞疫苗的体外实验
双基因共转染CEA-EPO红细胞疫苗体外刺激小鼠单核细胞增殖的作用及增殖细胞对结肠癌细胞的杀伤作用,具体如下:皮下接种小鼠结肠癌细胞系CT26肿瘤后两周,自小鼠尾静脉采血,密度梯度法分离单个核细胞,单核细胞与肿瘤细胞按1:10,1:20,20:1,40:1的比例于20孔板上混合培养,每孔4 × 104个单核细胞)设植物血凝素(PHA)作为对照,48小时后MTT法检测单核细胞杀伤率。靶细胞杀伤率 = (靶细胞OD + 单核细胞OD − 杀伤实验OD − 本底OD)/(靶细胞OD − 本底OD) × 100%
2.11. CEA-EPO基因转染红细胞疫苗的体内实验
研究双基因共转染红细胞疫苗对肿瘤成瘤性的影响,成瘤实验:收集处于对数生长期的结肠癌细胞株CT26,按以上所分成的4组,以每只小鼠5 × 105个细胞数接种于BALB/c小鼠右侧腋窝皮下,制作荷瘤动物模型,再分别从尾静脉注射疫苗或空白载体。观察肿瘤的生长情况及小鼠的生存时间。每周两次用游标卡尺测量肿瘤大小,肿瘤体积以公式1/2ab2计算,a为肿瘤长径,b为肿瘤短径,长度单位为cm。
2.12. 统计学方法
使用 SPSS for windows统计软件分析。对计量资料采用t检验或方差分析,对计数资料采用χ2检验。
3. 结果
3.1. 造血干细胞的磁珠纯化和收集
流式细胞仪分析结果:免疫磁珠纯化前CD117阳性CD117阳性细胞纯度由36.88% ± 4.51%提高到纯度为(90.28 ± 3.77)%,纯化前后有明显差异(P < 0.05)。
3.2. 检测CEA-EPO mRNA和蛋白表达
RT-PCR结果显示,在598 bp和630 bp处扩增获得特异性目的片段,表明转染的CEA-EPO基因成功。用Westernblot方法检测未转染、转染空载体和转染CEA-EPO慢病毒表达载体的造血干细胞中CEA-EPO表达水平。结果显示,转染CEA-EPO的造血干细胞中可检测到CEA-EPO的表达,未转染和转染空载体的无CEA-EPO的表达(图1)。
· 病毒转染效率
倒置相差显微镜观察显示:空载GFP质粒转染组无荧光表达,CEA-EPO转染组可见大量绿色荧光(如图2所示),提示重组腺病毒成功转染细胞。
 (a) (b)
(a) (b)
Figure 1. (a) The expression of EPO and CEA genes by RT-PCR; (b) the expression of EPO and CEA proteins by Westernblot
图1. (a) 检测EPO和CEA基因的表达;(b) Westernblot方法检测 CEA和 EPO蛋白表达
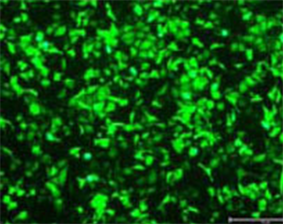
Figure 2. The EPO and CEA genes showed green fluorescence (×200)
图2. CEA-EPO 转染组可见大量绿色荧光
3.3. CEA-EPO基因转染红细胞疫苗的获得
收集各组从Balb/c小鼠外周血和脾脏得到的红细胞疫苗,用用表达CEA及EPO抗体的免疫磁珠分离,应用细胞红系相关标志抗体GPA和CD71标记,通过流式细胞仪进行分析GPA和CD71的结果如下(见表1):表明C组单纯EPO转染组和D组CEA-EPO转染组可以有效地向红细胞定向转化。
3.4. 双基因共转染红细胞疫苗的体外实验
CEA-EPO基因共转染红细胞疫苗激活的单核细胞对CT26细胞的杀伤作用,见表2,疫苗刺激增殖的单核细胞对CT26细胞的杀伤作用明显高于其他对照组,为57.34 ± 1.13%,(p < 0.05),而其他组(1:10, 1:20, 20:1)共转染组的杀伤作用没有统计学意义,在比例为40:1时,表明淋巴细胞:肿瘤细胞在40:1比例时,疫苗刺激增殖后的单核细胞对结肠癌细胞的杀伤具有明显特异性。
3.5. CEA-EPO转染红细胞疫苗的体内实验
结果表明:双基因共转染红细胞疫苗对肿瘤成瘤性有明显的影响,经过计算,肿瘤的生长的大小分别为:空载组1.33 ± 0.11、CEA-疫苗组1.27 ± 0.27,EPO疫苗组1.65 ± 0.22,CEA-EPO疫苗组0.29 ± 0.11 (cm3);各组小鼠的成活期分别为:空载组35.1±9.16天、CEA组36.23±2.88天、EPO疫苗组35.91±2.11天、CEA-EPO疫苗组69 ± 6.91天。肿瘤的生长情况及小鼠的生存时间见图3和图4。CEA-EPO疫苗组
Table 1. The positive of GPA and CD71 of erythrocyte vaccine(%)
表1. 红细胞疫苗GPA和CD71阳性率(%)
*分别与其他组相比,p < 0.05;**分别与其他组相比,p < 0.05
Table 2. Mononuclear cells in peripheral blood to activate cytotoxic lymphocytes (CTL) to CT26 (χ ± s)
表2. 疫苗激活的单核细胞对CT26细胞的杀伤作用(%) (χ ± s)
*分别与其他组相比,p < 0.05;△▲●分别与其他组相比,p > 0.05
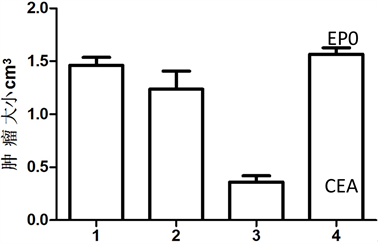 1.空载组;2.CEA疫苗组;3.CEA-EPO疫苗组;4.EPO疫苗组
1.空载组;2.CEA疫苗组;3.CEA-EPO疫苗组;4.EPO疫苗组
Figure 3. Immunization with erythrocyte vaccine markedly inhibited the size of tumor growth
图3. 双基因共转染红细胞疫苗对肿瘤成瘤大小的影响
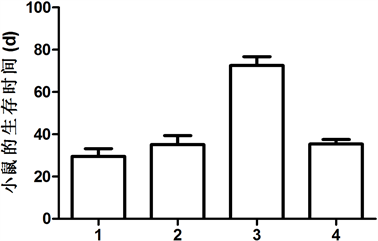 1.空载组;2.CEA疫苗组;3.CEA-EPO疫苗组;4.EPO疫苗组
1.空载组;2.CEA疫苗组;3.CEA-EPO疫苗组;4.EPO疫苗组
Figure 4. Immunization with erythrocyte vaccine markedly inhibited the murine live time
图4. 双基因共转染红细胞疫苗对小鼠的生存时间的影响
在肿瘤大小和小鼠的生存时间方面,与空载组、CEA疫苗组,EPO疫苗组之间差异有统计学意义(P < 0.05)。
4. 讨论
采用非基因修饰方法携带肿瘤抗原的红细胞作为免疫疫苗治疗肿瘤的研究在国外已有报道,携带抗原的红细胞可以诱导机体产生免疫反应的现象早已在医学界引起关注 [3] [4] [5] ,红细胞源于骨髓多能造血干细胞,是血液中数量最多的一种血细胞,在全血中容积百分比约为50%,通过血红蛋白起着运输氧和二氧化碳的重要生理功能,红细胞输注是目前治疗贫血的常用手段。已进入临床试验阶段的肿瘤疫苗主要有树突状细胞疫苗、DNA肿瘤抗原疫苗、肿瘤抗原蛋白或肽为基础的疫苗、自体或异体的肿瘤细胞疫苗和病毒携带肿瘤抗原疫苗,目前还没有哪一种疫苗治疗结肠癌有明显的疗效 [6] [7] [8] ,结肠癌的免疫治疗依然有待我们去研究,红细胞疫苗治疗肿瘤有重要的前景。
研究表明,与供体红细胞结合的抗原可以通过交叉激活进入受体抗原递呈细胞的主要组织相容性抗原(MHC-I)通路,从而导致受体CD8+T细胞对供体抗原特异性的激活和增殖。此外,抗原与细胞结合可以使其通过MHC-I交叉激活CD8+T细胞的效率增加,这些数据充分地证明采用携带抗原的红细胞作为肿瘤疫苗的可行性 [9] [10] [11] 。
促红细胞生成素(EPO)是一种小分子糖蛋白感应激素,参与调节许多细胞的生长发育过程,能促进血管再生和神经发育等。促红细胞生成素是促进红系祖细胞的增殖、分化和红细胞成熟的主要刺激因子,EPO能促进造血干细胞向原始红细胞分化,加速幼红细胞的分裂、增殖,促进血红蛋白的合成,红细胞疫苗能抑制淋巴细胞增生,促进静止和效应性T细胞、NK细胞和成熟树突状细胞抗肿瘤癌免疫作用。我们在本项的研究中发现:携带肿瘤抗原的红细胞可以通过EPO基因修饰胚胎干细胞、诱导多能干细胞或造血干细胞及其在体外红细胞分化大量产生 [12] [13] [14] 。
癌胚抗原是一种分子量为150~300 kD的糖蛋白,45%为蛋白质,其它为岩藻糖,甘露糖,半乳糖以及唾液酸。CEA属于免疫球蛋白IG超基因家族的成员,人类CEA家族含29个基因,其中18个基因表达。CEA的编码基因位于19号染色体。癌胚抗原是最早被发现和鉴定的肿瘤相关抗原之一,1965年Gold和Freedman首先自人结肠癌组织发现,是胚胎性致癌抗原,主要存在于胎儿消化道上皮组织、胰脏和肝脏,正常成人血清中CEA含量极低。对于结直肠癌的诊断,临床可以应用的有价值的肿瘤标志物很少,但血清CEA在结直肠癌预后、复发的评估中发挥重要作用 [15] [16] [17] ;CEA在正常人体内扮演着非特异性防御作用的角色,而在肿瘤患者中主要起调节肿瘤细胞对细胞毒性淋巴细胞敏感性的作用,使肿瘤细胞逃避免疫攻击。癌胚抗原对大肠癌的疗效判断、病情发展、监测和预后估计是一个较好的肿瘤标志物。由于CEA的免疫原性很弱,一般不能引起机体产生有效的免疫反应,因此机体的免疫系统无法识别肿瘤细胞表面的癌胚抗原,使肿瘤细胞逃避了免疫系统的杀伤,因此增强CEA的免疫原性,诱导机体产生特异性的免疫反应成为肿瘤治疗的一个新的靶点 [18] [19] 。
由于其表达量远高于端粒酶且在相应的正常组织细胞中没有表达,说明该基因启动子的应用有可能提高肿瘤细胞内目的基因表达水平,从而起到特异和高效治疗作用。本试验成功扩增了1 kb大小CEA启动子片断,构建了CEA启动子真核表达载体,所构建的CEA启动子有较强的启动活性,将EPO-cDNA插入pcDNA3.1质粒的多克隆位点,用CEA基因启动子替代pcDNA3.1质粒的CMV启动子,构建成CEA-EPO重组质粒。并且,将CEA启动子连接到EPOcDNA上游,构建表达载体。我们将CEA-EPO基因导入造血干细胞后,利用RT-PCR在mRNA水平检测到CEA-EPO的表达,说明CEA-EPO的转染成功。
我们的研究发现:携带CEA-EPO双基因肿瘤抗原的红细胞疫苗对结肠癌有明显的抗肿瘤作用,既可以诱导造血干细胞定向分化成红细胞疫苗,又可以合成肿瘤抗原的红细胞疫苗,是临床治疗肿瘤的理想疫苗。
骨髓细胞中造血干细胞含量少是分离纯化的困难之一,造血干细胞约占骨髓有核细胞的0.5%,而在外周血中的含量更低,我们的研究结果表明:免疫磁珠分离法、造血干细胞表面特异的抗原标记法、单克隆抗体特异性结合法,再借助抗体上的磁珠在磁场中进行分离,技术简单、易行、对细胞活力影响小,获得造血干细胞的纯度高 [20] [21] ,我们利用携带CEA-EPO基因构建肿瘤抗原的红细胞疫苗的方法可以在结肠癌的基因治疗。
本项目的结果表明:我们收集造血干细胞,并且定向转化成转染CEA-EPOmRNA基因的红细胞疫苗,流式细胞仪分析结果表明:纯化前后有明显差异(P < 0.05);检测CEA及EPOmRNA和蛋白表达的结果表明:造血干细胞体外转染CEA-EPOmRNA基因成功,获得CEA-EPO基因共转染红细胞疫苗;应用细胞红系相关标志抗体GPA和CD71标记,红系相关标志GPA和CD71的表达比率明显高于对照组。流式细胞证实红细胞疫苗培养成功;研究相关疫苗激活的单核细胞对结肠癌细胞系CT26细胞杀伤作用表明:在比例为40:1时,CEA-EPO疫苗组杀伤作用为57.34 ± 1.13%,高于空载组、CEA疫苗组和EPO疫苗组(P < 0.05),体内试验的成瘤性研究表明:CEA-EPO疫苗组肿瘤的生长的大小为0.29 ± 0.11 (cm3);高于其他各组的大小(P < 0.05),CEA-EPO疫苗组的成活期分别为:69 ± 6.91天,高于其他各组的大小(P<0.05);CEA-EPO疫苗组在肿瘤大小和小鼠的生存时间上,与空载组、CEA疫苗组,EPO疫苗组之间差异有统计学意义(P < 0.05)。
本实验采用免疫磁珠阳性选择法分选HSC,从小鼠股骨、胫骨可收集HSC,先进行系别细胞去除的阴性分选,磁性标记后去除系别细胞,根据CD117的表达对这些细胞做进一步的磁珠阳性分选,从复杂的细胞混合物中分离出很高纯度的细胞。
在本项研究携带CEA-EPO的红细胞的抗肿瘤作用在小鼠结肠癌模型进行了研究,这一治疗效果对发展更加有效的新型肿瘤疫苗具有重要的意义,我们认为:采取基因修饰的方法获得的携带抗原的红细胞有以下优点:携带抗原的红细胞可通过基因修饰胚胎干细胞、诱导多能干细胞或造血干细胞在体外大量产生;与使用其他方法获得的携带抗原的红细胞相比,基因修饰表达肿瘤抗原的红细胞可以同时表达促进交叉激活的共刺激免疫分子,进一步增强免疫反应,使肿瘤疫苗达到更好的疗效,本研究建立了转CEA及EPO双基因的造血干细胞的红细胞疫苗,有望在抗结肠癌治疗中发挥重要的作用。
文章引用
孙华文,杨厚来,王秋爽. CEA-EPO质粒的构建及诱导造血干细胞定向生成红细胞疫苗抗结肠癌的研究
Effects of Recombinant Adenovirus-Mediated Co-Transfection of CEA Gene and EPO Geneon Promoting Hematopoietic Stem Cell Directly Producing Erythrocyte Vaccine against Colon Cancer[J]. 外科, 2018, 07(01): 9-18. http://dx.doi.org/10.12677/HJS.2018.71002
参考文献 (References)
- 1. Kim, S.J., Jung, J.W., Ha, H.Y., Koo, S.K., Kim, E.G. and Kim, J.H. (2017) Generation of Hematopoietic Stem Cells from Human Embryonic Stem Cells Using a Defined, Stepwise, Serum-Free, and Serum Replacement-Free Monolayer Culture Method. Blood Research, 52, 37-43.
https://doi.org/10.5045/br.2017.52.1.37 - 2. Gutti, U., Pasupuleti, S.R., Sahu, I., Kotipalli, A., Undi, R.B., Kandi, R., Venakata Saladi, R.G. and Gutti, R.K. (2016) Erythropoietin and Thrombopoietin Mimetics: Natural Alternatives to Erythrocyte and Platelet Disorders. Critical Reviews in Oncolo-gy/Hematology, 108, 175-186.
https://doi.org/10.1016/j.critrevonc.2016.11.002 - 3. Tari, K., Atashi, A., Kaviani, S., Akhavan Rahnama, M., Anbarlou, A. and Mossahebi-Mohammadi, M. (2017) Erythropoietin Induces Production of Hepatocyte Growth Factor from Bone Marrow Mesenchymal Stem Cells in Vitro. Biologicals, 45, 15-19.
https://doi.org/10.1016/j.biologicals.2016.10.010 - 4. Shi, J., Yuan, B., Hu, W. and Lodish, H. (2016) JAK2 V617F Stimulates Proliferation of Erythropoietin-Dependent Erythroid Progenitors and Delays Their Differentiation by Activating Stat1 and Other Nonerythroid Signaling Pathways. Experimental Hematology, 44, 1044-1058.e5.
- 5. Aljitawi, O.S., Paul, S., Ganguly, A., Lin, T.L., Ganguly, S., Vielhauer, G., Capitano, M.L., Can-tilena, A., Lipe, B., Mahnken, J.D., Wise, A., Berry, A., Singh, A.K., Shune, L., Lominska, C., Abhyankar, S., Allin, D., Laughlin, M., McGuirk, J.P. and Broxmeyer, H.E. (2016) Erythropoietin Modulation Is Associated with Improved Homing and Engraftment after Umbilical Cord Blood Transplantation. Blood, 128, 3000-3010.
https://doi.org/10.1182/blood-2016-05-715292 - 6. Rauner, M., Franke, K., Murray, M., Singh, R.P., Hiram-Bab, S., Platzbecker, U., Gassmann, M., Socolovsky, M., Neumann, D., Gabet, Y., Chavakis, T., Hofbauer, L.C. and Wielockx, B. (2016) Increased EPO Levels Are Associated With Bone Loss in Mice Lacking PHD2 in EPO-Producing Cells. Journal of Bone and Mineral Research, 31, 1877-1887.
https://doi.org/10.1002/jbmr.2857 - 7. Sugiyama, D., Tanaka, Y., Yumine, A. and Kojima, N. (2016) Embryonic Regulation of the Mouse Erythropoietic Niche and Its Clinical Application. Rinsho Ketsueki, 57, 944-50.
- 8. Thériault, P., Le Béhot, A., El Ali, A. and Rivest, S. (2016) Sub-Acute Systemic Erythropoietin Administration Reduces Ischemic Brain Injury in an Age-Dependent Manner. Oncotarget, 7, 35552-35561.
https://doi.org/10.18632/oncotarget.9652 - 9. Lin, K.H., Ho, Y.H., Chiang, J.C., Li, M.W., Lin, S.H., Chen, W.M., Chiang, C.L., Lin, Y.N., Yang, Y.J., Chen, C.N., Lu, J., Huang, C.J., Tigyi, G., Yao, C.L. and Lee, H. (2016) Pharmacological Activation of Lysophosphatidic Acid Receptors Regulates Erythropoiesis. Scientific Reports, 6, 27-50.
https://doi.org/10.1038/srep27050 - 10. Shin, Y.K. and Cho, S.R. (2016) Exploring Erythropoietin and G-CSF Combination Therapy in Chronic Stroke Patients. International Journal of Molecular Sciences, 17, 463-469.
https://doi.org/10.3390/ijms17040463 - 11. Tayebi, B., Abrishami, F., Alizadeh, S., Minayi, N., Mohammadian, M., Soleimani, M., Dehghanifard, A., Atwan, H., Ajami, M. and Ajami, M. (2017) Modulation of microRNAs Expres-sion in Hematopoietic Stem Cells Treated with Sodium Butyrate in Inducing Fetal Hemoglobin Expression. Artificial Cells, Nanomedicine, and Biotechnology, 45, 146-156.
https://doi.org/10.3109/21691401.2016.1138487 - 12. Wege, A.K., Schmidt, M., Ueberham, E., Ponnath, M., Ortmann, O., Brockhoff, G. and Lehmann, J. (2014) Co-Transplantation of Human Hematopoietic Stem Cells and Human Breast Cancer Cells in NSG Mice: A Novel Approach to Generate Tumor Cell Specific Human Antibodies. MAbs, 6, 968-977.
https://doi.org/10.4161/mabs.29111 - 13. Mund, J.A., Shannon, H., Sinn, A.L., Cai, S., Wang, H., Pradhan, K.R., Pollok, K.E. and Case, J. (2013) Human Proangiogenic Circulating Hematopoietic Stem and Proge-nitor Cells Promote Tumor Growth in an Orthotopic Melanoma Xenograft Model. Angiogenesis, 16, 953-962.
https://doi.org/10.1007/s10456-013-9368-3 - 14. Lin, S. and Fu, S. (2013) The Correlation of Hematopoietic Stem Cells with Cancer Stem Cells through the Regulation of Stromal Cells in Tumor Microenvironment. Medical Hypotheses, 80, 494-497.
https://doi.org/10.1016/j.mehy.2012.12.016 - 15. Balint, J.P., Gabitzsch, E.S., Rice, A., Latchman, Y., Xu, Y., Messerschmidt, G.L., Chaudhry, A., Morse, M.A. and Jones, F.R. (2015) Extended Evaluation of a Phase 1/2 Trial on Dosing, Safety, Immunogenicity, and Overall Survival after Immunizations with an Advanced-Generation CEA Vaccine in Late-Stage Colorectal Cancer. Cancer Immunol Immunother, 64, 977-987.
https://doi.org/10.1007/s00262-015-1706-4 - 16. Bilusic, M., Heery, C.R., Arlen, P.M., Rauckhorst, M., Apelian, D., Tsang, K.Y., Tucker, J.A., Jochems, C., Schlom, J., Gulley, J.L. and Madan, R.A. (2014) Phase I Trial of a Recom-binant Yeast-CEA Vaccine (GI-6207) in Adults with Metastatic CEA-Expressing Carcinoma. Cancer Immunology, Immunotherapy, 63, 225-234.
https://doi.org/10.1007/s00262-013-1505-8 - 17. Diaz, C.M., Chiappori, A., Aurisicchio, L., Bagchi, A., Clark, J., Dubey, S., Fridman, A., Fabregas, J.C., Marshall, J., Scarselli, E., La Monica, N., Ciliberto, G. and Montero, A.J. (2013) Phase 1 Studies of the Safety and Immunogenicity of Electroporated HER2/CEA DNA Vaccine Followed by Adenoviral Boost Immunization in Patients with Solid Tumors. Journal of Translational Medicine, 11, 62.
https://doi.org/10.1186/1479-5876-11-62 - 18. Geynisman, D.M., Zha, Y., Kunnavakkam, R., Aklilu, M., Cate-nacci, D.V., Polite, B.N., Rosenbaum, C., Namakydoust, A., Karrison, T., Gajewski, T.F. and Kindler, H.L. (2013) A Randomized Pilot Phase I Study of Modified Carcinoembryonic Antigen (CEA) Peptide (CAP1-6D)/Montanide/GM-CSF-Vaccine in Patients with Pancreatic Adenocarcinoma. Journal for Immunotherapy of Cancer, 1, 8.
https://doi.org/10.1186/2051-1426-1-8 - 19. Park, J.S., Kim, H.S., Park, H.M., Kim, C.H. and Kim, T.G. (2011) Efficient Induction of Anti-Tumor Immunity by a TAT-CEA Fusion Protein Vaccine with poly(I:C) in a Murine Colorectal Tumor Model. Vaccine, 29, 8642-8648.
https://doi.org/10.1016/j.vaccine.2011.09.052 - 20. Japink, D., Leers, M.P., Sosef, M.N. and Nap, M. (2009) CEA in Activated Macrophages. New Diagnostic Possibilities for Tumor Markers in Early Colorectal Cancer. Anticancer Research, 29, 3245-3251.
- 21. Tuske, O., Adroit, G., Delferrière, O., De Menezes, D., Gauthier, Y., Gobin, R. and Harrault, F. (2008) BETSI, a New Test Bench for Ion Sources Optimization at Cea Saclay. Review of Scientific In-struments, 79, 02B710.
