International Journal of Ecology
Vol.1 No.2(2012), Article ID:7177,4 pages DOI:10.4236/ije.2012.12004
Effect of Drug Residues of Ibuprofen and Acetaminophen on Aquatic Neocaridina denticulate
1Department of Environmental Resources Management, Chia Nan University of Pharmacy & Science, Tainan
2Department of Environmental Engineering & Science, Chia Nan University of Pharmacy & Science, Tainan
3Department of Biomedical Science and Environmental Biology, Kaohsiung Medical University, Kaohsiung
4Department of Microbiology, Soochow University, Taipei
Email: *daji@ms19.hinet.net
Received: Oct. 19th, 2012; revised: Oct. 22nd, 2012; accepted: Nov. 12th, 2012
ABSTRACT:
The non-steroidal anti-inflammatory drug—ibuprofen (IBU) and acetaminophen (ACE) are common drug residues in water environment because they cannot be degraded completely in treatment industry. They could be potentially affect non-target aquatic organisms when they are input into an aquatic system. To investigate the impact of IBU and ACE on aquatic system, in this study, on day 1, 4 and 7 after Neocaridina denticulate exposed to either IBU (0, 0.1, 1, and 5.0 mg·L–1) or ACE (0, 0.1, 1 and 5.0 mg·L–1), four biochemical parameters were determined in the hepatopancreas, including the activities of monooxygenase (Mon) and glutathione-S-transferase (GST), the concentrations of hematopancrease-associated glutamic oxaloacetic transaminase (GOT) and glutamic pyruvic transaminase (GPT). After treatment in1, 4 and 7 days, all treatment groups of the Mon activity were higher than control group (37.8 ± 9.1 ΔA650mm /30 min/mg). The GST activity were significantly increased then control group in IBU and ACE group treated with 5 mg/L after expose 7 days. The concentrations of GOT and GPT was increased the control group in exposure 7 day. These results suggest that the detoxification may be initiated when the both drug residues in aquatic environment, and the IBU has deleterious effects on the aquatic organisms. Therefore, the risk of drug residues at water ecology will be an important environmental issue.
Keywords: Neocaridina denticulate; Drug Residues; Glutathione-S-Transferases; Monooxygenase; GOT (Glutamic Oxaloacetic Transaminase); GPT (Glutamic Pyruvic Transaminase)
人类常用止痛剂布洛芬(Ibuprofen)及乙酰胺酚 (Acetaminophen)对多齿新米虾 (Neocaridina denticulate)的影响
赖慧绮1,蔡宜君2,叶芳伶3,宋宏红4,陈健民1,黄大骏1*
1嘉南药理科技大学环境资源管理系,台南
2嘉南药理科技大学环境工程与科学系,台南
3高雄医学大学生物医学暨环境生物学系研究所,高雄
4东吴大学微生物学系,台北
Email: *daji@ms19.hinet.net
摘 要:
近年来许多研究指出,人类长期使用的药物如抗生素或止痛剂等医疗药品,无法经由污水处理厂而完全分解消失,当这些药物进入环境中时将可能具有生物毒性,并对生态环境系统造成冲击。为了解人类常用止痛剂—布洛芬(ibuprofen, IBU)及乙酰胺酚(acetaminophen, ACE)残留于水体后对水生生物可能的影响。本研究应用多齿新米虾(Neocaridina denticulate,后简称米虾)进行0.1、1和5 mg/L的IBU及ACE不同浓度的曝露。并于曝露后1、4及7天,并测定米虾体内解毒酵素的活性(monooxygenase, Mon)及glutathione-S-transferase, GST)与肝胰脏受损指标(glutamic oxaloacetic transaminase, GOT)及(glutamic pyruvic transaminase, GPT)。试验结果显示,米虾曝露IBU及ACE后1,4及7天,各处理组间Mon活性并无明显高于对照组(37.8 ± 9.1 ΔA650mm/30 min/mg),GST活性在曝露5 mg/L的IBU及ACE处理组中有明显上升的趋势;5 mg/L IBU处理组在7天时GOT及GPT有上升的情况,代表IBU可能米虾的肝胰脏造成影响。综合实验结果,止痛剂IBU及ACE等药物于水体中残留时,不但会诱发米虾的解毒机制,甚至可能造成肝胰脏的发炎的现象。初步结果显示,止痛剂IBU及ACE等药物残留于水体中确实会对水生生物生理上的影响,此等问题势必会成为环境生态重要议题之一。
收稿日期:2012年10月19日;修回日期:2012年10月22日;录用日期:2012年11月12日
关键词:多齿新米虾(Neocaridina denticulate);药物残留;麸胱苷肽硫基转移酶(Glutathione-S-Transferases);单氧酶(Monooxygenase);GOT (Glutamic Oxaloacetic Transaminase);GPT (Glutamic Pyruvic Transaminase)
1. 前言
人为活动造成的污染物,如:重金属、农药等排入水体后对水生生物造成影响,已经成为近年来研究人为活动对水域生态系统的重要研究项目之一。除了重金属、农药等常见的污染物外,近年来许多的研究陆续发现人类长期使用药物在水体残留浓度日益增加。林等[1]的研究发现,在制药厂与医疗院所之放流水、乃至于污水处理厂及畜牧业废水,均能检测出抗生素、解热镇痛剂(non-steroidal anti-inflammatories, NSAIDs)、雌性激素(estrogens)、降血脂剂(lipid regulators)、抗高血压用药、降血糖剂等,常用于医疗用途的药品[2]。美国环保署的研究指出,这类原本不应被检测出的药物,如今已可在部分水体中被检测出来,乃因目前并无针对药物移除的污水处理系统可供使用,因此这些带有药物的废水在未经处理的情况下,被排入自然水体将对水域生态造成影响,但这类药物对于水域生物所产生的影相之研究,依然阙如。
目前最多人使用的止痛剂主要为吗啡或阿司匹林为主,但其效能却有限,例如阿司匹林及其他非类固醇消炎药如布洛芬,对于大部份的严重疼痛则无明显效用。另外,在2005年台湾健保给付药品用量最多的前20种药物中,止痛剂如含乙酰胺酚类的阿司匹林药物均已囊括前几名[3]。除此之外,水中常见测得止痛剂则以阿司匹林及布洛芬最多,最高浓度分别为27.3~27,000 ng/L及711~17,933 ng/L。目前研究指出,当水生生物曝露于止痛剂布洛芬时,会抑制软件动物Planorbis carinatus生长[4]、降低甲壳类Daphnia magna 生殖能力[5]或导致Gammarus pulex行为异常 [6]等,当水中止痛剂布洛芬浓度大于100 mg/L甚至会造成鱼类Oryzias latipes死亡[4]。
环境遭受到破坏或污染时,将造成水生生物包括初级生产者、初级消费者、次级消费者及分解者生理、生殖等影响。多齿新米虾(Neocaridina denticulate)等,淡水虾等小型节枝动物在水域中的数量足以影响水质及鱼群族群的数量对生态环境有重大意义,再加上易于实验室畜养及控制、对毒性物质反应敏感性迅速等特性,常作为毒性试验所使用的模式动物[7]。毒性物质在生物体的代谢的状况可以用phase I及phase II的酵素活性反应来表示。phase I主要作用的酵素为单氧酶(monooxygenase, Mon)系统,主要位于软件动物的肝胰脏细胞中,当有毒物质经由单氧酶系统一连串的氧化、还原与水解的反应后,改变其有毒物质的官能基,产生较水溶性化合物以利排出体外,因此在接触到有毒物质时phase I单氧酶(Mon)酵素系统活性就会有升高的趋势;phase II方面,又称为结合反应,麸胱苷肽硫基转移酶(glutathione-S-transferases, GST)为参与进行解毒反应phase II中不可或缺的重要反应酵素,可使有毒物质转变为较不具活性并且使之增加亲水性,排泄至胆汁或由尿液排出体外,因此在生物体排除有毒物质时,就可看到phase II酵素系统活性上升的情况[8]。GOT(glutamic oxaloacetic transaminase)与GPT (glutamic pyruvic transaminase)为检测肝脏机能是否异常或肝损伤的评估分析,当生物体内的肝胰脏细胞遭到损毁或破坏时,GOT与GPT的值会有升高的情形[9]。
为了了解水生生物曝露于止痛剂布洛芬(Ibuprofen)及乙酰胺酚(acetaminophen, ACE)对水生生物的影响,本研究利用多齿新米虾(N. denticulate)进行两种水体中常检测出浓度的药物——IBU及ACE的曝露试验,并分析monooxygenase (MO),glutathione-S-transferase (GST),glutamic oxaloacetic transaminase (GOT)及glutamic pyruvictransaminase (GPT)来了解两种药物对米虾产生的影响。
2. 材料方法
实验之容器均依台湾环检所[10]“生物急毒性检测方法—米虾静水式法”清洗。步骤如下:1) 自来水浸泡15分钟后,用清洁剂清洗内壁;2) 以自来水冲洗二次;3)以10%硝酸清洗容器内部一次;4)以去离子水冲洗二次;5)以丙酮冲洗一次;6)以去离子水冲洗三次。做毒性试验前,测试容器需要以去离子水再次冲洗。
2.1. 实验动物准备
本实验动物–多齿新米虾(N. denticulate)购买于水族馆,买回后放入内盛40 L稀释水之饲养缸蓄养。缸内以通气设备曝气,待其稳定后选定额角至尾扇为1.3公分进行后续试验。
2.2. 布洛芬与乙酰胺酚储存溶液配制与曝露
布洛芬(IBU)及乙酰胺酚(ACE)的储存溶液利用100 mL的二甲基亚砜为溶剂配置成1000 mg/L的储存溶液,并将其以棕色瓶之试药瓶,保存于4℃以下,等待后续实验进行。
IBU及ACE曝露浓度为0、0.1、1和5 mg/L,每试验组30只。并于曝露后1、4及7天,分析米虾体内解毒酵素,monooxygenase (Mon)及glutathione-Stransferase (GST);肝胰脏受损指标glutamic oxaloacetic transaminase (GOT)及glutamic pyruvic transaminase (GPT) 的活性。
2.3. 萃取血淋巴液
曝露后马上进行米虾的血液生化值,分析前记录米虾的体重,加入0.5 mL tris-HCl buffer (Sigma, USA)及5 μL EDTA (Sigma, USA)于4℃下均质。均质液于4℃,10,000 rmp 下离心40分钟。离心后上清液保存于–20℃等待后续分析[11]。
2.4. 解毒酵素活性分析
测定Mon(monooxygenas)及GST(glutathione-Stransferase),血淋巴液进行解毒酵素分析,来检测米虾是否已有解毒机制的出现。由于单氧酶(Mon)活性消失快速,所以其分析经由萃取血淋巴液后,需马上进行分析[12]。
Mon分析:2 μL组织液加入80 μL 0.625 M potassium phosphate buffer,再加入200 μL反应药剂(以 1:3的比例混和3,31,5,51-tetramethyl benzidine与0.25 M sodium acetate buffer pH5.0),最后加入25 μL 3% hydrogen peroxide,在室温下反应30分钟后以波长650 mm下测定每分钟吸光值之变化[12,13]。
GST分析:10 μL组织液加入200 μL 63 Mm chlorodinitrobebzene与10 Mm glutathione 以1:20混合而成之药剂,在室温下等待10分钟后波长340 mm 下测定每分钟吸光值之变化[12,14]。
2.5. 生理生化值分析
测定GOT(glutamic oxaloacetic transaminase)及GPT(glutamic pyruvic transaminase)来检测米虾的肝胰脏是否有被破坏的情形出现。
GOT(AST)分析:测定以RANDOX出品的GOT (Cat. NO.AS 1267)测试剂测定。测定步骤如下:20 μL组织液加入200 μL的tris-buffer 80 mmol/L,pH7.5与L-aspartate 240 mmol/L的混合药剂与α-oxoglutarate 12 mmol/L、MDH ≥ 420 U/L、LD ≥ 600 U/L与NADH 0.18 mmol/L的混合药剂以1:1混合而成之试剂,在室温下以波长340 nm测定1、2及3分钟吸光值之变化后,浓度(U/L) = 1 746 × ΔA Hg 340 nm/min。
GPT(ALT)分析:测定以RANDOX出品的GPT (Cat. NO.AL 1268)测试剂测定。测定步骤如下:20 μL组织液加入200 μL的tris-buffer 100 mmol/L,pH7.5与L-alanine 0.6 mol/L的混合药剂与α-oxoglutarate 15 mmol/L、LD ≥ 1.2 U/mL与NADH 0.18 mmol/L的混合药剂以1:1混合而成之试剂,在室温下以波长340 nm测定1、2及3分钟吸光值之变化后,浓度(U/L) = 1746 × ΔA Hg 340 nm/min。
2.6. 统计分析
Monooxygenase,glutathione-S-transferase,glutamic oxaloacetic transaminase,glutamic pyruvic transaminase等血淋巴之分析经血淋巴中的总蛋白校正后以oneway ANOVA进行各天数不同处理组间的比较,分析后有显著差异者(p < 0.05)再以Duncan比较各组间的差异。
3. 结果与讨论
外来物的毒害一旦进入体内之后,生物体的反应是将其排泄或将其转换为较容易排除的代谢物(metabolite)。将毒物转换成易排除的状态称为生物转化(biotransformation)。生物转化分两阶段通常称为phase I及phase II,在进行解毒的过程中往往利用到许多酵素,这类酵素往往也可作为生物接触到毒性物质的指标。Mon为phase I的酵素,它主要氧化、还原或水解进入生物体内的污染物质;GST为phase II的酵素,它们通常与污染物质进行螯合后而排出体外。因此,当Mon或GST上升时即意味着生物体已经受到毒物的影响,进行解毒机制。本试验结果显示,米虾曝露IBU及ACE后0.5至7天,各处理组间Mon活性并无明显高于对照组(37.8 ± 9.1 ΔA650mm/30 min/mg, 图1),GST活性在部分处理组中有上升的趋势,其中又以曝露5 mg IBU/L及5 mg ACE/L的试验组特别明显(图2)。石田螺研究显示,曝露ACE时,Mon活性浓度皆有明显上升的趋势[15,16],本研究结果虽然没有统计上的显着差异,但是依然可以发现又增高的趋势。研究指出当ACE进入人体后95%会经phase I氧化后排出体外,期余5%会被氧化成有毒的物质N-acetyl-p-benzoquinone imine (NAPQI),NAPQI会经GST与在与麸胱甘肽(glutathione,GSH)结和排出体外[17]。此外,生物体接触到IBU时会将其排出体外亦会经由phase II的GST排出体外[18]。因此当米虾体内,GST活性升高时意味ACE或IBU已经进入米虾体内造成解毒的酵用。由本研究结果显示,曝露5 mg/L的IBU及ACE后Mon及GST已有明显的活性增加,此结果意味这两种药物以进入米虾体内,甚至可能造成虾体的影响。
毒性物质进入体内后除了被生理酵素解毒外,亦有可能在解毒的过程破坏节肢动物的肝胰脏。GOT (glutamic oxaloacetic transaminase)与GPT(glutamic pyruvic transaminase)为检测肝脏机能是否异常或肝损伤的评估分析,当生物体内GOT与GPT的值有升高的情形时,代表其肝胰脏细胞遭到损毁或破坏[9]。
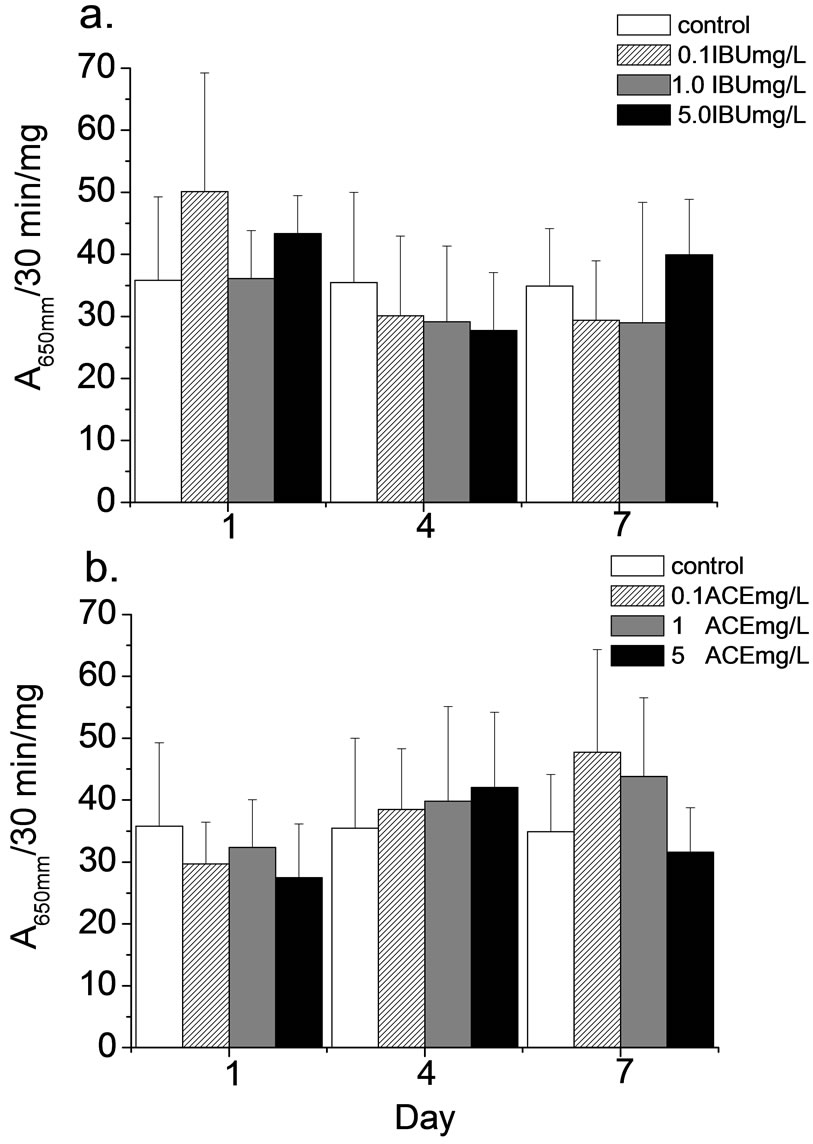
Figure 1. Monooxygenase activities in the hepatopancreas of N. denticulate after exposed IBU(a) and ACE(b).
图1. 米虾曝露于IBU(a)及ACE(b)后monooxygenase活性变化
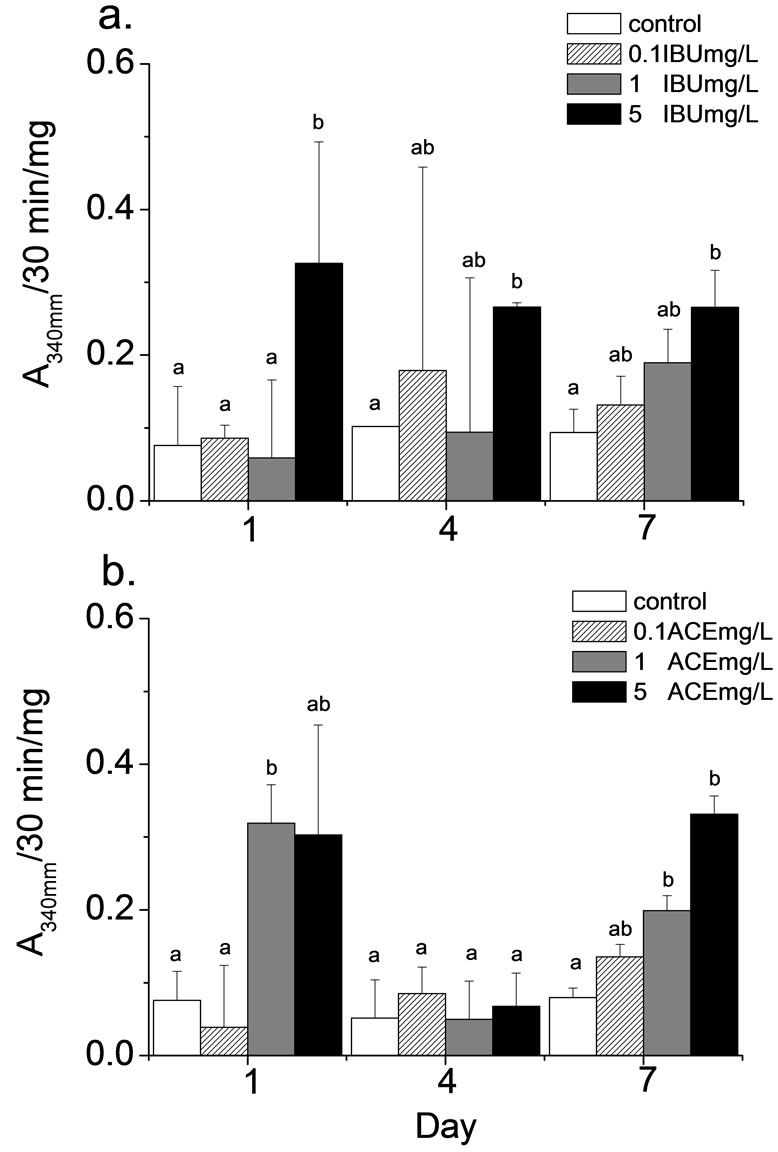
Figure 2. Glutathione-S-transferase activities in the hepatopancreas of N. denticulate after exposed IBU (a) and ACE (b)
图2. 米虾曝露于IBU(a)及ACE(b)后glutathione-S-transferase活性变化
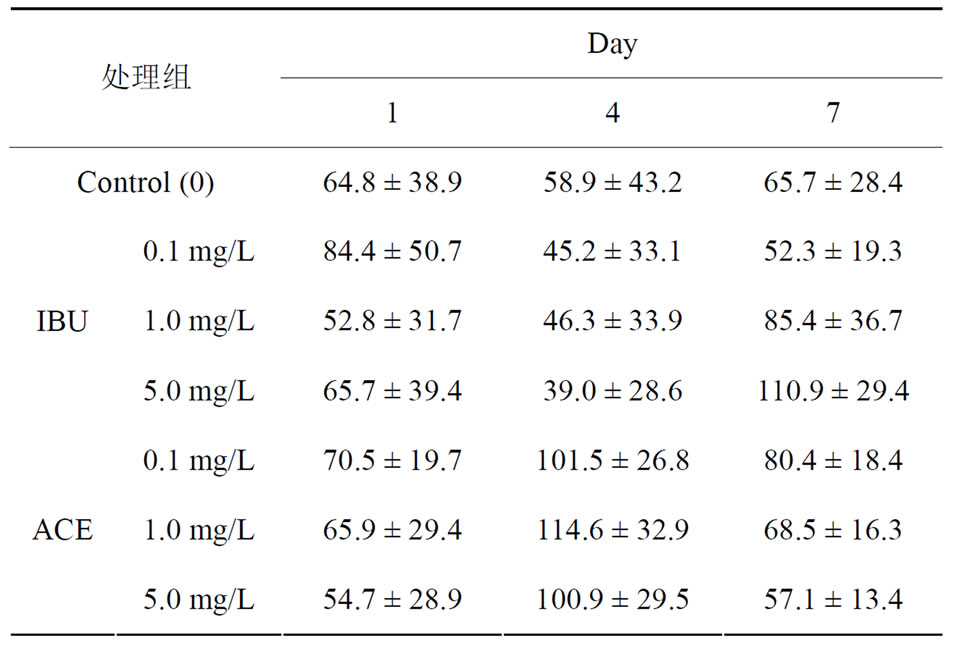
Table 1. Glutamic oxaloacetic transaminase (GOT) levels in the hepatopancreas of N. denticulate after exposed IBU (a) and ACE (b)
表1. 米虾曝露于IBU (a)及ACE (b)后肝胰脏glutamic oxaloacetic transaminase (GOT)浓度变化
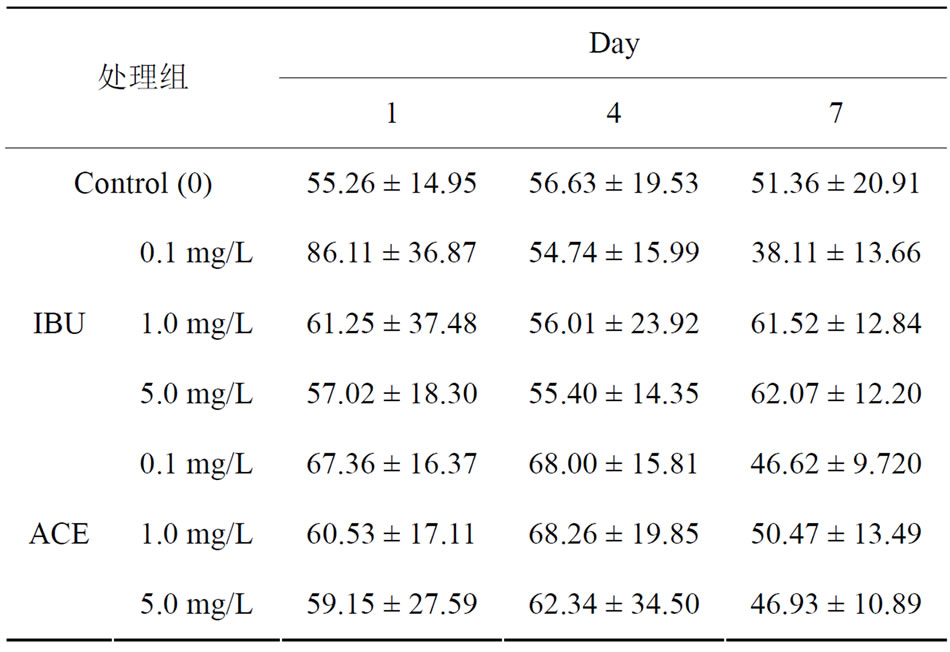
Table 2. Glutamic pyruvic transaminase (GPT) levels in the hepatopancreas of N. denticulate after exposed IBU (a) and ACE (b)
表2. 米虾曝露于IBU (a)及ACE (b)后肝胰脏glutamic pyruvic transaminase (GPT)浓度变化
肝胰脏生理指标的试验中,米虾曝露IBU及ACE两药物1、4及7天后个浓度试验组均与control组无明显的差异。但是,IBU试验组在7天时5 mg/L的处理组中GOT及GPT有上升的情况,代表IBU可能米虾的肝胰脏造成影响(表1、表2)。
综合实验结果,止痛剂IBU及ACE等药物于水体中残留时,不但会诱发米虾的解毒机制,甚至IBU可能造成肝胰脏的发炎的现象。初步结果显示,止痛剂IBU及ACE等药物残留于水体中确实会对水生生物生理上的影响。EEA[19]报告指出在未来的几年内,这类药物在水体中浓度势必增加,此等人类残留药物的问题将会变成尔后对水域生态环境重要的议题之一。
参考文献 (References)
[1] 林正芳, 林郁真, 余宗贤. 新兴污染物(抗生素与止痛药)于特定污染源环境之流布[Z]. 2008年持久性有机污染物(含戴奥辛)研讨会, 国立台湾大学公共卫生学院, 台北, 2008年9月5日.
[2] 林郁真, 林正芳, 康佩群, 余宗贤, 傅素乡, 蔡宇庭, 林志安. 水中医药类及其代谢之残留化学物质之检测技术建立研究(2/4)[R]. 台北: 行政院环境保护署环境检验所, 2008.
[3] 台湾行政院卫生署中央健康保险局. 健保数据库(全民健康保险研究数据库)[URL], 2005. http://nhird.nhri.org.tw
[4] N. Pounds, S. Maclean, M. Webley, D. Pascoe and T. Hutchinson. Acute and chronic effects of ibuprofen in the mollusc Planorbis carinatus (Gastropoda: Planorbidae). Ecotoxicology and Environmental Safety, 2008, 70(1): 47-52.
[5] L.-H. Heckamann, A. Callaghan, H. L. Hooper, R. Connon, T. H. Hutchinson, S. J. Maund and R. M. Sibly. Chronic toxicity of ibuprofen to Daphnia magna: Effects on life history traits and population dynamics. Toxicology Letters, 2007, 172(3): 137- 145.
[6] H. J. Lange, W. Noordoven, A. J. Murk, M. Lürling and E. T. H. M. Peeters. Behavioural responses of Gammarus pulex (Crustacea, Amphipoda) to lowconcentrations of pharmaceuticals. Aquatic Toxicology, 2006, 78(3): 209-216.
[7] L. G. Schweer. Draft detailed review paper on mysid life cycle toxicity test. Washington, DC: US Environmental Protection Agency, 2002.
[8] D. J. Liska. The detoxification enzyme systems. Alternative Medicine Review, 1998, 3(3): 187-198.
[9] 李文君. 从肝功能检查看肝病[R]. 台北: 中华民国肝病防治学术基金会, 1999.
[10] 环检所. 生物急毒性检测方法——米虾静水式法[Z]. 台湾环境检验所公告编号NIEA B905.12B, 2011.
[11] F. Gagne, C. Blaise, M. Salazar, S. Salazar and P. D. Hansen. Evaluation of estrogenic effects of municipal effluents to the freshwater mussel Elliptio complanata. Comparative Biochemistry and Physiology, Part C, 2001, 128(2): 213-225.
[12] WHO (World Health Organization). Techniques to detect insecticide resistance mechanisms: Field and laboratory manual. Geneva: World Health Organization, 1998.
[13] W. G. Brogden, J. C. McAllister and J. Vulule. Heme peroxidase activity measured in single mosquitoes identifies individuals expressing an elevated oxidase for insecticide resistance. Journal of the American Mosquito Control Association, 1997, 13(3): 233-240.
[14] W. G. Brogden, A. M. Barber. Microplate assay of acetylchinesterase inhibition kinetics in single mosquito homogenates. Pesticides Biochemistry and Physiology, 1987: 252-259.
[15] L. Wollenberger, B. Halling-Sørensen and K. O. Kusk. Acute and chronic toxicity of veterinary antibiotics to Daphnia magna, Chemosphere, 2000, 40(7): 723-730.
[16] 叶芳伶, 宋宏红, 黄大骏. 人类常用药物——抗生素氯四环霉素(chlortetracycline)及止痛剂乙酰胺酚(acetaminophen)对石田螺(Sinotaia quadrata)的影响[J]. 贝类学报, 2011, 35: 62- 78.
[17] C. D. David, T. M. Gerald, Y. H. L. Anthony and D. N. Sidney. N-acetyl-p-benzoquinone imine: A cytochrome P-450-mediated oxidation product of acetaminophen. Proceedings of the National Academy of Sciences, 1984, 81: 1327-1331.
[18] E. M. van Lieshout, D. M. Tiemessen, W. H. Peters and J. B. Jansen. Effects of nonsteroidal anti-inflammatory drugs on glutathione S-transferases of the rat digestive tract. Carcinogenesis, 1997, 18(3): 485-490.
[19] EEA (European Environment Agency). Pharmaceuticals in the environment results of an EEA workshop. Copenhagen: European Environment Agency, 2010.
NOTES
*通讯作者。