Asian Case Reports in Oncology
Vol.05 No.03(2016), Article ID:18151,10
pages
10.12677/ACRPO.2016.53005
Progress in Subclinical Cancer Foci around Liver under the Guidance of Precision Medicine
Zuoshen Zheng
Oncology Department, Jiangmen Central Hospital (Jiangmen Hospital Affiliated to Sun Yat-sen University), Jiangmen Guangdong

Received: Jul. 8th, 2016; accepted: Jul. 26th, 2016; published: Jul. 29th, 2016
Copyright © 2016 by author and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Precision medicine clinical analysis, small liver cancer surgical resection, local treatment or accurate radiotherapy coexisting defects, the thing that tumor is being resected completely and the thing that subclinical cancer around liver cancer "is missing" are the bottleneck that make the survival rate after small liver cancer surgery for 5 years not increased for more than 40 years. At present, the research of liver cancer is at a crossroad. In accordance with the principles of the precision medicine, completely treating the primary tumor foci (there are many treatment methods) and also treating cancer weeks subclinical cancer lesions (there is only one method that is the whole liver mobile radiation therapy), can reduce the recurrence and the metastasis. In this paper, we focus on the understanding that can control the range of the irregular distribution of the subclinical focus around the liver cancer to analyze advantages and disadvantages of the whole liver moving strip field radiotherapy, precise radiotherapy and surgical resection of the liver cancer, and explores the new scheme of multidisciplinary cooperation and comprehensive treatment that the advantages of three therapies supplement each other.
Keywords:Primary Liver Cancer, Recurrence, Subclinical Lesions, Treatment, Precision Medicine

精准医学引导下肝癌周围的亚临床癌灶研究进展
郑作深
江门市中心医院(中山大学附属江门医院)肿瘤科,广东 江门

收稿日期:2016年7月8日;录用日期:2016年7月26日;发布日期:2016年7月29日

摘 要
精准医学临床分析,小肝癌手术切除、局部治疗或精确放疗共存缺陷,肿瘤完整被切除,肝癌周围亚临床癌灶“被遗漏”,是40余年小肝癌术后5年生存率没有提高的瓶颈。当前肝癌研究正处于十字路口。遵照精准医学原则,完整治疗原发癌灶(治疗方法较多),并治疗癌周亚临床癌灶 (方法仅有全肝移动条野放疗1项),才能减少复发转移。本文围绕能够控制肝癌周围亚临床病灶不规则分布范围的认识来分析全肝移动条野放疗、精确放疗和外科切除肝癌的优缺点,探索三者优势互补的多学科合作与综合治疗的新方案。
关键词 :原发性肝癌,复发,亚临床病灶,治疗,精准医学

1. “癌中之王”肝癌研究的社会现状
据中国肿瘤防治研究办公室报道:2012年全球肝癌死亡病例约为74.6万例,超过50%的肝癌死亡病例发生于中国,5年生存率8.9%。肝癌是威胁中国居民健康的顾主要恶性肿瘤,死亡负担依然十分严重 [1] 。全球肿瘤研究已经过去很多年,学术界对肿瘤转移复发仍然“束手无策” [2] 。
目前针对肝癌的治疗方案较多,小肝癌进行肝移植者的5年生存率难以超过80%,小肝癌切除者的5年生存率为50%~60%,小肝癌射频消融者的5年生存率只有40~50%,40多年小肝癌术后5年生存率没有提高,这提示复发转移仍是攻克肝癌的主要瓶颈 [3] ,肝癌为何转移复发率高?精准肝癌病理学研究发现,医生在超声、CT和磁共振等影像检查上看到的,只是肝癌的一部分,即主癌灶,在主癌灶的周围,还有影像检查难以看到的显微镜下病灶,称为亚临床癌灶。事实上,肝癌的亚临床癌灶范围,比主癌灶要大的多。肝癌切除术、射频消融术和精确放疗等常用的肝癌治疗手段共同缺陷常难以一次性完全消除所有的肝癌亚临床癌灶,治疗后亚临床癌灶发生残留和复发几乎是一种必然 [4] 。经动脉介入栓塞治疗(TACE)更是难以彻底清除癌灶,TACE广泛用于肝癌治疗准确缺陷:1) 多支动脉供血、栓塞不完全及术后侧支循环形成致使肿瘤没有达到病理学完全坏死;2) TACE后局部缺血缺氧会反馈刺激肿瘤,导致血管内皮生长因子(VEGF)高表达,促进残癌复发转移 [5] 。
2015年美国国情咨文中提出了精准医学(precision medicine)的计划,该计划重点致力于治愈癌症等疾病,开发更加有效的肿瘤治疗方法,扩大临床癌症试验,进行癌症探索,因此,精准医学理念的提出为肝癌的诊断和治疗提供了崭新的思路,,转移复发的防治是延长肝癌病人术后生存的关键环节 [6] 。
2. 肝癌精准医学引导下,术后复发时揭示肝癌周围亚临床癌灶“被遗漏”的关键
精准医疗更深入、准确、全面地揭示小肝癌的本质特征,直接“定位”小肝癌手术切除、局部治疗或精确放疗共存缺陷,即使小肿瘤完整切除,“被遗漏”癌周亚临床癌灶没有治疗,术后复发的高风险的准确缺陷,揭示学术界长期对肝癌周围存在的亚临床癌灶“被忽视”的事实,进而对肝癌周围存在的亚临床癌灶必需按精准治疗原则深入研究 [6] 。呼吁有志重视亚临床癌灶精准治疗的肝癌学者应为此作出贡献,完善肝癌诊疗体系。
小肝癌周围存在的亚临床癌灶文献依据:中国《原发性肝癌诊疗规范》指出 [5] ,肝癌具有极易出现肝内外转移的特性,最初多为肝内播散转移,易侵犯门静脉及分支并形成瘤栓,术前己存在微小播散灶或多中心发生,却没有任何防治方法。北京大学三院张同琳 [7] 等报道89例原发性肝癌全肝切除标本的病理解剖学特征提供准确病灶浸润范围:其中75例(84.28%)无包膜,原发肿瘤边界不清,标本上的癌灶大小尚难准确测量,这些特点使术前的影像学检查结果不可能准确;13例原发肿瘤在右叶,但左叶存在小癌灶;16例的肿大淋巴结中7例有癌浸润(43.8%);有门静脉主干或分支瘤栓者42例(47.2%);有卫星灶者39例(43.8%);卫星灶距主癌灶的距离多为0.5~3.0 cm,最大距离达5.0 cm,全肝切除标本能全面地反映肝癌生长和浸润特征,应警惕门静脉瘤栓及卫星灶的存在,特别是距主癌灶较远的卫星灶及门静脉小支内的瘤栓,以及分布在另一肝叶的小癌灶,这些因素在影像学检查时容易漏诊或误诊。丛文铭 [8] 报道106例复发性肝癌再切除标本病理分析,多中心发生占25%和肝内转移占75%。Shi指出 [9] 有些癌灶是影像学上可以显示的,如主癌灶、较大的卫星灶;而另一些则在影像不能显示,如微小的卫星灶,微静脉癌栓和卫星灶常呈不规则分布。石明 [10] 等报道136例肝癌切除标本瘤周微转移占66.7%,其中91.7%扩散范围3.0 cm,最大距离为6.0 cm。徐彬 [11] 等报道43例肝癌切除标本58.7%肝内微转移,微转移距原发肿瘤最远距离4.7 cm。Nishikawa [12] 肝癌早期多有肝内播散,易侵犯门静脉及分支形成癌栓,其发生率可达62.12%~90.12%。LU [13] 发现甚至 ≤ 1 cm的微小肝癌也可以发生微血管癌栓,提示这些微小肝癌可较早地转入恶性演进阶段。U ka [14] 对151例合并肝外转移的肝癌患者统计后发现,淋巴结转移占全部肝外转移的45%。Toyoda [15] 报道肝癌直径小于2 cm也能发生淋巴结转移。Kojiro [16] 报道660例肝癌尸检证实肝癌伴有腹腔淋巴结转移最常见者为肝门淋巴结(58.3%),然后是胰腺周围淋巴结(54.2%),胃周围淋巴结(45.8%),主动脉周围淋巴结(33.3%)和锁骨上淋巴结约占10%。
因此,肝癌周围亚临床癌灶 [6] - [16] 为正确认识肝癌在癌周亚临床癌灶不规则分布的病理学特点提供了准确病灶浸润范围的参考依据,指导临床医生准确确定一个合理的精准临床治疗靶区,也为全肝移动条野放疗临床靶区合理设计精准治疗癌周亚临床病灶的分布范围不能遗漏指出方向,不能以现代影像学检查假阴性而否定亚临床癌灶存在的事实。
3. 肝癌精确放疗临床靶区与肝癌精准放疗临床靶区的区别
放射治疗是恶性肿瘤最主要的治疗手段之一,在百余年的发展中,放射治疗得到了长足的进步。由于全肝放疗的耐受剂量远低于肝癌组织的根治剂量,传统全肝照射 > 40 Gy时,75%的患者会出现肝功能不全,使放疗在治疗不可切除肝癌患者中受到限制 [17] ,随着放疗新技术的进展,郑作深 [18] - [21] 等学者报道开发肝癌精准放疗临床靶区(Clinical target volume CTV)定义,“CTV为全肝移动条野放疗35 Gy治疗癌周亚临床癌灶,局部缩野对准主癌灶(Gross tumor volume GTV)放射根治剂量递增至60 Gy”73例,临床受益率100%,1、3、5年生存率分别是90.2%、47.9%和10.9%,其中10例(13.7%)中位直径14 cm缩小至7 cm,使巨大肝癌缩小后二步切除,5、10年生存率分别为40%和30%,最长生存者28年仍健在,经长期随访,至今无肝肾功能损害记录,疗效令人鼓舞,提示当前能治疗肝癌亚临床癌灶的一丝曙光:全肝移动条野放射适应证对肿瘤边界在影像学上无法确认,有肝内亚临床病灶的肝癌患者,提高肿瘤的生物效应,改善正常组织的耐受量为全肝移动条野放疗30~35 Gy,局部缩野剂量递增至60 Gy的应用价值,正是移动条野技术的优点。符合国际放射单位与测量委员会(International Commis- sion on Radiation Unit and Measurements, ICRU) 50号和62号报告 [22] 关于临床靶区(CTV)包括GTV和亚临床癌灶或可能侵犯的区域的定义标准,对肝癌转移复发的防治具有重要临床意义,事实证明肆意杜撰“移动条野放疗无论从理论还是实践,都存在严重缺陷”的伪命题不能苟同,提出商榷综述 [21] 。当前肝癌研究正处于十字路口,欢迎有关学者在精准医学引导下对全肝移动条野放疗无论从理论还是实践再研究的学术新作,是74.6万例肝癌患者为减轻死亡负担的殷切期望。
20世纪80年代以来,中国放疗界与国际接轨进入精确放疗的时代,出现三维适形放疗,立体定向放疗,质子刀粒子刀治疗等。多年临床实践发现肝癌放疗精确临床靶区定位遗漏癌周亚临床癌灶导致复发转移的重大缺陷。因此,于金明院士 [23] 郑重指出:有关精确放疗的解剖影像空间分辨率与物理精度几乎已经达到极限,奢华的射线施照设备也已提供了高精确施照的条件,但恶性肿瘤精确放疗疗效仍难以令人满意。患者生存期的延长与全社会投入的巨大人力、物力、财力不成正比,值得我们深入思考的启示。
贾明 [24] 报道小肝癌患者100例。按不同的治疗方法分为三维适形放疗组(53例)和传统手术切除组(47例):三维适形放疗组1、2、5年生存率分为85.0%、75.3%、45.2%和86.7%、75.1%、44.5%;两组的平均生存时间分别为(30.26 ± 3.27)个月与(33.38 ± 3.55)个月;两组间比较无显著性差异(P > 0.05)。说明精确放疗与手术对患者生存率影响无差异。两组1、2、5年复发率分别为15.8%、29.9%、57.5%和14.3%、28.2%、55.9%,两组间比较无显著性差异(P > 0.05),说明放疗与手术对患者复发率影响无差异。但是,三维适形放疗组患者的肝内局部复发和远处复发的比例比手术组高,有显著性差异(P < 0.05)。提示三维适形放疗治疗后肝内局部复发率较高亟待解决。
NIRS [25] 报道了64名小肝癌患者接受了总剂量52.8Gy的碳离子放疗,5年生存率31.3%。奢华的质子重离子的装置极其复杂,体积庞大,造价昂贵,复旦大学肿瘤医院引进德国西门子建设项共投资33亿人民币,其中19亿人民币用于制造质子、重离子加速器装置 [26] ,上海质子重离子医院目前每个疗程平均收费27.8万元 [27] 。对照碳离子放疗5年生存率31.3% [25] ,明显低于手术组44.5%和三维适形放疗组45.2% [24] ,显然,上海质子重离子医院临床技术委员会主任蒋国梁教授 [28] - [33] 高调反复夸大宣扬《质子重离子放疗是一把“利刃”向肿瘤》,读者查阅原文却没有临床获益的实例报道。那么,遵照肝癌精准治疗原则,巨额投资质子重离子放疗的5年生存率没有明显提高,没有显示杀灭癌周亚临床癌灶的优点,能够解决肝癌死亡负担依然十分严重的投入吗?
笔者经30年开发肝癌精准放疗临床靶区“CTV为全肝移动条野放疗30~35 Gy治疗癌周亚临床癌灶,局部缩野对准GTV根治剂量递增至60 Gy”,仅需6~10 MV直线加速器设备1台,可谓经济实惠,能消灭癌周亚临床癌灶优于肝癌精确放疗,特别优于奢华的质子重离子治疗。因此,肝癌精准医学需要开发更有效治疗方法、经济效益及临床效果最大化。
示范病例1 [20] 。肝右叶巨大肝癌13 cm × 10 cm,边缘不清,肝功能child-Pugh A级,1987年9月25日起全肝移动条野放疗mTD 18 Gy (第1轮.全肝移动条野放疗9 Gy/腹面8条野移动11次,5次/周;第2轮。全肝移动条野放疗9 Gy/背面8条野移动11次,5次/周),休息2周;缩野(局部方野)放疗44 Gy (5次/周,2 Gy/次),放疗总剂量mTD 62 Gy,休息3周,肿瘤缩小至6 cm × 6 cm,缩小率72.6%,1987年12月29日 II 期切除。从放疗第1天1987年9月25日计至1987年12月29日手术共94天。随访29年,健在。
示范病例2 [20] 。肝右叶两个相邻病灶分别11 cm × 10 cm和8 cm × 7 cm,边缘不清,肝功能child-Pugh A级,1990年12月19日起改良全肝移动条野放疗mTD 36 Gy (第1轮.全肝移动条野放疗9 Gy/腹面10条野移动13次,5次/周;第2轮.全肝移动条野放疗9 Gy/背面10条野移动13次,5次/周;第3轮。全肝移动条野放疗9 Gy/腹面10条野移动13次,5次/周;第4轮。全肝移动条野放疗9 Gy/背面10条野移动13次,5次/周);休息4周,缩野(局部相邻两方野)放疗24 Gy (5次/周,2 Gy/次),放疗总剂量mTD 60 Gy,休息4周,肿瘤分别缩小至6 cm × 5 cm和6 cm × 4 cm,缩小率63.6%和57.1%,1991年5月14日II期切除。从放疗第1天1990年12月19日计至1991年5月14日手术共142天,1997年失访,生存期6年。
示范病例3 [20] 。肝右叶巨大肝癌13 cm × 12 cm,边缘不清,腹膜后淋巴结转移1.8 cm,肝功能child-Pugh A级,1991年8月7日起改良全肝移动条野放疗mTD 18 Gy (第1轮。全肝移动条野放疗9 Gy/腹面8条野移动11次,5次/周;第2轮。全肝移动条野放疗9 Gy/背面8条野移动11次,5次/周),休息4周;缩野(局部方野)放疗39 Gy (5次/周,2 Gy/次),放疗总剂量mTD 57 Gy,休息3周,肿瘤缩小至8 cm × 7 cm肿瘤缩小率64.8%,腹膜后淋巴结消失,1991年11月25日II期切除。从放疗第1天1991年8月7日计至1991年11月25日手术共108天。1998年失访,生存期7年。
示范病例4 [20] 。肝方叶及肝左内叶肝癌14 cm × 11 cm,边缘不清,肝功能child-Pugh A级,于1993年2月16日日起改良全肝移动条野放疗mTD 36 Gy (第1轮。全肝移动条野放疗9 Gy/腹面10条野移动13次,5次/周;第2轮。全肝移动条野放疗9 Gy/背面10条野移动13次,5次/周,休息2周;第3轮。全肝移动条野放疗9 Gy/腹面10条野移动13次,5次/周;第4轮。全肝移动条野放疗9 Gy/背面10条野移动13次,5次/周);休息4周,肿瘤缩小至8 cm × 8 cm,肿瘤缩小率58.4%,1993年6月20日 II 期切除。从放疗第1天1993年2月16日计至1993年6月20日手术共123天。1999年失访,生存期6年。
示范病例5 [20] 。肝右叶巨大肝癌11.5 cm × 10 cm,边缘不清,肝功能child-Pugh A级,于1993年3月13日起改良全肝移动条野放疗mTD 36 Gy (第1轮。全肝移动条野放疗9 Gy/腹面8条野移动11次,5次/周;第2轮。全肝移动条野放疗9 Gy/背面8条野移动11次,5次/周,休息2周;第3轮。全肝移动条野放疗9 Gy/腹面8条野移动11次,5次/周;第4轮。全肝移动条野放疗9 Gy/背面8条野移动11次,5次/周)休息4周,缩野(局部方野)放疗16 Gy (5次/周,2 Gy/次),放疗总剂量mTD 52 Gy,休息4周,肿瘤缩小至8 cm × 6 cm,肿瘤缩小率58.2%,1993年8月25日 II 期切除。从放疗第1天1993年3月18日计至1993年8月25日手术共153天。随访21年,健在。
小结:开发肝癌精准放疗临床靶区“CTV为全肝移动条野放疗30~35 Gy治疗癌周亚临床癌灶,局部缩野根治剂量GTV递增至60 Gy”,长期临床随访实践首次发现了肝癌传统放疗和三维适形放疗概念所未知的事实,为众多失去手术治疗机会的肝癌患者提供了新的选择,可以提高存活、改善生活质量,但并未被普通患者和医务人员广泛接受。学术界应正确理解移动条野放疗杀癌的理论、移动条野放疗的放射生物学特点、测量方法、计算公式、临床适应症和使用规则。适应症为肿瘤边界在影像学上无法确认者,突出特点是当前能治疗肝癌亚临床病灶的新技术。
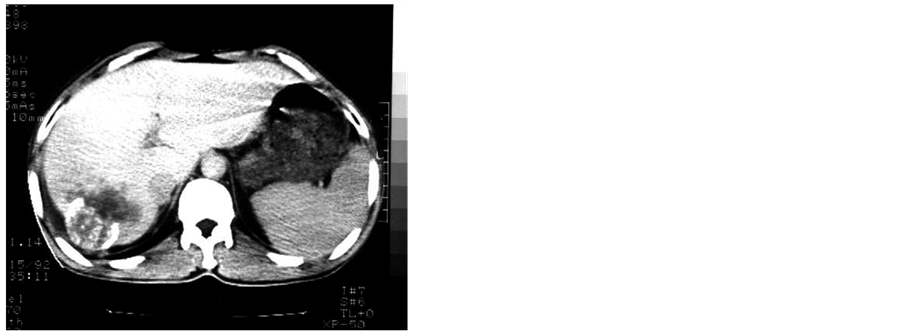
 注:肝右叶主癌灶12.5 × 8 cm,癌周多发性子灶互相融合,直径1~5 cm,浸润性生长,肿瘤边界在影像学上无法确认。
注:肝右叶主癌灶12.5 × 8 cm,癌周多发性子灶互相融合,直径1~5 cm,浸润性生长,肿瘤边界在影像学上无法确认。
Figure 1. CT figure 1
图1. CT图示1
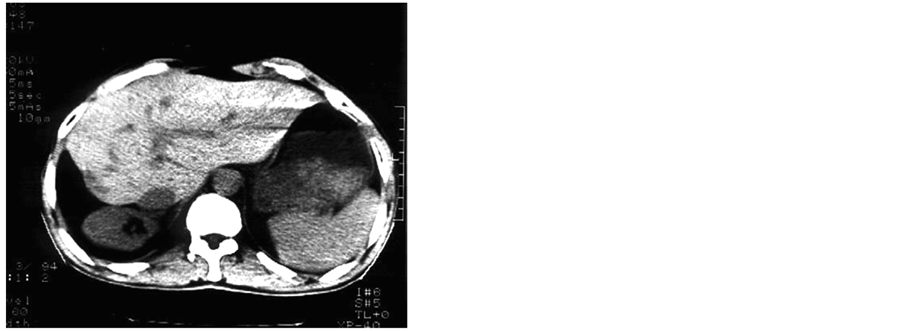
 注:开发肝癌精准放疗临床靶区“CTV为全肝移动条野放疗35 Gy治疗癌周亚临床癌灶,局部缩野根治剂量GTV递增至60 Gy”,主癌灶缩小到8 cm,多发性子灶消失。
注:开发肝癌精准放疗临床靶区“CTV为全肝移动条野放疗35 Gy治疗癌周亚临床癌灶,局部缩野根治剂量GTV递增至60 Gy”,主癌灶缩小到8 cm,多发性子灶消失。
Figure 2. CT figure 2
图2. CT图示2
 注:右肝部分切除术后,随访至2010年10月失访,生存18年。
注:右肝部分切除术后,随访至2010年10月失访,生存18年。
Figure 3. CT figure 3
图3. CT图示3
4. 在精准医学引导下要有勇气坚持探索肝癌术后转移复发的中国特色防治之路,多中心循证医学研究分组(草案)
研究目的:消灭主癌灶,同时消灭肝癌周围亚临床癌灶,降低肝癌术后复发率,提高生存率的临床实用的有效方法。
4.1. 小肝癌A组 ≤ 5 cm
治疗目的杀灭原发肿瘤,同时消灭残肝内亚临床病灶和肝门区域淋巴结转移,这些潜在的微转移灶是治疗后复发的主要原因。
1) 观察组:术后放疗组,原发肿瘤外科切除术后,间隙4周,施行全肝移动条野照射30~35 Gy,控制癌周亚临床病灶。随访生存情况。
2) 对照组:术后介入组,原发肿瘤外科切除术后,间隙4周,第1次TACE,间隙4周,第2次TACE共2次。随访生存情况。
3) 入组对象:小肝癌 ≤ 5 cm,癌旁亚临床病灶或肝门淋巴结 ≤ 1 cm,门静脉主干至二级分支无癌栓,肝功能Child-Pugh A级,KPS ≥ 70分。
4) 评价:客观疗效(1、2、3、4、5年累积生存率及总生存期、不良反应和失败原因。
4.2. 小肝癌B组 ≤ 5 cm
1) 观察组:射频消融术后,间隙4周,施行全肝移动条野照射30~35 Gy,控制癌周亚临床病灶。随访生存情况。
2) 对照组:射频消融术后,间隙4周,第1次TACE,间隙4周,第2次TACE共2次。随访生存情况。
3) 入组对象:小肝癌 ≤ 5 cm,癌旁亚临床病灶或肝门淋巴结 ≤ 1 cm,门静脉主干至二级分支无癌栓,肝功能Child-Pugh A级,KPS ≥ 70分。
4) 评价:客观疗效(1、2、3、4、5年累积生存率及总生存期、不良反应和失败原因。
4.3. 小肝癌C组 ≤ 5 cm
1) 观察组:氩氦刀消融术后,间隙4周,施行全肝移动条野照射30~35 Gy,控制癌周亚临床病灶。随访生存情况。
2) 对照组:氩氦刀消融术后,间隙4周,第1次TACE,间隙4周,第2次TACE共2次。随访生存情况。
3) 入组对象:小肝癌 ≤ 5 cm,癌旁亚临床病灶或肝门淋巴结 ≤ 1 cm,门静脉主干至二级分支无癌栓,肝功能Child-Pugh A级,KPS ≥ 70分。
4) 评价:客观疗效1、2、3、4、5年累积生存率及总生存期、不良反应和失败原因。
4.4. 大肝癌 ≥ 5 cm
此时肿瘤仍然局限于肝脏区域内,尚未出现远处转移,属于局部晚期。其治疗目的既要有效地杀灭原发肿瘤和肝内亚临床病灶,同时亦须注意治疗后肝内复发和肿瘤远处转移。此部分肝癌病情最为复杂,疗效较差,治疗方法众多,争议最多。
1) 观察组:术前放疗(降期治疗)组:全肝大野照射(全肝移动条野照射30~35 Gy)控制癌旁亚临床病灶,间隙4周,再以小野(精确放疗)对准原发肿瘤剂量递增照射至60 Gy,能控制原发肿瘤的移动条野放射综合治疗方案。放疗结束1~2月,待原发肿瘤缩小适合手术者,二期切除。
2) 对照组:TACE 2~3次,每次间隙4周,待原发肿瘤缩小适合手术者,二期切除。
3) 入组对象:大肝癌 ≥ 5 cm,最大径 < 10 cm,无包膜或包膜不完整,浸润性生长,癌旁亚临床病灶或肝门淋巴结 ≤ 1 cm,门静脉主干至二级分支无癌栓,肝功能Child-Pugh A级,KPS ≥ 70分。
4) 评价:客观疗效(1、2、3、4、5年累积生存率及总生存期、不良反应和失败原因。
4.5. 巨大肝癌 ≥ 10 cm
晚期肝癌治疗的终极目标是控制原发肿瘤和控制癌旁亚临床病灶、延长生命和维持良好的生活质量。
1) 观察组:全肝移动条野综合放疗组:全肝移动条野照射30~35 Gy)控制癌旁亚临床病灶,间隙4周,视放疗反应情况再以小野(精确放疗)对准原发肿瘤剂量递增照射至60 Gy,能控制原发肿瘤的移动条野放射综合治疗方案。放疗结束1~2月,待原发肿瘤缩小适合手术者,二期切除。如不能手术切除者,随访生存情况。
2) 对照组:肝动脉化疗栓塞(TACE)治疗肝癌,间隙4周,第2次肝动脉化疗栓塞(TACE)治疗肝癌,待原发肿瘤缩小适合手术者,二期切除。如不能手术切除者,随访生存情况。
3) 入组对象:巨大肝癌 ≥ 10 cm,无包膜或包膜不完整,浸润性生长,癌旁亚临床病灶或肝门淋巴结 ≤ 1 cm,门静脉主干至二级分支无癌栓,肝功能Child-Pugh A级,KPS ≥ 70分。
4) 评价:客观疗效(1、2、3、4、5年累积生存率及总生存期、不良反应和失败原因。
4.6. 对原发性肝癌包膜完整,不论肿瘤大小,均手术切除后综合治疗
1) 观察组:术后放疗组,术后4周,全肝移动条野放疗30~35 Gy消灭亚临床病灶。
2) 对照组:术后介入组,术后4周,第1次TACE,间隔4周,第2次TACE。
3) 入组对象:肿瘤包膜完整,不论肿瘤大小,均手术切除后综合治疗,癌旁亚临床病灶或肝门淋巴结 ≤ 1 cm,门静脉主干至二级分支无癌栓,肝功能Child-Pugh A级,KPS ≥ 70分。
4) 评价:客观疗效1、2、3、4、5年累积生存率及总生存期、不良反应和失败原因。
4.7. 肝移植–等待供肝期间,术前全肝移动条野综合放疗沏底清除术前巳存在显微镜下的腹腔淋巴结转移
肝移植术后复发根源:肝移植能够直接切除了确诊的主癌灶,也切除了潜在的未检测到的亚临床癌灶,却难以沏底清除术前巳存在显微镜下的腹腔淋巴结转移,文献报道,肝癌肝移植术后5年肝癌复发率可达20.0%~57.8% [34] ,淋巴结转移的患者不适合手术治疗,即使行肝门淋巴结清扫也不能达到根治的效果,并不能提高患者的生存期 [35] 。黄洁夫 [36] 认为肿瘤有无局部淋巴结侵犯是影响肝癌肝移植预后的重要因素,有淋巴结侵犯者和淋巴结阴性者术后的肝癌复发率分别是75%及34%。Kojiro [16] 报道660例尸检肝癌伴有腹腔淋巴结转移最常见者为肝门淋巴结(58.3%),然后是胰腺周围淋巴结(54.2%)和胃周围淋巴结(45.8%),主动脉周围淋巴结(33.3%)和锁骨上淋巴结约占10%。肝门局部淋巴结转移,术前往往难以发现。
肝癌腹腔淋巴结转移放疗有效,可降低病死率 [37] 。术前全肝移动条野综合放疗目的杀灭原发肿瘤,同时消灭肝内亚临床病灶和腹腔淋巴引流区域转移,预防肝癌肝移植术后复发的综合治疗方案,待循证研究证实。
1) 观察组:术前放疗组,全肝移动条野照射35 Gy控制癌旁亚临床病灶和肝门区域淋巴结转移,间隙4周,视放疗反应情况再以小野(精确放疗)对准原发肿瘤。
2) 对照组:术前介入组,TACE 2~3次,每次间隙4周。
3) 入组对象:米兰标准准入肝癌患者,癌旁亚临床病灶或肝门淋巴结 ≤ 1 cm,门静脉主干至二级分支无癌栓,肝功能Child-Pugh A级,KPS ≥ 70分。
4) 评价:客观疗效(1、2、3、4、5年累积生存率及总生存期、不良反应和失败原因。
5. 结论
精准医学理念的引导下,基于癌周微转移(亚临床)病灶认识的深入,以带动肝癌基础研究和临床诊疗的突破性进展。笔者从导致转移复发的肝癌周围亚临床癌灶找灵感,从消灭肝癌周围亚临床癌灶方法找思路。围绕能够控制肝癌癌周亚临床病灶不规则分布范围的认识来分析全肝移动条野放疗、精确放疗和外科切除肝癌的优缺点,探索三者各有所长,优势互补的多学科合作与综合治疗的新方案。我国肝癌患者占全球肝癌患者的一半以上,如能走出一条成功的中国肝癌防治之路,不仅造福中国人民,也将惠及全球,获得临床效益最大化,肝癌患者死亡的负担大大减轻。
文章引用
郑作深. 精准医学引导下肝癌周围的亚临床癌灶研究进展
Progress in Subclinical Cancer Foci around Liver under the Guidance of Precision Medicine[J]. 亚洲肿瘤科病例研究, 2016, 05(03): 45-54. http://dx.doi.org/10.12677/ACRPO.2016.53005
参考文献 (References)
- 1. 郑荣寿, 左婷婷, 曾红梅, 等. 中国肝癌死亡状况与生存分析[J]. 中华肿瘤杂志, 2015, 37(9): 697-702.
- 2. 樊嘉, 史颖弘. 精准医学引导下的肝脏外科[J]. 中华医学杂志, 2015, 95(31): 2500-2502.
- 3. 汤钊猷. 试论中国肝癌防治之路[J]. 中华肿瘤杂志, 2015, 37(9): 641-643.
- 4. 孙文兵. 肝癌患者出院后别忽视科学随访[J]. 中华养生保健, 2015(5): 27-28.
- 5. 中华人民共和国卫生部[卫办医政改(2011)121号]. 原发性肝癌诊疗规范(2011版)[J]. 临床肿瘤学杂志, 2011, 6(10): 929-946.
- 6. Fox, J.L. (2015) Obama Catapults Patient-Empowered Precision Medicine. Nature Biotechnology, 33, 325. http://dx.doi.org/10.1038/nbt0415-325
- 7. 张同琳, 马少华, 修典荣, 等. 原发性肝癌全肝切除标本的病理解剖学特征及其启示[J]. 中华外科杂志, 2010, 48(13): 964-967.
- 8. 丛文铭, 董辉, 王斌, 等. 复发性肝癌临床病理特点与发生方式探讨[J]. 中国实用外科杂志, 2009, 29(1): 71-73.
- 9. Shi, M., Zhang, C.Q., Zhang, Y.Q., et al. (2004) Micrometastases of Solitary Hepatoeellular Carcinoma and Appropriate Resection Margin. World Journal of Surgery, 28, 376-381. http://dx.doi.org/10.1007/s00268-003-7308-x
- 10. 石明, 张昌卿, 冯凯涛, 等. 肝细胞癌周围微转移分布的研究[J]. 中华肿瘤杂志, 2002, 24(3): 257-260.
- 11. 徐彬, 李强, 付丽, 等. 肝细胞癌肝内微转移的研究[J]. 中华普通外科杂志, 2006, 21(8): 577-579.
- 12. Nishikawa, H., Inuzuka, T., Takeda, H., et al. (2011) A Case of Advanced Hepatocellular Carcinoma with Portal Vein Tumor Thrombus Refractory to Epirubicin That Showed Marked Decrease in Tumor Markers after Transcatheter Arterial Infusion with Miriplatin. Case Reports in Oncology, 4, 327-335. http://dx.doi.org/10.1159/000330106
- 13. Lu, X.Y., Xi, T., Lou, W.Y., et al. (2010) Palhobiological Fealures of Small Hapatocallalar Cacinoma: Correlation between Tumor Size and Biological Behavior. Journal of Cancer Research and Clinical Oncology, 137, 567-575
- 14. Uka, K., Aikata, T., Karikomi, M., et al. (2007) Clinical Features and Prognosis of Patients with Extrahepatic mEtastases from Hepatocellular Carcinoma. World Journal of Gastroenterology, 19, 414-420.
- 15. Toyoda, H., Fukuda, Y., Koyama, Y., Koyama, Y., et al. (1996) Case Report: Multiple Systemic Lymph Node Metastases from a Small Hepatocellular Carcinoma. Journal of Gastroenterology and Hepatology, 11, 959-962. http://dx.doi.org/10.1111/j.1440-1746.1996.tb01854.x
- 16. Kojiro, M. (1997) Pathology. In: Livraghi, T., Makuuchi, M. and Buscarini, L., Eds., Diagnosis and Treatment of Hepatocellular Carcinoma, Greenwich Medical Media, London, 35.
- 17. 杨华, 郑勤. 肝癌放射治疗进展[J]. 东南大学学报(医学版), 2012, 31(4): 488-491.
- 18. Zheng, Z.S., Zou, Y.H., Rao, J., et al. (2005) 460 Cases of Radiotherapy for Primary Massive Liver Cancer. Journal of US-China Medical Science, 2, 16-21.
- 19. 郑作深. 放射治疗有可能成为治疗肝癌复发的新思路[J]. 世界肿瘤杂志, 2013, 3(3): 17-23.
- 20. 郑作深. 巨大肝癌术前放疗5例长期随访的启示[J]. 国际病例报告, 2014, 1(2): 5-11.
- 21. 郑作深, 吴庭安, 饶建, 等. 关于“移动条野放疗无论从理论还是实践, 都存在严重缺陷”的商榷[J]. 亚洲肿瘤科病例研究, 2014, 3(3): 25-36.
- 22. Intemational Commission on Radiation Units and Measurements (1999) ICRU Report 62: Prescribing, Recording, and Reporting Photonbeam Therapy (Supplement to ICRU Report 50). 4-13.
- 23. 于金明, 袁双虎. 肿瘤放疗的发展与挑战[J]. 山东大学学报(医学版), 2011, 49(10): 48-50.
- 24. 贾明. 三维适形放疗治疗原发性小肝癌的临床研究[J]. 中国医药指南, 2013, 11(12): 182-183.
- 25. Imada, H., Kato, H., Yasuda, S., et al. (2010) Comparison of Efficacy and Toxicity of Short Course Carbon Ion Radiotherapy for Heap to Cellular Carcinoma Depending on Their Proximity to the Porta Hepatis. Radiotherapy & Oncology, 96, 231-235. http://dx.doi.org/10.1016/j.radonc.2010.05.019
- 26. 肖平, 贾少微. 中国质子, 重离子放疗装置建设现状[J]. 罕少疾病杂志, 2014, 21(2): 1-5.
- 27. 秦颖. 上海质子重离子医院目前每个疗程平均费用227.8万元[N]. 解放日报, 2015-5-9.
- 28. 蒋国梁. 质子重离子放疗——一把“利刃”向肿瘤[J]. 抗癌, 2015, 28(2): 1-3.
- 29. 蒋国梁. 质子重离子放疗的放射生物学[C]//复旦大学附属肿瘤医院. 第七届上海国际放射肿瘤学会议论文集. 上海, 2013.
- 30. 蒋国梁. 肿瘤的质子和重离子放疗[C]//中华医学会, 中国抗癌协会. 中华医学会放射肿瘤治疗分会六届二次会议论文集. 济南, 2009.
- 31. 蒋国梁. 肿瘤的质子和重离子放疗[C]//中华肿瘤杂志编辑部. 第二届肿瘤多学科综合诊治新概念学术研讨会论文集. 三亚, 2011..
- 32. 蒋国梁. 肿瘤的质子和重离子放疗[C]//中华医学会. 中华医学会第九次全国放射肿瘤学学术会议论文集. 北京, 2012.
- 33. 蒋国梁. 肿瘤的质子和重离子放疗[C]//中华医学会肿瘤学分会, 中国抗癌协会. 第五届中国肿瘤学术大会暨第七届海峡两岸肿瘤学术会议、国际肿瘤细胞与基因治疗学术会议、第二届中日肿瘤介入治疗学术会议论文集. 石家庄, 2008.
- 34. 中华医学会器官移植学分会中华医学会外科学分会移植学组, 中国医师协会器官移植医师分会. 中国肝癌肝移植临床实践指南[J]. 中华外科杂志, 2014, 52(10): 721-725.
- 35. 何勇勇, 石洁, 程树群. 原发性肝癌门静脉癌栓患者合并肝门淋巴结转移手术疗效的比较研究[J]. 中国微创外科杂志, 2012, 12(8): 687-689.
- 36. 黄洁夫. 肝移植治疗原发性肝癌的现状及前景[J]. 肝胆外科杂志, 1999, 7(3): 163-165.
- 37. 曾昭冲. 消融治疗后复发肝癌及肝外转移的放射治疗[J]. 中华医学杂志, 2015, 95(27): 2164-2166.