Asian Case Reports in Oncology
Vol.05 No.01(2016), Article ID:18148,12
pages
10.12677/ACRPO.2016.51002
Significance of Peripheral Blood Neutrophil to Lymphocyte Ratio in the Prognosis of Breast Cancer
Zhenzhen Wang1, Yanhong Yang2*, Bo Feng1, Yue Feng1, Qianying Li1, Xiaoyu Wang1
1Chengde Medical College Graduate School, Chengde Hebei
2The First Hospital of Qinhuangdao, Qinhuangdao Hebei

Received: Jul. 7th, 2016; accepted: Jul. 26th, 2016; published: Jul. 29th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Objective: We performed this study of breast cancer patients to evaluate the prognostic value of the NLR. Methods: We retrospectively analyzed 263 cases of breast cancer patients treated in The First Hospital of Qinhuangdao after pathology diagnosis from January 2009 to January 2011. According to the ROC curve, while taking into account the sensitivity and specificity, we selected NLR = 2.08 as the cut-off value, and divided the patients into low NLR group (NLR < 2.08) and high NLR group (NLR > 2.08). Statistical analysis was performed with the statistical package for the social sciences (SPSS) software package version 19.0. We explore the relationship between NLR and clinical factors on prognosis by calculating 5-year survival rate. Results: 1) In term of age, history of cancer and menopausal status, there was no statistically significant difference. NLR difference between lower and upper groups has statistics significance (P < 0.05) on leukocyte counts before treatment. 2) In this study, 5-year survival rate of 263 cases of breast cancer was 80.23%. In NLR > 2.08 group, it was 65.00%; in NLR < 2.08 group, it was 89.57%. The difference was statistically significant (P < 0.01). 3) The high and low NLR groups have no statistics significance in Luminal B subtype and Her-2 subtype, while it has statistics significance (P < 0.05) in Luminal A subtype and triple-negative subtype. 4) NLR and molecular subtype were identified as independent prognostic factors for survival (P < 0.05). Conclusion: Prognosis in patients with NLR > 2.08 is worse than that in patients with NLR < 2.08. NLR, clinical stages and the molecular subtype are independent factors which influence the prognosis of breast cancer patients.
Keywords:Breast Cancer, Neutrophil, Lymphocyte, Neutrophil-to-Lymphocyte Ratio (NLR), Molecular Subtype, Prognosis

外周血中性粒细胞与淋巴细胞比值在乳腺癌 各分子分型预后中的意义
王真真1,杨雁鸿2*,冯博1,冯悦1,李倩影1,王小玉1
1承德医学院研究生院,河北 承德
2秦皇岛市第一医院,河北 秦皇岛

收稿日期:2016年7月7日;录用日期:2016年7月26日;发布日期:2016年7月29日

摘 要
目的:本研究旨在探讨NLR与乳腺癌各分子分型预后的关系。方法:回顾性研究秦皇岛市第一医院2009年1月至2011年1月经过病理学确诊的初治乳腺癌患者263例,通过ROC曲线,兼顾敏感性及特异性确定NLR截点(NLR = 2.08),分为高NLR组(NLR > 2.08)和低NLR组(NLR < 2.08)。所有数据采用SPSS19.0进行统计学分析,通过计算5年生存率,讨论NLR和乳腺癌各分子分型预后的关系。结果:1) 对年龄、肿瘤史、月经状态等因素进行比较,差异无统计学意义。在治疗前白细胞计数方面比较,差异有统计学意义(P < 0.05)。2) 本研究中263例乳腺癌患者5年生存率80.23%,其中NLR > 2.08组65.00%,NLR < 2.08组89.57%,差异具有统计学意义(P < 0.01)。3) Luminal B型、Her-2过表达型中高NLR和低NLR组差异无统计学意义;Luminal A型、三阴型中高NLR和低NLR组差异均有统计学意义(P < 0.05)。4) NLR值和分子亚型是影响乳腺癌患者预后的独立危险因素(P < 0.05)。结论:NLR > 2.08乳腺癌患者较NLR < 2.08患者预后差。NLR值、临床分期和分子亚型是影响乳腺癌患者预后的独立危险因素。
关键词 :乳腺癌,中性粒细胞,淋巴细胞,中性粒细胞/淋巴细胞比值(NLR),分子分型,预后

1. 引言
虽然医学诊治技术的日益发展,自20世纪90年代乳腺癌患者的死亡率下降,但乳腺癌仍是全球女性恶性肿瘤死亡的主要原因 [1] 。目前影响乳腺癌患者预后以及制定合理治疗方案的因素包括患者年龄、肿瘤大小、淋巴结转移、肿瘤分期、病理类型、雌激素受体、人表皮生长因子受体2 (Her-2)、Ki-67、分子亚型等 [2] [3] 。大量研究结果表明,机体自身免疫状态的改变及炎症反应的发生与肿瘤形成、转移及预后关系密切 [4] [5] 。正常细胞的内环境中有些炎性介质(如趋化因子、细胞因子、生长因子等)相互作用可以改变其稳定性,最终通过炎症级联反应导致细胞出现异常增殖。又因细胞修复程序被破坏,导致正常细胞发生癌变,同时炎症介质造成DNA氧化损伤、DNA突变,致使血管通透性增加,对于肿瘤的生长、血管生成及远处转移起到促进作用。目前一些系统性炎症反应状况的指标,包括C-反应蛋白和白蛋白,以及基于这些指标的格拉斯哥预后评分等已应用于评估患者的预后 [6] 。国内外多项研究结果已经证实中性粒细胞与淋巴细胞比值(NLR)可以作为炎症反应评价的指标,并且与多种肿瘤的预后密切相关,如肺癌 [7] 、结肠癌 [8] 、胃癌 [9] 、肝癌 [10] 、胰腺癌 [11] 、食管癌 [12] 。不过,国内关于该比值在乳腺癌临床预后相关性的报道较少。本课题拟对秦皇岛地区乳腺癌患者治疗前外周血中粒细胞和淋巴细胞的比值与临床预后的关系进行研究,以期为乳腺癌的诊疗提供参考依据。
2. 材料与方法
2.1. 研究对象
回顾性分析2009年1月至2011年1月期间就诊于秦皇岛市第一医院初治的符合纳入标准的263例乳腺癌患者。所有患者具有完整的临床病例资料、病理资料以及治疗前血常规结果,同时完成整个研究的随访。
2.1.1. 纳入标准
1) 所有患者均为经秦皇岛市第一医院初治的乳腺癌,采集标本前均未经历化疗、放疗以及内分泌治疗等;
2) 术后病理或穿刺病理诊断为乳腺癌;
3) 随访满5年或随访期间因本病死亡;
4) 所有患者血液学及肝肾功能正常,且无免疫系统疾病及严重的内科疾病等。
2.1.2. 排除标准:
1) 随访资料缺失;
2) 合并有血液系统疾病及其他影响血常规结果的疾病等;
3) 缺少治疗前一周内的完整血常规结果。
2.2. 标本采集
治疗前一周内采集患者外周静脉血,采用美国BECKEMan-750血常规分析仪记录患者外周血结果,包括白细胞计数、中性粒细胞计数、淋巴细胞计数、单核细胞计数,并计算中性粒细胞计数与淋巴细胞计数比值。
2.3. 资料采集
收集患者的基本情况、血常规结果、肿瘤分子分型以及治疗方法。基本情况包括患者年龄、身高、体重、体重指数(BMI)、肿瘤史、是否患有心脑血管病、月经状态;治疗前的血常规结果,包括白细胞计数、中性粒细胞计数、淋巴细胞计数、单核细胞计数;肿瘤分子分型(Luminal A型、Luminal B型、Her-2过表达型、三阴型)。
2.4. 随访
采用电话或者门诊随访,患者术后2年内每3个月随访一次,而后每6个月随访一次。复发以影像学资料(B超、CT、MRI)发现病灶为准,末次随访时间截止至2016年1月。
2.5. 数据分析
采用SPSS19.0软件进行统计学分析。建立受试者工作特征曲线(ROC曲线),确定NLR的临界值。计数资料的比较采用卡方检验或者Fisher确切概率法。分析描绘生存曲线采用Kaplan-Meier法,比较不同NLR组之间的生存差异采用Log-rank检验,并采用Cox比例风险模型对影响患者生存的因素进行单因素和多因素分析。
3. 结果
3.1. 研究对象的一般特征(表1)
回顾性研究乳腺癌患者263例,均为女性,平均年龄为52.48 ± 9.85岁,年龄 ≤ 35岁共8例,年龄 >
Table 1. Patient characteristics
表1. 患者特征
35岁共255例。分子分型Luminal A型70例,Luminal B型86例,Her-2过表达型50例,三阴型37例。所有乳腺癌患者白细胞计数中位数为5.4 × 109/L,中性粒细胞计数中位数为3.16 × 109/L,淋巴细胞计数中位数为1.72 × 109/L。NLR的均数为2.03 ± 1.06,中位数为1.79。
3.2. NLR最佳截点的确定(图1)
根据治疗前患者的NLR值评估生存情况的ROC曲线,曲线下面积为0.712,95%可信区间为0.635~0.789,当NLR = 2.08,约登指数最大为0.365,敏感度0.673,特异度0.692。
3.3. NLR与乳腺癌的基本临床特征关系(表2)
根据ROC曲线结果,分为低NLR组(NLR < 2.08)和高NLR组(NLR > 2.08),其中低NLR组共163例,高NLR组共100例。分析比较两组患者临床基本特征,结果显示治疗前白细胞计数与NLR存在相关性(P < 0.05),而不同年龄段(P = 0.057)及分子亚型(P = 0.232)与NLR均无显著差异。
Table 2. Relationship among clinicopathological features and NLR in 263 cases of breast cancer
表2. 263例乳腺癌临床病理特征和NLR之间的关系
3.4. NLR与乳腺癌患者的总体生存关系(图2)
描绘两组患者的生存曲线,并对两组进行生存分析。263例乳腺癌患者5年生存率80.23%,其中NLR > 2.08组65.00%,NLR < 2.08组89.57%,差异具有统计学意义(P < 0.01),高NLR组较低NLR组的患者预后差。
3.5. NLR与乳腺癌不同分子分型患者的生存关系
3.5.1. Luminal A型高NLR和低NLR生存比较(图3)
Luminal A型乳腺癌患者共70例,5年生存率80.00%,其中NLR < 2.08组5年生存率89.7%,NLR > 2.08组5年生存率67.7%,差异有统计学意义(P < 0.05)。

Figure 1. Identification of the best cut-off value of pretreatment NLR with ROC curve
图1. 根据治疗前患者的NLR值评估生存情况的ROC曲线

Figure 2. Overall survival curves stratified by NLR
图2. NLR与乳腺癌患者的总体生存关系比较
3.5.2. Luminal B型高NLR和低NLR生存比较(图4)
Luminal B型乳腺癌患者共86例,5年生存率88.37%,其中NLR < 2.08组5年生存率92.31%,NLR > 2.08组5年生存率82.35%,差异无统计学意义(P = 0.145)。
3.5.3. Her-2过表达型高NLR和低NLR生存比较(图5)
Her-2过表达型乳腺癌患者共50例,5年生存率78.57%,其中NLR < 2.08组5年生存率87.50%,NLR > 2.08组5年生存率71.05%,差异无统计学意义(P = 0.078)。
3.5.4. 三阴型高NLR和低NLR组比较(图6)
三阴型乳腺癌患者共37例,5年生存率54.05%,其中NLR < 2.08组5年生存率60.71%,NLR > 2.08组5年生存率33.33%,差异具有统计学意义(P < 0.05)。
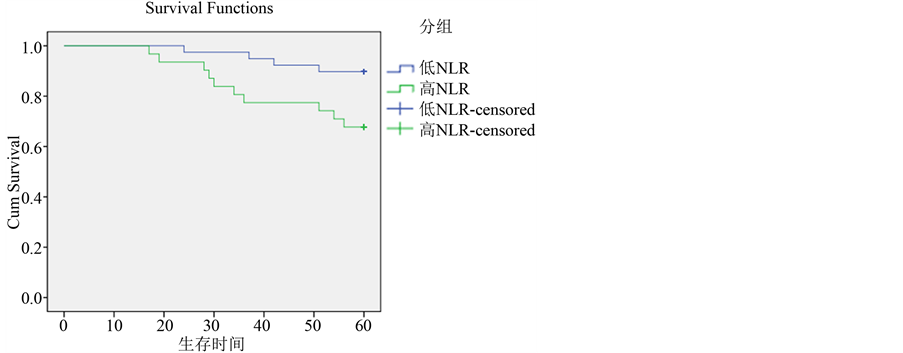
Figure 3. Overall survival curves stratified by NLR of Luminal A subtypes
图3. NLR与乳腺癌不同分子分型患者的生存关系比较
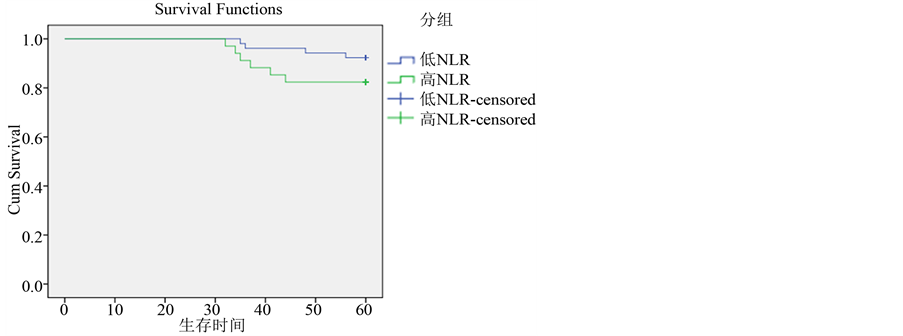
Figure 4. Overall survival curves stratified by NLR of Luminal B subtypes
图4. Luminal B型与NLR生存关系比较
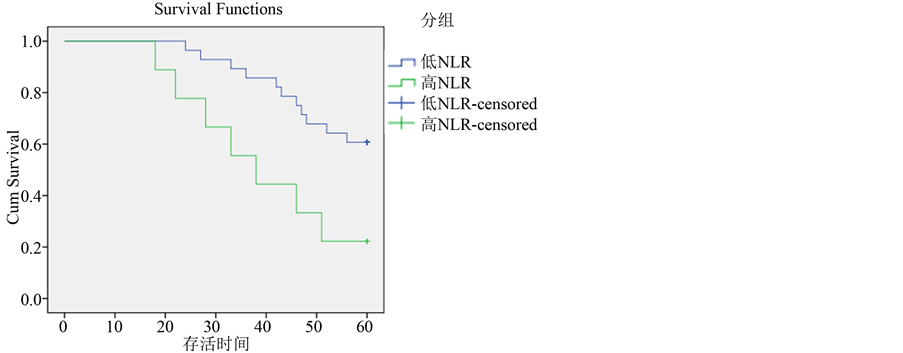
Figure 5. Overall survival curves stratified by NLR of Her-2 enriched subtypes
图5. Her-2过表达型与NLR生存关系比较
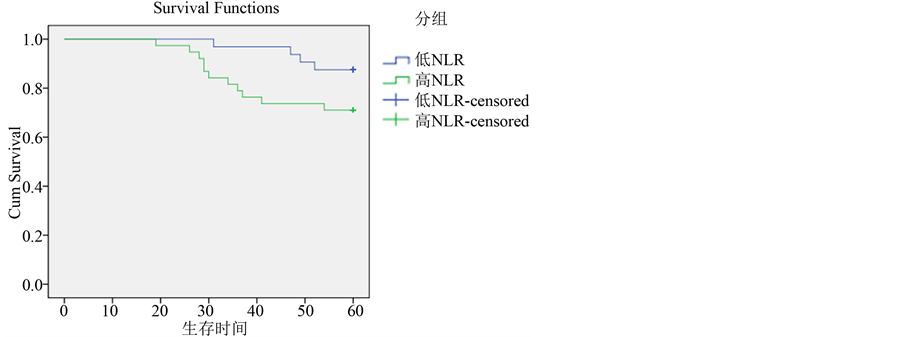
Figure 6. Overall survival curves stratified by NLR of triple-negative subtypes
图6. 三阴型与NLR生存关系比较
4. 讨论
虽然早期乳腺癌可以通过超声、钼靶、核磁共振等检测手段检出,并且可以采取手术、放化疗、内分泌治疗、靶向治疗等综合治疗改善患者生存情况,但影响乳腺癌患者预后的生存指标仍在不断探寻中,目前国内外学者发现在肿瘤的生长、浸润及转移等过程中,肿瘤微环境的组成成分对于机体正常组织的破坏起着不可忽视的作用,因此本研究拟探讨肿瘤微环境与肿瘤预后的相关性。
在本研究中,我们通过回顾性分析263例初治乳腺癌患者,从机体慢性炎症反应和肿瘤免疫反应的角度出发,分析中性粒细胞与淋巴细胞比值对乳腺癌患者预后的影响,结果发现治疗前外周血中性粒细胞与淋巴细胞比值和乳腺癌患者预后密切相关,其中高比值患者较低比值患者预后差,故而该比值可以作为乳腺癌患者的独立预后因素。这与国内外其他研究结果一致。Noh等 [13] 回顾性分析442例乳腺癌患者,外周血高水平NLR (NLR ≥ 2.5)与患者较低的疾病特异性生存率之间具有显著相关性。Azab B等 [14] 通过观察316例乳腺癌患者短期和长期生存情况,结果发现术前血NLR > 3.3将导致较高的1年、5年死亡率,故认为NLR水平(>3.3)是乳腺癌患者短期和远期死亡率的独立预测因子。Forget P [15] 对720例接受保乳手术的乳腺癌患者外周血中性粒细胞/淋巴细胞水平进行监测,结果显示,术前中性粒细胞/淋巴细胞水平升高(NLR > 3.3)的患者,其无病生存期较短、总体生存率较低。国内学者王腾等 [16] 通过统计273 例乳腺癌患者术前中性粒细胞/淋巴细胞和血小板/淋巴细胞与生存情况,分析并发现术前中性粒细胞/淋巴细胞是影响乳腺癌患者总体生存的一项独立预后因素。钱鹏 [17] 等对82例乳腺癌患者进行了回顾性分析,认为NLR检测有助于乳腺癌的早期诊断,高NLR可能是影响乳腺癌预后的危险因素。
中性粒细胞/淋巴细胞是绝对值计数,稳定性好,反映出中性粒细胞和淋巴细胞在机体中此消彼长的变化,而影响白细胞计数的生理、病理等因素均不对这一比值造成干扰,因而作为肿瘤患者预后的生物学指标优于其他白细胞参数(如中性粒细胞、淋巴细胞和白细胞计数)。本研究通过绘制ROC曲线,兼顾敏感性及特异性,确定了预测乳腺癌患者生存的最佳截点为2.08,与Nakano [18] 等研究存在差异,考虑可能因为种族差异、地理区域不同而导致NLR临界值的不同。根据最佳截点将患者分为高NLR组和低NLR组,高NLR者的生存时间短于低NLR者。
目前大量研究已证实NLR与肿瘤患者预后相关,可能NLR代表了肿瘤患者体内两个相对的炎症和免疫途径 [14] ,其准确的作用机制尚不明确。肿瘤通过募集的细胞(如骨髓源细胞)以及肿瘤细胞、间质细胞促进其生长、浸润及转移。在肿瘤进展过程中,肿瘤细胞及其所依赖的微环境发生着动态变化,因此导致一些行为特征发生了重要改变(如血管生成开关) [19] 。炎症包括由趋化因子引起的系统性反应,如中性粒细胞的升高、淋巴细胞的降低。自19世纪Rudolf Virchow发现白细胞存在肿瘤组织中,提出肿瘤起源于慢性炎症这一假说 [20] ,为炎症在肿瘤发生过程中的重要性提供了依据。炎性细胞在肿瘤细胞分泌趋化因子的吸引下,迁移至肿瘤细胞周围,随后其分泌细胞因子产生癌前细胞的肿瘤表型,这些细胞因子可以使细胞周期进程加快,更有利于肿瘤血管生成以及肿瘤细胞的生存和增殖;同时,炎症微环境也通过其他方式促进肿瘤生长、进展和转移,如破坏免疫反应、抑制细胞凋亡、改变肿瘤细胞对化疗药物的反应 [21] 。
炎症微环境中,在肿瘤细胞分泌的趋化因子作用下,循环中的中性粒细胞与血管内皮细胞之间发生粘附,穿过血管内皮细胞,迁移到内皮下层及血管外组织 [22] 。趋化因子进入血液循环,与中性粒细胞表面表达的G蛋白偶联受体的趋化因子受体-1(CXCR-l)和趋化因子受体-2(CXCR-2)结合,募集中性粒细胞迁移到肿瘤区域发挥趋化作用 [23] [24] 。中性粒细胞浸入至肿瘤微环境,使肿瘤组织内血管生成,肿瘤细胞增殖、迁移、侵袭、转移,甚至出现免疫逃逸 [23] 。第一,中性粒细胞可促进肿瘤细胞增殖。中性粒细胞内适量的碱性磷酸酶能够发挥抗肿瘤作用,但中性粒细胞释放过量碱性磷酸酶会引起组织的损伤,进而破坏肿瘤周围组织,有利于肿瘤扩散增殖;同时,过量释放的碱性磷酸酶降解机体内免疫球蛋白、补体和受体,阻断肿瘤坏死因子(TNF)介导的细胞凋亡途径,促进肿瘤细胞增殖。第二,中性粒细胞促进肿瘤细胞转移。中性粒细胞还可以释放中性粒细胞弹性蛋白酶(NE)、组织蛋白酶G、基质金属蛋白酶-8(MMP-8)等,这些物质通过降解细胞外基质(ECM)促进肿瘤细胞迁移。Spicer等 [25] 研究发现中性粒细胞通过Mac-1/ICAM-1使浸入循环中的肿瘤细胞发生粘附,从而使肿瘤细胞转移范围增大。肿瘤组织释放的白介素-8(IL-8)与中性粒细胞结合后转化为激活状态,通过酶促反应裂解细胞外基质,中性粒细胞随着IL-8的浓度梯度浸入肿瘤组织内,并重构细胞外基质。第三,中性粒细胞促进肿瘤细胞可促进肿瘤血管生成。中性粒细胞可以释放促血管生成因子,如基质金属蛋白酶-9(MMP-9)和血管内皮生长因子(VEGF),促进肿瘤组织内血管生成。Queen等 [26] 发现肿瘤来源的粒细胞巨噬细胞集落刺激因子(GM-CSF)刺激中性粒细胞释放抑癌蛋白M,通过进一步研究,将抑癌蛋白M与乳腺癌细胞共培养,发现其可诱导VEGF生成,使肿瘤细胞更易分离,侵袭能力增强。最后,也有研究表明中性粒细胞在肿瘤的发生、发展中具有免疫抑制作用 [27] 。
在我们的研究中,结果显示NLR及分子分型是乳腺癌的独立预后因素,我们对不同分子分型患者的高NLR和低NLR的生存情况做了进一步的研究,结果显示Luminal A型、三阴型中高NLR和低NLR组的生存差异具有统计学意义。对于不同分子分型临床特征及预后,国内外学者研究表明 [28] [29] ,Luminal A型是乳腺癌中最为常见的分子亚型,患者临床分期较早,复发率较低,预后较好,对化疗不敏感;Luminal B型患者发病年龄较高,且化疗敏感性易变,临床分期无明显集中趋势。总之,Luminal型患者总体的预后较好,其可以通过治疗反应敏感的内分泌治疗(包括选择性雌激素受体调节剂和芳香化酶抑制剂)来降低激素受体阳性患者肿瘤复发率及死亡率。Her-2过表达型乳腺癌患者确诊时多为晚期,腋窝淋巴结转移率高,恶性程度高,大多对化疗和内分泌治疗效果欠佳,预后差。三阴型乳腺癌好发于年轻、晚期和未绝经女性患者,该类型乳腺癌易出现复发转移,对化疗较为敏感。在不同分子分型比较中,LuminalA型、三阴型乳腺癌患者高NLR组较低NLR组预后差,而其他类型在高NLR与低NLR之间并无显著差异。虽然Her-2过表达型乳腺癌较Luminal A型乳腺癌预后差,但是在本研究中并未得出Her-2过表达型乳腺癌与NLR存在相关性,考虑是Luminal A型乳腺癌类型更易受微环境影响,Place等 [30] 在研究ER阳性乳腺癌与肿瘤微环境中对以上猜测给予了很好的论证。同时,一项关于内分泌治疗及其对乳腺癌发病率影响的前瞻性研究中,同样发现Luminal A型乳腺癌较其他类型乳腺癌更易受微环境影响 [31] - [34] 。三阴型乳腺癌是预后较差的乳腺癌类型,也是目前的研究热点。三阴型乳腺癌可能更易受到全身慢性炎症反应的影响。Retsky [35] 等研究表明,围手术期使用非甾体类抗炎药酮洛酸可降低早期乳腺癌患者复发,尤其是在三阴型乳腺癌患者中。与激素受体阳性乳腺癌相比,肿瘤浸润淋巴细胞(TILs)在三阴型乳腺癌中更易常见,并可作为三阴型乳腺癌患者独立预后因素 [36] [37] 。更进一步的研究表明,肿瘤浸润淋巴细胞越多,三阴型乳腺癌患者预后越好 [38] [39] 。Engel等 [40] 人发现三阴型乳腺癌细胞与ER阳性乳腺癌细胞相比,更能显著刺激自然杀伤细胞进行免疫反应,发挥免疫抑制作用的Tregs细胞(包括CD4 + T细胞,CD8 + T细胞,以及Foxp3 + 调节T细胞)在三阴型乳腺癌中增多。
目前对于高中性粒细胞/淋巴细胞比值可以预测肿瘤患者总体预后情况已经形成了共识。高NLR的患者处于一个相对高中性粒细胞和低淋巴细胞的环境中,导致对肿瘤的炎症反应及免疫调节的不平衡,这样可能形成一种肿瘤不断增殖并转移的适合微环境。相对减少的淋巴细胞可能导致机体抗肿瘤免疫降低,另一方面,中性粒细胞能够抑制肿瘤坏死因子-α的生成,可分泌产生促进肿瘤相关血管生成的血管内皮细胞生长因子(VEGF),从而促进肿瘤的进展及转移。不仅如此,实体瘤细胞还可以分泌能够活化浸润的中性粒细胞的可溶性因子,该因子能够使中性粒细胞生存能力增强,这无疑又促进了肿瘤的转移和复发。
文章引用
王真真,杨雁鸿,冯 博,冯 悦,李倩影,王小玉. 外周血中性粒细胞与淋巴细胞比值在乳腺癌各分子分型预后中的意义
Significance of Peripheral Blood Neutrophil to Lymphocyte Ratio in the Prognosis of Breast Cancer[J]. 亚洲肿瘤科病例研究, 2016, 05(01): 14-25. http://dx.doi.org/10.12677/ACRPO.2016.51002
参考文献 (References)
- 1. Jemal, A., Bray, F., Center, M.M., et al. (2011) Global Cancer Statistics. CA: A Cancer Journal for Clinicians, 61, 69- 90. http://dx.doi.org/10.3322/caac.20107
- 2. Schnitt, S.J. (2010) Classification and Prognosis of Invasive Breast Cancer: From Morphology to Molecular Taxonomy. Modern Pathology, 23, S60-S64. http://dx.doi.org/10.1038/modpathol.2010.33
- 3. Rakha, E.A. and Ellis, I.O. (2011) Modern Classification of Breast Cancer: Should We Stick with Morphology or Convert to Molecular Profile Characteristics. Advances in Anatomic Pathology, 18, 255-267. http://dx.doi.org/10.1097/PAP.0b013e318220f5d1
- 4. Clark, E.J., Connor, S., Taylor, M.A., et al. (2007) Preoperative Lymphocyte Count as a Prognostic Factor in Resected Pancreatic Ductal Adenocarcinoma. HPB (Oxford), 9, 456-460. http://dx.doi.org/10.1080/13651820701774891
- 5. Fridlender, Z.G., Sun, J., Kim, S., et al. (2009) Polarization of Tu-mor-Associated Neutrophil Phenotype by TGF-Beta: “N1” versus “N2” TAN. Cancer Cell, 16, 183-194. http://dx.doi.org/10.1016/j.ccr.2009.06.017
- 6. 郭鹏, 叶颖江, 尹慕军, 等. 格拉斯哥预后评分可用作结肠癌预后的指标[J]. 中华普通外科杂志, 2011, 26(7): 557-561.
- 7. Sarraf, K.M., Belcher, E., Raevsky, E., et al. (2009) Neutrophil/Lymphocyte Ratio and Its Association with Survival after Complete Resection in Non-Small Cell Lung Cancer. The Journal of Thoracic and Cardiovascular Surgery, 137, 425-428. http://dx.doi.org/10.1016/j.jtcvs.2008.05.046
- 8. Urrejola, G.I., Bambs, C.E., Espinoza, M.A., et al. (2013) An Elevated Neutrophil/Lymphocyte Ratio Is Associated with Poor Prognosis in Stage II Resected Colon Cancer. Revista Médica de Chile, 141, 602-608. http://dx.doi.org/10.4067/S0034-98872013000500008
- 9. Lee, S., Oh, S.Y., Kim, S.H., et al. (2013) Prognostic Significance of Neutrophil Lymphocyte Ratio and Platelet Lymphocyte Ratio in Advanced Gastric Cancer Patients Treated with FOLFOX Chemotherapy. BMC Cancer, 13, 350. http://dx.doi.org/10.1186/1471-2407-13-350
- 10. Lai, Q., Castro Santa, E., Rico Juri, J.M., et al. (2014) Neutrophil and Platelet-to-Lymphocyte Ratio as New Predictors of Dropout and Recurrence after Liver Transplantation for Hepatocellular Cancer. Transplant International, 27, 32-41. http://dx.doi.org/10.1111/tri.12191
- 11. Stotz, M., Gerger, A., Eisner, F., et al. (2013) Increased Neutrophil-Lymphocyte Ratio Is A Poor Prognostic Factor in Patients with Primary Operable and Inoperable Pancreatic Cancer. British Journal of Cancer, 109, 416-421. http://dx.doi.org/10.1038/bjc.2013.332
- 12. Feng, J.F., Huang, Y. and Chen, Q.X. (2014) Preoperative Platelet Lymphocyte Ratio (PLR) Is Superior to Neutrophil Lymphocyte Ratio (NLR) as a Predictive Factor in Patients with Esophageal Squamous Cell Carcinoma. World Journal of Surgical Oncology, 12, 58. http://dx.doi.org/10.1186/1477-7819-12-58
- 13. Noh, H., Eomm, M., Han, A., et al. (2013) Usefulness of Pretreatment Neutrophil to Lymphocyte Ratio in Predicting Disease-Specific Survival in Breast Cancer Patients. Journal of Breast Cancer, 16, 55-9. http://dx.doi.org/10.4048/jbc.2013.16.1.55
- 14. Azab, B., Bhatt, V.R., Phookan, J., et al. (2012) Usefulness of the Neutro-phil-to-Lymphocyte Ratio in Predicting Short- and Long-Term Mortality in Breast Cancer Patients. Annals of Surgical Oncology, 19, 17-224. http://dx.doi.org/10.1245/s10434-011-1814-0
- 15. Forget, P., Bentin, C., Machiels, J.P., et al. (2014) Intraoperative Use of Ketorolac or Diclofenac Is Associated with Improved Disease-Free Survival and Overall Survival in Conservative Breast Cancer. Surgery, 113, 82-87.
- 16. 王腾, 常树建, 沈娣, 等. 血常规参数对乳腺癌预后的判断价值[J]. 中华临床医师杂志(电子版), 2012, 6(17): 5100-5104. http://dx.doi.org/10.1093/bja/aet464
- 17. 钱鹏, 恽华忠, 朱玲, 等. 炎性指标在乳腺癌术前诊断和预后评估中的价值[J]. 检验医学与临床, 2015, 12(24): 3765-3767.
- 18. Nakano, K., Hosoda, M., Yamamoto, M. and Yamashita, H. (2014) Prognostic Significance of Pretreatment Neutrophil-Lymphocyte ratio in Japanese Patients with Breast Cancer. Anticancer Research, 34, 3819-3824.
- 19. Baeriswyl, V. and Christofori, G. (2009) The Angiogenic Switch in Carcinogenesis. Seminars in Cancer Biology, 19, 329-337. http://dx.doi.org/10.1016/j.semcancer.2009.05.003
- 20. Balkwill, F. and Mantovani, A. (2001) Inflammation and Cancer: Back to Virchow? Lancet, 357, 539-545. http://dx.doi.org/10.1016/S0140-6736(00)04046-0
- 21. 王宁舫, 洪群英. 肺癌转移的炎症微环境机制研究进展[J]. 国际呼吸杂志, 2014, 34(24): 1905-1908.
- 22. De Larco, J.E., Wuertz, B.R. and Furcht, L.T. (2004) The Potential Role of Neutrophils in Promoting the Metastatic Phenotype of Tumors Releasing Interleuking. Clinical Cancer Research, 10, 4895-4900. http://dx.doi.org/10.1158/1078-0432.CCR-03-0760
- 23. Dumitru, C.A., Lang, S. and Brandau, S. (2013) Modulmion of Neutrophil Granulocytes in the Tumor Microenvironment, Mechanisms and Consequences for Tumor Progression. Seminars in Cancer Biology, 23, 141-148. http://dx.doi.org/10.1016/j.semcancer.2013.02.005
- 24. Tazzyman, S., Niaz, H. and Murdoch, C. (2013) Neutrophil-Mediated Tumour Angiogenesis, Subversion of Immune Responses to Promote Tumour Growth. Seminars in Cancer Biology, 23, 149-158. http://dx.doi.org/10.1016/j.semcancer.2013.02.003
- 25. Spicer, J.D., McDonald, B., Cools-Lartigue, J.J., et al. (2012) Neutrophils Promote Liver Metastasis via Mac-L-Med- iated Interactions with Circulating Tumor Cells. Cancer Research, 72, 3919-3927. http://dx.doi.org/10.1158/0008-5472.CAN-11-2393
- 26. Queen, M.M. and Ryan, R.E. (2005) Breast Cancer Cells Stimulate Neutrophils to Produce Oncostatin M, Potential Implications for Tumor Progression. Cancer Research, 65, 8896-8904. http://dx.doi.org/10.1158/0008-5472.CAN-05-1734
- 27. Dumitru, C.A., Moses, K., Trellakis, S. Lang, S. and Brandau, S. (2012) Neutrophils and Granulocytic Myeloid-Derived Suppressor Cells, Immtmophenotyping, Cell Biology and Clinical Relevance in Human Oncology. Cancer Immunology, Immunotherapy, 61, 1155-1167. http://dx.doi.org/10.1007/s00262-012-1294-5
- 28. Zhang, H.M., Zhang, B.N., Xuan, L.X. and Zhao, P. (2009) Clinical Characteristics and Survival in the Operable Breast Cancer Patients with Different Molecular Subtypes. Chinese Journal of Oncology, 31, 447-451.
- 29. Ihemelandu, C.U., Leffall Jr., L.D., Dewitty, R.L., et al. (2007) Molecular Breast Cancer Subtypes in Premenopausal and Postmenopausal African-American Women, Age-Specific Prevalence and Survival. Journal of Surgical Research, 143, 109-118. http://dx.doi.org/10.1016/j.jss.2007.03.085
- 30. Place, A.E., Jin Huh, S. and Polyak, K. (2011) The Microenvironment in Breast Cancer Progression: Biology and Implications for Treatment. Breast Cancer Research, 13, 227. http://dx.doi.org/10.1186/bcr2912
- 31. Collaborative Group on Hormonal Factors in Breast Cancer (1997) Breast Cancer and Hormone Replacement Therapy, Collaborative Reanalysis of Data from 51 Epidemiological Studies of 52,705 Women with Breast Cancer and 108,411 Women without Breast Cancer. Lancet, 350, 1047-1059. http://dx.doi.org/10.1016/S0140-6736(97)08233-0
- 32. Chlebowski, R.T., Anderson, G.L., Gass, M., et al. (2010) Estrogen plus Progestin and Breast Cancer Incidence and Mortality in Postmenopausal Women. JAMA, 304, 1684-1692. http://dx.doi.org/10.1001/jama.2010.1500
- 33. Feigelson, H.S., Jonas, C.R., Teras, L.R., et al. (2004) Weight Gain, Body Mass Index, Hormone Replacement Therapy, and Postmenopausal Breast Cancer in a Large Prospective Study. Cancer Epidemiology, Biomarkers & Prevention, 13, 220-224. http://dx.doi.org/10.1158/1055-9965.EPI-03-0301
- 34. Adams, S., Gray, R.J., Demaria, S., et al. (2014) Prognostic Value of Tumorinfiltrating Lymphocytes in Triple-Nega- tive Breast Cancers from Two Phase III Randomized Adjuvant Breast Cancer Trials, ECOG 2197 and ECOG 1199. Journal of Clinical Oncology, 32, 2959-2966. http://dx.doi.org/10.1200/JCO.2013.55.0491
- 35. Retsky, M., Rogers, R., Demicheli, R., et al. (2012) NSAID Analgesic Ketorolac Used Perioperatively May Suppress Early Breast Cancer Relapse: Particular Relevance to Triple Negative Subgroup. Breast Cancer Research and Treatment, 134, 881-888. http://dx.doi.org/10.1007/s10549-012-2094-5
- 36. Loi, S., Sirtaine, N., Piette, F., et al. (2013) Prognostic and Predictive Value of Tumor-Infiltrating Lymphocytes in a Phase III Randomized Adjuvant Breast Cancer Trial in Node-Positive Breast Cancer Comparing the Addition of Docetaxel to Doxorubicin with Doxorubicin-Based Chemotherapy: BIG 02-98. Journal of Clinical Oncology, 31, 860-867. http://dx.doi.org/10.1200/JCO.2011.41.0902
- 37. Denkert, C., Loibl, S., Noske, A., et al. (2010) Tumor-Associated Lymphocytes as an Independent Predictor of Response to Neoadjuvant Chemotherapy in Breast Cancer. Journal of Clinical Oncology, 28, 105-113. http://dx.doi.org/10.1200/JCO.2009.23.7370
- 38. Liu, S., Lachapelle, J., Lenung, S., Gao, D., Foulkes, W.D. and Nielsen, T.O. (2012) CD8+ Lymphocyte Infiltration Is an Independent Favorable Prognostic Indicator in Basal-Like Breast Cancer. Breast Cancer Research, 14, R48. http://dx.doi.org/10.1186/bcr3148
- 39. Engel, J.B., Honig, A., Kapp, M., et al. (2014) Mechanisms of Tumor Immune Escape in Triple-Negative Breast Cancers (TNBC) with and without Mutated BRCA 1. Archives of Gynecology and Obstetrics, 289, 141-147. http://dx.doi.org/10.1007/s00404-013-2922-9
- 40. Buyukkaya, E., Karakas, M.F., Karakas, E., et al. (2014) Correlation of Neutrophil to Lymphocyte Ratio with the Presence and Severity of Metabolic Syndrome. Clinical and Applied Thrombosis/Hemostasis, 20, 159-163. http://dx.doi.org/10.1177/1076029612459675
