Advances in Microbiology
Vol.3 No.02(2014), Article
ID:13689,6
pages
DOI:10.12677/AMB.2014.32004
Establishment of Rapid Determining Method for Antibacterial Activity by Microplate Reader
1School of Traditional Chinese Medicine, Guangdong Pharmaceutical University, Guangzhou
2Guangdong Province Key Laboratory for Biotechnology Drug Candidates, School of Biosciences and Biopharmaceutics, Guangdong Pharmaceutical University, Guangzhou
Email: zzxyaoji@126.com, *bio_zhoulin@163.com
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



Received: Apr. 23rd, 2014; revised: May 28th, 2014; accepted: Jun. 4th, 2014
ABSTRACT
To investigate the main factors influencing the antimicrobial activity by microplate reader method for high throughput screen antimicrobial substances, the inhibitory rate of staphylococcus aureus was determinated against four typical antibiotics (kanamycin hydrochloride, terramycin, ampicillin, vancomycin) under different culture conditions. The result showed that the concentration of the drug, culture conditions and culture time will affect the inhibitory rate of Staphylococcus aureus. With bacterial concentrations of 5 × 105 cfu∙mL−1, static culturing, incubation time of 6 h, the inhibitory rate of kanamycin hydrochloride, terramycin, ampicillin, vancomycin was 57.4%, 52.8%, 57.4%, 52.8% respectively with the concentration of 100 μg/mL antibiotic, while the inhibitory rate was 55.6%, 36.1%, 56.5%, 36.1% respectively with the concentration of 10 μg/mL antibiotic, and the inhibitory rate was 46.3%, 10.0%, 52.8%, 50.0% respectively with the concentration of 1 μg/mL antibiotic. The precision and repeatability of the assay were good. There is no significant difference, in the inhibitory rate, between the microplate reader method and tube turbidimetry method from 2010 China Pharmacopoeia. The established microplate reader method could be applied to high throughput screen of antibacterial substances.
Keywords:Microplate Reader, Antimicrobial Activity, High Throughput Screen

酶标仪快速测定抗菌物质抑菌活性方法的建立
周子雄1,黄庆华2,朱 爽2,周 林2*
1广东药学院中药学院,广州
2广东药学院生命科学与生物制药学院,广东省生物技术候选药物研究重点实验室,广州
Email: zzxyaoji@126.com, *bio_zhoulin@163.com
收稿日期:2014年4月23日;修回日期:2014年5月28日;录用日期:2014年6月4日

摘 要
对酶标仪法测定药物抑菌活性的主要影响因素进行研究,为基于酶标仪法快速筛选抑菌活性物质提供实验依据。以金黄色葡萄球菌标准菌株为受试菌株,测定代表性抗菌药物(盐酸卡那霉素、土霉素、氨苄青霉素、万古霉素),在不同培养方式(静置培养、振荡培养)、不同培养时间条件下,对金黄色葡萄球菌的抑菌率。结果表明药物浓度、培养方式、培养时间显著的影响抑菌活性的测定,在金黄色葡萄球菌浓度约5 × 105 cfu∙mL−1、37℃静置培养6 h的条件下,盐酸卡那霉素、土霉素、氨苄青霉素、万古霉素浓度为100 μg/mL时,抑菌率分别为57.4%、52.8%、57.4%、61.1%;浓度为10 μg/mL时,抑菌率分别为55.6%、36.1%、56.5%、56.0%;浓度为1 μg/mL时抑菌率分别为46.3%、10.0%、52.8%、50.0%。方法的精密度和重现性良好。在设定的测试条件下,酶标仪法与2010版中国药典中试管浊度法没有显著性差异,可用于抗菌活性物质的高通量筛选。
关键词
酶标仪,抑菌活性,高通量筛选

1. 引言
药物单体或组分抑菌活性的评价是抗菌药物高通量筛选的关键环节,常用的抑菌活性筛选方法有平皿法、试管浊度法[1] 和琼脂扩散法。《中国药典》2010年版二部中的试管浊度法采用的是分光光度分析,分光光度分析在药物分析等领域发挥着重要作用[2] ,但该方法工作量大,操作繁琐,测定时间长,试剂消耗较大,对于微量物质,难以检测[3] 。
酶标仪是酶联免疫测定的常规仪器,主要应用在医药学领域[4] ,其测定的原理是建立在物质吸收光谱及可见光比色技术基础上的。由于酶标仪具有检测快速、应用样品微量的优点,适合用于大规模样品的快速检测[5] [6] ,并应用于抑菌活性的研究[7] [8] 。我们在实验中发现,针对同一个样品在不同批次中测定的抑菌活性数据常常缺乏一致性,应用于高通量筛选抑菌活性物质时存在不确定性的因素。采用代表性的抗菌药物对酶标仪法测定抑菌活性的影响因素进行研究,从而将测定过程标准化是开展高通量筛选过程的关键。本文重点研究在不同抗生素、不同培养条件对受试微生物抑菌活性的影响,为抗菌药物高通量筛选实验方案的标准化提供依据。
2. 材料与方法
2.1. 试剂
金黄色葡萄球菌(Staphylococcus aureus ATCC 25923)由广州威佳科技有限公司提供;氨苄青霉素(AMP)、万古霉素(VAN)、土霉素(OTC)、盐酸卡那霉素(KAN(HCl)),杭州天和微生物试剂有限公司;蛋白胨,北京奥博星生物技术有限责任公司;酵母浸出粉,浙江省富阳市杭富生物制品厂;氯化钠,广州化学试剂厂;磷酸二氢钾,天津市福晨化学试剂厂;氢氧化钠,天津市百世化工有限公司;96孔板,上海蔚宏生物科技有限公司。
2.2. 菌种活化
配制LB液体培养基,每试管分装5 mL,于高压锅内121℃灭菌30 min。无菌条件下,挑取平板保存的金黄色葡萄球菌单菌落接入试管,置于摇床37℃、170 r/min、培养14~16 h。
2.3. 抗生素溶液的配制
精密称取100 mg粉末状抗生素样品,加入1 mL灭菌纯水混匀,用0.22 μm滤膜过滤除菌,置于−20℃冻存备用。利用LB液体培养基稀释抗生素,使氨苄青霉素终浓度依次为100 μg/mL、10 μg/mL、1 μg/mL、0.1 μg/mL、0.01 μg/mL。盐酸卡那霉素、土霉素、万古霉素的浓度梯度为100 μg/mL、10 μg/mL、1 μg/mL。
2.4. 菌液的配制
取活化过夜的金黄色葡萄球菌菌液按1%接种量接入含5 mL LB液体培养基的试管,置于摇床37℃、170 r/min、培养3.5 h,10,000 r/min离心5 min,弃上清。加入1 mL磷酸缓冲液,吹打均匀,稀释至浓度为5 × 105 cfu∙mL−1,备用。
2.5. 抑菌活性测定
2.5.1. 静置和震荡培养的影响
各取5 μL浓度为5 × 105 cfu∙mL−1的受试菌加入5 mL分别含10 μg/mL、1 μg/mL氨苄青霉素的LB培养基。从上述菌悬液中各取250 μL于两块96孔板上,取等体积不含氨苄青霉素的菌悬液作空白对照,每个样品平行加6个复孔,两块96孔板用保鲜膜包好分别于37℃静置培养、于37℃震荡培养(转速为170 r/min),培养6 h。用酶标仪测定菌液的吸光值OD600。
2.5.2. 培养时间和氨苄青霉素浓度的影响
各取5 μL浓度为5 × 105 cfu∙mL−1受试菌加至5 mL含0.01~100 μg/mL氨苄青霉素的LB培养基。从上述菌悬液中各取250 μL于96孔板上,取等体积不含氨苄青霉素的菌悬液作空白对照,每个样品平行加6个复孔。测定后将96孔板用保鲜膜包好置于37℃培养箱中培养,分别测定在培养0 h,4 h,8 h,12 h后金黄色葡萄球菌的菌液OD600值。
2.5.3. 不同抗生素的影响
各取5 μL浓度为5 × 105 cfu∙mL−1的受试菌分别加入5 mL含盐酸卡那霉素、土霉素、氨苄青霉素、万古霉素的LB培养基中,各抗生素浓度依次为100 μg/mL、10 μg/mL、1 μg/mL。从各浓度的含抗生素菌悬液中分别取250 μL于96孔板上,取等体积不含抗生素的菌悬液作空白对照[7] ,每个样品平行加6个复孔。置于37℃生化培养箱中静置培养6 h,并测定菌悬液的OD600值。
2.6. 精密度试验
取5 μL浓度为5 × 105 cfu∙mL−1的受试菌液加至5 mL含0.1 μg/mL,1 μg/mL氨苄青霉素的LB培养基。取250 μL培养液于96孔板上,每个样品设6个复孔。计算各测量值的相对标准偏差(RSD%)。
2.7. 重复性试验
取5 μL浓度为5 × 105 cfu∙mL−1的受试菌液加至5 mL含0.1 μg/mL,1 μg/mL氨苄青霉素的LB培养基。取250 μL培养液于96孔板上,每个样品设6个复孔,求其平均值,重复6次实验。
2.8. 酶标仪法和试管浊度法的比较
各取5 μL浓度为5 × 105 cfu∙mL−1的受试菌加入5 mL含氨苄青霉素的LB培养基,氨苄青霉素浓度分别为100 μg/mL、10 μg/mL、1 μg/mL,按2.6.1操作将96孔板置于37℃生化培养箱静置培养,将3 mL试管置于37℃,170 r/min的摇床培养,培养6 h后测定其OD600。按以下公式计算抗生素抑菌率(%):

3. 结果与讨论
3.1. 静置和震荡培养对抑菌率测定的影响
酶标板上样后,分别置于转速170 r/min的摇床和静置下培养6 h,测定不同金黄色葡萄球菌的菌液吸光值。
由图1可知,金黄色葡萄球菌在37℃经震荡培养或静置培养6 h,抑菌率有所不同。在1 μg/mL的氨苄青霉素条件下,震荡和静置条件下的抑菌率分别为47.4%、48.5%;在10 μg/mL的氨苄青霉素条件下,震荡和静置条件下的抑菌率分别为54.4%、56.6%。震荡和静置培养的抑菌率没有明显差异。震荡条件下培养金黄色葡萄球菌有利于促进氧的溶解与营养物质代谢产物的分散,但是在酶标板上,微孔中的样品不是在完全密闭的环境下,在震荡过程中可能引起液滴溅出,而且由于分子运动加快,液体表面会蒸发,造成各孔内菌液体积不同,影响测定的精密度,特别是在170 r/min条件下尤为明显。所以选择在静置条件下进行抑菌活性的测定。
3.2. 培养时间和氨苄青霉素浓度对金黄色葡萄球菌生长的影响
酶标板上样后,置于37℃恒温箱。分别测定在培养0 h,4 h,8 h,12 h后金黄色葡萄球菌的菌液吸光值。
由图2可知,金黄色葡萄球菌的生长对数期为4~8 h,在0~12 h培养时间内,各剂量组和空白对照组比较,吸光值OD600均呈现明显差异(p < 0.02)。分析4 h和8 h的OD600可以发现,0.01 μg/mL氨苄青霉素比0.1 μg/mL氨苄青霉素的相对抑菌率高。可能由于菌液在低浓度抗生素(0.01~0.1 μg/mL)中生长较快,受试菌易团聚沉降引起吸收度测量误差。高浓度的氨苄青霉素(1.0~100 μg/mL)可以直接抑制金黄色
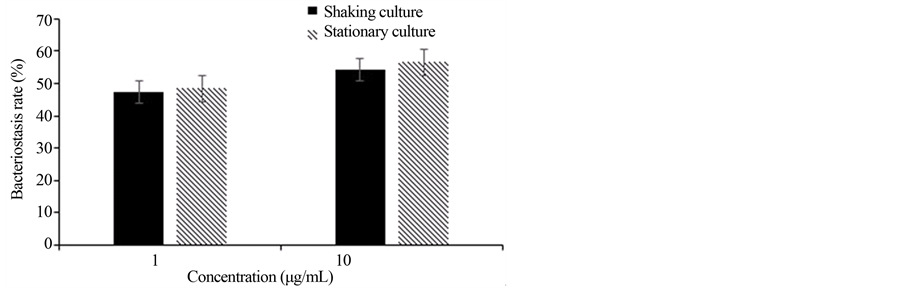
Figure 1. The inhibition of Ampon Staphylococcus aureus under the conditions of standing or shocking
图1. 静置或震荡条件下氨苄青霉素对金黄色葡萄球菌的抑制
葡萄球菌的生长,OD600测量值较低,容易影响试验的精密度。另外,长期暴露于高浓度的抗生素也容易使金黄色葡萄球菌标准菌株突变产生耐药性。故可选择0.1~1 μg/mL氨苄青霉素作为抑菌活性测试中阳性对照药物的浓度,测试时间约6 h。由于本实验研究的是快速微量测定抗菌物质的抑菌活性,因此没有设计更长的培养时间。
3.3. 不同抗生素对金黄色葡萄球菌抑制效果
选择盐酸卡那霉素,土霉素,氨苄青霉素和万古霉素4种不同样品分别在100 μg/mL,10 μg/mL和1 μg/mL的浓度下在酶标板上样后,置于37℃恒温箱培养6 h。
图3考察了四种代表性的抗生素盐酸卡那霉素,土霉素,氨苄青霉素和万古霉素在1~100 μg/mL时对金黄色葡萄球菌生长的影响。浓度为100 μg/mL时盐酸卡那霉素,土霉素,氨苄青霉素和万古霉素对金黄色葡萄球菌的抑制率分别为57.4%、52.8%、57.4%、61.1%;浓度为10 μg/mL时该4种的抑菌率分别为:55.6%、36.1%、56.5%、56.0%;浓度为1 μg/mL时它们的抑菌率分别为:46.3%、10.0%、52.8%、50.0%。可见1 μg/mL的各抗生素在37℃静置培养6 h条件下均能产生一定的抑菌活性,且对受试菌株的抑制活性呈现出差异。
3.4. 精密度试验和重复性试验
由表1、表2可知,浓度为0.1 μg/mL的氨苄青霉素作用下菌悬液吸光度的精密度符合仪器分析方法
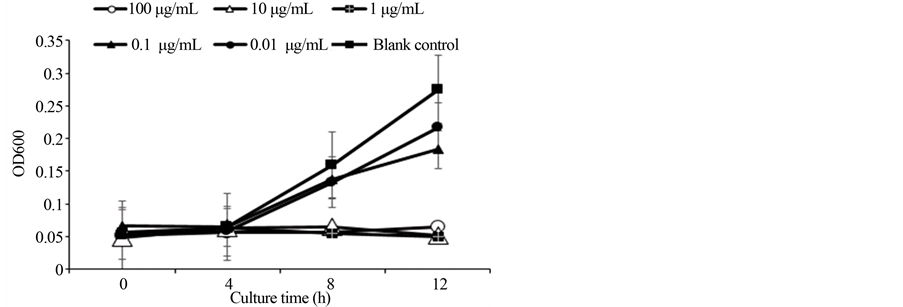
Figure 2. The effect of different concentrations of Amp on light absorption value of Staphylococcus aureus
图2. 不同浓度氨苄青霉素对金黄色葡萄球菌吸光值的影响

Figure 3. The inhibition of different antibiotic on Staphylococcus aureus
图3. 不同抗生素对金黄色葡萄球菌的抑制
的研究。实验RSD = 0.93 (n = 6)。采用1 μg/mL的氨苄青霉素可以得到相似的结论。
3.5. 酶标仪法和试管浊度法的比较
为了对酶标仪测定方法的准确性进行验证,我们用《中国药典》2010年版二部中的试管浊度法[10] 测试了相同浓度下氨苄青霉素的抑菌活性。
由图4可知,在浓度为100 μg/mL、10 μg/mL、1 μg/mL时,酶标仪法抑菌率为95.70%、95.10%、
表1. 精密度试验结果(0.1 μg/mL AMP)
表2. 重现性试验结果(0.1 μg/mL AMP)
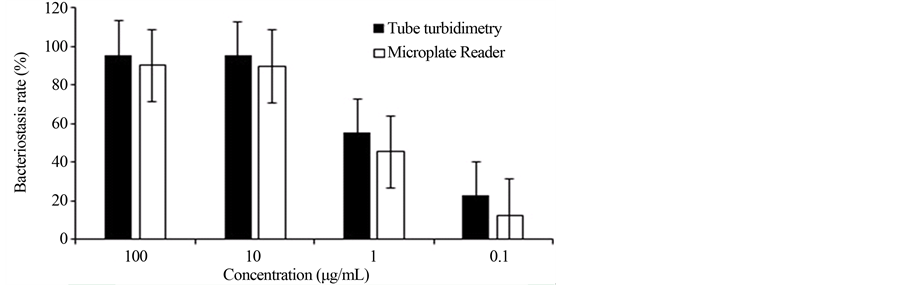
Figure 4. Comparison of bacteriostasis rate between nephelometry and Microplate Reader method
图4. 试管浊度法与酶标仪法测定的抑菌率比较
45.41%、12.21%;试管浊度法的抑菌率为95.78%、95.42%、55.42%、22.77%。经T检验,P > 0.05,两种方法无显著差异。
酶标仪测定抗生素抑菌活性有许多优势,培养和测定都在酶标板上进行,不用转移液体入比色皿,检测快速,受环境因素干扰小,不易感染杂菌。另外酶标板上可同时检测多个样品[9] ,与《中国药典》[10] 2010版二部中的浊度法用分光光度计测定相比,具有快速、准确和高通量的优点。酶标仪微量法的相对标准偏差比分光光度法测量的相对标准偏差小,这是由于酶标仪使用的是垂直光路,分光光度计使用的是水平光路[11] 。垂直光路的优点是标本吸光度受液体浓缩或稀释度的影响较小。使用酶标仪测量可减少稀释时的误差,故酶标仪微量法比分光光度法更精密[12] 。
4. 结论
以金黄色葡萄球菌标准菌株(Staphylococcus aureus ATCC 25923)为受试菌株,采用酶标仪法对四种代表性抗生素:盐酸卡那霉素,土霉素,氨苄青霉素,万古霉素对金黄色葡萄球菌的抑菌活性进行了研究,并和药典中试管浊度法进行了比较。结果表明:采用0.1 μg/mL、1 μg/mL的各抗生素作用于5 × 105 cfu∙mL−1金黄色葡萄球菌,在37℃静置培养6 h的条件下,可以获得稳定的抑菌活性。该方法与药典的试管浊度法测试效果无显著差异,可以用于抗菌活性物质的高通量筛选,并初步评价抑菌物质的抑菌活性。
基金项目
珠海市科技工贸和信息化局企业技术创新项目(珠经贸字(2009)414号)。
参考文献 (References)
- [1] 高燕霞, 姜建国, 王茉莉 (2009) 浊度法测定土霉素原料药及其片剂的效价. 中国药房, 20, 290-291.
- [2] 肖婷, 刘守柱, 薛超彬, 等 (2008) 紫外分光光度计法与酶标仪微量法测定酚氧化酶蛋白含量及活力的比较. 昆虫知识, 45, 306-309.
- [3] 薛超彬, 陈清西, 王勤, 等 (2004) 菜青虫不同虫态及虫龄的多酚氧化酶性质比较. 昆虫学报, 47, 305-309.
- [4] Kohji, O., Yuhsuke, W., Tetsuo, U., et al. (2003) Catalyst development for methanol synthesis using parallel react ors for high-through put screening based on a 96 well micro plate system. Journal of the Japan Petroleum Institute, 46, 328-334.
- [5] 王树栋, 罗万春, 高兴祥, 等 (2004) 曲酸对小菜蛾酚氧化酶抑制作用的研究. 中国农业科学, 37, 1316-1321
- [6] 余久如, 黎增文, 潘桂红, 等 (2011) 酶标仪自检方法的建立和应用评价. 现代检验医学, 31, 112-114.
- [7] 范鹏, 蒋林东, 王小丹, 等 (2010) 紫外分光光度计与酶标仪测定盐酸川芎嗪含量的比较. 西南国防医药, 23, 223-229.
- [8] 骆健美, 成永新, 李培君, 等 (2011) 基于抑菌活性的ε-聚赖氨酸的微孔板生物检测法. 微生物学通报, 38, 976-981.
- [9] 陈默, 王志伟, 胡长鹰, 等 (2009) 酶标仪法快速评价香兰素的抑菌活性. 食品与发酵工业, 35, 63-66.
- [10] 国家药典委员会 (2010) 中华人民共和国药典2010版. 中国医药科技出版社, 北京, 附录95.
- [11] 杨志俊 (2004) 酶标仪单、双波长比色测定OD值在卫检实验中的应用探讨. 口岸卫生控制, 9, 5-6.

NOTES
*通讯作者。
