Advances in Marine Sciences
Vol.03 No.04(2016), Article ID:19157,9
pages
10.12677/AMS.2016.34016
Response to Different Nitrogen Forms of Heterotrophic Nitrifying-Aerobic Denitrifying Bacteria X3
Yan Zhang, Yu Cheng, Yutao Fei, Qiufen Li*
Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Science, Qingdao Shandong

Received: Nov. 3rd, 2016; accepted: Dec. 5th, 2016; published: Dec. 8th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
For the development of biological denitrification technique, study on the response mechanism of heterotrophic nitrifying-aerobic denitrifying bacteria to nitrogen forms has great significance. Herein the relationship between the nitrogen form and the denitrification activity of Halomonas alkaliphila X3 was studied by monitoring the change of different nitrogen forms in the culture solution, and the results are as follows. 1) In the culture solution containing both organic nitrogen and inorganic nitrogen, Halomonas alkaliphila X3 mainly degrades organic nitrogen during the logarithmic growth period. Over the whole culture cycle, the concentration of ammonia nitrogen rises up in the first 48 h, followed by a decreasing trend; the concentration of nitrite nitrogen rises up in the first 4 d, followed by a decreasing trend; while the concentration of nitrate nitrogen decreases in the first 48 h, followed by a decreasing trend. In total 17.07% nitrogen is removed from the culture solution after a treatment for 96 h. 2) In the culture solution containing only inorganic nitrogen, the bacteria mainly degrades ammonia nitrogen during the logarithmic growth period. Over the whole culture cycle, the concentration of ammonia and nitrate nitrogen keeps down; the concentration of nitrite nitrogen rises up in the first 24 h, followed by a decreasing trend. In total 51.13% nitrogen is removed from the culture solution after a treatment for 96 h. In conclusion, the priority and efficiency of the nitrogen degradation by Halomonas alkaliphila X3 both depend on the initial nitrogen forms in the culture solution. These outcomes are promising to help the construction of biological denitrification engineering.
Keywords:Heterotrophic Nitrifying-Aerobic Denitrifying Bacteria, Organic Nitrogen, Inorganic Nitrogen, Nitrogen Forms, Response Mechanism

异养硝化–好氧反硝化细菌X3的氮形态响应
张 艳,成 钰,费聿涛,李秋芬*
中国水产科学研究院黄海水产研究所,山东 青岛

收稿日期:2016年11月3日;录用日期:2016年12月5日;发布日期:2016年12月8日

摘 要
异养硝化–好氧反硝化细菌的氮响应机制对研究生物脱氮技术具有重要意义。通过分析异养硝化–好氧反硝化细菌X3 (Halomonas alkaliphila)生化周期与培养液中氮形态的关系,对该菌的脱氮机制进行了研究。结果表明:1) 含混合形态氮培养液中,细菌X3在对数生长期主要进行有机氮的降解;整个周期中,氨氮先升高后降低,48 h达到最高值,亚硝酸氮先升高后降低,第4天达到最高值,硝酸氮表现为先下降,48 h后上升的变化趋势,96 h总氮去除率为17.07%;2) 仅含无机氮的培养液中,细菌X3在对数生长期主要进行氨氮和硝酸氮的降解;整个周期中,氨氮和硝酸氮持续下降,亚硝酸氮先升高后降低,24 h达到最高值,96 h总氮去除率可达51.13%。结论:细菌X3的氮降解优先顺序和最终效能皆受控于环境氮化合物形态。本研究有望为生物脱氮工程设计提供理论指导。
关键词 :异养硝化–好氧反硝化细菌,有机氮,无机氮,氮形态,响应机制

1. 引言
近年来水产养殖业的快速发展,在取得显著经济效益的同时,对生态环境也造成了严重污染。尤其是氮、磷营养元素更是超过了水体的自净负荷,导致一系列环境污染现象 [1] 。氮是水体初级生产力的关键限制性因素,养殖水体中的氮主要是来自养殖残饵和生物体的排泄物,生物能够利用的只有少部分,其余大部分会进入环境中 [2] 。在几种不同形态氮中,有机氮(Dissolved organic nitrogen DON)是多数天然水体中溶解态氮的主要组成部分,同时也是天然水体有机质的重要组成成分,它可以作为营养物被生物利用,刺激藻类生长,从而引起水体的富营养化;氨氮和亚硝酸氮是水产养殖水体中化合态氮的存在方式,对动物的危害较大。因此,如何对养殖水体中的氮进行降解和利用,是健康养殖的保障,也是对受损养殖环境进行生物修复的关键因素。
自Robertson和Kuenen [3] 发现异养硝化–好氧反硝化细菌并提出异养硝化–好氧反硝化的概念后,越来越多的异养硝化–好氧反硝化细菌从自然界或人工系统中被筛选出来,其在脱氮处理中的应用日益受到人们的关注 [4] [5] [6] ,为废水的生物脱氮处理带来更广阔的前景 [7] [8] [9] [10] [11] 。与自养硝化细菌相比,异养硝化–好氧反硝化细菌的研究仍处于起步阶段,其脱氮机理目前尚不清楚 [12] [13] ;该类细菌对不同形态氮的利用情况,包括在几种氮形态的利用方面是否有选择性?是否受环境因素的影响等问题尚缺乏进一步的研究。
课题组自象山湾浅海网箱养殖区富营养沉积环境中筛选到了一株中度耐盐异养硝化–好氧反硝化细菌X3,经鉴定属于嗜碱盐单胞菌(Halomonas alkaliphila)。该菌能够同时降解无机氮和有机氮,环境适应性较强,具有良好的应用前景。前期已行了异养硝化、好氧反硝化能力检测及环境适应性研究。本文针对废水中不仅存在无机氮,还存在有机氮的问题,研究该菌对不同氮形态的响应,找到优先利用的氮形态,明确氮形态对异养硝化和好氧反硝化反应的影响,为其在水产养殖水体净化中的应用提供理论依据。
2. 材料与方法
2.1. 菌株来源
异养硝化–好氧反硝化细菌X3是实验室在前期研究中筛选并保存的菌种,经中国科学院微生物研究所鉴定为嗜碱盐单胞菌Halomonas alkaliphila。
2.2. 降解液测试液配制
测试液1:100 mg/L(NH4)2SO4、100 mg/L KNO3、100 mg/LNaNO2、0.5 g/L蛋白胨,加入1 L海水,高压蒸汽灭菌;葡萄糖用0.22 um的醋酸纤维素酯微孔滤膜过滤后,加入测试液中使其终浓度达到64 mg/L。所用试剂均为分析纯。
测试液2:测试液1去掉0.5 g/L蛋白胨,其余试剂相同。
细菌生长培养基:Zobell氏2216E海水培养基。
2.3. 菌株X3生长曲线建立及细菌OD600值与菌体氮的关系建立
细菌活化后按5%活的量接种于300 mL新鲜2216 E液体培养基中,28℃、120 rpm/min摇床培养,间隔一定的时间采样,利用7230 G分光光度计在600 nm处检测菌体细胞OD值,建立t-OD600值曲线方程。采样时间为前2 h间隔30 min,2 h~4 h间隔1 h,其后间隔2 h。
细菌X3在2216E培养基中培养24 h后,离心倒掉上清液,在沉淀中加入灭菌蒸馏水,将菌体重新悬浮,按照一定的比例加入上述测试液中,每隔24 h,每个浓度各取一组进行离心,然后用TOC分析仪分析离心前后测试液中总氮含量,两者之差为菌体含氮量;菌体生长情况测量采用吸光度法,用可见分光光度计于600 nm测量吸光度值OD600,建立OD600与菌体氮的线性曲线。
2.4. 不同形态氮测定
在降解液测试中加入一定浓度的菌液,每隔24 h分别进行氨氮、亚硝酸氮、硝酸氮和总氮(含菌体氮)。其中氨氮、亚硝酸氮和硝酸氮的测量方法参照海洋监测规范GB17378.4-2007,氨氮采用次溴酸盐氧化法测定,亚硝酸氮采用盐酸萘乙二胺分光光度法测定,硝酸氮采用锌–隔还原法测定,总氮测量使用总有机碳(total organic carbon TOC)分析仪(TOC-VCPH, TNM-1),有机氮含量(mg/L) = 总氮 − 无机氮 − 菌体氮。
2.5. pH测量
每24 h取样,利用pH计(雷磁PHS-3C)对降解液进行pH测量。
3. 结果与分析
3.1. 细菌生长曲线及菌体氮与细菌OD600的线性关系建立
对菌株X3进行生长曲线测定,其结果如图1所示,由细菌细胞生长密度OD600的变化可知,该菌在0~0.5 h处于适应期,0.5 h后进入对数生长期,12 h进入稳定生长期,2~8 h繁殖最快。
如图2所示,菌体氮含量与细菌浓度OD600具有良好的线性关系,其线性方程为y = 0.0503x − 0.0118,R值为0.9996,根据此线性方程可方便、快捷的计算菌体氮浓度。

Figure 1. Growth curve of the strain X3
图1. 菌株X3的生长曲线

Figure 2. The linear relationship between the nitrogen content and OD600 of bacteria concentration
图2. 菌体氮含量与细菌浓度(OD600)的线性关系
3.2. 细菌对降解液中各种形态氮的降解及转化实验
3.2.1. 无机氮降解实验
如图3所示,添加有机氮和无机氮的实验组中,氨氮含量呈先升高后降低的变化趋势,在48 h左右,氨氮达到最高浓度,较初始值增加了2.94倍,然后开始下降。原因可能是细菌X3利用有机氮源,将其转化为氨氮,从而导致培养液中氨氮含量升高,而48 h后异养硝化作用使得氨氮浓度又开始下降;只添加无机氮的实验组,氨氮呈下降的变化趋势,在24 h内下降趋势最为明显,72 h后下降趋势减缓,96 h降解率为77.58%;两个实验组中的空白对照无明显变化。
亚硝酸氮在两个实验组中的变化趋势完全不同,具体见图4,添加有机氮和无机氮的实验组氨氮在24 h内变化不明显,24 h后明显上升,在第4天达到最高值,较初始值增加了10.66%,其后开始缓慢下降;只添加无机氮的实验组亚硝酸氮在24 h内明显上升,其后下降,96h降解率为39.64%,其后下降趋势减慢。
硝酸氮的变化趋势见图5,添加有机氮和无机氮的实验组,24 h硝酸氮无明显变化,其后开始下降,48 h达到最低,降解率为27.99%,之后开始升高,96 h降解率为12.57%;只添加无机氮的实验组硝酸氮持续下降,96 h降解率达74.42%。
无机氮含量变化与氨氮基本一致,具体见图6。由以上结果可以看出,在有机氮存在的情况下,异养硝化和好氧反硝化反应均有一定程度的延迟,且降解效率也受影响。

Figure 3. The result of ammonia nitrogen degradation of bacteria X3
图3. 细菌X3对氨氮的降解实验结果

Figure 4. The result of nitrite nitrogen degradation of bacteria X3
图4. 细菌X3对亚硝酸氮的降解实验结果

Figure 5. The result of nitrate nitrogen degradation of bacteria X3
图5. 细菌X3对硝酸氮的降解实验结果

Figure 6. The result of inorganic nitrogen degradation of bacteria X3
图6. 细菌X3对无机氮的降解结果
3.2.2. 有机氮降解实验
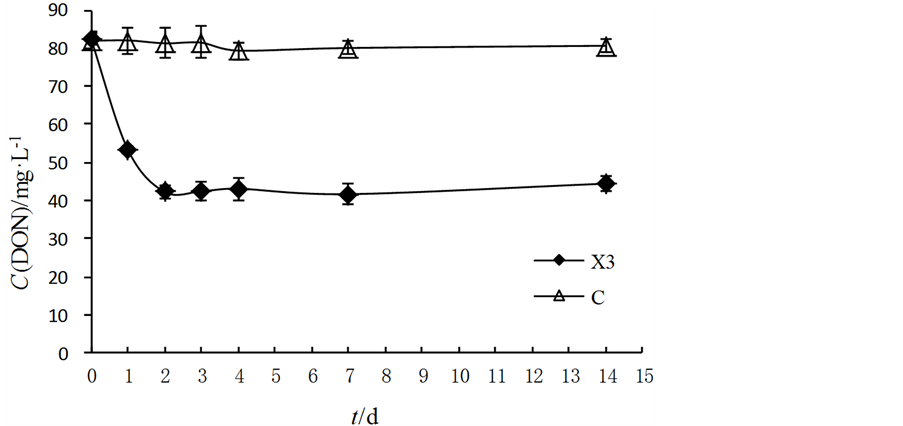
如图7所示,细菌X3对有机氮的降解在48 h内最为明显,呈明显下降趋势,降解率达48.76%;其后有机氮浓度略有回升,但变化幅度很小;对照组的有机氮无明显变化。由此可以推断,异养硝化–好氧反硝化细菌X3对降解液中的有机氮降解主要在48 h以内,48 h后其降解效果不明显,可能转为利用其它形态的氮源。
结合无机氮和有机氮降解实验结果,可以看出,细菌X3在几种形态氮都存在的情况下,优先利用的是有机氮,然后是无机氮。
3.2.3. 总氮降解实验
如图8所示,两组实验中,总氮含量均呈明显下降变化趋势,空白对照无明显变化。由此可推测,细菌X3可以将溶解态氮转化为气体将其去除,从而使降解液中的总氮含量下降;添加有机氮和无机氮的实验组96 h总氮去除率为17.07%,最高去除率为32.90%;只添加无机氮的实验组96 h总氮去除率为
 注:X3-1和X3-2分别为1、2号降解液加菌株X3;C-1和C-2分别为1、2号降解液不加细菌
注:X3-1和X3-2分别为1、2号降解液加菌株X3;C-1和C-2分别为1、2号降解液不加细菌
Figure 7. The result of dissolved organic nitrogen degradation of bacteria X3
图7. 细菌X3对有机氮的降解实验结果
 注:X3-1和X3-2分别为1、2号降解液加菌株X3;C-1和C-2分别为1、2号降解液不加细菌
注:X3-1和X3-2分别为1、2号降解液加菌株X3;C-1和C-2分别为1、2号降解液不加细菌
Figure 8. The result of dissolved total nitrogen degradation of bacteria X3
图8. 细菌X3对总氮的降解实验结果
51.13%,最高去除率为53.33%。
3.3. 降解液中pH变化
实验期间两组空白对照中的pH无变化,添加有机氮和无机氮的实验组pH呈先升高后降低的变化趋势,在48 h时pH达到最高值,其后pH开始下降,这个结果与该组中实验初始阶段氨氮浓度上升的结果起到相互验证的作用。未添加有机氮的实验组pH呈下降的变化趋势。见表1。
Table 1. The change of pH in different concentration degradation
表1. 降解液中pH变化
4. 讨论
孙雪梅等 [14] 在研究异养硝化–好氧反硝化细菌X3异养硝化和好氧反硝化能力的实验中表明该菌可能先启动硝化反应,后启动反硝化反应。在本实验中,只添加无机氮的实验组中得到的结果与前面的研究基本一致,另外还发现在有机氮、氨氮、亚硝酸氮和硝酸氮同时存在的情况下,细菌X3会优先利用有机氮,使其转变为氨氮,然后再利用氨氮,最后才利用亚硝酸氮,而硝酸氮在利用有机氮的过程中已开始降解,早于亚硝酸氮。在实验过程中还发现亚硝酸氮有明显的积累情况,这也表明该菌进行异养硝化时氨氮先转化为羟胺,然后再通过亚硝酸氮转化为氮氧化物,这个发现为充分认识异养硝化-好氧反硝化细菌的脱氮机理提供了理论依据。同时该菌对有机氮的优先利用也弥补了自养硝化细菌由于有机质含量较多而导致脱氮效果不佳的缺点,为异养硝化-好氧反硝化细菌在水体净化中的应用,尤其是在有机质含量较多的水体中的应用提供了理论支持。
研究表明 [15] [16] ,影响异养硝化和好氧反硝化的因素包括DO、C/N、pH、温度等。本实验结果表明,除了上述因素外,有机氮对异养硝化和好氧反硝化也存在一定影响,它的存在使细菌X3对氨氮、亚硝酸氮和硝酸氮的降解发生了较大变化,尤其是氨氮和亚硝酸氮,在含有机氮和不含有机氮的培养液中,两者基本呈相反的变化趋势,这个发现对异养硝化–好氧反硝化细菌在水质处理中的应用具有非常好的指导作用。
有报道表明 [17] [18] [19] ,异养硝化细菌能够将氮转化为气体,从而使其从系统中脱离出去。实验通过对总氮的测定,得到降解液中总氮含量有降低的变化趋势,与之前的研究一致,细菌X3能够把氮以气体的形式,从水体中去除,这对净化养殖用水和消除养殖废水对海洋环境的污染更具意义。在实验中还发现添加有机氮的实验组总氮去除率低于未添加有机氮的实验组,推测原因可能是有机氮对该菌的反硝化作用有一定的影响,具体原因还需要进一步的验证。
基金项目
国家自然科学基金课题(31170113)和中央级公益性科研院所基本科研业务费专项资金(20603022013019)共同资助。
文章引用
张 艳,成 钰,费聿涛,李秋芬. 异养硝化–好氧反硝化细菌X3的氮形态响应
Response to Different Nitrogen Forms of Heterotrophic Nitrifying-Aerobic Denitrifying Bacteria X3[J]. 海洋科学前沿, 2016, 03(04): 118-126. http://dx.doi.org/10.12677/AMS.2016.34016
参考文献 (References)
- 1. 丘耀文. 大亚湾营养物质变异特征[J]. 海洋学报, 2001, 23(1): 85-93.
- 2. 王文强, 温琰茂, 柴士伟. 养殖水体沉积物中氮的形态、分布及环境效应[J]. 水产科学, 2004, 23(1): 29-33.
- 3. Robertson, L.A. and Kuenen, J.G. (1983) Thiosphaera pantotropha gen. nov. sp. nov., a Facultatively Anaerobic, Facultatively Autotrophic Sulphur Bacterium. Microbiology, 129, 2847-2855. https://doi.org/10.1099/00221287-129-9-2847
- 4. 辛玉峰, 曲晓华, 袁梦冬, 等. 一株异养硝化反硝化不动杆菌的分离鉴定及脱氮活性[J]. 微生物学报, 2011.51(12): 1646-1654.
- 5. 杨小龙, 李文明, 陈燕, 等. 一株好氧反硝化菌的分离鉴定及其脱氮特性[J]. 微生物学报, 2011, 51(8): 1062-1070.
- 6. 苏俊峰, 马放, 王继华, 等. 新型异养硝化细菌的硝化和反硝化特性[J]. 天津大学学报, 2007, 40(10): 1205-1208.
- 7. Patureau, D., Zumstein, E., Delgenes, J.P., et al. (2000) Aerobic Denitrifiers Isolated from Diverse Natural and Managed Ecosystems. Microbial Ecology, 39, 145-152. https://doi.org/10.1007/s002480000009
- 8. Kim, Y.J., Yoshizawa, M., Takenaka, S., et al. (2002) Isolation and Culture Conditions of a Klebsiella pneumoniae Strain That Can Utilize Ammonium and Nitrate Ions Simultaneously with Controlled Iron and Molybdate Ion Concentrations. Bioscience, Biotechnology, and Biochemistry, 66, 996-1001. https://doi.org/10.1271/bbb.66.996
- 9. Chen, F., Xia, Q. and Ju, L.K. (2003) Aerobic denitrification of Pseudomonasaeruginosa monit ored by onl ine NAD( P)H fluorescence. Applied and Environmental Microbiology, 69, 6715-6722. https://doi.org/10.1128/AEM.69.11.6715-6722.2003
- 10. Kesseru, P., Kiss, I., Bihari, Z., et al. (2003) Biological denitrificat ion in acontinuous f low pilot bioreactor containing immobilized Pseudomonasbutannovora cells . Bioresource Technology, 87, 75-80. https://doi.org/10.1016/S0960-8524(02)00209-2
- 11. 杨航, 黄钧, 刘博. 异养硝化–好氧反硝化菌Paracoccus pantotrophus ATCC 35512的研究进展[J]. 应用与环境生物学报, 2008, 14(4): 585-592.
- 12. 郭艳丽. 三株轻度嗜盐反硝化菌的分离鉴定和讲解特性初探[D]: [硕士学位论文]. 青岛: 青岛大学, 2009.
- 13. 温东辉, 唐孝炎. 异养硝化及其在污水脱氮中的作用[J]. 环境污染与防治, 2003, 25(5): 283-285.
- 14. 孙雪梅, 李秋芬, 张艳, 等. 一株海水异养硝化-好氧反硝化菌系统发育及脱氮特性[J]. 微生物学报, 2012, 52(6): 687-695.
- 15. 王欢, 汪苹, 张海波. 一株戴尔福特菌的异养硝化与好氧反硝化性能研究[J]. 北京工商大学学报: 自然科学版, 2008, 26(2): 1-5.
- 16. 孙英杰, 吴昊, 王亚楠. 硝化反硝化过程中N2O释放影响因素[J]. 生态环境学报, 2011, 20(2): 384-388.
- 17. 李秋芬, 孙雪梅, 张艳, 等. 异养硝化–好氧反硝化菌株X3的环境适应性[J]. 渔业科学进展, 2013, 34(3): 120-125.
- 18. Abou Seada, M.N.I. and Ottow, J.C.G. (1985) Effect of Increasing Oxygen Concentration on Total Denitrification and Nitrous Oxide Release from Soil by Different Bacteria. Biology and Fertility of Soils, 1, 31-38. https://doi.org/10.1007/bf00710968
- 19. 陈圳, 王立刚, 王迎春, 等. 异养硝化–好氧反硝化菌的筛选及脱氮性能的实验研究[J]. 环境科学, 2009, 30(12): 3614-3618.
