Open Journal of Nature Science
Vol.2 No.02(2014), Article ID:13597,4 pages
DOI:10.12677/OJNS.2014.22003
The Functions of Programmed Cell Death during Plant Development and Environmental Adaptation
Dandan Chen, Qi Chen, Xiaorui Guo*
Key Laboratory of Forest Plant Ecology, Ministry of Education, Northeast Forestry University, Harbin
Email: *xruiguo@nefu.edu.cn
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



Received: Apr. 10th, 2014; revised: May 1st, 2014; accepted: May 10th, 2014
Programmed cell death (PCD) in plants is a kind of the spontaneous cell death events, which commonly occurs in plant developmental process and environmental adaptation. The study of plant PCD has become a hot issue of scholars at home and abroad in recent years. Accumulating evidences show that plant PCD process is tightly associated with plant growth, and this event can help plant change structure property, activate cascade of genes involved in stress-response genes. In this review, recent research progress with respect to the correlation between plant vegetative growth and PCD, the PCD-related signaling molecules, the function of PCD during plant typical adversity stress responses of salt stress and the innovative methods implicated in the plant PCD research. Ultimately, we raised some outlook regarding the trends and significance of PCD investigation in plants.
Keywords:Programmed Cell Death, Adversity Stress, Signaling Molecules, Development

程序化死亡在植物发育和环境适应
过程中的功能
陈丹丹,陈 琪,郭晓瑞*
东北林业大学森林植物生态学教育部重点实验室,哈尔滨
Email: *xruiguo@nefu.edu.cn
收稿日期:2014年4月10日;修回日期:2014年5月1日;录用日期:2014年5月10日

植物程序化死亡是植物在生长发育和环境适应过程中的自发性死亡过程,近年来已成为国内外学者关注的热点。大量研究表明,植物程序化死亡进程对植物生长具有重要意义,主要表现为诱导植物细胞死亡来达到改变植物结构特性、启动一系列逆境响应基因等。本文主要从程序化死亡与植物营养生长的关系,程序化死亡的相关信号分子,典型逆境胁迫盐胁迫下程序化死亡的作用及主要采用的研究技术等方面做出了简要综述,最后对程序化死亡的研究方向和发展意义提出了展望。
程序化死亡,逆境胁迫,信号分子,生长发育

程序化死亡(programmed cell death, PCD)普遍存在于植物生长发育过程中,是由基因调控的、主动编程的细胞死亡过程[1] 。这个过程是植物生长和发育不可或缺的环节,它在清除多余和受损细胞,激发植物衰老进程以及形成植物通气和维管组织等方面均发挥着重要调控作用[2] 。近年来大量研究表明,植物PCD进程对植物主动适应逆境及提高植物抗性方面具有重要意义,植物可以通过激发植物体特定部位发生PCD,形成细胞主动死亡,改变植物组织结构特征,从而提高植物抗逆性[3] 。目前植物PCD进程已被认为是植物主动抗逆反应的重要组成部分,但是有关不同环境下植物PCD进程调控的深入机制还不很清楚。本文主要从PCD与植物营养发育的关系,及以盐逆境胁迫为例阐述PCD在环境适应过程中所发挥的作用等方面,试图揭示PCD对植物发育和生态适应的调控作用,帮助我们更好地理解植物PCD进程植物生长中的功能和意义。
2.1. 糊粉层细胞的消失
糊粉层细胞位于单子叶植物种子的胚与胚乳间,主要作用是在种子萌发时分泌水解酶类,为胚发育供给营养物质。当胚发芽后糊粉层细胞便很快死亡消失。研究表明,糊粉层的细胞死亡与细胞程序化死亡有关。在一些已死和将近死亡的糊粉层细胞中发现了细胞胞质和细胞核都发生了浓缩现象,这些都说明了糊粉层细胞通过PCD过程结束了短暂的生命来为幼苗的生长提供更好的营养基础。
2.2. 根冠细胞的死亡
根冠细胞是根尖最前端分生区外面的薄壁细胞,其目的是保护根尖分生组织。根发育时根冠最外边的细胞逐渐死去,根尖分生组织的原始细胞分裂产生的根冠细胞不断的分裂取代最外边的细胞。实验发现即将死亡的蕃茄和洋葱的根冠细胞发生萎缩,细胞核收缩同时产生了片段化DNA[4] 。
2.3. 导管分子的分化
导管位于木质部,行使水分及无机盐运输的作用;为非活细胞,导管分子的分化主要存在于细胞伸长、自溶和次生壁物质的积累等生理现象。其自溶时,细胞质和核收缩,最后破损形成许多小块组织发生PCD[5] 。
2.4. 植物衰老的发生
在植物衰老过程中细胞核发挥了重要的作用,并且与信号传导途径密切相关。在衰老的豌豆果皮和黑麦中积累的核酸酶和寡聚核小体片段的存在为植物衰老与PCD之间的联系提供了有力的证据[6] 。叶片的黄化衰老以及根冠细胞的死亡都表明PCD参与诱导了植物的衰老[4] 。
2.5. 小结
PCD是植物生长发育必不可少的生理过程,它充满了植物的整个生命过程。植物通过这种主动的筛选、保留方式来剔除死亡或者衰老的组成部分,来达到更好地营养发育和生存状态。
3.1. 乙烯
乙烯(ethylene, ET)是一种在植物中普遍存在的植物激素,在调节植物PCD过程中也有重要作用。在喜树碱(camptothecin)调控的番茄悬浮细胞死亡过程中,乙烯会加剧细胞H2O2和死亡的发生发挥了重要的催化物质作用[7] 。在月季花发育过程中,同时检测到了乙烯及ACC合酶基因的转录过程的发生,且含量保持一致,表明ACC和ET都参与了PCD过程。
3.2. NO
NO是一种植物体内存在的重要信号分子,在植物抗病及非生物胁迫等过程都有调节作用[7] 。机械伤害可导致红豆杉细胞的NO含量上升,从而间接或直接的诱导了红豆杉细胞PCD的发生,且用L-NMMA(NO合成酶抑制剂)处理时能明显的控制NO和PCD的发生;在干旱胁迫下豌豆和康乃馨也会有大量的NO释放,这都表明NO作为信号分子在环境胁迫诱导PCD发生过程中有着重要的作用[7] 。
3.3. 其他信号分子
据报道,乙酰水杨酸可以诱发拟南芥悬浮细胞PCD的发生,且所需浓度要比H2O2和SA所需浓度低。最近也有研究发现,大豆中的钙调蛋白基因ScaM4和ScaM5在烟草细胞中的过量表达将诱发类HR的反应和细胞死亡现象[8] 。Xu等人发现在真菌侵染抗性豇豆的细胞壁实验中,细胞内的Ca2+浓度升高,而用Gd3+(Ca2+通道抑制剂)则可抑制ROS的积累及细胞死亡的发生,可见细胞内Ca2+的浓度升高在HR信号传导途径激发过程中也有着重要的作用。此外放线菌D、放线菌酮和秋水仙素也可诱导植物细胞PCD的发生,在植物PCD过程中发挥功效[9] 。
盐胁迫(NaCl)是植物在生态环境中遇到的最重要胁迫因子之一。有研究表明,一定程度的盐胁迫能诱导高等植物、酵母及海藻发生细胞膜裂解、细胞器和DNA降解等PCD标志性进程[10] [11] 。
4.1. PCD与钾钠离子的关系
盐胁迫诱导的PCD进程与钾钠离子平衡及氧化还原状态(redox state)密切相关。盐胁迫诱导的植物PCD进程被推测主要是与钾钠离子平衡有关,因为Affenzeller等(2009)观察到,同时施加山梨醇对植物产生渗透胁迫过程中并没有像盐胁迫那样发生相应的PCD进程。在盐胁迫条件下,植物由于吸收过量的钠离子将导致钾离子的大量流失。恰恰相反,诸如甘露醇和山梨醇等渗透物质处理引起的细胞膜超极化能导致植物吸收钾离子[12] 。也就是说盐胁迫和渗透胁迫处理能否引起PCD进程差异可能主要是和植物胞内钾离子水平有关[13] 。
4.2. PCD与活性氧物质的关系
环境胁迫还会通过ROS含量的升高来伤害植物细胞的。在此过程中植物PCD进程也参与了ROS的启动[14] ,这项研究的最早证据来源于Levine et al。他们的研究表明,H2O2诱导的PCD进程可以被ROS产生抑制剂放线菌酮和蛋白酶抑制剂所阻碍。最近利用拟南芥(Arabidopsis thaliana)或烟草有关ROS信号功能缺失的突变体对ROS-诱导的PCD进程进行研究为ROS是否直接参与PCD进程的问题提供了更直接的证据[15] 。Shabala认为盐胁迫条件下,钠离子首先进入植物体内,引起钾离子的流失[12] ;同时盐胁迫诱导的钙离子升高将作用于NADPH氧化酶,引起ROS水平升高,这将进一步促进钾离子的流失,激发caspase类似蛋白激酶,导致PCD进程的发生。这个信号级联机制对钾和ROS两个信号节点表示了高度重视,为植物PCD进程问题提供了技术框架(图1)。
植物PCD进程是一个动态的、渐进的、涉及多种生化过程的复杂体系。主要通过测试植物细胞核DNA降解、caspase类似蛋白水解酶活性以及线粒体细胞色素c的外泄等指标来衡量植株是否发生PCD。
DNA梯度以及TUNEL测定方法体系是较成熟的观察PCD晚期进程发生的DNA片断化过程的主要手段。植物PCD进程的一个早期重要形态学特征是质膜上磷脂酰丝氨酸(phosphatidylserine, PS)的外翻,这个变化可以外加荧光染色剂——annexin V特异结合到PS上后运用流式细胞仪观察发生PCD的原生质
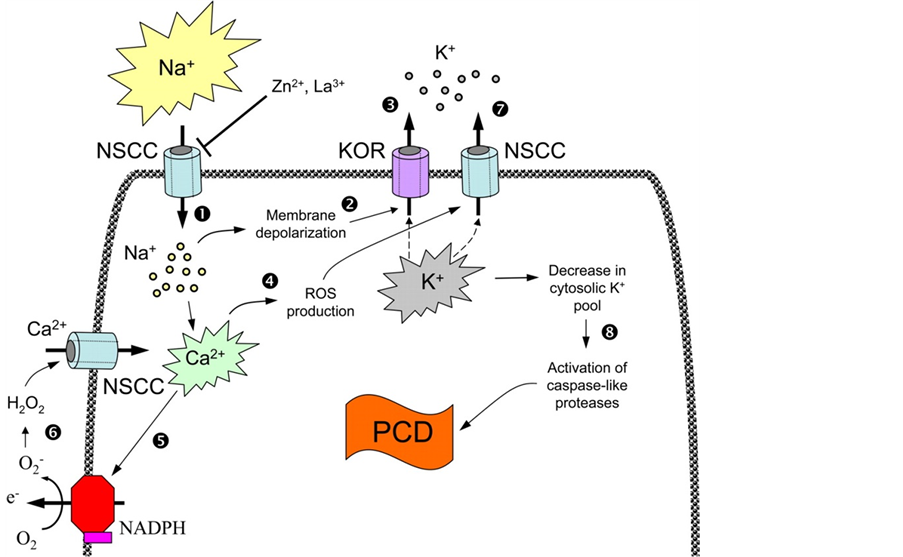
Figure 1. Cascading mechanism of signal transduction in PCD induced by salt stress (Shabala, 2009)
图1. 盐胁迫诱导植物程序化死亡(PCD)进程的信号转导的级联效应机制(引自Shabala, 2009)
体数量[1] 。以动物细胞为参照,与DNA梯度和TUNEL测定相比,该技术指标已被证明是刻画植物PCD进程发生早期的一个更加敏感和稳定的参数[1] 。
PCD普遍存在于植物的生长发育过程中,并通过协调自身的营养发育及与外界环境的适应来改善植物的存在状态。细胞程序化死亡已被证实是植物体自身为了更好地生存、应对胁迫环境的一种抗逆性保护机制[12] ,且在进行过程中不同植物体内的发生水平能够反映植物对抗外界逆境的强弱,因此可以利用植物胁迫环境下诱导PCD进程来揭示植物的抗逆机制。我们通过对PCD机制及调控因子的研究和掌握,人为的介入信号分子来改善植物的抗逆性,从而达到提高对胁迫环境的适应。PCD机制的深入研究不仅对植物地理分布及抗性机制的研究具有重要意义,而且有可能为进化生物学的研究提供基础材料,同时还对抗逆育种的选择提供了理论指导。
感谢林业公益性行业科研专项经费(20120460108)、国家林业局林业科学技术推广项目([2012] 46)和东北林业大学青年拔尖人才支持计划(PYTT-1213-07)的资助。
- [1] Pennell, R.I. and Lamb, C. (1997) Programmed cell death in plants. Plant Cell, 9, 1157-1168.
- [2] Drew, M.C., He, C.J. and Morgan, P.W. (2000) Programmed cell death and aerenchyma formation in roots. Trends in Plant Science, 5, 123-127.
- [3] Huh, G.H., Damsz, B., Matsumoto, T.K., Reddy, M.P., Rus, A.M., Ibeas, J.I., Narasimhan, M.L., Bressan, R.A. and Hasegawa, P.M. (2002) Salt causes ion disequilibrium-induced programmed cell death in yeast and plants. The Plant Journal, 29, 649-659.
- [4] Wang, H., Li, J. and Bostock, R.M. (1996) Apoptosis: A functional paradigm for programmed plant cell death induced by a host-selective phytotoxin and invoked during development. The Plant Cell, 8, 375-392.
- [5] Lai, V. and Srivasyava, L.M. (1976) Nuclear changes during differentiation of xylem vessel elements. Cytobiologie, 12, 220-243.
- [6] Orzaez, D. and Granell, A. (1997) DNA fragmentation is regulated by ethylene during carpel senescence in Pisum sativum. The Plant Journal, 11, 137-144.
- [7] 孙鑫博, 代小梅, 王怡杰, 韩烈保 (2010) 植物细胞程序化死亡研究进展. 11, 1-6.
- [8] 吴俊华 (2006) 植物细胞程序化死亡的研究进展. 生命科学仪器研究报告, 10, 37-43.
- [9] 宁顺斌等 (1999) 细胞毒胞类药物诱导的植物细胞程序化死亡及凋亡细胞电泳行为的研究. 云南大学学报(自然科学版), 21, 131-132.
- [10] Katsuhara, M. and Shibasaka, M. (2000) Cell death and growth recovery of barley after transient salt stress. Journal of Plant Research, 113, 239-243.
- [11] Katsuhara, M. (1997) Apoptosis-like cell death in barley roots under salt stress. Plant and Cell Physiology, 38, 1091- 1093.
- [12] Shabala, S. (2009) Salinity and programmed cell death: Unraveling mechanisms for ion specific signaling. Journal of Experimental Botany, 60, 709-712.
- [13] Shabala, S. and Cuin, T.A. (2008) Potassium transport and plant salt tolerance. Physiologia Plantarum, 133, 651-669.
- [14] Bi, Y., Chen, W., Zhang, W., et al. (2009) Production of reactive oxygen species, impairment of photosynthetic function and dynamic changes in mitochondria are early events in cadmium-induced cell death in Arabidopsis thaliana. Biology of the Cell, 101, 629-643.

*通讯作者。