Journal of Organic Chemistry Research
Vol.06 No.01(2018), Article ID:24087,10
pages
10.12677/JOCR.2018.61002
Synthesis and Development of Coumarin Compounds
Kaiqiang Nie, Lin Shen
College of Material Science and Technology, Nanjing University of Aeronautics and Astronautics, Nanjing Jiangsu

Received: Feb. 23rd, 2018; accepted: Mar. 13th, 2018; published: Mar. 20th, 2018

ABSTRACT
Fluorescence detection received attention because of its high sensitivity, ease of use and other advantages. In recent years, it has been growing rapidly in ion detection and biomarkers. This article summarizes the synthesis of coumarin fluorescent compounds and the development of the situation, hoping to provide relevant reference for researchers.
Keywords:Coumarin, Synthesis, Development
香豆素类化合物的合成方法及发展概述
聂凯强,申霖
南京航空航天大学材料科学与技术学院,江苏 南京
收稿日期:2018年2月23日;录用日期:2018年3月13日;发布日期:2018年3月20日

摘 要
荧光检测以其灵敏度高、使用方便等优点备受人们的关注,近年来尤其是在离子检测和生物标记方面得到了迅速的发展。本文总结了香豆素类荧光化合物的合成方法及发展情况,希望对相关科研人员提供参考。
关键词 :香豆素,合成,发展

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
1820年VOGER首次发现了天然香豆素,从此香豆素类化合物便开始引起了科研工作者们的兴趣。香豆素类化合物是一种以苯并吡喃酮为母环结构的重要有机杂环化合物(如图1)。许多自然界中的高等植物中都存在天然香豆素例如:伞形科、芸香科、豆科、菊科、瑞香科等。香豆素类衍生物很多以单香豆素的形式存在于植物体内,少数以双分子或者三分子的聚合物形式存在。
研究表明,香豆素类化合物具有多方面独特的生理学和生物学活性,例如抗高血压、抗凝血、抗真菌、抗细菌、抗病毒、抗癌等一系列的生物和药用活性。近年来发现香豆素类化合物还具有抗氧化、抗衰老以及在抵抗当今危害人类健康的顽症和肿瘤方面有较好的药物活性,因此引起国内外学者的广泛关注 [1] 。
香豆素化合物除具有独特生物活性外,还具有优异的光学特性。香豆素类化合物的母核苯并毗喃本身是没有荧光的无色物质,但取代后的香豆素衍生物,由其是在3 [2] 或4位上引入给电子基团,形成推拉电子体系,便得到了强荧光物质,最大吸收波长和发射波长都会发生红移。
香豆素作为一类重要的杂环化合物,广泛应用于医药和荧光材料等领域,近年来受到人们的大量关注。香豆素类化合物合成文献报道很多,大致有以下几种方法:Perkin合成法、Knoevena合成法、Pechmann合成法、witting合成法。
2. 香豆素类染料合成方法
2.1. Perkin合成法
该方法是以水杨醛和乙酸酐为原料,在乙酸钠的催化下发生反应得到中间体邻羟基肉桂酸,然后发生分子内缩合的关环反应得到香豆素母环 [3] [4] ,如下图2。
该方法的缺点是反应温度高、时间长、副反应多、收率低。后来通过对该方法进行改进,陆续探索出以DDC和CDI和有机碱Et3N等作催化剂来加快反应速度并提高产率的合成方法。
2.2. Knoevena合成法
该方法是用水杨醛和含有活泼亚甲基的乙酸衍生物在碱的催化下得到香豆素母环,如下图3。反应温度低,反应时间短,产率较高。
2.3. Witting合成法
该方法是用取代水杨醛和乙氧羰基甲叉磷叶立德反应合成中间体邻羟基肉桂酸乙酯,然后中间体发生分子内酯交换得到香豆素母环,如下图4。这种方法使用比较少,但一般用来合成吡喃环上无取代的香豆素。
2.4. Pechmann合成法
该方法是以苯酚为原料,在路易斯酸的催化下与取代的乙酰乙酸乙酯发生缩合反应得到香豆素母环 [5] ,如下图5。但是该方法操作简单,产率较高,但是反应时间较长,而且易产生废弃物。
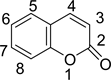
Figure1. Coumarin’s nuclear structure
图1. 香豆素的母核结构
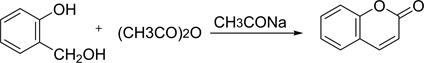
Figure 2. Perkin synthesis
图2. Perkin合成法

Figure 3. Knoevena synthesis
图3. Knoevena合成法

Figure 4. Witting synthesis
图4. Witting合成法
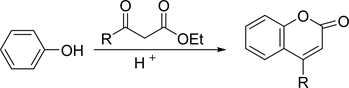
Figure 5. Pechmann synthesis
图5. Pechmann合成法
后来WU等对该方法进行了改进,以间苯二酚和乙酰乙酸乙酯为原料,浓硫酸为催化剂,在室温条件下就得到了目标产物。
3. 香豆素类衍生物的应用发展
3.1.香豆素衍生物在生物光学方面的发展
① 香豆素类络合型金属离子荧光探针
香豆素类络合型金属离子荧光探针因设计方法简单、络合基团多样、络合反应可逆、条件温和以及络合反应较快等优点,被众多科研工作者所重视并加以深入研究。Suzuki [6] 等根据ICT原理,通过在香豆素的3号位上连上乙酰氧甲基,合成了两种增强型的镁离子选择性荧光探针,如下图6中a,b。香豆素的β-二酮通过与Mg2+络合形成1:l的络合物,使香豆素3位的吸电子能力增加,导致荧光增强。该探

Figure 6. Mg2+ fluorescent probe
图6. Mg2+荧光探针
针的选择性是市售荧光探针的200多倍。同时该课题组将该探针在PCI2活细胞中进行Mg2+荧光成像,根据荧光强弱判断出Mg2+主要是分布在细胞质中,细胞核中只存在少Mg2+。
Valeur [7] 小组设计出了以香豆素衍生物为荧光团,能够同时检测K+1和Ba2+的荧光探针,如下图7。双氮杂冠-18-冠-6通过亚甲基连接两个相同香豆素分子的3位。因为冠醚具有柔韧性从而使两个香豆素分子可以互相靠近而产生自猝灭作用。而K+1和Ba2+离子半径与探针中的氮杂-18-冠-6中的空穴尺寸相匹配,K+1和Ba2+与荧光探针化合物的通过络合增加了冠醚的刚性,因而探针分子中的两个香豆素分子不能相互靠近,自猝灭被部分或全部禁阻而提高焚光量子产率。
2013年,Sumiya [8] 等设计合成了对Zn2+和Cd2+具有双重选择性的探针(图8)。当该探针单独存在于水溶液中时荧光较弱,但当水溶液中有Zn2+和Cd2+并形成配合物时。抑制了PET效应,在437 nm或386 nm处产生较强的荧光,Zn2+的加入使体系向长波长方向移动,Cd2+的加入使体系的波长蓝移,该探针对其他离子无明显响应作用。
2014年,El-Shekheby [9] 等人根据CHEF原理合成了一种连有二硫代甲酰肼的香豆素衍生物,该香豆素存在着互变异构,如下图9。他们在香豆素探针MeOH/H20 (v:v = 1:1)的溶液中将Hg2+和Ag+加入,金属离子与异构体内的氮孤对电子通过鳌合,抑制了PET效应,使探针荧光增强。通过Job曲线证明探针的异构体与金属离子是以1:1的方式络合。该探针对Ag+的具有较高的检测灵敏度并且可逆,在实际应中前景广阔。
② 香豆素类反应型荧光探针
近几年来,关于几种金属反应型的探针屡见报道,相关科研人员通过研究发现有一部分活性较高的金属离子能够诱导某些特定的有机官能团发生化学反应。因此可以通过化学反应将相关的官能团引入有机分子结构中。特定的金属离子与特定的官能团发生化学反应就会引起有机分子结构的改变,荧光信号也会发生改变,通过荧光信号的改变能够就对这些特定的金属离子进行高选择性识别及定量测定。
Jung [10] 等在2011年,用一种香豆素衍生物和高氯酸铜形成没有金属荧光的配合物,如下图10。而在水溶液中CN−能夺取配合物中的Cu2+形成中间体,中间体可以继续发生水解形成具有较强荧光的香豆素衍生物。
Cu2+能够催化腙的水解,酯的水解和环内酰胺的开环反应。Cu2+催化的环内酰胺的开环反应设计的荧光探针以香豆素为荧光团,以罗丹明B为基础 [11] 。同时以Cu2+催化酯和腙的水解反应为原理设计的荧光探针也被报道。2011年,Zhou [12] 等将7-羟基香豆素与2-羧基吡啶在DCC的缩合作用下合成没有荧光的化合物,如下图11,利用Cu2+催化酯的水解反应生成具有荧光的7-羟基香豆素。该种探针合成方法简单,能够在中性环境中对Cu2+实现高选择性识别,检出限也低,因此该探针可用于水体中微量Cu2+的检测。Cu2+催化的酯水解反应型探针早于2008就已有报道,因此可以参考Cu2+催化酯的水解反应来设计出高选择性的铜离子荧光探针,具有较大的参考价值。
大连理工大学高倍等研究合成了一种新的反应型汞离子探针,如下图12,Hg2+能引起该探针发生

Figure 7. Coumarin fluorescent probe capable of detecting potassium and barium ions
图7. 能检测钾离子和钡离子的香豆素荧光探针

Figure 8. Zn2+ and Cd2+ decamer complex fluorescent probe
图8. Zn2+和Cd2+配合物荧光探针

Figure 9. Complex recognition of Hg2+ and Ag+
图9. Hg2+和Ag+的络合识别

Figure 10. CN− fluorescent probe
图10. CN−荧光探针

Figure 11. Cu2+ ion-reactive probe mechanism
图11. Cu2+反应型离子探针机理

Figure 12. Hg2+ ion-reactive probe mechanism
图12. Hg2+离子反应型探针机理
分子内关环反应,进而实现对Hg2+的检测及移除。通过研究发现,该探针分子本身是有微弱的荧光,加入Hg2+后分子关环刚性增加,发出强烈的绿色荧光。在中性左右的缓冲体系中,加入该探针检测Hg2+,发现未引起其他金属阳离子明显变化,加入其他阴离子,亦也能排除其他阴离子的干扰。将该探针应用于生物学上PC-12细胞中Hg2+的检测时,该探针能对细胞内的Hg2+快速响应,说明该探针的选择性高,检测效果良好。
3.2. 在生物活性方面的发展应用
随着科技的发展以及对中医理论研究的日益深入,科研人员发现大量药材中的有效成分含有香豆素衍生物,因此科研人员通过化学手段修饰天然香豆素或者和合成新的香豆素衍生物,并通过对产物进行药理学等的实验和分析,开发出了大量有效的低毒性药物。
口服抗凝血的基本药物一直以香豆素的衍生物为主,属于维生素K拮抗剂。这类药物的有效成分均具有4-羟基香豆素的结构,主要包括:双香豆素、节丙酮香豆素、环香豆素和苯丙香豆素等,如下图13所示。因为该类药物的主要成分与维生素K相似,因此该类药物作用机理是在肝脏中与酶蛋白结合时和维生素K存在竞争性,从而抑制酶蛋白的活性,抑制了凝血酶原和维生素K对应的凝血因子的生成。华法林由于具有剂量小、口服易吸收、持续时间长等 [13] 特点而在临床上具有广泛应用。
艾滋病是一种由人类免疫缺陷病毒引起的传染病,自从被发现以来,它已经开始严重威胁人类的生命健康。1992年,第一代HIV-PR抑制剂 [14] 由Kashman [15] 等首次从胡桐属植物中分离出来,该类香豆素类化合物Calanolides (图14)可以在保护人类T淋巴细胞不受攻击的同时也能抑制HIV逆转录酶的活性,并且该制剂具有很高的耐药性和专一性。后来的科研工作者对香豆素衍生物生物活性的进一步研究。又陆续发现了苯丙香豆素、法华林等其他HIV-PR抑制剂。

Figure 13. Two types of important anticoagulant drugs
图13. 两类重要的抗凝血药物

Figure 14. Calanolides
图14. Calanolides
2002年,许嵩等 [16] 设计并合成一系列笨基亚胺次甲基取代的香豆素染料,如下图15所示,并取用人提不同地方的癌细胞:如口腔上皮癌细胞KB、早幼粒白血病细胞HL-60、结肠癌细胞HCT-8和人肝癌细胞B e1-7402作为瘤株进行了体外抑制癌细胞活性筛选和构效关系研究,实验表明有12个香豆素衍生化合物对KB,HCT-8和Bel-7402细胞的增值能进行有效抑制。
2012年,Francisco等 [17] 合成了5个新型的苯并吠喃并香豆素衍生物,并且研究了他们对乳腺癌细胞MDA MB 231,宫颈癌细胞Hela和膀肌癌细胞TCC-SUP)的抑制作用机理,探讨了他们结构与活性的关系,如下图16。研究结果显示这几种化合物即使在浓度低为0.5 μM时仍对以上三种癌细胞具有优异的抑制作用。除此以外,这几种物质对其他的癌细胞,诸如乳腺癌细胞MCF-7,肺癌细胞NCl-H460和中枢神经癌细胞SF-268均有一定的抑制作用。
2013年,Manidha [18] 等先设计并且合成了一系列香豆素衍生物,通过研究显示8号位置的修饰4-甲基-7-轻基香豆素对一些特定的蛋白质具有亲合作用,该发现为一些靶向性药物的研究提供了可能性的指导,如下图17。
2013年,Varun等 [19] 设计合成了一系列吡啶并香豆素衍生物,他们研究了该系列物质对一些比较典型的细菌和结核杆菌H37Rv的抑制作用,如下图18。研究结果显示该系列物质都具有良好的抑菌作用,且部分产物的抑菌效果和市场上的优良药物的效果相当。但就抗结核效果而言,只有三种药物表现出较好的抗结核作用,也就是说该类香豆素衍生物表现出较好的抗菌性和较弱的抗结核作用。
4. 总结
通过以上叙述可知,香豆素类化合物无论是应用于离子探针还是生物医药方面都具有广泛且有效的应用价值。同时最近香豆素作为激光染料在激光行业发展迅猛近 [20] ,自上世纪七十年代以来,得到迅速的发展,已从主要由黄、橙品种发展到红、蓝等深色品种,色谱已基本齐全。在日本、德国和瑞士等染料工业发达的国家都给予高度重视 [21] ,希望我国的科研工作者能对香豆素类物质在生物医药方面的性能做进一步的探索研究,使香豆素类物质能更好的服务于我国的国计民生。

Figure 15. Stupid imine methine substituted coumarin
图15. 笨基亚胺次甲基取代的香豆素

Figure 16. Benzofurantiocoumarin derivatives
图16. 苯并吠喃并香豆素衍生物
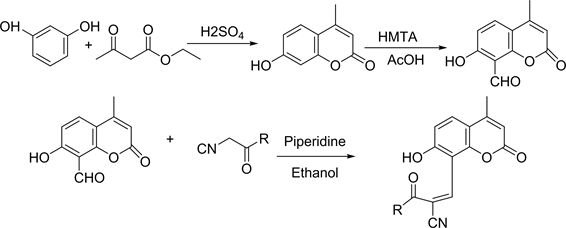
Figure 17. Targeted drug synthesis
图17. 靶向药物的合成
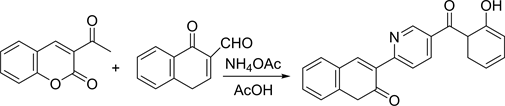
Figure 18. Pyridocoumarin
图18. 吡啶并香豆素
致谢
江苏省高校优势学科建设工程项目。
文章引用
聂凯强,申 霖. 香豆素类化合物的合成方法及发展概述
Synthesis and Development of Coumarin Compounds[J]. 有机化学研究, 2018, 06(01): 9-18. https://doi.org/10.12677/JOCR.2018.61002
参考文献
- 1. 张韶瑜, 孟林, 高文远, 等. 香豆素类化合物生物学活性研究进展[J]. 中国中药杂志, 2005, 30(6): 410-414.
- 2. Borsche, W. and Streitberger, F. (1904) Ueber α-Phenyl-o-Oxyzimmtsäurenitril und α-Phenyl-Cumarin. European Journal of Inorganic Chemistry, 37, 3163-3167.
https://doi.org/10.1002/cber.190403703111 - 3. Perkin, W.H.J. (1868) VI.—On the Artificial Production of Coumarin and Formation of Its Homologues. Journal of the Chemical Society, 21, 53-63.
https://doi.org/10.1039/JS8682100053 - 4. Warwick, R.T. and Ashken, M.H. (1967) The Functional Results of Partial, Subtotal and Total Cystoplasty with Special Reference to Ureterocaecocystoplasty, Selective Sphincterotomy and Cystocystoplasty. British Journal of Urology, 39, 3.
https://doi.org/10.1111/j.1464-410X.1967.tb11774.x - 5. Jiwan, J.L.H., Branger, C., Soumillion, J.P., et al. (1998) Ion-Responsive Fluorescent Compounds V. Photophysical and Complexing Properties of Coumarin 343 Linked to Monoaza-15-Crown-5. Journal of Photochemistry & Photobiology A Chemistry, 116, 127-133.
https://doi.org/10.1016/S1010-6030(98)00286-X - 6. Suzuki, Y., Komatsu, H., Ikeda, T., et al. (2002) Design and Synthesis of Mg2+-Selective Fluoroionophores Based on a Coumarin Derivative and Application for Mg2+ Measurement in a Living Cell. Analytical Chemistry, 74, 1423-1428.
https://doi.org/10.1021/ac010914j - 7. Sumiya, S., Shiraishi, Y. and Hirai, T. (2013) Mechanism for Different Fluorescence Response of a Coumarin-Amide-Dipicolylamine Linkage to Zn(II) and Cd(II) in Water. Journal of Physical Chemistry A, 117, 1474-1482.
https://doi.org/10.1021/jp3111315 - 8. Elshekheby, H.A., Mangood, A.H., Hamza, S.M., et al. (2014) A Highly Efficient and Selective Turn-On Fluorescent Sensor for Hg2+, Ag+ and Ag Nanoparticles Based on a Coumarindithioate Derivative. Luminescence, 29, 158-167.
https://doi.org/10.1002/bio.2521 - 9. Jung, H.S., Kwon, P.S., Lee, J.W., et al. (2009) Coumarin-Derived Cu2+-Selective Flu-orescence Sensor: Synthesis, Mechanisms, and Applications in Living Cells. Journal of the American Chemical Society, 131, 2008-2012.
https://doi.org/10.1021/ja808611d - 10. Dujols, V., Ford, F. and Czarnik, A.W. (1997) A Long-Wavelength Fluorescent Che-modosimeter Selective for Cu(II) Ion in Water. Journal of the American Chemical Society, 119, 7386-7387.
https://doi.org/10.1021/ja971221g - 11. Zhou, Z., Li, N. and Tong, A. (2011) A New Coumarin-Based Fluorescence Turn-On Chemodosimeter for Cu2+, in Water. Analytica Chimica Acta, 702, 81-86.
https://doi.org/10.1016/j.aca.2011.06.041 - 12. Gao, B., Gong, W.-T., Zhang, Q.-L., et al. (2012) A Selective “Turn-On” Fluorescent Sensor for Hg2+, Based on “Reactive” 7-Hydroxycoumarin Compound. Sensors & Actuators B Chemical, 162, 391-395.
https://doi.org/10.1016/j.snb.2011.12.060 - 13. Daly, A.K. (2013) Optimal Dosing of Warfarin and Other Coumarin Anticoa-gulants: The Role of Genetic Polymorphisms. Archives of Toxicology, 87, 407-420.
https://doi.org/10.1007/s00204-013-1013-9 - 14. 孔令义, 裴月湖, 李铣, 等. 凯林内酯类香豆素的研究进展[J]. 天然产物研究与开发, 1994(1): 50-65.
- 15. Kashman, Y., Gustafson, K.R., Fuller, R.W., et al. (1992) The Calanolides, a Novel HIV-Inhibitory Class of Coumarin Derivatives from the Tropical Rainforest Tree, Calophyllum lanigerum. Journal of Medicinal Chemistry, 35, 2735-2743.
https://doi.org/10.1021/jm00093a004 - 16. 徐嵩, 徐世平, 李兰敏. 4-,6-或7-位取代苯基亚胺次甲基香豆素的合成及其抗癌活性[J]. 药学学报, 2002, 37(2): 113-116.
- 17. Francisco, C.S., Rodrigues, L.R., Cerqueira, N.M., et al. (2012) Synthesis of Novel Benzofurocoumarin Analogues and Their Anti-Proliferative Effect on Human Cancer Cell Lines. Cheminform, 47, 370-376.
- 18. Manidhar, D.M., Kesharwani, R.K., Reddy, N.B., et al. (2013) Designing, Synthesis, and Characterization of Some Novel Coumarin Derivatives as Probable Anticancer Drugs. Medicinal Chemistry Research, 22, 4146-4157.
https://doi.org/10.1007/s00044-012-0299-0 - 19. Kastenholz, F., Grell, E., Bats, J.W., et al. (1994) Fluorescence Studies and Semiempirical Calculations on Alkali Ion Indicators. Journal of Fluorescence, 4, 243-246.
https://doi.org/10.1007/BF01878457 - 20. Wu, S., Song, H., Song, J., et al. (2014) Development of Triphenylamine Functional Dye for Selective Photoelectrochemical Sensing of Cysteine. Analytical Chemistry, 86, 5922-5928.
https://doi.org/10.1021/ac500790u - 21. Shiu, H.Y., Wong, M.K. and Che, C.M. (2011) “Turn-On” FRET-Based Luminescent Iridium(iii) Probes for the Detection of Cysteine and Homocysteine. Chemical Communications, 47, 4367-4369.
https://doi.org/10.1039/c0cc04288a