Modern Anthropology
Vol.03 No.03(2015), Article ID:15734,10
pages
10.12677/MA.2015.33005
The Development of Human Brain Volume in the Biological Evolution
Shuhua Jiang, Yonghong Shen, Jinbo Deng*
Institute of Neurobiology, School of Life Science, Henan University, Kaifeng Henan
Email: shuhua@henu.edu.cn, *jinbo_deng@henu.edu.cn
Received: Jul. 4th, 2015; accepted: Jul. 17th, 2015; published: Jul. 23rd, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
In the process of biological evolution, the animal’s nervous system has experienced a process from simple to complex, the advanced, sophisticated brain eventually formed until to the appearance of the vertebrate. And with the evolution of the animal’s nervous system, the brain volume increases gradually. As to the human beings, the overall development trend of brain volume evolution appears as a “S” curve type; from the “Homo habilis” period, the brain volume starts expansion rapidly; and after the period of “Homo sapiens”, the development of human brain volume becomes stable; the distensible brain volume may cause the improvement of human’s intelligence and cognitive abilities. Brain volume is regulated by many factors, including gene and behavior; In humans, the things such as the manufacture and the use of tools, the increasing of labor, the formation of language, changing of feeding from vegetarian to carnivorous all play a crucial role in promoting the brain volume evolution.
Keywords:Brain Volume, Biological Evolution, Vertebrate, Human Being, Gene Evolution, Cognitive Ability

生物进化过程中人类脑容量的演变
姜树华,沈永红,邓锦波*
河南大学生命科学学院神经生物学研究所,河南 开封
Email: shuhua@henu.edu.cn, *jinbo_deng@henu.edu.cn
收稿日期:2015年7月4日;录用日期:2015年7月17日;发布日期:2015年7月23日

摘 要
在生物进化的过程中,动物的神经系统从低级到高级,不断地由简单到复杂进行过渡,到脊椎动物最终形成了高级、复杂的大脑。而脑容量的演变是随着动物神经系统的进化而逐渐发展的,动物从低等到高等,脑容量逐渐增大。人类脑容量的演变趋势总体呈现为“两头缓慢,中间迅速”的“S”型曲线式发展;从“能人”时期开始,人类的脑容量迅速扩张;而经“智人”后,人类脑容量的发展渐趋平缓;脑容量的扩增在一定程度上可能促进了人类智力和认知能力的提升。脑容量的变化受到了包括基因和行为等多种因素的共同调节;就人类而言,诸如工具的制造和使用,劳动的日益增加,语言文字的形成,食性由素食向肉食转变等等,这些都对脑容量的进化起到了至关重要的推动作用。
关键词 :脑容量,生物进化,脊椎动物,人类,基因进化,认知能力

1. 引言
千百年来,“脑”这一构造精巧同时又充满着无限奥秘的物质正吸引着人们极大的研究兴趣。早在古希腊时代,人们就已经开始了对脑的认识。被称为“西方医学之父”的希波克拉底(Hippocrates,公元前460~379)认为脑不仅主导动物对外界环境的感知,而且是知识和智慧的发源地。直到19世纪末到20世纪初,随着神经解剖学和神经生理学以及其他相关科学技术的不断发展,人们对大脑的研究和认识才开始逐步加深。1873年,意大利组织学家卡米洛·高尔基(Camillo Golgi, 1843~1926)发明的高尔基染色法开创了对脑和脊髓的结构进行细微研究的先河;而“现代神经科学之父”——圣地亚哥·拉蒙–卡哈尔(Santiago Ramón y Cajal, 1852~1934)在高尔基染色法的基础上,通过研究神经细胞之间的联系,提出了开创性的“神经元”学说(neuron doctrine) [1] 。20世纪以后,人们逐渐开始了对大脑的系统研究。然而,随着脑研究的深入,研究者们相继发现了一些令人困惑的问题:动物是不是脑袋越大越聪明?脑容量跟智力成正比吗?人类的思维和智力发展到底有没有极限?脑容量是否决定了我们的认知能力?追本溯源,对脑容量的演变过程进行探究和分析势必将有助于我们来解答这些问题,消除困惑。
目前,很多脑科学问题众说纷纭,尤其是关于“脑容量与智力之间是否有必然的联系”这一问题尚无定论。虽然很多研究者大都持否定态度,但不可否认的是:“脑容量”在脑功能和神经系统的进化中扮演着举足轻重的角色,它是衡量动物进化程度的重要依据之一,同时也是人类脑进化中的一个重要组成部分。有研究表明,人类脑容量的增加是人类智力和思维能力提升的标志[2] 。另外,由于脑容量具有很高的遗传性,并且在多种精神疾病病例中发生了明显突变[3] ,因此研究脑容量的变化对人们深入了解人类精神疾病的发生机制也具有相当重要的意义。我们经过广泛、大量的查阅国内外文献资料,对当前的研究现状进行归纳整理,从生物进化的角度,对脊椎动物脑容量的演变作了纵向的系统分析,试图理清脑容量演变与生物脑进化之间的联系,希望进一步揭示脑容量在生物进化,尤其是在人类智商和认知能力发展中所起到的作用和意义。这样不仅可以使我们明晰脑容量演变的历程,同时也可以为我们更加全面、深入的理解动物和人类的智力发展以及认知、行为方式提供可靠的依据。
2. 生物进化中的脑容量演变
2.1 神经系统的演变历程
1859年,英国生物学家达尔文(Charles Darwin, 1809~1882)出版了著名的《物种起源》一书,在书中他首次提出了生物进化论的观点。按照他的进化理论,地球上一切生物的进化都是经历从无到有,由简单到复杂、低等到高等,并且不断向前发展的过程。同样,神经系统的演变也是从低级到高级,伴随着生物的进化而不断发展的。在较为低等的无脊椎动物以及脊索动物中,神经系统是最原始的、分散的网状神经。单细胞的草履虫(Paramecium caudatum)虽然是一个简单的原生生物,但是细胞内已经分化出了具有感觉并能响应外界刺激功能的纤毛和刺丝泡。水螅(Hydra)等其他腔肠动物的体壁布满了分散的神经纤维,并且彼此相互联结成为神经网,形成了神经系统的起始。此后,神经系统又经历梯状、链状,进而形成两端闭合的管状神经系统;这一个阶段,神经系统由分散到集中,不断进行发展,逐渐形成了脑的雏形[4] 。真正意义的大脑是随着脊椎动物的出现而诞生的。经历过漫长的演变,到脊椎动物,神经系统进一步发展,在身体的前端形成了神经元高度集中、具有不同分工区域的中枢神经——脑,并且随后形成原始的脑皮质区域,然后由初始的古皮质向新皮质进行过渡,进而成为神经系统进化的最高级形式[5] 。在这个过程中,脑的半球逐渐增大,脑体积显著扩增,脑容量得到极大的发展。
2.2. 脊椎动物的脑与脑容量进化
脊椎动物的神经系统非常发达,各器官高度完善,在动物进化中处于最高等级。脊椎动物的主要特点有:a) 一些重要的感官在身体前方聚集,形成明显的头部,被称为有头类(craniata);b) 具有保护脊髓作用的脊柱(vertebral column)取代了脊索;c) 成对的肌肉群形成了高度完善的运动系统。最为重要的是,脊椎动物的神经系统高度发达,由脑和脊髓构成,其中管状神经系统的前端特化为脑,后端分化形成脊髓,脑进一步形成了大脑、间脑、中脑、小脑和延脑[5] 。在低等脊椎动物,脑主要是协调控制各器官的运动;而在高等脊椎动物,脑不仅可以接收各种刺激信息,并且还能对信息进行分析整合,进而调节、控制机体的运动。从鱼类到两栖类、爬行类、鸟类、哺乳类、灵长类进而到人类,脑所起到的作用都是非常重要的,它支配着动物个体几乎所有的生命活动,而脑容量在大脑发挥作用的过程中占据着不可或缺的地位。
2.2.1. 鱼类的脑与脑容量进化
鱼类是最古老的脊椎动物,它们出现并兴盛于4亿~3.6亿年前的泥盆纪时期,一生都在水中活动[6] 。鱼类的脑已经有了明确的分区,由端脑、间脑、中脑、小脑和延脑五部分组成。端脑相对较小,由嗅脑(rhinencephalon)和大脑(pallium)构成,嗅脑在大脑前端,包括嗅球、嗅束和嗅叶。大脑主要由嗅神经(olfactory nerve)组成的古皮质(paleopallium)构成,具有控制嗅觉和协调运动的功能。与大脑相比,鱼脑的下皮质(Subpallium)较发达,又被称为古纹状体(Palaeostriatum),与记忆和空间定位有关。相对于其他脊椎动物而言,鱼类的脑所占身体的比重较小。据测定,鳗鲡(Anguilla japonica)的脑容量在重量上仅占其体重的0.05%,江鳕(Lota lota)的脑约占其体重的0.14% [5] 。2010年,Jeremy F.P. UIImann等人通过核磁共振成像法对幼年尖吻鲈(Lates calcarifer)的分析表明,其脑容量平均约为43.88mm3,脑重所占体重之比为0.26% [7] 。而在金刚、丁莉等人的研究中,鲫鱼(Carassius auratus)的脑重所占其体重的比例达到了0.31% [8] 。较小的脑容量决定了鱼类较为简单的行为和认知能力,研究表明鱼类的学习能力相比于其他高等脊椎动物而言明显较低,在一定的外界压力[9] 和干扰存在的情况下,它们表现出记忆衰退,注意力难以集中[10] 等现象。
2.2.2. 两栖类的脑与脑容量进化
从鱼类进化到两栖类,脊椎动物开始了向陆地扩展的进程。在泥盆纪的末期两栖动物开始出现,它们在距今3.6亿~3亿年前的石炭纪得到蓬勃发展。两栖类作为由水生动物向陆生动物的中间过渡形态,其脑的结构与鱼类基本相似,但在发育程度上则有明显的提升。首先,两栖类的大脑左右半球完全分开,以矢状裂相隔。其次,大脑在古皮质和旧纹状体(archistriatum)的基础上,在顶部新出现了旧皮质(archipallium),主要司嗅觉。中脑背部为圆形视叶,腹部增厚,是两栖类的视觉中心和神经系统的最高中枢[11] 。两栖类的脑容量比鱼类有一定的扩张。但由于其头骨宽而扁,以及平颅型的脑颅构造,导致脑腔狭小,因而对其脑容量的发展起到了一定的限制作用。同时,两栖动物的纹状体和小脑不发达,这也限制了其脑的进化。在Gerhard Roth [12] 等人对17种不同的蛙类和22种蝾螈大脑的研究中,蝾螈比蛙类的大脑结构更为简单,而且脑容量也更小。这表明,脑容量可能在一定程度上决定了动物的活动能力和活动范围。
2.2.3. 爬行类的脑与脑容量进化
在古生代的石炭纪末期,爬行动物开始登上陆地,真正摆脱了对水的依赖。它们从古两栖类中演化出了以羊膜卵进行繁殖的能力,解决了以往动物不能在陆地繁殖的问题,成功地完成了由水栖到陆生的过渡。随着脑的进化,它们脑的各部分已不是排列在一条直线上了,而是出现了颈曲。它们的大脑比鱼类和两栖类具有更复杂的分析、综合能力。而且其大脑半球增大,纹状体扩增明显;中脑随着进化出现四叠体(corpora quadrigemina)。爬行类的大脑皮质仍属旧皮质(archicortex),但是在大脑的顶部已经开始出现锥体细胞,并进一步聚集为脑神经细胞层,成为神经相互联系的中心[11] 。旧皮质的残余是人类海马的前身,仍司嗅觉。爬行动物的头骨出现了颞窝,因而进化出了发达的咬肌。虽然颅腔进一步扩大,但是由于咬肌的牵制作用,颅腔难以得到充分的发展,从而限制了脑容量的发展。虽然爬行动物脑容量所占身体的比重仍然较低,但是已经远高于低等的脊椎动物,如绿蜥蜴(Lacerta viridis)的脑体比为0.242%,是鳕鱼(Gadus callarias)(0.084%)的近3倍(见图1)。较高的脑容量使它们具有比鱼类更加复杂的认知和行为方式,学习能力和记忆能力大大提高,如某些蛇类可以依靠对气味的记忆进行捕食;这表明,随着脑容量的扩增,爬行动物智力的发展也受到了非常积极的影响。
2.2.4. 鸟类的脑与脑容量进化
鸟类起源于距今约2.3亿年前的早三叠纪时期,是由古爬行类进化而来的一种广泛分布于地球各地
的高等脊椎动物,它们的脑基本结构与爬行动物相似,但更为发达。鸟类的大脑主要由大脑皮层和纹状体构成,是各种本能活动以及认知、学习的中枢。过去传统的观点认为鸟类的大脑皮层很薄而且不发达,上纹状体(hyperstriatum)和新纹状体(neostriatum)是鸟类的高级神经中枢。然而,根据近年来的多方面研究,已经证实鸟类的背腹嵴(dorsal ventricular ridge, DVR)非常发达,这是一种位于大脑皮质底侧部的类皮质结构,它与哺乳类的大脑皮层(pallium)是同源的[13] [14] ,且具有类似的功能,被认为是鸟类神经系统的最高中枢。鸟类的中脑和小脑也非常发达,中脑为比较发达的视叶,接受来自视觉的冲动,小脑司协调和平衡运动。到鸟类,动物脑容量的发展出现了明显的转折,进入了迅速扩增的阶段。鸟类的头骨顶部发生了圆拱化,使颅腔更加膨大,为脑容量的发展提供了有利条件。它们的脑容量仅次于哺乳动物,脑重占身体总重的2%~5%。在Crile & Quiring [15] 的统计数据中,体重仅为23.26g的家麻雀(Passer domesticus)的脑重就已经达到了1.0185 g,占身体重量的4.38%,甚至超过了大多数的哺乳动物。脑容量的扩张极大地增强了鸟类的适应能力。2013年的一项对200多种鸟类的研究表明,脑容量较大的鸟类的压力激素循环水平更低,从而能够更加轻松、从容地应对野外自然环境中的生存压力[16] 。而如鹌鹑和鸡之类的小脑容量鸟类,学习能力和应对复杂环境变化的抗压能力明显较低。
2.2.5. 哺乳类的脑与脑容量进化
哺乳类和鸟类的进化都是以爬行动物为起源的,它们出现的时间大致相同。哺乳动物高度适应陆地生态环境,它们胎生、哺乳以及具备恒温的特点使其各方面得到了充分的发展和完善,尤其是神经系统的进化更是明显。哺乳动物的脑由大脑、间脑、中脑、小脑及延脑组成,其大脑半球表面的皮质已经进化为新皮质(neocortex),具有典型的六层结构,而且皮质出现了沟纹和回转,功能的复杂性和精确性大大增加。而且大脑皮层是整个神经系统的联系中心,负责分析、处理来自全身各处的神经冲动。它们的纹状体显著退化为基底核;古皮质和旧皮质分别退化为梨状叶和海马(hippocampus),都与嗅觉有关。随着皮质的进化,哺乳动物大脑的左右半球出现了很多神经元相互联络形成的通道,称为胼胝体(corpus callosum),为哺乳类所特有。哺乳类的中脑较为退化,底部加厚形成大脑脚(cerebral peduncle),顶部形成四叠体(corpora quadrigemina),司视觉和听觉。小脑极其发达,位于后脑背部,是协调运动和控制平衡的中枢。随着大脑结构的复杂化,哺乳动物新皮质的容量也迅速增加,皮质增厚增高,表面积加大,脑容量明显扩增,大脑的左右半球体积极度膨大,不仅充满了颅腔的前部,更向后遮盖了间脑和中脑,灵长类的甚至盖住了小脑。另外,哺乳类的头骨出现愈合现象,骨块减少,脑颅扩大,脑容量得到极大提升,哺乳类的脑容量在脊椎动物中是最大的,脑占身体的比重为2%~9% [5] 。尤其是人类脑容量的发展更为明显,如生活在古印度的玛雅人(Maya-Quiche Indian)平均体重不超过50千克,但脑容量所占体重之比达到了3.17%。较大的脑容量使哺乳动物在陆地上得到长足的发展,它们的智力更为进化,行为方式更加复杂,社会关系更加紧密,因此哺乳类成为高度适应陆地生活的霸主。
在对鱼类的鳕鱼(Gadus callarias)、两栖类的牛蛙(Rana catesbiena)、爬行类的绿蜥蜴(Lacerta viridis)、鸟类的鸽(Columba livia)以及哺乳类的狒狒(Papio cynocephalus)和人(Homo sapiens)的脑容量进行分析和比较之后我们发现,在脊椎动物中,随着进化等级的提高,动物的脑容量以及脑体比总体呈现逐渐增加的趋势,低等脊椎动物的脑重所占体重之比极低,高等脊椎动物的脑体比相对较高,可以高达低等脊椎动物如鱼类、两栖类的几十倍(如图1)。据此,我们推测,脑容量与智力可能存在一定的相关性,如短嘴鸦(Corvus brachyrhynchos),一种被普遍认为是高智商的鸟类之一,其脑容量占体重之比为2.76%,远远超过了同为鸟类的鸽(Columba livia),几乎可以与人类(2.96%)相媲美。1940年,Crile & Quiring [15] 对3690种脊椎动物的脑重及体重等相关项目进行了数据统计,我们从中选取了鱼类、两栖类、爬行类、鸟类以及哺乳类的几个物种为研究对象,对脑容量的发展历程进行了分析(图1)。
 随着进化等级的提高,动物的脑容量以及脑体比总体呈现逐渐增加的趋势,且在从爬行类向鸟类过渡的过程中,脑容量出现了明显的转折,从爬行类以后,脊椎动物的脑容量开始急速扩增
随着进化等级的提高,动物的脑容量以及脑体比总体呈现逐渐增加的趋势,且在从爬行类向鸟类过渡的过程中,脑容量出现了明显的转折,从爬行类以后,脊椎动物的脑容量开始急速扩增
Figure 1. The variation tendency of several different groups of vertebrates’ brain-body size
图1. 几种不同类群的脊椎动物脑容量占身体比重的变化趋势
3. 人类进化历程中脑容量的演变
研究动物的脑容量变化,不得不提到灵长目的人类。灵长类动物是哺乳动物中进化得最完善、最成功的高等级智力动物。而人类更是灵长动物中的佼佼者,他们的大脑很早就已经进化到了较高的水平,
大脑皮层的精细程度比其他任何哺乳动物都要发达。虽然,数十万年来人类的脑容量几乎没有多少明显的提升,但相对于其他较低等的脊椎动物而言,人类的脑容量的发展是飞跃式的。
文化以及社会行为的进步极大地促进了人类脑的进化,对人科颅骨化石的研究表明,300多万年前生活的早期人类—阿法南方古猿(Australopithecus afarensis)的脑容量还不到450立方厘米,而同属南方古猿的体型稍大的鲍氏傍人(Paranthropus boisei)的脑容量可以达到500~550立方厘米。随着不断的进化,到230~150万年前,能人(Homo habilis)开始出现,这标志着人类与猿开始分离。能人已经可以制造并使用简单的石器,而且脑的大小也有了迅速的增加,他们的平均体重不超过30千克或者40千克,脑量已经达到600立方厘米以上[17] 。到旧石器时代,生活在距今200万~50万年前的直立人(Homo erectus)开始形成了原始的文明和社会组织,他们已经具备了语言交流的能力。在这个时期,随着石器工具的复杂化以及捕猎活动的集体化,语言被更加广泛、频繁地运用,个体变得越来越聪明,社会行为更加复杂[18] 。直立人的脑容量进一步扩大,生活在北京周口店的北京直立人(H. erectus pekinensis)的脑容量为915~1200立方厘米,平均可以达到1000立方厘米左右。直到30万~10万年以前,智人(Homo sapiens)的出现加速了人类的现代化,他们形成了相对较高水平的文明,脑容量上升到了1300多立方厘米,几乎达到了现代人的水平。生活在距今20万~3万年前的尼安德特人(Neanderthal)(简称尼人)是早期智人的代表,他们广泛使用精细的打制石器,拥有了使用火的能力,并且发明了一些较为进步的劳动工具和武器,情感和友谊在他们之间得到发展,精神世界已相当丰富。虽然仍有一些直立人的特征,但尼人的脑非常发达,脑容量与现代人类相差无几,平均为1500立方厘米。从尼安德特人以后,人类大脑所发生的深刻变化已经很少了[19] 。从人类整个进化的历程来看,人类脑容量的变化经历了一个近“S”形(图2),即两头进展缓慢,中间演变迅速的过程[20] 。
在人类进化的早期,脑容量的发展极其缓慢,其智力也处于较低等级;经历相当长时间的进化,到“能人”时期开始出现转折,人类脑容量迅速提升。在“能人”向“智人”过渡的时期中,许多人类特有的大脑皮质中枢得以产生,如运动性语言中枢、书写中枢、听力语言中枢等等。同时,大脑皮质还出现了欣赏音乐、舞蹈和绘画等艺术的中枢,大脑的功能越来越复杂、完善。尤其是随着抽象思维的发展,人类大脑额叶得到迅速扩张。到“智人”时期,脑容量的发展又出现了一个转折(图2,图3),自此之后,人类脑容量的进化又进入了一个缓慢发展的平台期或者说是停滞期,而且这个停滞期可能要持续相当长的
 人类的脑容量总体呈现“两头缓慢,中间迅速”的“S”型曲线式发展状态;其中“能人”和“智人”是两个关键的转折性时期。自“能人”以后,人类脑容量开始急速扩张;而经“智人”后,人类脑容量的发展渐趋平缓
人类的脑容量总体呈现“两头缓慢,中间迅速”的“S”型曲线式发展状态;其中“能人”和“智人”是两个关键的转折性时期。自“能人”以后,人类脑容量开始急速扩张;而经“智人”后,人类脑容量的发展渐趋平缓
Figure 2. The variation tendency of the brain size in human’s evolution
图2. 人类进化过程中脑容量的变化趋势
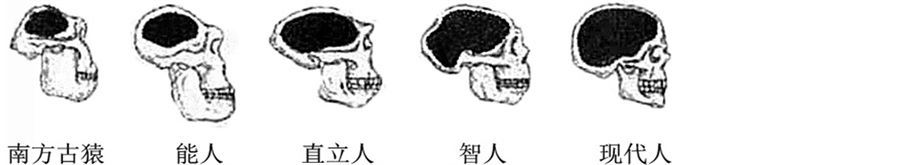 从南方古猿到现代人,人类的颅骨不断向外膨胀、向内扩张而逐渐隆起、椭圆化,颅腔容积不断增加,脑容量逐渐增大[21] ;能人的脑量是南方古猿的近2倍,是人类脑容量进化的一个重大转折;智人的脑量是能人的近2倍,已经达到现代人的水平,是脑容量进化的又一转折;现代人的颅骨极度圆拱化,其脑容量达到人类脑容量进化的最高水平
从南方古猿到现代人,人类的颅骨不断向外膨胀、向内扩张而逐渐隆起、椭圆化,颅腔容积不断增加,脑容量逐渐增大[21] ;能人的脑量是南方古猿的近2倍,是人类脑容量进化的一个重大转折;智人的脑量是能人的近2倍,已经达到现代人的水平,是脑容量进化的又一转折;现代人的颅骨极度圆拱化,其脑容量达到人类脑容量进化的最高水平
Figure 3. The variation of the skull morphology and brain size in human’s evolution (From Wu XJ, Liu W, Norton C. 2007)
图3. 人类进化过程中颅骨形态和脑容量的变化(自吴秀杰,刘武,Norton C. 2007)
时间。在整个脊椎动物的进化过程中,脑容量的变化是逐渐增加的,而且在低等脊椎动物中增加的速度较慢,随着动物进化等级的提高,脑容量得到迅速提升。数量庞大、种类繁多的神经细胞是大脑发挥功能的物质基础,脑容量的扩增为脑内神经元的增殖和分化提供了条件,从而进一步促进大脑功能的进化和发展。
4. 脑容量演变历程中的影响因素
对动物来说,无论是低等还是高等,脑容量在很大程度上决定了它们的认知能力、智力水平以及社会关系复杂程度[22] 。而动物的遗传特性、认知能力、社会地位、种群关系以及生活环境等一系列的因素又反过来对它们的脑容量造成影响。在漫长的进化过程中,脑容量的演变受到了多种因素的共同影响。
4.1. 基因进化对脑容量的影响
人类之所以区别于其他种类的脊椎动物,就在于人拥有世界上最为先进、精巧的大脑和复杂的认知能力。而脑容量的变化是人类拥有高度发达的大脑的主要特征之一。与其他灵长类相比,人类的脑容量为黑猩猩脑容量的近4倍,猕猴的近20倍。近年来,随着分子生物学、遗传学的发展以及核磁共振成像技术(Magnetic Resonance Imaging, MRI)的不断完善,人们得以从更加具体、微观的角度研究基因对脑容量的变化所造成的影响[23] 。研究表明,脑容量具有很高的遗传特性,将脑容量的变化与基因的进化相联系,有助于从根源上发现问题的本质,从而阐明脑容量进化的机制。随着诸如MCPH1、ASPM、FOXP2、MYH16等一系列与脑容量有关的基因的发现(表1),脑容量发生变化的机制正在被逐渐揭示。
Table 1. The Genes associated with the variation of brain volume
表1. 与脑容量变化相关的基因
MCPH1基因是最早被发现导致人类出现原发性小头症的基因。分析表明,MCPH1、ASPM基因存在一些特殊的突变位点,这些位点可以改变其对下游基因的调控作用,从而造成氨基酸的特异性突变。它们是人类发生进化的强烈正向选择信号,可能直接导致了人类在进化的初期阶段大脑容量的急剧扩增[24] ,并最终造成了人类与黑猩猩在进化上的分离。FOXP2基因于20世纪末被科学家首次发现,它可能通过影响语言的进化而影响脑容量的发展[25] 。在人类与其他灵长类分离后,FOXP2基因发生了T303N和N325S两个位点的突变;其中N325S位点的突变受到正向选择,并改变了转录因子的调控路径,进而对人类中枢神经系统的发育造成影响。同时,FOXP2的突变使脑皮质—基底核回路得到改善,导致语言发生进化,从而促进了脑容量的增加[26] 。Pax-6和Emx-2是在端脑进化过程中发挥作用的基因。这两个基因的表达是互补的,Pax-6基因在端脑的表达水平从前到后逐渐降低;而Emx-2的表达量从前到后逐渐增高,在前侧部低表达,中后部高表达[27] [28] 。然而有趣的是,Emx-2突变动物表现为中后部皮质区缩小,前侧部皮质区扩张;而Pax-6突变的动物则表现为前侧部缩小和后中部扩张[29] 。上述证据表明,基因不同位置的梯度表达可能对端脑的增长和发育有着极其重要的影响,进而影响到整个大脑的体积。
PDGFD是生长信号通路的关键成员,它作用于人类大脑中的放射状胶质细胞(radial glial cell)等前体细胞,保证干细胞的正常扩增。实验证明,在哺乳动物的进化过程中,PDGFD的表达影响了放射状胶质细胞增殖的信号通路[30] ,使细胞活性增强,从而促进大脑神经细胞增多,大脑皮层增大,脑容量显著膨胀。ADCYAP1是被发现的另一个与神经前体细胞的增殖有关的基因。该基因携带有加速蛋白序列进化的信息,在神经细胞从增殖到分化状态进行过渡中起到的调节作用意义非凡。重要的是,与非人灵长类相比,在人类中ADCYAP1具有较高的专一性非同义替换率,这表明它与人类的脑进化密切相关。2012年,Lou XJ,Li M等人在研究脑容量对人类认知能力的影响时,发现位于人类5号染色体长臂23.2~33.1区域的序列变异位点(rs31480等)与脑容量强烈相关[31] 。实验分析发现,受rs31480影响的Interleukin-3 (白介素-3,IL-3)基因所表达的白介素-3能够参与中枢神经系统的发育,从而提升神经前体细胞的增殖和存活能力。也就是说,该序列变异位点通过白介素-3间接地促进了脑容量的增加。AHI1与Joubert syndrome脑畸形有关,这种畸形是由脑向脊髓的纤维导向障碍造成的[4] 。ASPM、ADCYAP1和AHI1都具有促进非同义序列改变的功能,并且这种改变自人类与黑猩猩发生分离后,在人类这条谱系得到不断的延续。
MYH16是负责编码一种肌球蛋白的基因。在非人类灵长类动物,MYH16专一性表达在某些头部肌肉,特别是下颌嚼肌。在人体内,MYH16基因发生了突变,减缓了嚼肌的生长速率,从而解放了以往被束缚的颅骨,大脑容量因此有了充足的空间进行发展。虽然目前对造成MYH16基因突变的原因尚不清楚,但可以肯定的是该基因的突变极大地促进了人类脑容量的进化[32] 。
与脑容量变化相关基因的发现,使传统的脑进化观点面临着新的挑战,同时也在生物界引发了一场意义重大的变革。但也有一些研究者对“基因突变论”持反对态度,他们认为,仅仅将脑容量的进化归因于少数几个基因的突变是明显不合理的,这是一种违背进化基本原理的推断。但基因突变在一定程度上确实对人类以及脊椎动物的脑容量变化造成了不可忽视的影响[33] 。研究表明,在人脑中,相关基因的突变可以直接导致该区域面积的缩减[34] ,从而对整个大脑的体积造成影响。
4.2. 行为变化对脑容量的影响
行为和认知方式的差别也是人类与其他动物之间最显著的区别之一。行为和认知的复杂性与组织性,都与脑容量的扩大有着直接的联系[35] 。在进化过程中,动物的行为变化是极其复杂的,工具的创造和使用是动物尤其是人类行为特征变化的重要方面。由于生存的需要,使用工具进行捕食对于动物变得越来越重要,一些动物逐渐学会了使用简单的工具,如海獭会用石块砸开贝类坚硬的外壳,黑猩猩会用树枝钓取地下的白蚁等。人类不仅拥有构造精细的大脑,而且还有着一双可以与大脑媲美的灵活而巧妙的手。人类通过双手来制造并使用工具,为了获得蛋白质、脂质等更高热量、高营养的食物,人类就要不断发明更为先进、方便的工具,采用更加高效的狩猎方式,这反过来使人的智力得到进一步的发展[36] 。工具使人类的生活和劳作变得更为高效、便利,同时也导致人类的双手和大脑变得更为灵巧、先进。人类在进化的过程中,这一行为方式得到不断的选择和发展,它与大脑的进化得到相互促进。
4.3. 劳动和语言对脑容量的影响
恩格斯说:“劳动是同制造工具一起开始的……语言是从劳动中并和劳动一起产生的……首先是劳动,然后是语言和劳动一起,成了人脑发展的两个最主要的推动力……”[37] 。在人类进化的过程中,随着各种工具、武器的制造和使用,狩猎和劳作的集体化,组织与协作的需求逐渐增多,人们之间的交流愈加频繁。劳动使人们得以获得足够的食物和生活资料,并且更加适应自然环境。更为重要的是,在进行劳动的过程中,人类产生了意识能力,并不断得到发展,进而形成独特的语言能力。劳动使人脑得到充足的锻炼,变得更为精巧和复杂,大脑皮质不断出现区域性特化,逐渐形成了人类所特有的语言中枢,如运动性语言中枢(说话中枢)、视运动性语言中枢(书写中枢)、视觉性中枢(阅读中枢)、听觉性语言中枢等[38] 。关于语言对人类所产生的意义,鲁迅认为:语言文字是人类生命中必不可少的重要部分,它与人的生存息息相关。文字是人类独有的抽象性符号语言,是语言的进一步发展。文字的出现使得语言可以跨过时间和空间进行传播,大大提高了人类沟通交流的效率,拓展了社会活动的空间。有了语言和文字作为交流的媒介,人与人之间逐渐形成情感的纽带,社会关系进一步亲密、复杂化。在进行交流的同时,人们的思维开始产生创新,进而创造出绘画、音乐等艺术以及文学,渐渐形成了人类社会独有的文化体系。人类通过劳动能力、语言能力和思维能力创造了先进的物质文明和精神文明,社会文明的形成和复杂化反过来又极大地促进了人类神经系统的发展,进而导致人类脑容量和智力的不断进化。
4.4. 食物对脑容量的影响
食物为人类提供生命活动所需的能量和营养,它对脑容量和智力的进化有着不可忽视的影响[23] [39] 。人类是杂食性动物,最早的人类主要依靠植物性食物为生,他们的饮食中至少有95%的热卡是来自水果、树叶和秸秆等植物。早期人类的大脑很难从低能量、低营养的淀粉等糖类食物中获得足够的营养进行发育,因此他们的智力水平不高,脑容量普遍较小。随着生存环境的不断变化,进化了的灵长类(300多万年前的早期人类)学会使用工具进行捕猎,他们的食谱开始向肉类过渡。“肉食使脑髓获得了比过去多得多的营养和发展所必需的材料,因此脑髓就能够一代一代更迅速更完善地发展起来……我们必须承认:假若不食肉食,人就不会发展到这个地步……”[39] 。由于饮食中肉类的比例越来越大,人类得到的动物蛋白越来越多,食物营养更加丰富,从而为大脑的发育提供了充足能量和营养,脑容量得到极大扩展。现代人的食物营养更加均衡,他们的脑容量几乎比早期的古猿类扩增了3~4倍(图2),这为人类智力的发展打下了良好的物质基础。
脑容量的变化受到多种因素的共同调节,基因的进化为脑容量的发展打下基础,而动物本身行为特征的改变又推动了脑容量的进一步发展。在适应复杂多变的环境的同时,动物产生了更加丰富的社会行为和组织关系,社会行为的不断进化导致动物的脑容量和行为认知能力之间形成一个良性循环,进而引起大脑智力的不断提升和发展。
5. 结束语
动物从低等到高等,它们的神经系统从原始的简单网状神经开始,到梯状神经、链状神经,最后到脊椎动物形成高级复杂的大脑,经历了漫长的演变历程。而在脊椎动物在进化的过程中,脑容量也随着神经系统的复杂化逐渐扩增。脑容量的变化关系着认知能力、智力水平以及大脑功能的进化。较高的脑容量为动物的认知和智力发展提供了保障,高等脊椎动物具有较高的脑容量,因而也具有较高的智力和更加高等的认知能力以及复杂的行为。在进化中,基因以及行为的改变是造成脑容量发生变化的关键因素。就人类来说,行为的改变所造成的影响是巨大的,包括工具的制造和使用,劳动的日益增加,语言文字的形成,食性由素食向肉食转变等等,这些都对脑容量的进化起到了至关重要的推动作用。
发展的脚步永不停歇,生命的进化也将继续。脑容量的进化虽然缓慢,但随着时代的更迭,它终将不断引起大脑功能的发展和完善。只有综合考虑与大脑进化相关的各种因素,才能全面地把握脑容量发展的脉络,从而合理有效地开发我们的大脑。
基金项目
国家自然科学基金(31070952, U1204311);河南省自然科学基金(12B320011, 12B180016);河南省科技厅年度研究计划项目(122102310495)。
文章引用
姜树华,沈永红,邓锦波, (2015) 生物进化过程中人类脑容量的演变
The Development of Human Brain Volume in the Biological Evolution. 现代人类学,03,32-42. doi: 10.12677/MA.2015.33005
参考文献 (References)
- 1. Bear, M.F., Connors, B.W. and Paradiso, M.A. (2004) 神经科学——探索脑. 2版, 王建军, 等, 译. 高等教育出版社, 北京, 3-25.
- 2. Henneberg, M. (1998) Evolution of the human brain: Is bigger better? Clinical and Experimental Pharmacology and Physiology, 25, 745-749. http://dx.doi.org/10.1111/j.1440-1681.1998.tb02289.x
- 3. Honea, R., Crow, T.J., Passingham, D., et al. (2005) Regional deficits in brain volume in schizophrenia: A meta-analy- sis of voxel-based morphometry studies. American Journal of Psychiatry, 162, 2233-2245. http://dx.doi.org/10.1176/appi.ajp.162.12.2233
- 4. 邓锦波, 席艳, 李瑞玲 (2010) 脑的进化及其基因调控. 解剖学研究, 1, 59-65.
- 5. 刘凌云, 郑光美 (2009) 普通动物学. 4版, 高等教育出版社, 北京, 320-557.
- 6. 崔佳 (2014) 生物进化的历史. 1版, 中华工商联合出版社, 北京, 163-219.
- 7. Ullmann, J.F.P., Cowin, G. and Collin, S.P. (2010) Quantitative assessment of brain volumes in fish: Comparison of methodologies. Brain, Behavior and Evolution, 76, 261-270. http://dx.doi.org/10.1159/000321467
- 8. 金刚, 丁莉, 李钟杰 (2008) 保安湖四种小型鱼类脑指数初步研究. 水生生物学报, 1, 109-111.
- 9. Yu, L., Tucci, V., Kishi, S. and Zhdanova, I.V. (2006) Cognitive aging in zebrafish. PLoS ONE, 1, e14. http://dx.doi.org/10.1371/journal.pone.0000014
- 10. Gaikwad, S., Stewart, A., Hart, P., Wong, K., Piet, V., Cachat, J. and Kalueff, A.V. (2011) Acute stress disrupts performance of zebrafish in the cued and spatial memory tests: The utility offish models to study stress-memory interplay. Behavioural Processes, 87, 224-230. http://dx.doi.org/10.1016/j.beproc.2011.04.004
- 11. 刘敬泽, 吴跃峰 (2013) 动物学. 1版, 科学出版社, 北京, 197-305.
- 12. Roth, G., Blanke, J. and Wake, D.B. (1994) Cell size predicts morphological complexity in the brains of frogs and salamanders. Proceedings of the National Academy of Sciences of the United States of America, 91, 4796-4800. http://dx.doi.org/10.1073/pnas.91.11.4796
- 13. Jarvis, E.D., Güntürkün, O., Bruce, L., Csillag, A., Karten, H., Kuenzel, W., et al. (2005) Avian brains and a new understanding of vertebrate brain evolution. Nature Reviews Neu-roscience, 6, 151-159. http://dx.doi.org/10.1038/nrn1606
- 14. Ulinski, P.S. (1980) Functional morphology of the vertebrate visual system an essay on the evolution of complex systems. Integrative and Comparative Biology, 20, 229-246. http://dx.doi.org/10.1093/icb/20.1.229
- 15. Crile, G., Quiring, D.P. (1940) A record of the body weight and certain organ and gland weights of 3690 animals. The Ohio Journal of Science, 40, 219-285.
- 16. Lendvai, A.Z., Bokony, V., Angelier, F., Chastel, O. and Sol, D. (2013) Do smart birds stress less? An interspecific relationship be-tween brain size and corticosterone levels. Proceedings of the Royal Society B, 280, Article ID: 20131734. http://dx.doi.org/10.1098/rspb.2013.1734
- 17. 吴秀杰 (2005) 化石人类脑进化研究与进展. 化石, 1, 8-13.
- 18. Reader, S.M. and Laland, K.N. (2002) Social intelligence, innovation, and enhanced brain size in primates. Proceedings of the National Academy of Sciences of the United States of America, 99, 4436-4441. http://dx.doi.org/10.1073/pnas.062041299
- 19. Pilbeam, D. (1983) 周明镇, 周本雄, 译. 人类的兴起——人类进化概论. 1版, 科学出版社, 北京, 102-105.
- 20. 陈文静, 邓锦波 (2012) 浅谈人类脑与智力进化. 河南大学学报(医学版), 1, 52-54.
- 21. 吴秀杰, 刘武, Norton, C. (2007) 颅内模——人类脑演化研究的直接证据及研究状况. 自然科学进展, 6, 707-715.
- 22. Rushton, J.P. and Ankney, C.D. (2009) Whole brain size and general mental ability: A review. International Journal of Neuroscience, 119, 691-731. http://dx.doi.org/10.1080/00207450802325843
- 23. Gilert, S.L., Dobyns, W.B. and Lahn, B.T. (2005) Genetic links between brain development and brain evolution. Nature Reviews Genetics, 6, 581-590. http://dx.doi.org/10.1038/nrg1634
- 24. Shi, L., Li, M., Lin, Q., Qi, X. and Su, B. (2013) Functional divergence of the brain-size regulating gene MCPH1 during primate evolution and the origin of humans. BMC Biology, 11, 62. http://dx.doi.org/10.1186/1741-7007-11-62
- 25. Benítez-Burraco, A. and Boeckx, C. (2014) FOXP2, retinoic acid, and language: A promising direction. Frontiers in Cellular Neuroscience, 8, 387. http://dx.doi.org/10.3389/fncel.2014.00387
- 26. Catania, A.C. (2014) Environments organize the verbal brain. Behavioral and Brain Sciences, 37, 550-551.
- 27. Bishop, K., Goudreaua, M. and O’Leary, D. (2000) Regulation of area identity in the mammalian neocortex by Emx2 and Pax6. Science, 288, 344-349. http://dx.doi.org/10.1126/science.288.5464.344
- 28. Mallamaci, A., Muzio, L., Chan, C.H., Parnavelas, J. and Boncinelli, E. (2000) Area identity shifts in the early cerebral cortex of Emx 2-/- mutant mice. Nature Neuroscience, 3, 679-686. http://dx.doi.org/10.1038/76630
- 29. Szucsik, J.C., Witte, D.P., Li, H., Pixley, S.K., Small, K.M. and Potter, S.S. (1997) Altered forebrain and hindbrain development in mice mutant for the Gsh2 homeobox gene. Deve-lopmental Biology, 191, 230-242. http://dx.doi.org/10.1006/dbio.1997.8733
- 30. Lui, J.H., Nowakowski, T.J., Pollen, A.A., Javaherian, A., Kriegs-tein, A.R. and Oldham, M.C. (2014) Radial glia require PDGFD-PDGFRβ signalling in human but not mouse neocortex. Nature, 515, 264-268. http://dx.doi.org/10.1038/nature13973
- 31. Lou, X.J., Li, M., Huang, L., Nho, K., Deng, M., Chen, Q., et al. (2012) The interleukin 3 gene (IL3) contributes to human brain volume variation by regulating proliferation and survival of neural progenitors. PLOS ONE, 7, e50375. http://dx.doi.org/10.1371/journal.pone.0050375
- 32. Perry, G.H., Verrelli, B.C. and Stone, A.C. (2005) Compar-ative analyses reveal a complex history of molecular evolution for human MYH16. Molecular Biology and Evolution, 22, 379-382. http://dx.doi.org/10.1093/molbev/msi004
- 33. Hager, R., Lu, L., Rosen, G.D. and Williams, R.W. (2012) Genetic architecture supports mosaic brain evolution and independent brain-body size regulation. Nature Communications, 3, 1079. http://dx.doi.org/10.1038/ncomms2086
- 34. Derrek, P. and Hibar, J.L. (2015) Common genetic variants influence human subcortical brain structures. Nature, 520, 224-229. http://dx.doi.org/10.1038/nature14101
- 35. Isler, K. and van Schaik, C.P. (2009) The expensive brain: A frame-work for explaining evolutionary changes in brain size. Journal of Human Evolution, 57, 392-400. http://dx.doi.org/10.1016/j.jhevol.2009.04.009
- 36. Lefebvre, L. (2013) Brains, innovations, tools and cultural transmission in birds, non-human primates, and fossil hominins. Frontiers in Human Neuroscience, 7, 245. http://dx.doi.org/10.3389/fnhum.2013.00245
- 37. 恩格斯 (1952) 劳动在从猿到人转变过程中的作用. 5版,人民出版社, 北京, 8-15.
- 38. Foley, A.C. and Stern, C.D. (2001) Evolution of vertebrate forebrain development: how many different mechanisms? Journal of Anatomy, 199, 35-52. http://dx.doi.org/10.1046/j.1469-7580.199.parts1-2.5.x
- 39. Sternberg, R.J. (2004) Culture and intelligence. American Psychologist, 59, 325-328. http://dx.doi.org/10.1037/0003-066X.59.5.325
