Journal of Comparative Chemistry
Vol.02 No.03(2018), Article ID:25719,15
pages
10.12677/CC.2018.23011
Progress in Endogenous Substances Related Sedative—Hypnotic and Arousal
Ying Zhang1, Gang Wang2, Qing Min3, Mixia Ma1,4,5, Wenxiang Hu1,4,6*
1Jingdong Xianghu Microwave Chemistry Union Laboratory, Beijing Excalibur Space Military Academy of Medical Sciences, Beijing
2Beijing Institute of Information Technology, Beijing
3School of Pharmacy, Hubei University of Science and Technology, Xianning Hubei
4Wuhan Institute of Technology, Wuhan Hubei
5Beijing Union University, Beijing
6Space Systems Division, Chinese People’s Liberation Army Strategic Support Troops, Beijing
Received: Jun. 1st, 2018; accepted: Jun. 25th, 2018; published: Jul. 2nd, 2018

ABSTRACT
The search for endogenous inducing sleep substances has been a research focus of many scientific research institutions. Recent studies suggest that the occurrence of sleep-wake is closely related to the specific structure of the central nervous system and the role of different transmitters (also known as endogenous substances). These endogenous substances have their own safety and efficacy characteristics as medicines, health food ingredients, and the like. This article briefly describes the correlation, mechanism, chemical structure and composition of these endogenous substances with sedation and hypnosis and related applications and development prospects. Progress in the study on endogenous substances related sedative-hypnotic and arousal was reviewed.
Keywords:Composure, Hypnosis, Arousal, Endogenous Substances
镇静催眠–觉醒相关内源性物质研究进展
张莹1,王刚2,闵清3,马密霞1,4,5,胡文祥1,4,6*
1北京神剑天军医学科学院京东祥鹄微波化学联合实验室,北京
2北京信息技术研究所,北京
3湖北科技学院药学院,湖北 咸宁
4武汉工程大学,湖北 武汉
5北京联合大学,北京
6中国人民解放军战略支援部队航天系统部,北京

收稿日期:2018年6月1日;录用日期:2018年6月25日;发布日期:2018年7月2日

摘 要
寻找内源性诱导睡眠物质一直是很多科研机构的研究重点。近期的研究认为,睡眠–觉醒的发生与中枢神经系统内的某些特定结构以及不同递质(也称为内源性物质)的作用密切相关。这些内源性物质本身作为药物、保健食品原料等,具有安全有效的特点。本文简述了这些内源性物质与镇静催眠的相关性、机制、化学结构和组成、有关的应用及发展前景。
关键词 :镇静,催眠,觉醒,内源性物质

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
人们对睡眠–觉醒的确切发生机制至今仍然知之不多,研究发现:睡眠是中枢神经系统内产生的一个主动循环的过程,主要经历非快速眼球运动睡眠(NREMS)和REMS (快速眼球运动睡眠)的循环;对丘脑正中线或者基底前脑进行电刺激可以引起睡眠;损伤下丘脑吻部可引起慢性睡眠抑制。其主要机制分为神经递质机制、免疫调节机制、肽类物质诱导睡眠机制、激素调节机制、一氧化碳与睡眠机制五个方面。可见与镇静催眠–觉醒有关的内源性物质发挥着重要的生理作用 [1] 。
2. 神经递质机制的内源性物质——氨基酸
2.1. γ-氨基丁酸(GABA)
神经递质机制GABA是哺乳动物中枢神经系统内最重要的氨基酸类神经递质,对神经元的活动具有抑制性调控作用。研究证明,不同脑区γ-氨基丁酸含量及受体功能的改变参与睡眠及不同睡眠时相的转换,在睡眠的调节中发挥着重要作用。一些药物能通过抑制GABA的分解以提高其在脑内的含量,也在一定程度上增加慢波睡眠SWS。
γ-氨基丁酸(GABA)
2.2. γ-羟基丁酸(GHB)
GHB是哺乳动物和人体内γ-氨基丁酸的代谢物,它是一种内生的生物物质,在医学、药学领域里被认为是一种神经递质,在自我平衡调整和产生有规律睡眠等方面起着非常重要的作用,是一种高效能的中枢神经抑制剂。GHB有严重的副作用,已逐渐被其它药物取代。它有强烈的镇静作用和健忘效果,与酒精混合使用毒副作用更加明显,常常被用作迷奸药,会带来严重的社会问题。2007年国家食品药品监督管理局将GHB列为一类精神药物进行管理。现在,GHB仍被作为附加麻醉剂和催眠剂使用,还被应用于酒精依赖和鸦片戒断综合征以及嗜睡病人等治疗中,GHB也能刺激体内荷尔蒙的分泌,增加欣快感。
γ-羟基丁酸(GHB)
2.3. γ-丁内酯(GBL)
GBL是GHB的前体药物,通常被看作摄取后转化为GHB的相关物质,也是哺乳动物的大脑里的内生物质,是一种高效能的中枢神经抑制剂。医药工业中,用作麻醉剂及镇静药治疗癫痫、脑出血和高血压,研究发现,它们具有抗肿瘤和类似昆虫激素等生物活性。GBL在酶催化作用下或是增加pH的情况下,很快转化为GHB,是重要的有机化工原料及精细化工中间体,在石油化工、医药、农药等领域有着广泛的应用。
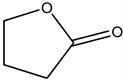
γ-丁内酯(GBL)
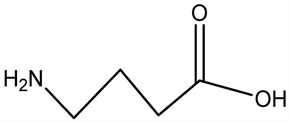
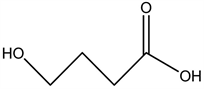
2.4. 1,4-丁二醇
1,4-丁二醇(1,4-BD)是GHB的前体药物,通常被看作摄取后转化为GHB的相关物质,也是哺乳动物的大脑里的内生物质,是一种高效能的中枢神经抑制剂。1,4-BD在酶催化作用下或是增加pH的情况下,很快转化为GHB,是重要的有机化工原料。

1,4-丁二醇
2.5. 甘氨酸(Gla)
甘氨酸也是一种抑制性递质,广泛分布于中枢神经系统。

甘氨酸(Gla)
2.6. 牛磺酸(Taurine)
牛磺酸可增加纹状体多巴胺的合成与释放,突触小泡对多巴胺的摄取需要Cl−的存在,而牛磺酸可增加Cl−的传导,牛磺酸与肾上腺素能神经元间存在着相互作用,在大脑和松果体,β-肾上腺素可导致牛磺酸的释放。牛磺酸可促进REMS和觉醒,一般认为脑内DA神经兴奋,动物觉醒增加,睡眠减少。
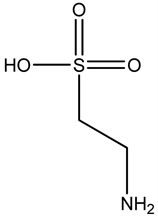
牛磺酸(Taurine)
2.7. 谷氨酸(Glu)
神经递质机制,谷氨酸是哺乳动物中枢神经系统内最重要的氨基酸类神经递质,对神经元的活动具有抑制性调控作用。研究室发现双侧海马微量注射L一谷氨酸(L-Glu)和环磷酸腺苷引起慢波睡眠(SWS)和总睡眠时间(TST)增加,觉醒减少。
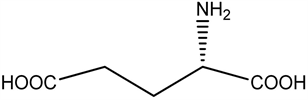
谷氨酸(Glu)
3. 神经递质机制的内源性物质——胺
3.1. 5-羟色胺(5-HT血清素)
5-HT血清素主要集中于中脑的中缝系统。中脑的中缝核头端含有大量的5-HT能神经元,破坏此处,NREMS完全消失,这一效应可被静脉内注射5-羟基色氨酸消除。所以,5-HT是引发NREMS的重要递质。5-HT还可通过对其他神经通路的调节发挥对睡眠调节功能。如,5-HT可以通过抑制背侧被盖和脑桥脚盖核的Ach神经元的活动,使REMS减少,也可作用于蓝斑处NE神经元调节睡眠–觉醒。

5-羟色胺(5-HT)
3.2. 多巴胺(DA)
DA促进REMS和觉醒,一般认为脑内DA神经兴奋,动物觉醒增加,睡眠减少。

多巴胺(DA)
3.3. 去甲肾上腺素(NA)
实验性损伤脑桥蓝斑核和其发出的去甲肾上腺素上行神经纤维后,可造成觉醒明显减少,证实蓝斑核中去甲肾上腺素能神经元参与行为觉醒和脑电觉醒的调节,去甲肾上腺素能神经元活动增加与机体的过度警觉状态相关。黑质和中脑腹侧被盖区的多巴胺神经元也与行为觉醒和脑电觉醒有关。去甲肾上腺素和多巴胺增加觉醒时间、延长睡眠潜伏期和快速眼动睡眠潜伏期;减少总睡眠时间,主要减少快速眼动睡眠和深睡眠时间。
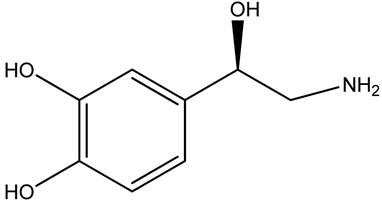
去甲肾上腺素(NA)
3.4. 组胺(Histamine)
哺乳动物组胺能神经元集中分布于下丘脑后部的结节乳头核(TMN),其神经纤维投射至全脑。研究发现,中枢组胺的释放与觉醒时相呈正相关,觉醒期的释放量是睡眠期的4倍;内源性物质前列腺素E2和神经肽阿立新激活TNM组胺能神经元,增加组胺释放,促进觉醒;前列腺素D2和腺苷抑制组胺能神经元活性,诱导睡眠。
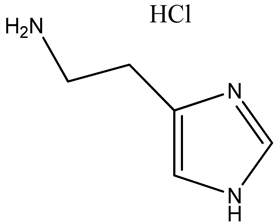
组胺(Histamine)
4. 神经递质机制的内源性物质——季铵盐
乙酰胆碱(Ach)
背外侧和脚桥被盖核区(LD-PPT)的乙酰胆碱能神经元直接或与基底前脑的乙酰胆碱能神经元投射到大脑皮层,以维持大脑皮质兴奋状态,并与快速眼动睡眠有关,背外侧和脚桥被盖核区的乙酰胆碱能神经元向下投射至脊髓r运动神经元抑制肌紧张。
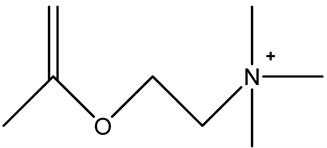
乙酰胆碱(Ach)
5. 神经递质机制的内源性物质——嘌呤
5.1. 腺苷(adenosine, AD)
腺苷又称腺嘌呤核苷,是一种内源性核苷,由腺嘌呤和戊糖结合而成。它是一种睡眠因子,是脑内能量代谢的产物。其A1及A2A受体与睡眠调节密切相关,它能通过A1受体抑制基底前脑胆碱能神经元活性。通过A2A受体激活VLPO区促睡眠神经元,抑制TMN等促觉醒脑区神经元从而促进睡眠。
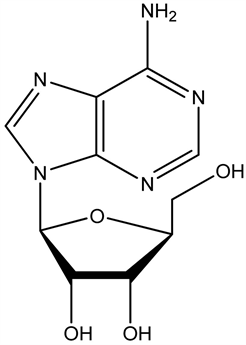
腺苷(adenosine, AD)
5.2. 环磷酸腺苷(Cyclic AMP)
谷氨酸(L-GLU)和环磷酸腺苷引起慢波睡眠(SWS)和总睡眠时间(TST)增加,觉醒减少。
6. 神经递质机制——免疫调节机制
6.1. 白细胞介素-1 (1L-1)
1L-1可由多种细胞产生,在生理状态下还能调节食欲、睡眠、胃肠道功能、大脑的发育及内分泌。有研究表明,家兔脑室内注射人的单核细胞及兔的腹腔巨噬细胞产生的1L-1,可引起体温升高,并呈剂量依赖性的增加动物慢波睡眠(SWS)。应用抗热原Anisomycin可对抗1L-1的致热作用,而对睡眠增多无影响。研究证实1L-1的致睡作用并非发热引起的,而是直接作用于中枢的结果。在大鼠脑内1L-1mRNA表达及1L-1受体分布,主要集中于海马、下丘脑、小脑及皮层等,可见中枢神经系统内有合成1L-1的细胞,也有1L-1受体,且1L-1的表达存在昼夜节律,表达的高峰相与睡眠高峰一致。在人体内,血浆中1L-1的高峰水平出现在睡眠的启动时刻,而人在睡眠剥夺后,脑脊液中的1L-1水平增加。1L-1与TNT有协同调节睡眠的作用。
IL-1有两种不同的分子形式,一种称IL-1α,由159个氨基酸组成;另一种称为IL-1β,含153个氨基酸;两者由不同的基因分别编码。虽其氨基酸顺序仅有26%的同源性,然而IL-1α和IL-1β以同样的亲和力结合于相同的细胞表面受体,发挥相同的生物学作用。
6.2. 白细胞介素(1L-2)
1L-2又叫T细胞生长因子,具有多种神经生物学特性。Born报道,睡眠时血清1L-2水平是增高的,并且有着明显的昼夜节律性。有资料表明睡眠剥夺时体内去甲肾上腺素(NE)浓度升高是由1L-2介导的,后者使β-肾上腺素受体激活。在鼠第二脑室或脑室蓝斑处注入鼠1L-2或重组人1L-2可诱导睡眠,同时脑电图也有相应变化,其效应约维持25~140 min与剂量相关。
其分子量约为15.5 KDa的糖蛋白,由153个氨基酸肽链N端剪掉20个氨基酸残基的信号肽后剩下的133个氨基酸残基组成,它与其它的细胞因子在序列上无同源性。
6.3. 白细胞介素4、10 (1L-4、1L-10)
1L-1、1L-2、1L-6及TNT在睡眠过程中具有一定的昼夜节律性,它们能不同程度地促进睡眠,L-1、TNT能协同作用调节睡眠,用其拮抗剂均能减弱催眠功能,脑内催眠因子通过脑脊液向外周传递信息。另外,1L-4、1L-10、GABA等亦参与睡眠的调节。细胞因子等基因疗法用于人体治疗失眠症已取得初步疗效,但仍有许多问题尚待解决。
1L-4相对分子量为15.0 × 103,有N糖基化位点且不同条件下呈现不同的糖基化程度,其前体是153肽,成熟的1L-4去除信号肽后为129肽。1L-4分子内的3组二硫键为生物活性所必需,分别形成于C3-C127,C24-C64,C46-C99处。1L-4分子构型以α螺旋为主 [2] 。
6.4. 白细胞介素-6 (1L-6)
1L-6是近十年来发现的一种多功能细胞因子,除参与免疫反应外,还是中枢神经内分泌调节递质。现证实1L-6在睡眠调节中起着一定的作用。资料显示在嗜睡及肥胖患者血清中1L-6水平显著增高。
1L-6的基因长约5 kb,定位于7q,由5个外显子加4个内含子组成。
6.5. 肿瘤坏死因子(TNF)
TNF经静脉注射或脑室内注入均可延长家兔睡眠时间,SWS为主。TNF促进小鼠、大鼠脑内5-HT的合成,提高5-HT及其代谢产物的含量,这可能是TNT促进SWS的机制 [3] 。
TNF是一种多肽。TNF含157个氨基酸残基,相对分子量为17,350,它的第一结构是一种三聚体,其中的每一个亚基都具有一个典型的Jcllyroll-β结构。它是迄今所知的第一个非病毒蛋白,而且具有典型病毒胞衣。
6.6. 异丙肌苷
异丙肌苷注射1周(25.50 mg,1次/d),可明显延长小鼠戊巴比妥诱导的睡眠时间,增强ConA,LPS诱导的淋巴细胞转化,促进腹腔分泌1L-1和TNF。
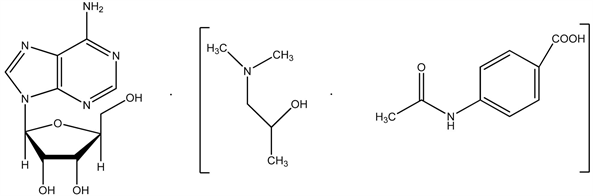
异丙肌苷(Isoprinosine)
7. 神经调质——肽类物质诱导睡眠
7.1. 血管活性肠肽
血管活性肠肽(VIP)是一种碱性多肽,它作为神经肽递质的信号分子,参与机体多种功能的信息传递和生理调控。VIP主要通过中枢影响动物的睡眠。猫和兔脑室内给予VIP后呈现REMS睡眠增多,而NREMS睡眠无变化。大鼠脑室内注射VIP,可使REMS睡眠和NREMS睡眠都增多。
VIP是由28个氨基酸组成的多肽,为一直链结构的小分子神经肽,相对分子质量为3323,属胰高血糖素–胰泌素家族 [4] 。
7.2. 甘丙肽(GAL)
实验结果均表明,腹外侧视前区中含有睡眠活性神经元是诱发睡眠的主要中枢,尤其与深睡眠有关,腹外侧视前区的睡眠活性神经元中含有抑制性神经递质GABA和甘丙肽(GAL),GAL是维持正常睡眠的主要物质,甘丙肽由29个氨基酸残基组成的多肽 [5] 。
7.3. 神经肽P物质(SP)
神经肽P物质(SP)属于速激肽(Tachykinin)家族中的一员,是体内最早发现的一种神经肽。SP神经元及其受体广泛分布于外周及中枢神经系统中,既往研究发现SP在痛觉调制、心血管活动和胃肠道运动中发挥重要作用。最近,Lieb等研究发现健康成人经外周静脉给予SP可影响机体睡眠。Kohlmeier等发现位于中脑和脑桥背侧的胆碱能神经元胞体内共存着SP,其轴突纤维投射到与诱导异相睡眠(PS)相关的脑桥网状结构,提示SP可能参与机体睡眠的调节。已知下丘脑腹外侧视前区(VLPO)对机体睡眠的产生和维持起关键作用,被公认为是机体慢波睡眠(SWS)的中枢。免疫组织化学研究已证实VLPO神经元上有SP受体并接受来自SP阳性神经元的纤维投射。
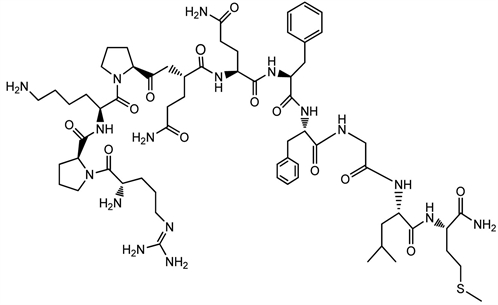
神经肽P物质(SP)
7.4. 阿片肽–脑啡肽(ENK)、内啡肽、强啡肽
阿片类似物吗啡有感觉麻醉和行为迟缓等作用。阿片肽,包括脑啡肽,内啡肽和强啡肽(dynorphin, DYN)在感觉调节和止痛中起一定作用,对睡眠的启动很重要,却不延长SWS。
阿片肽–脑啡肽结构:
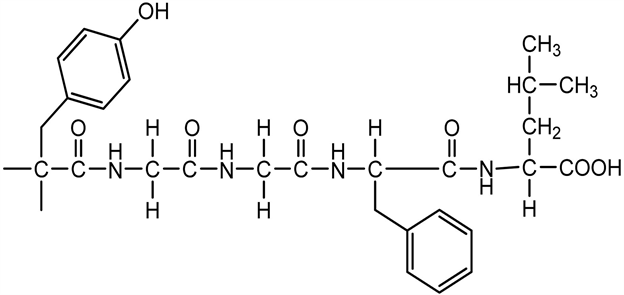
阿片肽–脑啡肽
7.5. 阿片肽–内啡肽(endorphin)
有三种主要的内啡肽:α-内啡肽,一种由β-促脂解素分子的61~76位氨基酸组成的阿片肽;由β-促脂解素分子的61~91位氨基酸组成的β-内啡肽;由β-促脂解素分子的61~77位氨基酸组成的γ-内啡肽 [6] 。内啡肽(endorphin)亦称安多芬或脑内啡,是一种内成性(脑下垂体分泌)的类吗啡生物化学合成物激素。它是由脑下垂体和脊椎动物的丘脑下部所分泌的氨基化合物(肽)。它能与吗啡受体结合,产生跟吗啡、鸦片剂一样有止痛和欣快感。等同天然的镇痛剂。利用药物可增加脑内啡的分泌效果。
7.6. 阿片肽–前强啡肽(PDP)
含有256个氨基酸残基,可水解产生强啡肽A (Dyn-A)、强啡肽B (Dyn-B)、α-新内啡肽(α-N-EP)和β-新内啡肽(β-N-EP)等 [6] 。
7.7. 胆囊收缩素(CCK)
胆囊收缩素(CCK)广泛存在于中枢及外周神经系统,并以神经递质或神经调节的形式发挥重要的生理作用,因而它已经成为一种典型的脑肠肽,参与了痛觉感受、食欲调节、记忆等生理过程,亦有调节垂体激素释放的作用,与惊恐、焦虑、癫痫等病理表现有关;同时其还具有控制中枢吸收节律及调节心血管紧张的作用。胆囊收缩素在进食后由内脏分泌并促进更多摄食,这种所谓饱激素也促进休息和睡眠。研究表明CCK常和其他神经递质或神经肽共存于同一神经元,如在大鼠、小鼠、猫、灵长类动物的中脑腹侧有CCK和多巴胺共存,在人和豚鼠这种共存较弱。此外还发现其和P物质在中脑灰质共存,和内啡肽在海马共存,和促皮质激素释放激素在室旁核共存,和催产素在视上核和室旁核共存。
7.8. δ-睡眠肽(DSIP)
δ-睡眠肽(DSIP主要促进慢波睡眠),在下丘脑、松果体、脑下垂体有较高浓度的分布,脑脊液中的S因子作用较DISP缓慢。
Trp-Ala-Gly-Asp-Ala-Ser-Gly-Glu
δ-睡眠肽(DSIP)
7.9. 神经肽P物质(SP)
最近,有学者研究发现健康成人经外周经脉给予SP可影响机体睡眠。有研究发现位于中脑和脑桥背侧的胆碱能神经元胞体内共存着SP,其轴突纤维投射到与诱导异相睡眠(PS)相关的脑桥网状结构,提示SP可能也参与机体睡眠的调节。SP是近年针灸机制研究中的热门话题。动物试验及临床实验均已证明,针灸可以产生包括脑啡肽、内啡肽和强啡肽的阿片样肽、P物质、血管活性肠肽、胆囊收缩素等各类神经肽,进而影响针灸的免疫调节作用。
SP是一种线形多肽,含11个氨基酸残基,氨基酸顺序为:
N-Met-Leu-Gly-Phe-Gln-Gln-Pro-Lys-Pro-Arg-COOH。
神经肽P物质(SP)
7.10. 食欲素(orexin)
Orexin在动物和人中都参与了睡眠–觉醒循环调节。Bourdin等发现大鼠蓝斑核注入Orexin会抑制快速眼球运动睡眠,延长睡眠时间,而且第一次产生快速眼球运动的睡眠的潜伏期也延长。Catherine报道,前Orexin原和OX2R受体的缺乏都将导致嗜睡(Orexin是通过作用于OX2R受体调节觉醒状态的)。这些结构表明,Orexin对睡眠–觉醒周期有重要的调节作用。下丘脑食欲素(orexin)是调节睡眠与觉醒、饮食行为、情感、自主神经活动以及全身糖代谢的主要神经肽之一。
有学者通过筛库的方法获得了人orexin的基因组 DNA,包括2个外显子和1个内含子,共1432个碱基对,编码含131个氨基酸残基的多肽。第一外显子(147 bp),包括与端不翻译区和编码信号肽前7个氨基酸的碱基。第二外显子(473 bp),包括3’端不翻译区和开放阅读框架的其他部分 [7] 。
7.11. 胞壁酰二肽(MDP)
MDP是人工合成的细菌壁肽聚糖中具有免疫佐剂活性的最小结构单位,它可提高血清中脑内1L-1与TNF水平,对免疫具有广泛的影响,同时具有抗肿瘤及抗感染作用。经iv或op给予MDP均可促进家兔的SWS,脑内注射低剂量MDP可使SWS增加50%左右,作用维持6 h以上,证明脑内可能有MDP受N-乙酰胞壁酸-L-丙氨酸-D-异谷氨酰胺,简称胞壁酰二肽(MDP)体存在,与MDP类似结构的其他肽聚糖亦可促进动物的慢波睡眠。
7.12. 长链脂肪酸酰(ODA)、花生四烯酰乙醇胺(AEA)
油酰胺是近几年来发现的内源性睡眠诱导物质,可增加总的慢波睡眠时间和个体平均慢波睡眠时间。油酰胺可显著增加给予阈下催眠剂量戊巴比妥钠的小鼠的睡眠率并缩短睡眠潜伏期,延长催眠剂量戊巴比妥钠引起的睡眠时间。其作用机制的五个假说:
1) 通过加强5-羟色胺对5-HT受体的作用而产生。
2) 通过抑制在神经胶质细胞间由缝隙连接介导的信号传输而产生。
3) 通过对GABAA受体的变构调节而产生。
4) 通过类似与全麻药对细胞膜的扰动而产生。
5) 通过对大麻受体的作用而产生。
ODA在50 μmol/L浓度下,可加强AEA与Cβ1受体结合作用大约一个数量级并且通过竞争性抑制AEA水解来调节AEA的浓度,从而通过大麻受体而起作用。
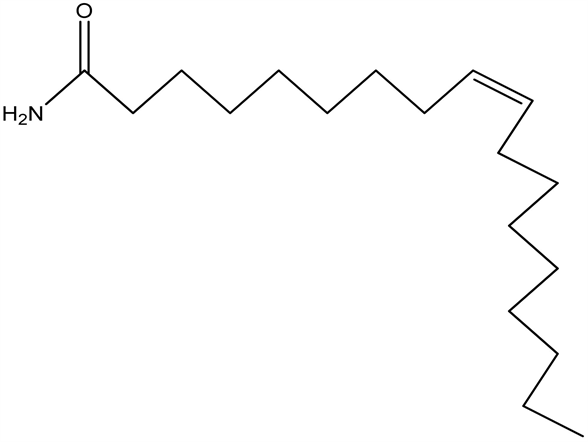
长链脂肪酸酰(ODA)
7.13. 褪黑素(MLT)
褪黑素参与了睡眠–觉醒节律的调节,是公认的生理性睡眠因子,是松果体分泌的主要激素,因此又称松果体素,是控制人类生物钟的重要内源性物质。白天光照时可抑制褪黑素分泌,故白天血浆浓度下降;而黑暗则刺激褪黑素分泌使夜晚血浆浓度高,午夜2~3点达到高峰。另有实验研究表明,褪黑素的睡眠调节作用与下丘脑GABA含量有关。人类在受到伤害或患病时,会很痛苦,这时人体会分泌内啡肽来减轻痛苦。内啡肽是人体内制造的吗啡类物质,有镇痛作用。
褪黑素与内啡肽有良好的协同作用,而且可使免疫系统帮助内啡肽的释放。对晚期癌症病人,往往要用麻醉剂来减轻病人的痛苦,若同时使用褪黑素,不但可以减轻麻醉剂的用量,而且可以减少麻醉剂的副作用和人体对它的依赖性。
我们实验室的研究工作表明:镇静催眠药与麻醉镇痛剂具有显著的协同药理作用,能够加强镇静催眠药的效果(形成最强的镇静催眠药物)或减小麻醉镇痛药的依赖性 [8] 。
曾在20世纪80~90年代,胡文祥为载人航天工程专门立项成功研发以褪黑素为主要成分的航天牌眠尔康,产生了显著的军事经济社会效益 [9] - [21] 。
褪黑素(MLT)
7.14. 前列腺素E2 (PGE2)
内源性物质前列腺素E2和神经肽阿立新(orexin)激活TMN组胺能神经元,增加组胺释放,促进觉醒。
前列腺素E2 (prostaglandin E2, PGE2)是花生四烯酸在环氧合酶(cyclo-oxygenases, COXs)及前列腺素 E2合成酶(prostaglandin E2 synthase, PGES)这两种关键酶催化下产生的一种前列腺素,可以在机体所有类型的细胞中表达。PGE2 通与 4 种功能各异的G蛋白偶联受体结合,参与了多种生理病理过程,如炎症反应、细胞增殖和血压调节等,是体内作用最多样化的前列腺素。PGE2 作为一种重要的炎症介质,其产量可被作为环氧合酶抑制剂的非甾体类抗炎药(non steroidal anti-inflammatory drugs, NSAIDs)抑制 [22] 。
7.15. 前列腺素D2 (prostaglandin, PGD2)
前列腺素D2是目前已知最有潜力的内源性促睡眠物质之一。鼠脑脊液(GSF)中PGD2浓度与睡眠–觉醒周期一致,呈现节律性改变,并且随睡眠剥夺期间嗜睡倾向增加而增加。PGE2在维持大脑清醒状态下起主要作用。PGD2和PGE2的平衡对正常睡眠–觉醒周期的维持十分关键 [23] 。
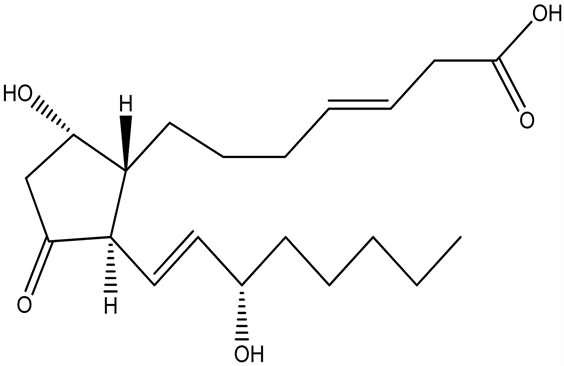
前列腺素D2 (Prostaglandin, PGD2)
7.16. Lipocalin型前列腺素D合成酶(L-PGDS)
L-PGDS和PGD2在脑室系统、蛛网膜下腔及细胞外间隙中循环。循环中的PGD2可与前脑头端基底腹内侧面的化学感受器中的PGD2受体(DPR)的活化可导致腹测视前区(VLPO)内神经元的活化,其可通过抑制结节乳头核(TMN)而促进睡眠。尽管野生型和过度表达L-PGDS的转基因(TG)鼠间睡眠–觉醒的方式未见差异,TG鼠的NREM以时间依赖方式增加。TG鼠的NREM的诱导与脑中PGD2产生正相关,且TG鼠应答夹尾时的自发性运动活性显著降低,而野生型鼠应答夹尾时的睡眠运动特性及PGD2含量不变。在两个不同系的TG鼠得到一致结果,提示,L-PGDS与NREM的调节有关 [22] 。
L-PGDS为分子量约26KD的糖蛋白。鼠和蟾蜍的L-PGDS与类视色素和甲状腺激素的亲和力可与Lipocalin超家族的成员相比。L-PGDS在血–脑脊液、血–视网膜及血脑屏障位点产生,并分泌入体循环相对独立的密闭腔室中,提示,L-PGDS可作为这些脑室中细胞外亲脂/疏水分子的载体。
7.17. 泌乳素(PRL)
PRL的分泌是有睡眠–醒觉周期变化的,分泌规律是白天比夜间低,入睡后逐渐升高至醒来前1小时达到高峰,醒后逐渐下降,上午10点~下午2点为全天谷值,男女均值不同,且女性大于男性。
泌乳素是垂体前叶泌乳素细胞分泌的一种多肽蛋白,由198个相对分子质量为(22 − 100) × 10的氨基酸构成,人体内主要存在3中不同分子量形式的PRL,分别是单体PRL、大PRL和巨PRL。垂体激素–泌乳素水平的检查来诊断和治疗溢乳症、继发闭经有一定的临床意义 [24] 。
7.18. 甲状腺素(T4)
甲亢患者由于血中甲状腺激素水平增高,作用于神经系统,临床表现出失眠多梦,精神紧张,情绪激动,烦躁多虑等。甲亢患者睡眠障碍发生率高;甲亢患者比普通人群有更多的心理应激;甲亢患者的睡眠问题影响心理健康。
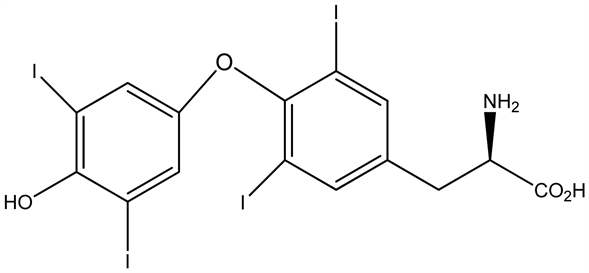
甲状腺素(T4)
7.19. 生长激素(GH)、生长激素释放抑制激素(SRIF)、生长激素释放激素(GHRH)
GH是人们发现的第一个与睡眠相关的激素,在人类及其他动物都观察到GH释放与睡眠有关。睡眠紊乱时,GH释放减少或释放规律改变。Toppila等曾发现,大鼠睡眠剥夺后,其下丘脑室旁核和弓状核GHRH和SRIF不仅调节垂体释放GH,也参与睡眠调节。
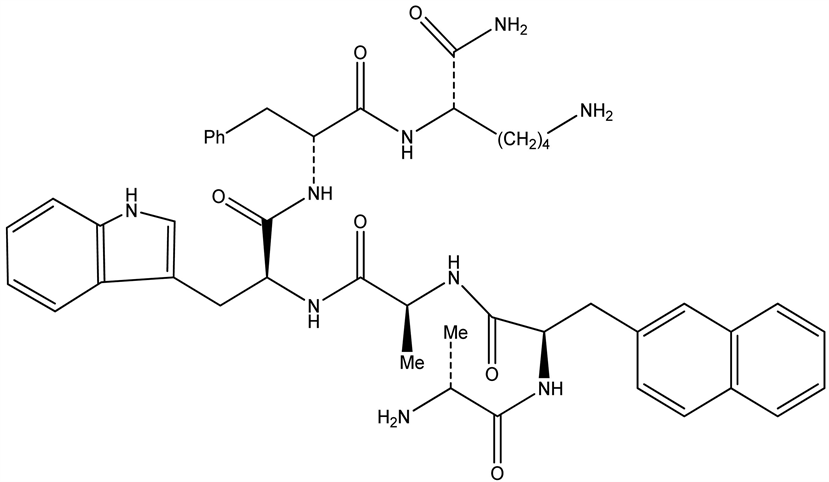
生长激素(GH)
7.20. 8-精崔产素(AVT)
AVT在人体促进快速眼球运动睡眠(REMS),它可能是至今所知最活跃的促睡眠物质。目前具有催眠作用的化学合成药花生四烯酸:
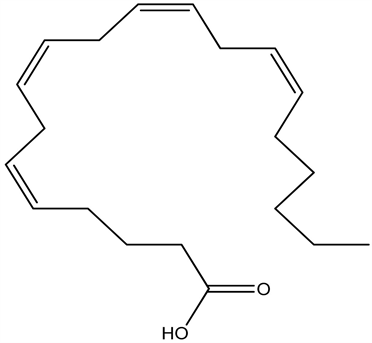
花生四烯酸(Arachidonic acid)
8. 一氧化氮与睡眠机制
一氧化氮(NO)在脑内作为一种信使,能增强和保护神经活性,参与中枢多种功能调节;高浓度NO则是一种非调节型杀伤分子,以自由基等形式产生明显的神经毒作用。研究发现,NO对睡眠–觉醒周期起着重要的调控作用,是睡眠调节因子发挥睡眠调节作用的共同通路。剥夺动物睡眠的研究发现,大鼠睡眠剥夺72小时后精神萎靡、反应迟钝,学习和记忆力明显下降,与此同时额叶海马、中脑和下丘脑的NO含量及NOS活性均异常升高,推测持续觉醒状态使脑内产生大量的NO是脑神经受损和精神行为改变的重要原因。
9. 展望
临床上常用的镇静催眠药物虽然延长了总睡眠时间,却损害了睡眠的两种重要成分SWS (慢波睡眠)和REMS (后者保持固定的比例最为重要),并未起到改善睡眠质量的作用。寻找选择性延长深慢波睡眠(SWS2),同时能够保证REMS正常比例的药物,是目前的研究方向。由于内源性诱导睡眠物质是机体的一部分,具有安全、有效特点,但也受到来源的限制,提取获得单一物质成本又非常高,研究内源性诱导睡眠物质的结构组成、人工合成和内源性物质的结构改造及内源性物质结构改造后的新物质的药理作用具有广阔的前景。已有学者通过对油酰胺衍生物的合成及催眠活性研究获得了这方面的一些有益进展 [25] 。
是上述内源性镇静催眠物质,还是天然植物镇静催眠有效成分 [26] ,还是人工合成镇静催眠药物,或者它们的合理组方,或它们与其他类药物(如麻醉镇痛药等)的组方,它们之中究竟哪一类是最理想的镇静催眠药物?这需要根据具体情况、具体要求,研究后才能给出比较合理的回答。
文章引用
张 莹,王 刚,闵 清,马密霞,胡文祥. 镇静催眠–觉醒相关内源性物质研究进展
Progress in Endogenous Substances Related Sedative—Hypnotic and Arousal[J]. 比较化学, 2018, 02(03): 85-99. https://doi.org/10.12677/CC.2018.23011
参考文献
- 1. 刘珊珊. 槲皮苷和熊果酸对睡眠内源性物质影响的研究[D]: [硕士学位论文]. 哈尔滨: 黑龙江中医药大学, 2008.
- 2. 董锡亮, 赵宏斌. 1L-4抑制骨吸收的研究进展[J]. 中国老年学杂志, 2009, 29(5): 634-636.
- 3. 罗甜甜. 肿瘤坏死因子-ɑ(TNF-ɑ)与肝再生研究进展[J]. 西部医学, 2010, 22(3): 558-560.
- 4. 张旸, 李平. 血管活性肠肽的研究进展[J]. 医学综述, 2009, 15(21): 3235-3238.
- 5. 陆婕, 杨精静. 甘丙肽家族及其受体的功能[J]. 生命化学,2003, 30(4): 533-539.
- 6. 郑文果. 尖吻蝮蛇毒中非成瘾性止痛剂的研究[D]: [硕士学位论文]. 长春: 吉林大学, 2004.
- 7. 吕继蓉, 喻鳞. 食欲增食因子(orexin)对动物采食的调节[J]. 中国饲料, 2007(18): 24-27.
- 8. 杨博文. 硫醚芬太尼衍生物与硝基三唑仑的合成和配伍及生物效应研究[D]: [硕士学位论文]. 成都: 西南民族大学, 2018.
- 9. Peng, Q.T., Chen, P.R., Hu, W.X. and Tan, S.J. (1998) Determination of Melatonin in the Mianerkang Capsules by HPLC. Chinese Chemical Letters, 9, 839-842.
- 10. 胡文祥, 王建营, 谭生建, 张向先. 褪黑素的设计合成及应用研究[J]. 高等学校化学学报, 1998, 19(S1): 86-87.
- 11. 台大力, 胡文祥, 谭生建, 陈培让, 王建社. 催眠药研究进展[J]. 中国临床药学杂志, 1998, 7(4): 195-197.
- 12. 胡文祥. 广义组合化学[J]. 化学通报, 1999(10): 34-38.
- 13. 彭清涛, 胡文祥, 陈培让, 王建社. 眠尔康对小鼠骨髓嗜多染红细胞微核形成的影响[J]. 解放军预防医学杂志, 2002, 20(3): 220.
- 14. 胡文祥, 彭清涛, 王建民, 陈培让. 眠尔康胶囊对小鼠睡眠的影响[J]. 总装备部医学学报, 2003, 5(2): 99-100.
- 15. 高婷, 刘亚军, 王刚, 邵开元, 胡文祥. 常用催眠药物研究进展[J]. 有机化学研究, 2015, 3: 105-114.
- 16. 何华军, 王刚, 刘亚军, 谢艳蓉, 沈喜洲, 邵开元, 胡文祥. 苯二氮䓬类催眠药物三维定量构效关系研究[J]. 药物化学, 2016, 4(4): 25-37.
- 17. 邵开元, 何华军, 王刚, 刘亚军, 沈喜洲, 胡文祥. 化学势变化率对催眠药类化合物QSAR影响[J]. 化学通报, 2017, 80(11): 1061-1066.
- 18. 何华军, 王刚, 刘亚军, 沈喜洲, 邵开元, 胡文祥. 失眠症的治疗药物研究进展[J]. 药物化学, 2017, 5(1): 1-10.
- 19. Shen, X., He, H., Yang, B., Zhao, Z., Shao, K. and Hu, W. (2017) Studies on the Activities of Electrophilic Sites on Benzene Ring of 4-Substituted Anilines and Their Acyl Compounds with Multiphilicity Descriptor. Chemical Research in Chinese Uni-versity, 33, 773-778. https://doi.org/10.1007/s40242-017-7112-z
- 20. 闵庆旺, 胡文祥, 等. 载人航天工程医疗救护机动卫生装备的专用集装箱[P]. 中国实用新型专利, ZL200320121651.3.
- 21. 胡文祥, 王建营. 褪黑素的制备方法[P]. 中国国防发明专利, ZL02101035.8.
- 22. 管又飞. 前列腺素E2的生理功能[C]//中药生理学会第23届全国会员代表大会暨生理学术大会论文摘要文集. 2010.
- 23. 陆金春, 张红烨. 前列腺素D2与睡眠调节[J]. 生命科学, 2002, 3: 176-179.
- 24. 石青峰, 杨峻. 高泌乳素血症患者不同时段巨泌乳素水平的初步分析[J]. 国际检验医学杂志, 2013, 8: 932-933.
- 25. 郭长彬. 油酰胺衍生物的合成及催眠活性研究[D]: [硕士学位论文]. 沈阳: 沈阳药科大学, 2001.
- 26. 张莹, 马密霞, 王刚, 付梦蕾, 曲有乐, 胡文祥. 镇静催眠天然植物有效成分研究进展[J]. 比较化学, 2018, 2(2): 54-79.
NOTES
*通讯作者。