Hans Journal of Computational Biology
Vol.08 No.02(2018), Article ID:25976,7
pages
10.12677/HJCB.2018.82005
Identification and Characterization of APX Genes in Cucumber
Libin Li1, Zhaojuan Meng1, Yongqiang Wang1, Guilan Yang1, Zonghui Yang1, Fuqin Ji2, Meixiang Han2, Qiwei Cao1*
1Key Laboratory of Greenhouse Vegetable’s Biology of the Shandong Province, Vegetable Science Observation and Experiment Station in Huang Huai District of Ministry of Agriculture (Shandong), Shandong Branch of National Improvement Center for Vegetables, Vegetable Institute of Shandong Academy of Agricultural Sciences, Jinan Shandong
2Wanfeng Seed Company Limited in Ningyang County, Shandong Province, Ningyang Shandong
Received: Jun. 27th, 2018; accepted: Jul. 12th, 2018; published: Jul. 19th, 2018

ABSTRACT
Plant ascorbate peroxidase (APX) genes play significant roles in environmental stress response and development. However, the knowledge about them in the important vegetable cucumber is scarce. In this paper, 6 APX genes in cucumber genome were identified through bioinformatics method. And their chromosome location, gene exon-intron structure, phylogeny, and cis-elements were systematically analyzed. The results showed that cucumber APX genes distribute in different chromosomes, and their putative coding sequence size ranges from 750 bp to 1425 bp. They all have 8 or more exons, and their putative encoded proteins are predicted to localize in cytosol or chloroplast. There are typical ascorbate peroxidase domain, myristoylation sites, and phospharylation sites in APXs encoded proteins of cucumber. And also, multiple cis-elements responsive to different environmental stimuli and hormones are existed in cucumber APX upstream sequences, which suggests they may have some roles in environmental stress responses.
Keywords:Cucumis sativus L., Ascorbate Peroxidase Gene, Structure, Phylogeny, Cis-Element
黄瓜抗坏血酸过氧化物酶基因的 鉴定和特征分析
李利斌1,孟昭娟1,王永强1,杨桂兰1,杨宗辉1,纪复勤2,韩梅香2,曹齐卫1*
1山东省农业科学院蔬菜花卉研究所,国家蔬菜改良中心山东分中心,农业部黄淮地区蔬菜科学观测实验站(山东),山东省设施蔬菜生物学重点实验室,山东 济南
2山东宁阳万丰种业有限公司,山东 宁阳

收稿日期:2018年6月27日;录用日期:2018年7月12日;发布日期:2018年7月19日

摘 要
植物抗坏血酸过氧化物酶基因在逆境应答和发育过程中具有重要功能,但是在我国重要蔬菜黄瓜中缺乏报道。本文通过生物信息学的方法,从黄瓜基因组中鉴定出6个抗血酸过氧化物酶基因,并对它们的染色体分布、基因结构、系统进化和顺式元件进行了系统分析。结果显示,黄瓜APX分布在不同的染色体上,编码区大小在750~1425 bp,含有8个以上外显子,预测编码蛋白定位在细胞质或者叶绿体中。它们都具有抗坏血酸过氧化物酶的特征结构域和磷酸化及豆蔻酰化位点。在它们的上游基因序列中,存在多个逆境和激素应答顺式调控元件,暗示它们在逆境应答中具有一定功能。
关键词 :黄瓜,抗坏血酸过氧化物酶基因,结构,系统进化,顺式元件

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
维生素C过氧化物酶(ascorbate peroxidase, APX)是植物AsA-GSH氧化还原途径的重要组分,是清除H2O2 (特别是叶绿体中的H2O2)的关键酶 [1] [2] [3] 。植物APX基因家族由4个亚家族组成,分别为细胞质、叶绿体、线粒体和过氧化物酶体基因亚家族。它们在植物非生物逆境和生物逆境应答、生长发育过程中具有重要功能,并得到广泛研究 [4] - [10] 。有关植物APX基因的研究在模式植物拟南芥中最为系统和深入。例如,拟南芥的APX1在氧化胁迫应答 [11] [12] 、盐胁迫应答 [13] 、重金胁迫应答和硒的应答等方面具有重要功能 [14] [15] ,APX2能够提高热胁迫下种子的产量 [16] ,APX3对植株的生长发育至关重要,而且与分子伴侣蛋白结合起作用 [17] [18] ,APX4可调节种子活力和幼苗生长 [19] ,APX6能够保护种子免遭胁迫并介导活性氧、脱落酸和生长素信号的交叉应答 [20] ,而TAPX和SAPX在植物发育 [21] 、干旱和盐胁迫应答 [22] 、光保护等 [23] [24] [25] 过程中具有重要功能。
目前,有关黄瓜APX生理水平的研究比较多 [26] [27] [28] ,但有关它们基因水平的研究还很缺乏。因此,本文利用生物信息学的方法,从黄瓜基因组中鉴定出6个APX基因,并对这些基因的染色体分布、基因结构、遗传进化和顺式调控元件进行了系统分析,为研究黄瓜APX基因在生长发育和逆境应答中的功能提供线索。
2. 研究方法
利用拟南芥的APX基因序列来搜索黄瓜进组数据库 (http://cucumber.genomics.org.cn/page/cucumber/blast.jsp)和NCBI数据库 (http://blast.st-va.ncbi.nlm.nih.gov/Blast.cgi?CMD=Web&PAGE_TYPE=BlastHome)中黄瓜APX基因。通过blastX来确定基因及其编码序列。根据它的编码区序列确定其所在染色体及位置。利用Mega4.1软件对这些基因进行遗传进化分析,并与拟南芥的APX基因进行比较分析。利用motif-Scan (http://myhits.isb-sib.ch/cgi-bin/motif_scan)对黄瓜的APX蛋白进行结构域预测和分析。通过APX编码区和基因组序列的比对来显示基因外显子和内含子的组成。根据编码区序列和其所在scaffold的序列得到黄瓜APX基因起始密码子ATG上游1500 bp的序列。利用PLANTCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对启动子区的顺式反应元件进行预测分析。遗传进化分析利用MEGA4.1进行,采用Bootstrap test-Neighbor Joining方法,重复500次运算。利用WoLF PSORT (http://www.genscript.com/psort/wolf_psort.html)对黄瓜APX基因编码的蛋白进行亚细胞定位预测。
3. 结果与分析
3.1. 黄瓜APX的鉴定、系统进化和蛋白基序分析
利用生物信息学方法,作者从黄瓜基因组中鉴定出6个APX基因,编码区大小为750~1425 bp,外显子数为8~13个,预测编码的蛋白分别位于细胞质、叶绿体或者线粒体中(见表1,图1)。除4号染色体外,其余染色体上各含有一个APX基因。系统进化分发现,黄瓜的Csa019442和Csa018312与拟南芥的APX1直系同源,Csa013991与拟南芥的APX3直系同源,Csa020418与AtTAPX直系同源,Csa006095与AtAPX6直系同源,Csa002249与AtAPX4直系同源(见图2)。Csa019442和Csa018312编码蛋白的序列一致性为70.71%,Csa019442和Csa018312与拟南芥APX1的序列一致性分别为72.50%和67.86%,Csa013991与AtAPX3,Csa020418与AtTAPX,Csa006095与AtAPX6,Csa002249与AtAPX4的序列一致性分别为69.35%9,63.15%,54.28%和62.70%。蛋白基序分析发现,黄瓜APX基因编码的蛋白都含有2~6个豆蔻酰化位点,一个特征结构域抗坏血酸过氧化物酶结构域,2~9个磷酸激酶C磷酸化位点。Csa006095,Csa002249和Csa020418都含有糖基化位点,Csa006095和Csa020418还含有一个乙酰化位点(见表2)。亚细胞定位预测显示,Csa019442和Csa018312的编码产物定位在细胞质中,Csa006095、Csa002249和Csa013991定位在叶绿体上,而Csa020418定位在线粒体上(见表1)。
3.2. 黄瓜APX的顺式元件和功能预测
顺式调控元件分析对于基因功能的预测具有重要意义。笔者发现,在黄瓜APX基因的上游序列中存在多个逆境和激素应答调控元件,而且各不相同(见表3)。其中,Csa018312和Csa013991各有2和3个ABA应答元件ABRE,Csa019442,Csa006095和Csa002249各有一个生长素应答元件AuxRR-core或者
Table 1. Molecular feature of APX genes
表1. 黄瓜APX基因的分子特征
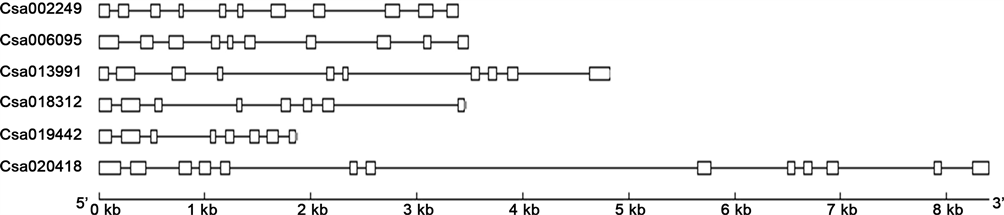
Figure 1. Exon-intron structure of cucumber APX genes: square frame substitutes exon, straight line substitutes intron
图1. 黄瓜APX基因的外显子-内含子结构:方框代表外显子,直线代表内含子

Figure 2. Phylogeny of cucumber and arabidopsis APX genes
图2. 黄瓜和拟南芥APX基因的系统进化
Table 2. Motifs of cucumber APX encoded proteins
表2. 黄瓜APX编码蛋白的基序
Table 3. Cis-elements of cucumber APX genes
表3. 黄瓜APX基因的顺式元件
注:ABRE为脱落酸应答元件,CGTCA-motif为茉莉酸甲酯(MeJA)应答元件,ERE为乙烯应答元件,GARE-motif和P-ox为赤霉素应答元件,HSE为热胁迫应答元件,LTR为低温应答元件,MBS为干旱应答元件,TC-rich repeats为逆境和防卫应答元件,TGA-element位生长素应答元件,TCA-element为水杨酸应答元件,W box为病原物答元件。
TGA-element,Csa018312和Csa013991分别含有1个真菌应答元件的Box-W1,Csa019442、Csa002249和Csa020418都含有茉莉酸甲酯应答元件CGTCA-motif,Csa019442和Csa006095含有激发子互作元件EIRE,Csa019442、Csa020418和Csa013991都含有乙烯应答元件ERE,Csa002249、Csa018312、Csa020418和Csa013991含有赤霉素应答元件GARE-motif或者P box,Csa019442、Csa018312、Csa020418和Csa013991含有热胁迫应答元件HSE,Csa019442和Csa006095含有低温应答元件LTR,Csa006095、Csa018312和Csa020418含有干旱应答元件MBS,所有的APX基因都含有逆境和防卫应答元件TC-richRepeats,Csa019442、Csa002249、Csa018312和Csa020418都含有水杨酸应答元件TCA-element,而Csa018312和Csa013991含有防卫应答元件W box。从以上分析可以看出,黄瓜的APX基因不仅含有非生物逆境应答元件,也含有生物逆境应答元件,而且它们含有的应答元件的类型和数目都有所不同。结合进化分析和拟南芥APX的研究结果,笔者认为,Csa019442在温度胁迫应答和防卫反应中具有一定功能,可响应生长素、茉莉酸甲酯、乙烯和水杨酸,Csa018312在干旱、热胁迫应答和防卫过程中具有一定功能,可响应ABA、赤霉素和水杨酸信号,Csa006095在干旱、冷胁迫应答和种子成熟萌发中具有一定功能,可响应生长素信号,Csa002249在种子活力和幼苗生长中具有一定功能,可应答生长素、茉莉酸甲酯、赤霉素和水杨酸信号,Csa020418在热和干旱应答中具有一定功能,可响应多种激素信号,而Csa013991可应答ABA、乙烯、赤霉素信号,在热胁迫和生物逆境应答中具有一定功能。
4. 结论
笔者从黄瓜基因组中鉴定出6个APX基因,它们在染色体分布、基因和编码蛋白的结构、系统进化和顺式调控元件等方面存在明显差异,说明它们在功能上存在分化。这与拟南芥的研究结果相一致。顺式元件分析结果表明,黄瓜的APX基因可对干旱等多种逆境和脱落酸等多种植物激素信号做出应答,可能具有复杂多样的生物学功能。至于它们在植物逆境和激素应答中的具体功能,需要进一步结合分子生物学和生物化学的方法进行研究。
基金项目
本文受山东省农业良种工程项目(2016LZGC033)和山东省农业科学院农业科技创新工程项目(CXGC2018D05)资助。
文章引用
李利斌,孟昭娟,王永强,杨桂兰,杨宗辉,纪复勤,韩梅香,曹齐卫. 黄瓜抗坏血酸过氧化物酶基因的鉴定和特征分析
Identification and Characterization of APX Genes in Cucumber[J]. 计算生物学, 2018, 08(02): 33-39. https://doi.org/10.12677/HJCB.2018.82005
参考文献
- 1. Sofo, A., Scopa, A., Nuzzaci, M. and Vitti, A. (2015) Ascorbate Peroxidase and Catalase Activities and Their Genetic Regulation in Plants Subjected to Drought and Salinity Stresses. International Journal of Molecular Sciences, 16, 13561-13578. https://doi.org/10.3390/ijms160613561
- 2. 李泽琴, 李静晓, 张根发. 植物抗坏血酸过氧化物酶的表达调控以及对非生物胁迫的耐受作用[J]. 遗传, 2013, 35(1): 45-54.
- 3. Yang, H., Mu, J., Chen, L., Feng, J., Hu, J., Li, L., Zhou, J.M. and Zuo, J. (2015) S-Nitrosylation Positively Regulates Ascorbate Peroxidase Activity during Plant Stress Responses. Plant Physiology, 167, 1604-1615. https://doi.org/10.1104/pp.114.255216
- 4. 曾秀存, 孙万仓, 方彦, 刘自刚, 董云, 孙佳, 武军艳, 张鹏飞, 史鹏辉, 孔德晶, 张腾国, 何丽, 赵彩霞. 白菜型冬油菜抗坏血酸过氧化物酶(APX)基因的克隆、表达及其活性分析[J]. 作物学报, 2013, 39(8): 1400-1408.
- 5. 王竹青, 陈云, 杨玉婷, 苏亚春, 陈珊珊, 吴期滨, 许莉萍. 甘蔗抗坏血酸过氧化物酶基因(ScAPX)的克隆及表达分析[J]. 农业生物技术学报, 2015, 23(2): 170-180.
- 6. 赵雁, 车伟光, 毕玉芬. 高温胁迫下“德钦”紫花苜蓿APX活性和转录水平分析[J]. 分子植物育种, 2015, 13(7): 1611-1615.
- 7. 许传俊, 孙叙卓, 李玲, 茹志伟, 曾碧玉, 刘育梅, 黄珺梅. 蝴蝶兰抗坏血酸过氧化物酶基因克隆及其表达研究[J]. 园艺学报, 2012, 39(4): 769-776.
- 8. 龙娅丽, 朱白婢, 徐子健, 张文, 江雪飞. 西瓜APX 基因的序列分析及其茉莉酸甲酯诱导表达特性[J]. 基因组学与应用生物学, 2016, 35(8): 2125-2132.
- 9. 陈莉, 辛海波, 孙向荣, 尹慧, 李晓昕, 义鸣放. 百合APX 基因的克隆及转LlAPX 提高拟南芥耐盐性[J]. 园 艺学报, 2010, 37(1): 1983-1990.
- 10. Duan, M., Feng, H.L., Wang, L.Y., Li, D. and Meng, Q.W. (2012) Overexpression of Thylakoidal Ascorbate Peroxidase Shows Enhanced Resistance to Chilling Stress in Tomato. Journal of Plant Physiology, 169, 867-877. https://doi.org/10.1016/j.jplph.2012.02.012
- 11. Davletova, S., Rizhsky, L., Liang, H., Shengqiang, Z., Oliver, D.J., Coutu, J., Shulaev, V., Schlauch, K. and Mittler, R. (2005) Cytosolic Ascorbate Peroxidase 1 Is a Central Component of the Reactive Oxygen Gene Network of Arabidopsis. Plant Cell, 17, 268-281. https://doi.org/10.1105/tpc.104.026971
- 12. Maruta, T., Inoue, T., Noshi, M., Tamoi, M., Yabuta, Y., Yoshimura, K., Ishikawa, T. and Shigeoka, S. (2012) Cytosolic Ascorbate Peroxidase 1 Protects Organelles against Oxidative Stress by Wounding- and Jasmonate-Induced H(2)O(2) in Arabidopsis Plants. Biochimica et Biophysica Acta, 1820, 1901-1907. https://doi.org/10.1016/j.bbagen.2012.08.003
- 13. Koussevitzky, S., Suzuki, N., Huntington, S., Armijo, L., Sha, W., Cortes, D., Shulaev, V. and Mittler, R. (2008) Ascorbate Peroxidase 1 Plays a Key Role in the Response of Arabidopsis thaliana to Stress Combination. The Journal of Biological Chemistry, 283, 34197-34203. https://doi.org/10.1074/jbc.M806337200
- 14. Jiang, L., Wang, W., Chen, Z., Gao, Q., Xu, Q. and Cao, H. (2017) A Role for APX1 Gene in Lead Tolerance in Arabidopsis thaliana. Plant Science, 256, 94-102. https://doi.org/10.1016/j.plantsci.2016.11.015
- 15. Jiang, L., Chen, Z., Gao, Q., Ci, L., Cao, S., Han, Y. and Wang, W. (2016) Loss-of-Function Mutations in the APX1 Gene Result in Enhanced Selenium Tolerance in Arabidopsis Thaliana. Plant Cell Environment, 39, 2133-2144. https://doi.org/10.1111/pce.12762
- 16. Suzuki, N., Miller, G., Sejima, H., Harper, J. and Mittler, R. (2013) Enhanced Seed Production under Prolonged Heat Stress Conditions in Arabidopsis thaliana Plants Deficient in Cytosolic Ascorbate Peroxidase 2. Journal of Experimental Botany, 64, 253-263. https://doi.org/10.1093/jxb/ers335
- 17. Narendra, S., Venkataramani, S., Shen, G., Wang, J., Pasapula, V., Lin, Y., Kornyeyev, D., Holaday, A.S. and Zhang, H. (2006) The Ara-bidopsis ascorbate Peroxidase 3 Is a Peroxisomal Membrane-Bound Antioxidant Enzyme and Is Dispensable for Arabidopsis Growth and Development. Journal of Experimental Botany, 57, 3033-3042. https://doi.org/10.1093/jxb/erl060
- 18. Shen, G., Kuppu, S., Venkataramani, S., Wang, J., Yan, J., Qiu, X. and Zhang, H. (2010) Ankyrin Repeat-Containing Protein 2A Is an Essential Molecular Chaperone for Peroxisomal Membrane-Bound Ascorbate Peroxidase3 in Arabidopsis. Plant Cell, 22, 811-831. https://doi.org/10.1105/tpc.109.065979
- 19. Wang, Y.Y., Hecker, A.G. and Hauser, B.A. (2014) The APX4 Locus Regulates Seed Vigor and Seedling Growth in Arabidopsis thaliana. Planta, 239, 909-919. https://doi.org/10.1007/s00425-014-2025-2
- 20. Chen, C., Letnik, I., Hacham, Y., Dobrev, P., Ben-Daniel, B.H., Vanková, R., Amir, R. and Miller, G. (2014) Ascorbate Peroxidase6 Protects Arabidopsis Desiccating and Germinating Seeds from Stress and Mediates Cross Talk between Reactive Oxygen Species, Abscisic Acid, and Auxin. Plant Physiology, 166, 370-383. https://doi.org/10.1104/pp.114.245324
- 21. Miller, G., Suzuki, N., Rizhsky, L., Hegie, A., Koussevitzky, S. and Mittler, R. (2007) Double Mutants Deficient in Cytosolic and Thylakoid Ascorbate Peroxidase Reveal a Complex Mode of Interaction between Reactive Oxygen Species, Plant Development, and Response to Abiotic Stresses. Plant Physiology, 144, 1777-1785. https://doi.org/10.1104/pp.107.101436
- 22. Kangasjärvi, S., Lepistö, A., Hännikäinen, K., Piippo, M., Luomala, E.M., Aro, E.M. and Rintamäki, E. (2008) Diverse Roles for Chloroplast Stromal and Thylakoid-Bound Ascorbate Peroxidases in Plant Stress Responses. Biochemistry Journal, 412, 275-285. https://doi.org/10.1042/BJ20080030
- 23. Awad, J., Stotz, H.U., Fekete, A., Krischke, M., Engert, C., Havaux, M., Berger, S. and Mueller, M.J. (2015) 2-Cysteine Peroxiredoxins and Thylakoid Ascorbate Peroxidase Create a Water-Water Cycle That Is Essential to Protect the Photosynthetic Apparatus under High Light Stress Conditions. Plant Physiology, 167, 1592-1603. https://doi.org/10.1104/pp.114.255356
- 24. Maruta, T., Tanouchi, A., Tamoi, M., Yabuta, Y., Yoshimura, K., Ishikawa, T. and Shigeoka, S. (2010) Arabidopsis Chloroplastic Ascorbate Peroxidase Isoenzymes Play a Dual Role in Photoprotection and Gene Regulation under Photooxidative Stress. Plant Cell Physiology, 51, 190-200. https://doi.org/10.1093/pcp/pcp177
- 25. van Buer, J., Cvetkovic, J. and Baier, M. (2016) Cold Regulation of Plastid Ascorbate Peroxidases Serves as a Priming Hub Controlling ROS Signaling in Arabidopsis thaliana. BMC Plant Biology, 16, 163. https://doi.org/10.1186/s12870-016-0856-7
- 26. 高俊杰, 秦爱国, 于贤昌. 低温胁迫对嫁接黄瓜叶片抗坏血酸——谷胱甘肽循环的影响[J]. 园艺学报, 2009, 36(2): 215-220.
- 27. 郑俊鶱, 孙艳, 韩寿坤, 张浩, 王益权. 土壤紧实胁迫对黄瓜抗坏血酸——谷胱甘肽循环的影响[J]. 中国农业科学, 2013, 46(2): 433-440.
- 28. 徐向东, 孙艳, 郭晓芹, 孙波, 张坚. 褪黑素对高温胁迫下黄瓜幼苗抗坏血酸代谢系统的影响[J]. 应用生态学报, 2010, 21(10): 2580-2586.
NOTES
*通讯作者。
