Pharmacy Information
Vol.
08
No.
06
(
2019
), Article ID:
33142
,
7
pages
10.12677/PI.2019.86026
The Basic Characteristics of Glutamate Dehydrogenase and Its Inhibitors
Hengyu Ye, Wei Hou, Benfang Ruan*
School of Pharmacy, Zhejiang University of Technology, Hangzhou Zhejiang
Received: Nov. 1st, 2019; accepted: Nov. 19th, 2019; published: Nov. 26th, 2019

ABSTRACT
Glutamate dehydrogenase (GDH) is located in mitochondria of animals, plants and microorganisms, and plays a vital role in energy metabolism of tricarboxylic acid cycle, intracellular redox balance, stable maintenance of ammonia content and regulation of signal transduction. However, it has many regulatory factors and is prone to mutation, which leads to some diseases, such as cancer, hyperinsulinemia-hyperammonemia syndrome, Parkinson’s disease, etc. Therefore, the research on GDH inhibitors has great development potential and application prospect. However, the literature review on GDH inhibitors has not been reported. According to the structural types of GDH inhibitors, this paper reviews the research progress of some representative GDH inhibitors, including polyphenols, chlorine and sulfur compounds, isophthalic acids, steroid hormones and new selens. It shows that in-depth study of GDH and its effective inhibitors has a good development prospect for the treatment of related diseases.
Keywords:Glutamate Dehydrogenase, Characteristics, Cancer, Inhibitor
谷氨酸脱氢酶的基本特性及其抑制剂的相关研究进展
叶恒宇,侯卫,阮奔放*
浙江工业大学药学院,浙江 杭州
收稿日期:2019年11月1日;录用日期:2019年11月19日;发布日期:2019年11月26日

摘 要
谷氨酸脱氢酶(GDH)位于动植物以及微生物体内的线粒体中,对于三羧酸循环的能量代谢、细胞内氧化还原平衡、氨含量的稳态维持和信号转导的调控起着至关重要的作用。但它的调控因子较多,易发生突变,从而导致一些疾病的产生,如癌症、高胰岛素–高血氨综合征、帕金森病等。因此,针对GDH抑制剂的研究具有很大的开发潜力和应用前景。但有关GDH抑制剂的文献综述尚未见报道。本文根据GDH抑制剂的结构类型,综述了一些具有代表性的GDH抑制剂的研究进展,包括多酚类、含氯硫类、间苯二甲酸类、甾体激素类以及新型硒啉类等化合物。表明深入研究GDH及其有效的抑制剂对于治疗相关疾病具有很好的发展前景。
关键词 :谷氨酸脱氢酶,特性,癌症,抑制剂

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 谷氨酸脱氢酶
谷氨酸脱氢酶(Glutamate dehydrogenase, GDH)存在于线粒体中,位于动物、植物以及微生物体内,起着代谢平衡的作用。谷氨酸脱氢酶常以同源六聚体的形式存在。哺乳动物GDH由500个残基组成,与其他种类的GDH不同,它受多种代谢物的变构调节。主要的变构激活剂是二磷酸腺苷(Adenosine Diphosphate, ADP)和亮氨酸(Leucine),而主要的抑制剂包括三磷酸鸟苷(Guanosine triphosphate, GTP)、三磷酸腺苷(Adenosine triphophate, ATP)和棕榈酰辅酶A (CoenzymeA) [1]。谷氨酰胺(Glutamine, GLN)是哺乳动物体内大量存在的非必需氨基酸,它在谷氨酰胺酶(Glutaminase, GLS)的催化下转化为谷氨酸盐和氨,谷氨酸盐可以进一步在谷氨酸脱氢酶的催化下转化为α-酮戊二酸(α-ketoglutarate, α-KG)从而进入三羧酸循环,这一生物转化过程被称为谷氨酰胺代谢(Glutaminolysis) [2],这个反应是可逆的,并通常需要烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide, NAD)和(或)烟酰胺腺嘌呤二核苷酸磷酸(Nicotinamide adenine dinucleotide phosphate, NADP+)作为辅因子 [3] [4]。NAD主要负责促进细胞内ATP(腺苷三磷酸)的合成,而NADP+则主要作为生物合成的还原剂 [5]。谷氨酰胺代谢可以为肿瘤细胞的增殖提供充足的能量,为核酸、氨基酸的合成提供氮源,为NADPH和其他生物大分子的合成提供碳链 [6]。研究发现,某些肿瘤细胞表现出谷氨酰胺依赖性生长,这种现象称为“谷氨酰胺成瘾” [7],由于人体正常细胞的生长不依赖谷氨酰胺,因此,靶向谷氨酰胺代谢过程的关键酶为开发低毒高效的抗肿瘤药物提供了可能性。
研究表明,人源谷氨酸脱氢酶具有多样性,包含两种亚型,分别是由GLUD1基因编码的hGDH1和由GLUD2基因编码的hGDH2 [8],有证据表明两种人类同工酶具有不同的细胞功能,其中hGDH1参与细胞能量学,hGDH2参与代谢循环过程 [9]。hGDH2蛋白主要存在于人大脑皮质星形胶质细胞、睾丸支持细胞和肾脏近曲小管的上皮细胞中,它与一些神经系统疾病如帕金森病 [10] 和Rett综合征 [11] 的发病有关。正常情况下hGDH1在所有细胞中均有表达,但在许多恶性肿瘤患者中却表现为异常的高表达。例如:神经胶质瘤 [12]、结直肠癌 [13]、乳腺癌 [14],并且与肿瘤细胞的增殖、迁移和侵袭密切相关,而且对患者的预后有显著的影响 [15]。此外,编码GDH1蛋白的GLUD1基因调控区发生突变会导致罕见病“高胰岛–高血氨综合征”(hyperinsulinism/hyperammonemia syndrome, HI/HA or HHS),这种突变减弱了GTP对其的抑制作用,患者表现出反复性蛋白质诱导的低血糖症,同时还表现为轻度持续的血氨增高。如果不能及时治疗,会导致惊厥或永久性脑损伤 [16]。临床上主要采用二氮嗪进行治疗,但二氮嗪本身是一种降压药,其作用机制是松弛血管平滑肌,降低外周血管阻力,使血压急剧下降。因此,采用二氮嗪虽然能够缓解患者的某些症状,但是不能从根本上抑制GDH1,反而可能引起低血压的副作用。因此,选择性的GDH抑制剂在多种高表达肿瘤和罕见病HHS的治疗方面具有广阔的应用空间,针对该酶的药物研发具有较大的开发和应用潜力。
2. 谷氨酸脱氢酶抑制剂
2.1. 表没食子儿茶素等多酚类
茶树中儿茶素类化合物主要包括,儿茶素(catechin, C)、表儿茶素(epicatechin, EC)、没食子儿茶素(gallocatechin, GC)、表没食子儿茶素(epigallocatechin, EGC)、儿茶素没食子酸酯(catechin gallate, CG)、表儿茶素没食子酸酯(epicatechin gallate, ECG)、没食子儿茶素没食子酸酯(gallocatechin gallate, GCG)及表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG) 8种单体 [17],其中ECG和EGCG对GDH有抑制作用。ECG作用于ADP的变构调节位点,它的多羟基结构可以与变构位点的氨基酸残基形成多重氢键而发挥抑制作用。EGCG是一种GDH非竞争剂,它独立于GTP抑制位点,类似于GTP抑制,它的抑制作用被亮氨酸,BCH (2-aminobicyclo(2,2,1)-heptane-2-carboxylic acid)和ADP废除。哺乳动物GDH有一个48-残基的天线样特征,这是ADP、GTP和棕榈酰辅酶a调节所必需的,Li等人的研究发现 [18],EGCG不抑制人类GDH的“无天线”形式,这表明GDH的EGCG抑制作用与黄酮类化合物的抗氧化活性无关,不直接影响活性部位,而是依赖于天线结构来发挥其活性,进一步证明 EGCG是GDH的变构抑制剂。有研究通过结构-功能分析发现,EGCG对hGDH2 (IC50 = 0.26 μM)的抑制作用比对hGDH1 (IC50 = 0.77 μM)的更强。这种抑制作用对于hGDH1而言,表现为协同性,而hGDH2则表现为非协同性。这一差异性,可能是两种亚型间15个不同氨基酸中的一个或多个造成的结果。此外,与野生型GDH相比,EGCG对高胰岛素血症/高氨血症中的突变GDH有同等有效抑制作用,使其成为可能的治疗先导化合物。
与EGCG类似,具有大型多酚结构的化合物ATA (金精三羧酸)和BSB同样是GDH的抑制剂 [19]。ATA干扰蛋白质/核糖核酸的相互作用,BSB与淀粉样聚合物相互作用。结合结果清楚地表明,ATA和BSB与GDH以高度特异性的方式相互作用,就像EGCG和ECG对GDH的特异性超过EC和EGC的特异性一样。ATA和BSB的另一个有趣的共同特征是,在谷氨酸盐浓度较高时,抑制作用似乎较弱,暗示这些化合物可能通过干扰催化裂缝的闭合来影响催化复合物的形成。化合物EGCG, ECG, ATA, BSB的结构见图1。
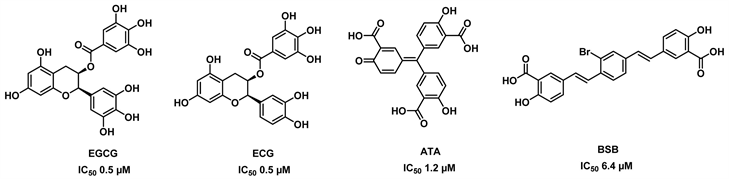
Figure 1. Structure of EGCG, ECG, ATA, BSB [19]
图1. EGCG, ECG, ATA, BSB的结构式 [19]
2.2. 含氯,硫类
部分含氯化合物如六氯酚(Hexachlorophene, HCP)、硫氯酚(Bithionol, BTH)、氯喹(Chloroquene)等,对于大脑皮质细胞膜的浓度依赖型谷氨酸摄取有抑制作用,从而对谷氨酸脱氢酶起到抑制活性的效果 [20]。它们与酶的结合位点在组成酶的两个亚基之间的交互界面上,而此交互界面是酶构象得以改变的基础。若酶构象无法改变,则酶对谷氨酸的催化分解效果就会大打折扣。
HCP在谷氨酸脱氢酶六聚体的内核处形成一个六重非对称环,HCP与GDH之间的大部分相互作用是疏水的,并且存在一个芳香族堆积相互作用环。HCP在两个方向上结合,第一种方向上,HCP环大约与对角相邻亚基的两条侧链重叠。另一个结合方向上的HCP与一系列亚甲基侧链原子进行疏水相互作用。此外,HCP分子的芳香环在这种环构象中相互堆叠。BTH则不和HCP在同一位点结合。当HCP与内核结合时,BTH在内核和六聚体外部之间结和 [21]。Tomita等人 [22] 发现,BTH的结合位点可能参与亮氨酸变构激活,这些氨基酸结合在亚单位界面上,紧邻BTH位点。这个可能的变构亮氨酸激活位点的位置由消除亮氨酸激活的接触残基突变所支持,这个位点与动物GDH体内亮氨酸激活之间的联系尚不清楚,还需要进一步证实。
氯喹已被认为是一种在兔的渗透性肝和肾皮质中有效的管家型GDH抑制剂,其对GDH的两种亚型都有很好的抑制效果,且它对管家型hGDH1更为敏感。此外,这种抑制效果会被ADP、L–亮氨酸消除,表明它们可能与氯喹共享结合位点 [23]。化合物HCP, BTH, Chloroquene的结构式见图2。
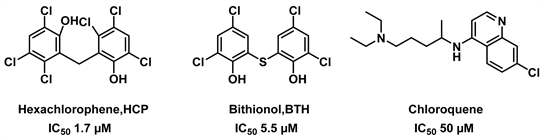
Figure 2. Structure of HCP, BTH, Chloroquene [19] [23]
图2. 六氯酚,硫氯酚,氯喹的结构式 [19] [23]
2.3. 间苯二甲酸类
间苯二甲酸(isophthalic acid, IPA)、二甲基间苯二甲酸(dimethyl isophthalic acid, DMIPA)也曾被报道可作为潜在的谷氨酸脱氢酶抑制剂。有研究表明,间苯二甲酸不仅能高效抑制GDH的活性,还表现出对疟原虫源GDH (Plasmodium GDH)的高度选择性。抑制机理可能是间苯二甲酸选择性地结合疟原虫源GDH的催化活性中心,进而影响其生物功能。而邻苯二甲酸则不是GDH抑制剂。此外,间苯二甲酸对哺乳动物源GDH抑制效力较低,这给人们带来了希望,通过仔细的设计或彻底的筛选,有可能找到在寄生虫和人类GDHs之间具有必要选择性的抑制剂。因此以它为前体开发抗寄生虫药物的潜力巨大 [24]。化合物IPA,DMIPA的结构式见图3。
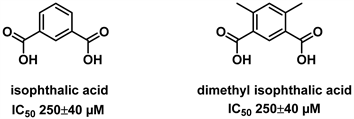
Figure 3. Structure of IPA, DMIPA [24]
图3. 间苯二甲酸,二甲基间苯二甲酸的结构式 [24]
2.4. 甾类激素
部分甾类激素也可作为内源性谷氨酸脱氢酶抑制剂。众所周知,雌激素通过与许多细胞中存在的雌激素受体结合而发挥多种生理作用。这种结合触发下游级联,启动调节细胞生长、迁移和其他功能的基因转录。然而,除了影响核DNA过程外,雌激素也可以通过非基因组机制起作用,包括对代谢酶的直接作用。其中哺乳动物谷氨酸脱氢酶最初被证明是由雌激素修饰的 [25]。这些激素通过在其封闭状态下与hGDH2有效相互作用,可能有助于调节大脑中谷氨酸代谢。但在表达GDH的组织或细胞内,雌激素的含量并没有达到上述水平,因此这些效应的生理相关性尚不确定。有数据显示,雌二醇(ß-estradiol)、雌三醇(Estriol)等激素都可以高效抑制GDH的活性,同时表明雌激素效应与hGDH2的活性状态的关联比hGDH1更强 [26]。此外,己烯雌酚(Diethylstilbestrol)作为人工合成的非甾体雌激素物质,对GDH也有很好的抑制效果。有独立研究提供证据,证明雌性激素可预防帕金森病 [27] 以及雄性芳香化酶敲除小鼠多巴胺能神经元发生凋亡 [28]。因此,阐明雌激素调节GDH活性的机制可能对理解这些激素在健康和疾病的细胞生物学中的作用以及开发治疗人类退行性疾病的新方法具有重要意义。化合物ß-estradiol, Estriol, Diethylstilbestrol的结构式见图4。
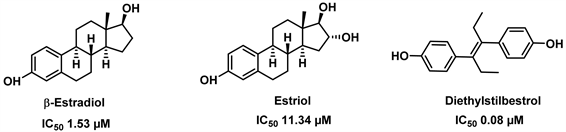
Figure 4. Structure of ß-estradiol, Estriol, Diethylstilbestrol [26]
图4. 雌二醇,雌三醇,己烯雌酚的结构式 [26]
2.5. 新型硒啉类
依布硒啉(Ebselen)作为一种合成的脂溶性有机含硒类化合物,它对神经系统疾病、急性胰腺炎、噪音引起的听力损失和心脏毒性有治疗作用。它还表现出抗动脉粥样硬化、抗血栓形成和细胞保护的特性 [29] [30] [31]。近年来,笔者实验室团队首先开发了一种新型细胞活力检测法—EZMTT检测法,为酶水平筛选GDH抑制剂提供了有效的检测方法 [32]。随后我们设计合成了荧光素和生物素标记的依布硒啉类似物,通过ForteBio分子互助实验、蛋白质组学分析和凝胶迁移实验我们确证了依布硒啉为有效的GDH1抑制剂 [33]。随后我们又进一步发现依布硒啉可能作用于GDH的NDA结合口袋 [34]。最近,我们合成得到了丙烷硒啉(Propylselen),并通过点突变观察对抑制剂活性的影响,发现丙烷硒啉是辅酶NADP+的竞争性抑制剂,并且Pro320对丙烷硒啉的结合非常重要,同时我们还发现丙烷硒啉对人乳腺癌细胞A549和人肝癌细胞H22具有较好的抑制作用,IC50分别为说明靶向NADP+结合口袋可以增强化合物的抗肿瘤活性 [35]。化合物Ebselen, Propylselen的结构式见图5。
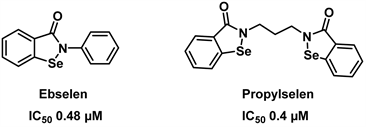
Figure 5. Structure of Ebselen, propylselen [35]
图5. 依布硒啉,丙烷硒啉的结构式[35]
3. 总结与展望
目前已知的GDH抑制剂有以下三方面不足:一是结构单一,主要为一些多酚类化合物;二是多酚类化合物化学性质不稳定,易被氧化失活;三是多酚类化合物具有较好的亲水性,因此较难通过生物体内的多重膜系统而被有效吸收。因此,开发结构新颖、作用明显和类药性质良好的GDH抑制剂以用于肿瘤及其并发症的治疗具有十分重要的意义。本课题组计划以依布硒啉和丙烷硒啉为先导化合物,通过计算机辅助药物设计、药物拼合原理、生物电子等排和辅酶类似物杂交等手段,设计和合成一系列靶向NADP+结合口袋的新化合物,以期得到活性和靶向性增强的化合物,进一步通过多重活性评价、深入的作用机制研究和多轮的构效关系研究,并且充分考虑分子的类药性质,期望获得1~2个活性先导化合物或候选化合物,为进一步开发具有完全自主知识产权的结构类型新颖的GDH抑制剂奠定基础。同时为进一步研究GDH抑制剂在肿瘤和HHS综合征等疾病治疗方面的应用前景奠定良好的理论和实验基础。
文章引用
叶恒宇,侯 卫,阮奔放. 谷氨酸脱氢酶的基本特性及其抑制剂的相关研究进展
The Basic Characteristics of Glutamate Dehydrogenase and Its Inhibitors[J]. 药物资讯, 2019, 08(06): 195-201. https://doi.org/10.12677/PI.2019.86026
参考文献
- 1. Li, C., Li, M., Chen, P., et al. (2011) Green Tea Polyphenols Control Dysregulated Glutamate Dehydrogenase in Trans-genic Mice by Hijacking the ADP Activation Site. Journal of Biological Chemistry, 286, 34164-34174. https://doi.org/10.1074/jbc.M111.268599
- 2. Ward, P. and Thompson, C. (2012) Metabolic Reprogramming: A Cancer Hallmark Even Warburg Did Not Anticipate. Cancer Cell, 21, 297-308. https://doi.org/10.1016/j.ccr.2012.02.014
- 3. Arthur, C. and Thomas, J. (2016) Central Role of Glutamate Metab-olism in the Maintenance of Nitrogen Homeostasis in Normal and Hyperammonemic Brain. Biomolecules, 6, 1-33. https://doi.org/10.3390/biom6020016
- 4. Baggio, L. and Morrison, M. (1996) The Nad(p)h-Utilizing Glutamate Dehydrogenase of Bacteroides Thetaiotaomicron Belongs to Enzyme Family I, and Its Activity Is Affected by Trans-Acting Gene(s) Positioned Downstream of Gdha. Journal of Bacteriology, 178, 7212-7220. https://doi.org/10.1128/jb.178.24.7212-7220.1996
- 5. Engel, P.C. (2014) Glutamate Dehydrogenases: The Why and How of Coenzyme Specificity. Neurochemical Research, 39, 426-432. https://doi.org/10.1007/s11064-013-1089-x
- 6. Altman, B.J., Stine, Z.E. and Dang, C.V. (2016) From Krebs to Clinic: Glutamine Metabolism to Cancer Therapy. Nature Reviews Cancer, 16, 619-634. https://doi.org/10.1038/nrc.2016.71
- 7. Still, E.R. and Yuneva, M.O. (2017) Hopefully Devoted to Q: Targeting Glutamine Addiction in Cancer. British Journal of Cancer, 116, 1375-1381. https://doi.org/10.1038/bjc.2017.113
- 8. 徐晓光, 朱静, 师俊玲, 等. 谷氨酸脱氢酶的基本特性及其与疾病的相关研究进展[J]. 生命科学, 2016, 28(11): 1314-1320.
- 9. Plaitakis, A. and Zaganas, I. (2001) Regulation of Human Glutamate Dehydrogenases: Implications for Glutamate, Ammonia and Energy Metabolism in Brain. Journal of Neuroscience Research, 66, 899-908. https://doi.org/10.1002/jnr.10054
- 10. Plaitakis, A., Latsoudis, H., Kanavouras, K., et al. (2010) Gain-of-Function Variant in Glud2 Glutamate Dehydrogenase Modifies Parkinson’s Disease Onset. European Journal of Human Genetics, 18, 336-341. https://doi.org/10.1038/ejhg.2009.179
- 11. Wan, M. and Francke, U. (1998) Evaluation of Two X Chromosomal Candidate Genes for Rett Syndrome: Glutamate Dehydrogenase-2 (Glud2) and Rab Gdp-Dissociation Inhibitor (Gdi1). American Journal of Medical Genetics, 78, 169-172. https://doi.org/10.1002/(SICI)1096-8628(19980630)78:2<169::AID-AJMG14>3.0.CO;2-L
- 12. Chen, R., Nishimura, M.C., Kharbanda, S., et al. (2014) Hominoid-Specific Enzyme Glud2 Promotes Growth of IDH1r132h Glioma. Proceedings of the National Academy of Sciences of the United States of America, 111, 14217-14222. https://doi.org/10.1073/pnas.1409653111
- 13. Liu, G., Jie, Z., Yu, M., et al. (2015) Glutamate Dehydrogenase Is a Novel Prognostic Marker and Predicts Metastases in Colorectal Cancer Patients. Journal of Translational Medicine, 13, 144-153. https://doi.org/10.1186/s12967-015-0500-6
- 14. Craze, M.L., El-Ansari, R., Aleskandarany, M.A., et al. (2019) Glutamate Dehydrogenase (Glud1) Expression in Breast Cancer. Breast Cancer Research and Treatment, 174, 79-91. https://doi.org/10.1007/s10549-018-5060-z
- 15. Yang, L., Moss, T., Mangala, L.S., et al. (2014) Metabolic Shifts toward Glutamine Regulate Tumor Growth, Invasion and Bioenergetics in Ovarian Cancer. Molecular Systems Biology, 10, 728-728. https://doi.org/10.1002/msb.20134892
- 16. Ninkovic, D., Sarnavka, V., Basnec, A., et al. (2016) Hyperinsulin-ism-Hyperammonemia Syndrome: A De Novo Mutation of the Glud1 Gene in Twins and a Review of the Literature. Journal of Pediatric Endocrinology and Metabolism, 29, 1083-1088. https://doi.org/10.1515/jpem-2016-0086
- 17. 李维熙, 王葳, 王文静. 茶多酚的氧化聚合机制研究进展[J]. 暨南大学学报(自然科学与医学版), 2016, 37(3): 193-200.
- 18. Li, C., Allen, A., Kwagh, J., et al. (2006) Green Tea Polyphenols Modulate Insulin Secretion by Inhibit-ing Glutamate Dehydrogenase. Journal of Biological Chemistry, 281, 10214-10221. https://doi.org/10.1074/jbc.M512792200
- 19. Li, M., Allen, A. and Smith, T.J. (2007) High Throughput Screening Reveals Several New Classes of Glutamate Dehydrogenase Inhibitors. Biochemistry, 46, 15089. https://doi.org/10.1021/bi7018783
- 20. Whitelaw, B.S. and Robinson, M.B. (2013) Inhibitors of Glutamate Dehy-drogenase Block Sodium-Dependent Glutamate Uptake in Rat Brain Membranes. Frontiers in Endocrinology, 17, 123. https://doi.org/10.3389/fendo.2013.00123
- 21. Li, M., Li, C., Allen, A., et al. (2014) Glutamate Dehydrogenase: Structure, Allosteric Regulation, and Role in Insulin Homeostasis. Neurochemical Research, 39, 433-445. https://doi.org/10.1007/s11064-013-1173-2
- 22. Tomita, T., Kuzuyama, T. and Nishiyama, M. (2011) Structural Basis for Leucine-Induced Allosteric Activation of Glutamate Dehydrogenase. Journal of Biological Chemistry, 286, 37406-37413. https://doi.org/10.1074/jbc.M111.260265
- 23. Choi, M.M., Kim, E.A., Choi, S.Y., et al. (2007) Inhibitory Proper-ties of Nerve-Specific Human Glutamate Dehydrogenase Isozyme by Chloroquine. Korean Society for Biochemistry and Molecular Biology, 40, 1077-1082. https://doi.org/10.5483/BMBRep.2007.40.6.1077
- 24. Aparicio, I.M., Marin, A., Bell, A. and Engel, P.C. (2010) Susceptibility of Plasmodium Falciparum to Glutamate Dehydrogenase Inhibitors—A Possible New Antimalarial Target. Molecular & Biochemical Parasitology, 172, 152-155. https://doi.org/10.1016/j.molbiopara.2010.04.002
- 25. Pons, M., Michel, F., Descomps, B. and de Paulet, A.C. (1978) Structural Requirements for Maximal Inhibitory Allosteric Effect of Estrogens and Estrogen Analogues on Glutamate Dehydrogenase. FEBS Journal, 84, 257-266. https://doi.org/10.1111/j.1432-1033.1978.tb12164.x
- 26. Borompokas, N., Papachatzaki, M.M., Kanavouras, K., et al. (2010) Estrogen Modification of Human Glutamate Dehydrogenases Is Linked to Enzyme Activation State. Journal of Biological Chemistry, 285, 31380-31387. https://doi.org/10.1074/jbc.M110.146084
- 27. Quesada, A., Lee, B.Y. and Micevych, P.E. (2008) Pi3 Kinase/Akt Activation Mediates Estrogen and Igf-1 Nigral Da Neuronal Neuroprotection against a Unilateral Rat Model of Parkin-son’s Disease. Developmental Neurobiology, 68, 632-644. https://doi.org/10.1002/dneu.20609
- 28. Hill, R.A., Chua, H.K., Jones, M.E.E., Simpson, E.R. and Boon, W.C. (2009) Estrogen Deficiency Results in Apoptosis in the Frontal Cortex of adult Female Aromatase Knockout Mice. Molecular and Cellular Neuroscience, 41, 1-7. https://doi.org/10.1016/j.mcn.2008.12.009
- 29. Sies, H. and Masumoto, H. (1997) Ebselen as a Glutathione Pe-roxidase Mimic and as a Scavenger of Peroxynitrite. Advances in Pharmacology, 38, 229-246. https://doi.org/10.1016/S1054-3589(08)60986-2
- 30. Batna, A., Fuchs, C. and Spiteller, G. (1997) Lipid Peroxi-dation in Presence of Ebselen. Chemistry and Physics of Lipids, 87, 149-158. https://doi.org/10.1016/S0009-3084(97)00037-6
- 31. Yang, C.F., Shen, H.M. and Ong, C.N. (1999) Protective Effect of Ebselen against Hydrogen Peroxide-Induced Cytotoxicity and DNA Damage in HepG2 Cells. Biochemical Pharmacology, 57, 273-279. https://doi.org/10.1016/S0006-2952(98)00299-8
- 32. Zhang, W., Zhu, M., Wang, F., et al. (2016) Mono-Sulfonated Tetrazolium Salt Based Nad(p)h Detection Reagents Suitable for Dehydrogenase and Real-Time Cell Viability Assays. Analytical Biochemistry, 509, 33-40. https://doi.org/10.1016/j.ab.2016.06.026
- 33. Yu, Y., Jin, Y., Zhou, J., et al. (2017) Ebselen: Mechanisms of Glu-tamate Dehydrogenase and Glutaminase Enzyme Inhibition. ACS Chemical Biology, 12, 3003-3011. https://doi.org/10.1021/acschembio.7b00728
- 34. Jin, Y., Li, D., Lu, S., Zhao, H., Chen, Z., Hou, W. and Ruan, B.H. (2018) Ebselen Reversibly Inhibits Human Glutamate Dehydrogenase at the Catalytic Site. Assay and Drug Devel-opment Technologies, 16, 115-122. https://doi.org/10.1089/adt.2017.822
- 35. Hou, W., Lu, S., Zhao, H., et al. (2019) Propylselen Inhibits Cancer Cell Growth by Targeting Glutamate Dehydrogenase at the NADP+ Binding Site. Biochemical and Biophysical Research Communications, 509, 262-267. https://doi.org/10.1016/j.bbrc.2018.12.117
NOTES
*通讯作者。