Bioprocess
Vol.07 No.03(2017), Article ID:22678,9
pages
10.12677/BP.2017.73005
Comparative Study on Degradation Process of Acellular Porcine Small Intestinal Submucosa Matrix In Vivo and In Vitro
Xiaolong Zheng1, Yi Chen1, Fumin Men1, Yang Zhang1, Yongsheng Li2, Hongquan Wang1, Jinhui Zhang1, Hairong Liu2, Leilei Xia1*, Bo Zhao1*
1Beijing Biosis Healing Biological Technology Co., Ltd., Beijing
2College of Materials Science and Engineering, Hunan University, Changsha Hunan

Received: Oct. 25th, 2017; accepted: Nov. 10th, 2017; published: Nov. 15th, 2017

ABSTRACT
Degradation behaviors of acellular porcine small intestinal submucosa (SIS) matrix under different circumstances were investigated by taking the degradation experiments in vivo and in vitro respectively. In vitro, solutions of collagenase type I and Proteinase K were used to mimic the degradation environment. Wistar mice and New Zealand Rabbits were used as subcutaneous and abdominal degradation model in vivo. Results showed that it took 8-12 weeks for the tissue to repair in vivo, while the time intervals needed to get the same degradation percentage for collagenase I and Proteinase K in vitro were 12 h and 60 min respectively. SIS was totally degraded in 24 weeks in vivo and the corresponding time for collagenase I and Proteinase K in vitro were 96 h and 120 min. Besides, SIS showed good histocompatibility and did not have symptoms of adhesion and hematomas. Results demonstrated the processes of degradation and tissue repair were matched well with each other without immunological rejection and SIS could supply the mechanical strength and biological template during tissue repair, suggesting SIS is a potential surgical biomaterial for clinical applications.
Keywords:Degradation, In Vivo and In Vitro, Porcine Small Intestinal Submucosa, Biomaterial
脱细胞猪小肠粘膜下层材料体内外 降解过程对比研究
郑晓龙1,陈毅1,门福民1,张扬1,李永生2,王洪权1,张晋辉1,刘海蓉2,夏磊磊1*,赵博1*
1北京博辉瑞进生物科技有限公司,北京
2湖南大学材料科学与工程学院,湖南 长沙

收稿日期:2017年10月25日;录用日期:2017年11月10日;发布日期:2017年11月15日

摘 要
通过对脱细胞猪小肠粘膜下层基质材料进行体内外降解实验,考察了SIS材料在不同降解环境下的降解行为,为其在临床应用中的有效性提供依据。体外降解实验采用I型胶原酶,蛋白酶K酶解来模拟体内降解环境;体内降解实验采用大鼠和新西兰兔分别进行皮下以及腹壁植入。结果显示SIS材料在体内修复组织需要8~12周,相当于体外I型胶原酶降解12 h (降解40.24%),蛋白酶K降解60 min (56.33%);材料在体内完全降解的时间为24周,而体外胶原酶和蛋白酶K完全降解分别需要96 h和120 min,同时SIS材料组织相容性好,无黏连,血肿等症状发生。结果表明SIS降解与组织修复过程相匹配,排异反应弱,可以为组织修复提供力学强度与生物学模板,表明SIS材料是一种可用于临床修复的生物材料。
关键词 :降解,体内外,脱细胞猪小肠粘膜下层,生物材料

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
脱细胞基质(Acellular tissue matrix, ACTM)是动物源组织经过物理化学等方法去除组织中的免疫原物质,保留细胞外基质(ECM)的一种天然可生物降解材料。ACTM材料主要作用是为组织细胞生长提供场所,同时引导组织再生,并为组织提供一定力学强度。材料因为去除了免疫原物质,所以组织相容性较好,同时具有一定的力学强度可以支持组织重建,因此是较为理想的组织修复材料。天然可生物降解材料的降解速率对材料植入体内的安全性和有效性影响巨大,当材料降解过快,其无法为组织提供生物学及力学性能,进而导致手术失败,并发症增加,若材料降解过慢,又会影响组织的再生修复 [1] ,因此生物材料应当在组织修复完全之前保持自身特性,使得组织完成重建。
脱细胞小肠粘膜下层基质材料(SIS)是以猪源小肠经过一系列处理去掉免疫成分,保留ECM得到的一种生物材料,材料以其优异的理化性能、生物相容性和可降解吸收能力受到越来越多的关注 [2] ,现今SIS已广泛用于腹壁修复、肌腱修复以及硬脑膜修复。张喜海等人对小肠黏膜下层修复大鼠腹壁缺损进行了研究,结果显示动物无不良反应,无疝瘘发生,疝补片植入12周时未见破裂 [3] 。宋致成等人进行了小肠黏膜下层与肌腱细胞构建组织工程支架修复大鼠腹壁缺损,实验显示支架与肌肉组织交界区有血管长入和肌肉组织长出,同时力学性能显示支架力学强度大于SD大鼠腹壁强度 [4] 。虽然材料已经被证明具有良好的相容性,以及高强度的力学性能,但是材料的体内外降解对比性研究却鲜有报道。本文选择SIS分别进行I型胶原酶、蛋白酶K体外降解实验和动物皮下植入以及腹壁修复实验,对比体内外降解趋势,探讨降解与组织修复的相关关系,为SIS用于组织修复体内降解行为的研究提供理论依据 [5] [6] [7] 。
2. 实验部分
2.1. 主要原料
脱细胞猪小肠粘膜下层基质材料(VIDASIS),北京博辉瑞进生物科技有限公司产品;蛋白酶K (德国默克公司,Merck);I型胶原酶(C0130, Sigma)。
蛋白酶K:准确称取酶20 mg,用PBS溶解定容到100 mL,取定容溶液2 mL用PBS溶液定容到100 mL。
I型胶原酶:准确称取I型胶原酶50 mg,用PBS溶解,定容至100 mL容量瓶中。
2.2. 主要仪器
本研究所采用的主要仪器见表1。
2.3. I型胶原酶降解实验
取1 × 2 cm2 SIS烘干称重放入5 mL离心管中,按照一定的比例加入I型胶原酶(样品:酶溶液 = 4 mg:1 mL),在恒温摇床中反应(37℃,200 rpm),分别在3 h、6 h、9 h、12 h、20 h、28 h、36 h、48 h、60 h、72 h、96 h取出样品烘干称重,计算降解率。
2.4. 蛋白酶K降解实验
取2 × 0.7 cm2 SIS烘干称重,按照一定比例加入蛋白酶K(样品:酶溶液 = 5 mg:1 mL),水浴56℃,分别在15 min、30 min、45 min、60 min、75 min、90 min、105 min、120 min取出样品并称重,计算样品降解率。
2.5. 大鼠皮下降解实验
将16只Wistar大鼠(常规体重100 g~140 g,获得中国人民解放军军事医学科学院野战输血研究所全军血液安全与保障重点实验室动物伦理批准)随机分为4组:第1周组、第4周组、第8周组和第12周组(每组4只,雌雄各半)。每只大鼠腹腔注射3%戊巴比妥钠(30 mg/kg体重)麻醉。在无菌条件下,于腹部正中皮肤行纵切口,向两边钝性分离皮下组织,埋入40 mm × 70 mm SIS,然后缝合皮肤,肌肉注射庆大霉素(20 mg/kg体重),每天1次,连续给药3天,正常饲养、进食饮水。在不同时间,麻醉处死大鼠,肉眼观察埋植部位SIS的吸收降解情况,并记录。
2.6. 兔腹壁植入降解实验
新西兰兔(常规体重2.5~3.0 kg,获得山东省医学科学院药物研究所动物伦理批准)称重,用3%戊巴比妥钠以1.5 mL/kg剂量静脉注射麻醉。兔麻醉后,仰卧固定,剔除腹部被毛,碘伏消毒。铺无菌洞巾,
Table 1. Mainly used instruments in this study
表1. 本研究所使用的主要仪器
沿腹正中线切开约8 cm纵行切口,钝性剥离皮肤与皮下组织,距腹中线左右各1 cm的位置,剪下2 cm × 3 cm大小腹壁组织,剪取3.5 cm × 2.5 cm SIS,四周间断缝合到腹膜内腹部开口,观察有无出血后,依次缝合皮下组织与皮肤,手术图片见图1。耳缘静脉注射头孢哌酮钠舒巴坦钠,消毒手术部位,将其放回笼中。术后5天进行常规消炎,并密切观察兔生理情况。于术后2周、4周、8周、12周、24周,动物采用3%戊巴比妥钠麻醉,股动脉放血处死动物,进行材料降解评估。
3. 结果
3.1. I型胶原酶降解
如图2,I型胶原酶的体外降解过程表明,随着降解时间的延长样品质量逐渐减少,肉眼观察降解液中的样品随着降解时间的延长逐渐减少,酶解96 h后实验样品固体碎片质量均近乎为零。从降解率和降解曲线可以看出,6 h样品降解率29%左右,12 h降解率为40%,20 h降解率达68%左右,至96 h样品降解率达90%以上。

Figure 1. The picture of SIS implanted into abdomen
图1. SIS植入动物腹膜内照片

Figure 2. In vitro degradation curve of SIS dissolved in protease solution of type I collagenase
图2. SIS在I型胶原酶溶液中的体外降解曲线
3.2. 蛋白酶K降解
进一步采用蛋白酶K进行体外降解实验如图3,相比于I型胶原酶,蛋白酶K对SIS材料的酶解能力更强,体外降解过程更快。通过降解曲线可以发现,15 min时降解率为29.67%,60 min时一半以上样品已降解,降解率为56.33%,90 min时大部分样品已降解,降解率为71.62%,120 min时降解率90%以上。
3.3. 大鼠皮下降解
采用大鼠皮下植入实验观察SIS在体内的降解,SIS材料在植入大鼠腹部皮下1、4、8、12周后,随着植入周期的延长,SIS被逐渐吸收。植入1周后,可见完整的SIS,样品周围被少量结缔组织包裹,极易剥离;植入4周后,SIS体积开始变小(肉眼观察估计约缩小五分之一),样品周围的结缔组织增多,但容易剥离;植入8周后,SIS体积明显缩小(约五分之二),样品周围被大量结缔组织包裹,仍可剥离;植入12周后,SIS基本完成组织修复与重建,样品(保留略多于二分之一)周围被结缔组织紧密包裹,不易剥离。以此估计SIS植入体内1、4、8、12周后材料降解率分别为0%、20%、40%、45%,其降解曲线如图4所示。
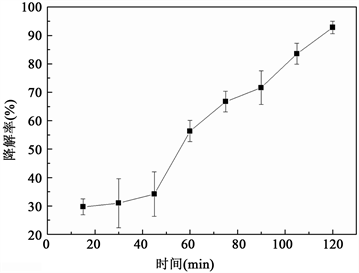
Figure 3. Degradation curve of SIS dissolved in protease K solution
图3. SIS在蛋白酶K溶液中体外降解曲线

Figure 4. Degradation curve of SIS implanted into rat subcutaneous tissue
图4. SIS植入大鼠皮下体内降解曲线
3.4. 兔腹壁植入实验
将 SIS植入兔腹膜内,观察样品在腹膜内降解过程,发现SIS与周围组织均未见粘连,无脱出、变形、移位情况,修补片周围未见血块,周围无纤维包膜形成。降解曲线如图5所示,SIS在植入动物腹膜内创面2周、4周、8周后,材料柔软、顺应性好,未发现皱缩情况,16周、24周时材料与组织融合,无法分离。植入2周后,可见完整的SIS,基本无降解,材料周围被少量纤维组织浸润,与周围极易分离;植入4周后,SIS部分被组织替代(肉眼观察估计约缩小四分之一),材料周围的纤维组织增多,但容易剥离;植入8周后,SIS被组织替代部分增加(约二分之一),材料周围被大量纤维组织浸润,仍可剥离;植入16周后,SIS基本完成组织修复与重建,材料(约五分之四)周围已与新生腹膜完全融合,无法分离;植入24周后,腹膜组织基本已完全再生,无法观察到材料,如图6所示。

Figure 5. Degradation curve of SIS implanted into abdomen of rabbit
图5. SIS植入兔腹膜内降解曲线
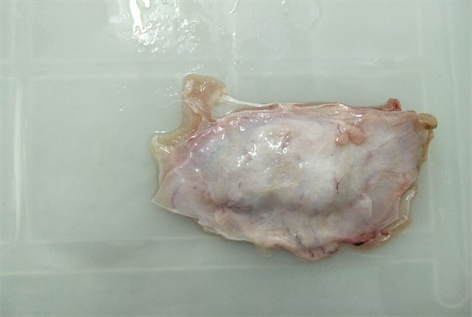
Figure 6. Tissue repaired after implanting SIS into abdomen for 24 weeks
图6. SIS植入腹膜内24周后的组织修复图
3.5. 体内体外拟合
上述体内、体外降解实验结果可以说明SIS为可降解材料,在12周时材料基本可完成组织修复和重建,对应体外I型胶原酶降解时间约为12 h,16周体内降解情况对应体外降解48 h,而体内降解24周对应体外降解时间96 h。从材料降解量上分析,体外降解时间关键时间点为12小时(对应于体内8~12周),此时材料出现大部分降解情况,代表体内大部分材料被降解吸收,力学性能较差,为完成材料加固、修复、重建缺损组织的目的,材料的体外模拟降解过程应控制在12 h降解量小于50% (I型胶原酶),或60 min降解量小于56.33% (蛋白酶K),体内植入初期的4周相当于体外降解实验的6 h (I型胶原酶)、30 min (蛋白酶K),而植入后期的16周相当于体外降解实验的48 h (I型胶原酶)、105 min (蛋白酶K),体内完全降解时间点相当于体外降解实验的96 h (I型胶原酶)、120 min (蛋白酶K)。降解数据见表2,体内降解12周对比体外降解的时间如图7虚线框部分所示,体内完全降解对应体外降解的时间如图7中的实线框部分所示。

Figure 7. Degradative trend and simulation in vivo and in vitro ((a) The degradation curve of type I collagenase; (b) the degradation curve of abdominal implantation; (c) The degradation curve of subcutaneous implantation; (d) The degradation curve of proteinase K)
图7. 体内体外降解趋势与模拟((a) I型胶原酶降解曲线;(b) 腹腔植入降解曲线;(c) 皮下植入降解曲线;(d) 蛋白酶K降解曲线)
Table 2. Comparison of degradation rate and time in vivo and in vitro
表2. 体内外降解率时间对比表
4. 讨论
随着临床需求量的增加,生物材料出现了一系列并发症,如肠梗死,肠瘘,腹壁粘连等,经研究发现并发症与材料的降解率有较大的关系,因此弄清材料降解规律对于后续工作具有重大的意义 [8] 。材料降解包括体内降解及体外模拟降解,体内降解通常是将材料植入到皮下或者修复部位,观察并记录材料降解情况以及组织重建情况,这种方法更接近临床应用,但是存在费用高、周期长以及不同动物之间存在个体差异等缺点,而体外降解实验一般是将材料浸泡到模拟体液(如PBS、SBF等)或者酶溶液(如胶原酶、蛋白酶等)中观察材料的降解情况,这种方法由于采用简化的模型,没有细胞等参与,具有可控性好、周期短等优点,作为动物试验及临床前的快速评价方法,对于降低材料开发过程的动物使用量与动物实验研究费用、缩短材料的研发周期具有重要作用 [5] [6] [7] 。因此,建立SIS材料体内外降解规律相关性,对于了解SIS材料降解行为、组织相容性以及材料开发具有重要的意义。本实验选用I型胶原酶以及蛋白酶K溶液模拟体内降解实验,并采用大鼠皮下植入实验及兔腹部修复实验研究材料体内降解行为,拟合材料体内体外降解曲线,建立体内外降解相关性。
SIS材料包含I型胶原,及少量III型和IV型胶原,还包含多种的细胞因子,如成纤维细胞生长因子、转化生长因子、血管内皮生长因子等,此外还有弹性纤维、黏蛋白、GAGs等成份 [9] 。I型胶原酶是I型胶原蛋白的特定水解酶,SIS材料中胶原蛋白含量高达93%以上,I型胶原蛋白约占总胶原蛋白的40%。从I型胶原酶的体外降解过程数据可以发现,材料随着降解时间的延长逐渐变小且结构越来越松散,在降解初期速度较快,酶解12 h降解率达到40%,20 h降解率达68%左右,后期速度开始减慢,这主要是因为在初期I型胶原含量较多,随着降解进行,I型胶原含量逐渐减少,至酶解96 h降解率达90%以上,材料完全降解,这可能是因为I型胶原作为SIS的主要成分对材料结构具有一定维持作用,当其被破坏时,材料失去支撑,三维结构遭到破坏。进一步采用蛋白酶K进行体外降解实验,相比于I型胶原酶,蛋白酶K是一种切割活性较广的丝氨酸蛋白酶,可以用于消化各种蛋白,是一种广谱性的蛋白消化酶。从实验数据可以看出,蛋白酶K的消化速度明显高于I型胶原酶,这是因为SIS材料中除了I型胶原外,还含有其它的蛋白,包括Ⅲ型胶原、IV型胶原以及一些弹性蛋白等,这些都可以作为蛋白酶K的消化对象。在蛋白酶K中,材料60 min时降解率为56.33%,120 min时降解率达90%以上。
将材料植入到大鼠皮下或者腹壁后,发现材料在两个组织中的降解过程相似,SIS在植入体内后随着植入时间的延长,SIS被逐渐吸收,并与周围组织结合,最终完成组织的修复与重建。通过观察材料在体内的变化情况,发现在植入1~2周,材料没有发生变化,到4周时,材料开始降解,至12周材料降解了50%左右,到24周腹膜组织基本已完全再生,无法观察到材料,材料可认为已经被完全降解。
综合对比观察体内外降解的结果,可以看出SIS材料的体内外降解曲线相类似,从降解量分析,体内植入初期的4周相当于体外降解实验的6 h (I型胶原酶)、30 min (蛋白酶K),植入后12周相当于体外降解12 h (胶原酶),或60 min (蛋白酶K),而植入后期的16周相当于体外降解实验的48 h (胶原酶)、105 min (蛋白酶K),体内完全降解时间点相当于体外降解实验的96 h (胶原酶)、120 min (蛋白酶K)。体外降解速率快于体内降解速率,可能原因是体外酶浓度高于体内浓度,且体外在液体环境中酶容易接触到材料整个机体。孙皎等研究聚乙交酯丙交酯体内外生物降解性能结果发现,体外降解速率低于体内降解速率 [10] ,本研究结果与其它研究有区别的原因可能是因为人工合成材料与细胞外基质材料在体内降解的机制不同,人工合成材料的降解主要是以水解方式进行,而细胞外基质材料的降解主要是酶降解 [11] 。
综上所述,通过研究SIS材料体内外降解行为发现,体外降解行为与体内降解行为具有一定的相关性,体外降解速率快于体内降解速率。本研究初步揭示了体内外降解的相关性,为体外模拟体内降解提供一定参考,有助于体外快速评价材料的降解行为,缩短可降解生物补片的开发周期。
致谢
本研究得到国家863计划新材料领域专项(2015AA033602)和科技型中小企业创新基金(Z14010101281)的经费支持。
文章引用
郑晓龙,陈毅,门福民,张扬,李永生,王洪权,张晋辉,刘海蓉,夏磊磊,赵博. 脱细胞猪小肠粘膜下层材料体内外降解过程对比研究
Comparative Study on Degradation Process of Acellular Porcine Small Intestinal Submucosa Matrix In Vivo and In Vitro[J]. 生物过程, 2017, 07(03): 31-39. http://dx.doi.org/10.12677/BP.2017.73005
参考文献 (References)
- 1. 姜岩, 张剑, 王强. 三种猪源性细胞外基质体内降解规律的实验研究[J]. 现代生物医学进展, 2014, 14(23): 4430- 4433.
- 2. 夏磊磊, 陈毅, 门福民, 等. 不同组织来源的胶原蛋白生物材料物理性能对比研究[J]. 材料科学, 2017, 7(4): 431- 439.
- 3. 张喜海, 罗静聪, 杨志明, 等. 小肠黏膜下层与聚丙烯修复大鼠腹壁缺损的对比研究[J]. 中国修复重建外科杂志, 2005, 19(7): 574-577.
- 4. 宋致成, 顾岩. 应用猪小肠黏膜下层与肌腱细胞构建组织工程支架修复大鼠腹壁缺损的实验研究[J]. 外科理论与实践, 2012, 17(3): 270-274.
- 5. 鲍时根, 张云, 朱玉俊, 等. 聚(L-乳酸)体内外降解相关性研究[J]. 安徽医药, 2014, 18(5): 808-810.
- 6. Patrick, K.B., Jaroslaw, D. and Jeremy, G. (2013) A New in Vitro–in vivo Correlation for Bioabsorbable Magnesium Stents from Mechanical Behavior. Materials Science and Engineering C: Materials for Biological Applications, 33, 5064-5070. https://doi.org/10.1016/j.msec.2013.08.042
- 7. Patrick, J.P. and Suzanne, A.M. (2001) Issues in Pre-Clinical Testing of Implants. Journal of Materials Processing Technology, 118, 337-342. https://doi.org/10.1016/S0924-0136(01)00858-5
- 8. Thomas, W.G., Ann, M.S. and Stephen, F.B. (2007) A Quantitative Method for Evaluating the Degradation of Biologic Scaffold Materials. Biomaterials, 28, 147-150. https://doi.org/10.1016/j.biomaterials.2006.08.022
- 9. Lei, S. and Vincent, R. (2013) Biochemical and Biome-chanical Characterization of Porcine Small Intestinal Submucosa (SIS): A Mini Review. International Journal of Burns and Trauma, 3, 173-179.
- 10. 孙皎, 何伟. 聚乙交酯丙交酯体内外生物降解性能的相关研究[J]. 生物医学工程学杂志, 2004, 21(5): 717-720.
- 11. Robert, V. and Hideaki, N. (2003) Matrix Metalloproteinases and Tissue Inhibitors of Metalloproteinases: Structure, Function, and Biochemistry. Circulation Research, 92, 827-839. https://doi.org/10.1161/01.RES.0000070112.80711.3D
NOTES
*通讯作者。
