World Journal of Cancer Research
Vol.
11
No.
01
(
2021
), Article ID:
39686
,
7
pages
10.12677/WJCR.2021.111001
基于酸性微环境研究养阴扶正方对肺癌小鼠体内HIF-1α、Arg1表达的影响
魏冬梅*,孙玺媛,尹钢,姜梅,刘锐,陈宏#
齐齐哈尔市第一医院,黑龙江 齐齐哈尔
收稿日期:2020年12月7日;录用日期:2020年12月30日;发布日期:2021年1月8日

摘要
目的:探讨养阴扶正方对肺癌小鼠体内HIF-1α、Arg1表达的影响。方法:建立Lewis肺癌C57BL/6鼠移植瘤模型,建模成功后,分别予以养阴扶正方低、中、高剂量组进行干预;绘制肿瘤生长曲线,计算抑瘤率,Elisa方法检测瘤组织中乳酸的含量,West-blot、Real-time分别检测Lewis肺癌HIF-1α、Arg1的蛋白及mRNA表达。结果:Lewis肺癌移植瘤模型建立;养阴扶正方可抑制Lewis肺癌生长,降低Lewis肺癌乳酸,减瘤组织HIF-1α、Arg1的mRNA的表达。结论:养阴扶正方改善了肺癌的酸性微环境,通过对HIF-1α、Arg1的调控,减少M2型TAMs的数量,降低免疫抑制蛋白因子的分泌,逆转了免疫抑制,抑制了肺癌的生长,是养阴扶正方抗NSCLC的新机制。
关键词
肺癌,养阴扶正方,HIF-1αArg1

A Study of the Effects of Yangyin Fuzheng Decoction on HIF-1α and Arg1 Expression in Lung Cancer Mice Based on Acidic Microenvironment
Dongmei Wei*, Xiyuan Sun, Gang Yin, Mei Jiang, Rui Liu, Hong Chen#
The First Hospital of Qiqihar, Qiqihar Heilongjiang
Received: Dec. 7th, 2020; accepted: Dec. 30th, 2020; published: Jan. 8th, 2021

ABSTRACT
Objective: Discuss the effects of Yangyin Fuzheng Decoction on HIF-1α and Arg1 expression in lung cancer mice. Method: Establish the model of Lewis lung cancer C57BL/6 mouse transplantation tumor; the low, medium and high dose of Yangyin Fuzheng Decoction were given for intervention after modeling successfully. Draw the tumor growth curve, calculate tumor-inhibition rate, detect the lactic acid content of with Elisa, test HIF-1α, Arg1 protein and mRNA expression of Lewis lung cancer with West-blot and Real-time respectively. Result: The establishment of Lewis lung cancer transplantation tumor model establishment; Yangyin Fuzheng Decoction can inhibit the growth of Lewis lung cancer, decrease Lewis lung cancer lactic acid and reduce mRNA expression of tumor tissue HIF-1αand Arg1. Conclusion: Yangyin Fuzheng Decoction improves the acidic microenvironment of lung cancer by regulating HIF-1αand Arg1, reduces the amount of M2 style TAMs, decreases the secretion of immunosuppressive protein factor, reverses the immunosuppression and inhibits the growth of lung cancer, which is an Anti-NSCLC new mechanism of Yangyin Fuzheng Decoction.
Keywords:Lung Cancer, Yangyin Fuzheng Decoction, HIF-1α, Arg1

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
随着近几十年来肿瘤免疫学和分子生物学的发展与进步,研究发现恶性实体肿瘤组织中肿瘤细胞外pH偏酸性,为6.5~6.9,细胞内pH值 > 7.4,相对偏碱性,相应正常组织细胞外pH偏碱性,为7.2~7.5 [1] [2] [3],因此,乳酸导致了肺癌的酸性微环境形成,是酸性微环境的主要成分。肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)是存在于肿瘤微环境中的一群巨噬细胞,是肿瘤微环境中关键的炎性细胞 [4],巨噬细胞分为经典活化巨噬细胞 M1型和选择性活化巨噬细胞M2型。研究表明,在低氧诱导因子-1α (hypoxia-inducible factor-1 α, HIF-1α)的作用下,乳酸诱导VEGF和M2型TAMs的极化,乳酸还可诱导巨噬细胞表达精氨酸酶-1 (arginase 1, Arg-1),Arg-1可产生多胺,促进肺癌的生长 [5]。因此,在前期研究的基础上,我们提出:养阴扶正方可以抑制HIF-1α、Arg1的表达,减少乳酸的生成及抑制TAMs向M2型的迁移,上调免疫应答,逆转免疫抑制,改善肺癌酸性免疫抑制微环境,进而抑制肺癌的发展。为养阴扶正方的应用和肿瘤微环境研究提供一种新的实验和理论依据。
2. 材料与方法
2.1. 实验材料
2.1.1. 细胞与动物
Lewis肺癌细胞株:购自美国ATCC公司;C57BL/6小鼠,雄性,鼠龄6~8周,20 ± 2 g/只,SPF级,购自浙江维通利华实验动物技术有限公司,动物合格证号:SCXK(浙)2019-0001。本实验通过《齐齐哈尔市第一医院实验动物管理办法(试行)》伦理审核(NO.2020-05)。
2.1.2. 药品
养阴扶正方由黄芪、党参、沙参、天冬、麦冬、生白术、山药、白花蛇舌草、拳参、绞股蓝、茯苓、莪术组成,取以上药加水煎煮二次,每次加10倍量水,提取2小时,滤过后合并滤液,制成5.25克(生药)/ml,齐齐哈尔市中医医院制剂室提供。
2.2. 方法
2.2.1. Lewis肺癌荷瘤鼠模型的建立
体外培养Lewis肺癌细胞系,传代培养,取对数生长期细胞经PBS冲洗、胰酶消化、离心后加入生理盐水制成细胞悬液,调整细胞浓度至5 × 106/mL,测定活细胞数大于95%,在无菌工作台内,取细胞悬液0.2 ml,接种到C57BL/6小鼠右前肢腋窝处皮下,接种后腋窝皮下会出现可触摸到的肿瘤结节,则造模成功。
2.2.2. 实验分组及给药方法
瘤体达到100 mm3时,将40只肺癌模型C57BL/6荷瘤鼠随机分为4组,每组10只。分别为Control组(模型组):0.4 ml生理盐水灌胃,每日一次;YYFZDL组(养阴扶正方组低剂量组):养阴扶正方26 g/kg/d,0.4 ml灌胃,每日一次,YYFZDM组(养阴扶正方中剂量组):养阴扶正方52 g/kg/d,0.4 ml灌胃,每日一次,YYFZDH组(养阴扶正方组高剂量组):养阴扶正方104 g/kg/d,0.4 ml灌胃,每日一次。药物治疗21天。
2.3. 观察指标及测定
2.3.1. 养阴扶正方对Lewis肺癌的增殖抑制作用以及对荷瘤鼠体重影响
药物治疗后,每3天用游标卡尺测量1次C57BL/6荷瘤鼠瘤灶长短径(由3~4名实验组成员对C57BL/6小鼠肿瘤最长径(m)与短径(n)进行测量,最终取平均值),按Steel公式计算肿瘤体积:V = mn2/2,测算C57BL/6荷瘤鼠肿瘤体积的变化,每3天用精密电子天平测量C57BL/6荷瘤鼠体重变化,绘制肿瘤生长曲线;无菌操作下从C57BL/6荷瘤鼠右侧前腋皮下剥取肿瘤组织,剔除纤维包膜,称量其瘤重,计算抑瘤率。
2.3.2. 养阴扶正方对Lewis肺癌乳酸的影响
取C57BL/6荷瘤鼠右侧前腋皮下瘤组织及左腋下的脂肪组织,以眼科剪充分剪碎,分别放入Hanks缓冲液中(300 mg/ml),混匀后以300 G室温37℃离心10 min。吸取上清液,过滤后得到肿瘤组织上清。乳酸Elisa检测试剂盒检测上清液中及乳酸含量。
2.3.3. 养阴扶正方Lewis肺癌HIF-1α、Arg1表达的影响
Western blot法检测瘤组织HIF-1α、Arg1蛋白表达:提取瘤组织全蛋白,蛋白定量后加入相应体积缓冲液煮沸变性,SDS-PAGE凝胶电泳分离、转膜并封闭,一抗4℃孵育过夜,次日洗脱,加入辣根过氧化物酶标记的二抗,室温孵育1 h左右,充分洗脱后化学发光法显影;Real-time PCR法检测瘤组织HIF-1α、Arg1 mRNA表达:采用Trizol法提取瘤组织总RNA,测定纯度并定量后逆转录,取逆转录产物进行Real-time PCR反应,检测HIF-1α、Arg1 mRNA表达的变化。
3. 统计方法
采用SPSS20.0软件,计量资料以均数±标准差( )表示,组间比较采用单因素方差分析,组间两两比较采用t检验。P < 0.05为差异有统计学意义。
4. 结果
4.1. 养阴扶正方对Lewis肺癌细胞的增殖抑制作用以及对荷瘤鼠体重影响
Table 1. The body weight, Lewis lung cancer xenograft tumor weight and tumor inhibition rate of mice in each group
表1. 各组小鼠体重、Lewis肺癌移植瘤重量及肿瘤抑制率( , n = 10)
注:与模型组相比,※P < 0.01;与YYFZDH组相比,▲P < 0.01;与YYFZDL相比,★P < 0.01。
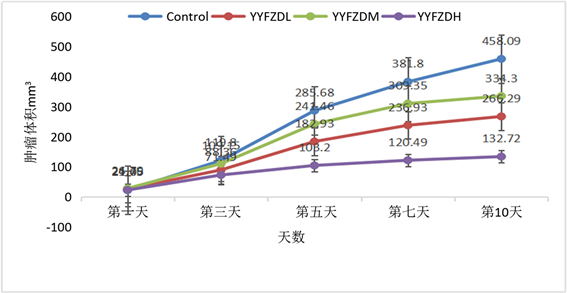
Figure 1. The growth curve of Lewis lung tumor in each group
图1. Lewis肺癌各组肿瘤生长曲线
如表1所示,养阴扶正方高剂量组小鼠体重略有增加,其余三组体重均有不同程度下降,其中低剂量组下降最明显。各治疗组的瘤重均低于荷瘤对照组,差异显著(P < 0.01),其中养阴扶正方高剂量组的抑瘤作用最强,抑瘤率为62.73%,中剂量组的抑瘤率为57.45%,低剂量组的抑瘤率为52.48%。说明养阴扶正方具有抑制肿瘤生长的作用。
如图1所示,AYYFZD可抑制Lewis肺癌的生长,与Control组比较,P < 0.01,差异有统计学意义。
4.2. 养阴扶正方对Lewis肺癌乳酸的影响
Table 2. The effect of Yangyin Fuzheng Decoction on lactification in A549 nude mice xenograft tumors modle
表2. 养阴扶正方对A549裸鼠移植瘤乳酸生成的影响(n = 10, mmol/gprot, )
注:**与Control组比较,P < 0.01。
 注:**与Control组比较,P < 0.01
注:**与Control组比较,P < 0.01
Figure 2. The effect of Yangyin Fuzheng Decoction on lactification of human lung adenocarcinoma cell gland in A549 nude mice xenograft tumors modle
图2. 养阴扶正方对人肺腺癌细胞A549裸鼠移植瘤乳酸生成的影响
如表2、图2所示,药物处理各组荷瘤鼠21天后,检测各组荷瘤鼠瘤组织乳酸含量,结果显示:低剂量、中剂量、高剂量的养阴扶正方均能抑制人肺腺癌细胞A549裸鼠移植瘤乳酸的生成,并且随着养阴扶正方剂量的增加,乳酸生成量逐渐减少,与Control相比较,YYFZDM组、YYFZDH组P < 0.01,差异极显著。
4.3. 养阴扶正方对Lewis肺癌荷瘤鼠的瘤组织HIF-1α、Arg1蛋白的影响

Figure 3. The effect of Yangyin Fuzheng Decoction on HIF-1α and arg1 protein of human lung adenocarcinoma cell gland xenograft tumors in A549 nude mice xenograft tumors modle
图3. 养阴扶正方对人肺腺癌细胞A549裸鼠移植瘤HIF-1α、Arg1蛋白的影响
如图3所示,与Control组比较,YYFZDL组、YYFZDM组瘤组织中的HIF-1α、Arg1蛋白的表达量减少,P < 0.01或P < 0.05,差异有统计学意义;与YYFZDM组比较,YYFZDH组瘤组织中的HIF-1α、Arg1蛋白的表达量减少,P < 0.01或P < 0.05,差异有统计学意义。
4.4. 养阴扶正方对荷瘤鼠瘤组织的HIF-1α、Arg1mRNA的影响
如图4、图5所示,与Control组比较,YYFZDL组、YYFZDM组瘤组织中的HIF-1α、Arg1的mRNA表达量减少,P < 0.01或P < 0.05,差异有统计学意义;与YYFZDM组比较,YYFZDMH组瘤组织中的HIF-1α、Arg1的mRNA表达量减少,P < 0.01或P < 0.05,差异有统计学意义。
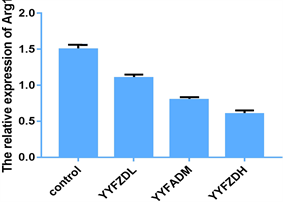
Figure 4. The effect of Yangyin Fuzheng Decoction on HIF-1α and arg1 mRNA expression of human lung adenocarcinoma cell gland xenograft tumors in A549 nude mice xenograft tumors modle
图4. 养阴扶正方对人肺腺癌细胞A549裸鼠移植瘤HIF-1α、Arg1 mRNA生成的影响
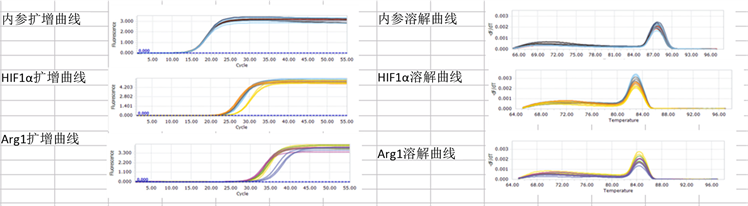
Figure 5. The fusion and amplification curves of HIF-1α and arg1 mRNA in tumor tissues of each tumor-bearing mice group
图5. 各荷瘤鼠组瘤组织HIF-1α、Arg1mRNA融解和扩增曲线
5. 讨论
肿瘤细胞即使在供氧充足的情况下,葡萄糖代谢也以糖酵解为主,葡萄糖转变为乳酸,并产生ATP,以适应肿瘤对能量的大量需求,这种代谢称为有氧糖酵解(aerobic glycolysis)。研究表明,肺癌细胞的有氧糖酵解产生乳酸,在低氧诱导因子-1α (hypoxia inducible factor-1α, HIF-1α)的作用下,乳酸诱导VEGF和M2型TAMs的极化,乳酸还可诱导巨噬细胞表达精氨酸酶-1 (arginase 1, Arg-1),Arg-1可产生多胺,促进肺癌的生长。在肺癌酸性微环境中,HIF-1α、VEGF的高表达参与免疫抑制的形成。乳酸作为有氧糖酵解的产物,导致了肺癌酸性微环境,诱导巨噬细胞分泌VEGF、HIF-1α,促进巨噬细胞向M2型迁移,形成了以免疫抑制为中心的正气亏虚的酸性微环境。乳酸可以激活巨噬细胞上的Gps132受体,促使M2型TAMs的极化,促进肿瘤的黏附、转移和侵袭。肺癌微环境中的Gps132受体及VEGF、HIF-1α、Arg-1,诱导M2型TAMs极化,使肺癌酸性微环境向正气亏虚的免疫抑制微环境转变,如《医宗必读》言:“邪气侵凌,正气消残”,形成了“正气亏虚为本,痰、瘀、毒为标”酸性免疫抑制微环境。
养阴扶正方具有益气养阴、化痰通络、散瘀解毒的功效,由党参、沙参、黄芪、天冬、麦冬、生白术、山药、白花蛇舌草、拳参、绞股蓝、败酱草、茯苓、莪术组成,由《温病条辨》的“沙参麦冬汤”化裁而来。经过十余年的临床使用,表明养阴扶正方能够改善非小细胞肺癌患者的临床症状、稳定瘤灶、改善生活质量。本研究结果证实养阴扶正方通过减低瘤组织的HIF-1α、Arg1的表达,改变了肺癌的免疫微环境,进而抑制肺癌的发展。为养阴扶正方临床治疗非小细胞肺癌及转化提供了新的实验数据。
基金项目
2019-2020年度黑龙江省中医药学会青年中医药科技创新项目。
文章引用
魏冬梅,孙玺媛,尹 钢,姜 梅,刘 锐,陈 宏. 基于酸性微环境研究养阴扶正方对肺癌小鼠体内HIF-1α、Arg1表达的影响
A Study of the Effects of Yangyin Fuzheng Decoction on HIF-1α and Arg1 Expression in Lung Cancer Mice Based on Acidic Microenvironment[J]. 世界肿瘤研究, 2021, 11(01): 1-7. https://doi.org/10.12677/WJCR.2021.111001
参考文献
- 1. Semenza, G.L. (2016) The Hypoxic Tumor Microenvironment: A Driving Force for Breast Cancer Progression. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 1863, 382-391.
https://doi.org/10.1016/j.bbamcr.2015.05.036 - 2. Peppicelli, S., Andreucci, E., Ruzzolini, J., Laurenzana, A., Margheri, F., Fibbi, G., Del Rosso, M., Bianchini, F. and Calorini, L. (2017) The Acidic Microenvironment as a Possible Niche of Dormant Tumor Cells. Cellular and Molecular Life Sciences, 74, 2761-2771.
https://doi.org/10.1007/s00018-017-2496-y - 3. Wike-Hooley, J.L., Haveman, J. and Reinhold, H.S. (1984) The Relevance of Tumour pH to the Treatment of Malignant Disease. Radiother & Oncol, 2, 343-366.
https://doi.org/10.1016/S0167-8140(84)80077-8 - 4. Balkwill, F., Charles, K.A. and Mantovani, A. (2005) Smoldering and Polarized Inflammation in the Initiation and Promotion of Malignant Disease. Cancer Cell, 7, 211-217.
https://doi.org/10.1016/j.ccr.2005.02.013 - 5. Colegio, O.R., Chu, N.-Q., Szabo1, A.L., Chu, T., Rhebergen, A.M., Jairam, V., et al. (2014) Functional Polarization of Tumour-Associated Macrophages by Tumour-Derived Lactic Acid. Nature, 513, 559-563.
https://doi.org/10.1038/nature13490
