Asian Case Reports in Oncology
Vol.1 No.2(2012), Article ID:5024,5 pages DOI:10.12677/ACRPO.2012.12002
Effect of Recombinant Endostatin in Combination with Radiotherapy on the Expression of TGF-β1 and HIF-1α in Lung Adenocarcinoma Cell A549*
1Department of Oncology, Renmin Hospital of Wuhan University, Wuhan
2Basic Medical Sciences, Wuhan University, Wuhan
Email: #gewei514@126.com
Received: Aug. 14th, 2012; revised: Aug. 27th, 2012; accepted: Sep. 13th, 2012
ABSTRACT:
Objective: To observe the effect of Endostar combined with Radiotherapy on the expression of Transforming Growth Factor-beta 1 (TGF-β1) and Hypoxia-induced factor-1 (HIF-1α) in lung adenocarcinoma A549 cells and to discuss the possible mechanisms. Methods: To culture the A549 cell, when the cells achieve Logarithmic phase and there are four groups: Control group; Endostar group; Radiotherapy group; Endostar in combination with Radiotherapy. Cell proliferate rate was measured by CCK8, and the expression level of TGF-beta 1 and HIF-1α protein and mRNA of A549 cells in each group were examined by ELISA and PCR. Result: 1) Besides control group, the proliferation of tumor cells in each group are subject to different degree of inhibition. Compared with control and Endostar groups, there is a significant difference of proliferate inhibition in Endostar combined with Radiotherapy group (p < 0.05). 2) After treatment, the expressions of TGF-β1 and HIF-1 of A549 cells in each group appears to be declining differently. The Radiotherapy group and combined group have a significant difference in cell proliferation at 24 hours, compared to control group (p < 0.05). 3) After PCR amplification, the changes of expressions of TGF-β1 and HIF-1α mRNA over time (0 - 24 hours) compared with the control group, all treatment groups showed a decreasing trend. After 24 hours of treatment, Compared with control group and Endostar group, the difference in the combined group was statistically significant (p < 0.05). Conclusion: Endostar combined with Radiotherapy could significantly enhance the inhibition of proliferate of cells and expressions of TGF-β1 and HIF-1α in tumor cells. Thus enhance the inhibition of tumor angiogenesis and metastatic.
Keywords: Endostar; Radiotherapy; Transforming Growth Factor-Beta 1; Hypoxia Induced Factor-1α; Lung Adenocarcinoma
重组人血管内皮抑素联合放疗对肺腺癌A549细胞TGF-β1、HIF-1α表达的影响*
介芳芳1,曹德东1,戈 伟1#,徐细明1,李长虎1,杨 芳2,黄 玉1,刘 梁1,郑永法1
1武汉大学人民医院肿瘤中心,武汉
2武汉大学基础医学院,武汉
Email: #gewei514@126.com
摘 要:
目的:通过观察Endostar联合放疗对肺腺癌A549细胞增值及TGF-β1、HIF-1α表达的影响,初步探讨重组血管内皮抑素的放疗增敏机制。方法:将培养至对数生长期的A549细胞分为对照组、单纯放疗组、恩度组、联合组,检测各组A549细胞增殖率及TGF-β1、HIF-1α蛋白和mRNA表达情况。结果:1) 除对照组外,各组细胞的增殖随时间的改变都受到不同程度的抑制,以联合组最为明显,差异具有统计学意义(p < 0.05);2) 处理后各组A549细胞TGF-β1、HIF-1α的分泌下降,24 h以放疗组及联合组TGF-β1、HIF-1α表达量明显下降 (p < 0.05);3) PCR扩增后,各处理组 TGF-β1、HIF-1α mRNA的表达随着时间变化均表现出下降趋势,联合组在24 h差异有显著统计学意义(p < 0.05)。结论:恩度联合放疗可显著抑制肺腺癌A549细胞增殖及TGF-β1、HIF-1α的表达,恩度可能通过下调TGF-β1、HIF-1α的表达进而发挥放疗增敏作用。
收稿日期:2012年8月14日;修回日期:2012年8月27日;录用日期:2012年9月13日
关键词:重组人血管内皮抑素;放射治疗;转化生长因子-β1;乏氧诱导因子-1α;肺腺癌
1. 引言
肺癌是发病率和死亡率都很高的恶性肿瘤,由于其解剖部位及功能的特殊性,导致其易侵袭及转移,绝大多数患者确诊时因出现转移或局部晚期而失去手术机会,放射治疗是其主要的治疗方法之一。肿瘤组织的血管及血供对肿瘤的生长有重要作用,早在上世纪70年代,Folkman便提出以肿瘤血管及血供为治疗目标,通过阻断血供及氧供来治疗肿瘤。在体内,肿瘤组织经放疗后可不同程度的上调HIF、VEGF、PDGF等的表达,促进肿瘤血管生成及肿瘤细胞迁移,使放射治疗效果受到限制。然而,一些研究表明,抗血管生成药物联合放疗可以不同程度的解除这些限制从而达到“1 + 1 > 2”的效果[1],但其具体作用机制并不十分清楚。
内皮抑素(Endostatin)是一种重要的血管生成抑制剂,是胶原ⅩⅧ羧基末端的一个分子量为20 kD的蛋白水解片段。研究表明内皮抑素能特异性的作用于新生血管的内皮细胞并抑制内皮细胞的迁移,同时诱导其凋亡,从而发挥抗血管生成作用;另外,还通过调节血管生长因子信号通道,多靶点发挥抗血管生成作用,间接导致肿瘤休眠或者退缩[2,3]。但是由于国外生产的内皮抑素容易形成包涵体,具有很难复性、性质不稳定、不能大规模生产等缺点,长期停留在Ⅱ期研究水平。而我国研究者通过在内皮抑素肽链末端添加9个氨基酸并采用大肠杆菌作为表达体系,使该蛋白得以大规模成功复性,生产出了新型重组人血管内皮抑制素(Endostar, ES, YH-16),中文名称恩度。主要用于治疗初治和复治的晚期非小细胞肺癌。王金万[4]等进行的Ⅲ期临床研究表明Endostar联合NP方案化疗能提高晚期非小细胞肺癌治疗疗效。
本实验通过观察恩度联合放疗对肺腺癌A549细胞TGF-β1、HIF-1α蛋白及mRNA表达的影响,分析其临床意义,进而探讨恩度可能存在的放疗增敏机制,对抗血管生成治疗理论进行补充。
2. 材料与方法
2.1. 主要材料及设备
人肺腺癌A549细胞由武汉大学中南医院肿瘤研究所提供;重组人血管内皮抑制素由先声药业提供(生产批号:201108020);TGF-β1及HIF-1α ELISA试剂盒购于RD公司;RNA提取试剂盒购于百泰克公司(货号:RP4001);DNA试剂提取盒购于天根公司(货号:DP304-02);23EX医用直线加速器(美国瓦里安公司)。
2.2. 实验方法
2.2.1. 细胞培养及分组
A549细胞培养于含有10%新生小牛血清的RPMI 1640培养基(100 kU/L青霉素和100 g/L链霉素,pH 7.2 - 7.4) 中,37℃,5% CO2条件下常规培养。取对数生长期的肺癌A549细胞,用0.25%胰酶消化,用含10%的胎牛血清RPMI1640培养液配制成单个细胞悬液,接种于96孔培养板中,使各个孔中细胞数量大致为5000个;培养细胞:将培养板放入37℃,5% CO2温箱中培养12 h,待细胞贴壁后,分别给予相应处理,每组设3个复孔,分别培养,实验孔周围用PBS填充。根据不同处理方法分为四组:1) 对照组:加入生理盐水10 μl;2) 恩度组:加入浓度为5 g/L恩度10 μl,(终浓度12.5 mg/L);3) 放疗组:4 MV e射线2 Gy,单次照射,SSD = 100;4) 恩度联合放疗组(简称联合组),加入10 μl恩度后立即给予4 MV e射线2 Gy,单次照射。分别在处理后0、6、12、18、24 h收集细胞标本及上清液标本。
2.2.2. CCK8测定A549细胞增殖情况
各组于处理后0、12、24 h加入CCK8液进行检测。具体操作按试剂盒说明书进行。全自动酶标仪检测450 nm处吸光度OD值,每组设3个重复孔,根据OD值计算抑制增殖率。细胞增殖抑制率 。
。
2.2.3. ELISA法检测各组TGF-β1、HIF-1α蛋白表达量
分别于0、6、12、18、24 h收集各组细胞培养液,离心,取上清,按试剂盒说明书步骤采用ELISA法检测上清液中TGF-β1、HIF-1α的含量。
2.2.4. Real Time PCR检测各组TGF-β1及HIF-1αmRNA表达量
分别于0、6、12、18、24 h收集各组细胞培养液,离心,去上清,按试剂盒说明书步骤采用Real Time PCR法检测各组TGF-β1、HIF-1αmRNA的含量。每组样本重复3次,以对照组表达量为1,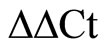 法计算各组TGF-β1及HIF-1相对表达量。
法计算各组TGF-β1及HIF-1相对表达量。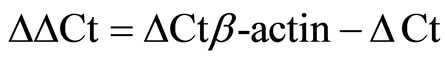 待测样品。
待测样品。
2.2.5. 统计学方法
应用SPSS17.0统计分析软件。计量数据以均数 ±标准差(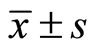 )表示,多组均数比较方差齐性时采用单向方差分析,均数间两两比较采用q检验,方差不齐时则用非参数检验,p < 0.05时差异有统计学意义。
)表示,多组均数比较方差齐性时采用单向方差分析,均数间两两比较采用q检验,方差不齐时则用非参数检验,p < 0.05时差异有统计学意义。
3. 结果
3.1. 不同组别A549细胞增殖抑制情况
除对照组外,各组细胞的增殖随时间改变都受到不同程度的抑制,其中以联合组最为明显,放疗组其次,恩度组抑制A549细胞增殖程度不如其他两个实验组(56.327% ± 5.124%、19.037% ± 5.187%、9.662% ± 1.536%)。联合组抑制细胞增殖程度与对照组、恩度组相比,均具有显著统计学意义(p < 0.05)。恩度组与对照组相比,差异无明显统计学意义(p > 0.05) (表1,图1)。
3.2. 不同组别A549细胞中TGF-β1、 HIF-1α蛋白表达的情况
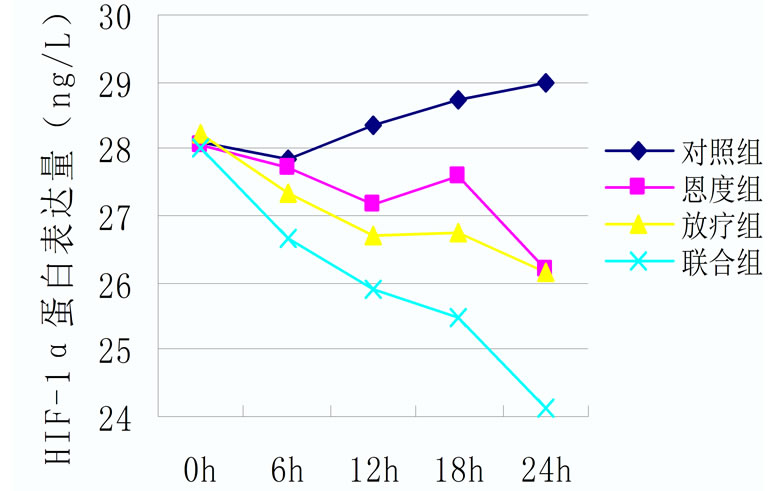
各处理组A549细胞TGF-β1的分泌情况都有所下降,其中放疗组及联合组在24 h内使TGF-β1表达量下降的作用明显。根据统计结果,实验中各组在处理前TGF-β1、HIF-1α表达量无显著差异(p > 0.05),处理后24 h内各组TGF-β1表达量均有所下降,24 h联合组下降程度与对照组及恩度组相比,有明显统计学意义(p < 0.05),恩度组在24 h与对照组相比,有明显统计学意义(p < 0.05)。HIF-1α在24 h联合组与对照组、恩度组及放疗组相比,其结果有统计学意义(p < 0.05) (表2,表3,图2)。
3.3. 不同组别A549细胞中TGF-β1、HIF-1αmRNA表达的情况
经PCR扩增后,随着时间的变化(0至24 h)与对照组相比,各处理组TGF-β1、HIF-1α均表现出下降趋势,其中24 h的扩增倍数最低;与对照组比较,12 h、18 h及24 h各实验组HIF-1α mRNA的扩增倍数降低均有统计学差异(p < 0.05)。与放疗组及恩度组比较,12 h、18 h及24 h联合组HIF-1α mRNA的扩增倍数降低有统计学意义(p < 0.05),而恩度组与放疗组比较无统计学差异(p > 0.05)。与对照组比较,24 h各实验组TGF-β1mRNA的扩增倍数降低有统计学差异(p < 0.05)。与放疗组及恩度组比较,24 h联合组TGF-β1mRNA的扩增倍数降低有统计学意义(p < 0.05) (表4,表5,图3)。
4. 讨论
在体外,重组人内皮抑素及大鼠内皮抑素均对内
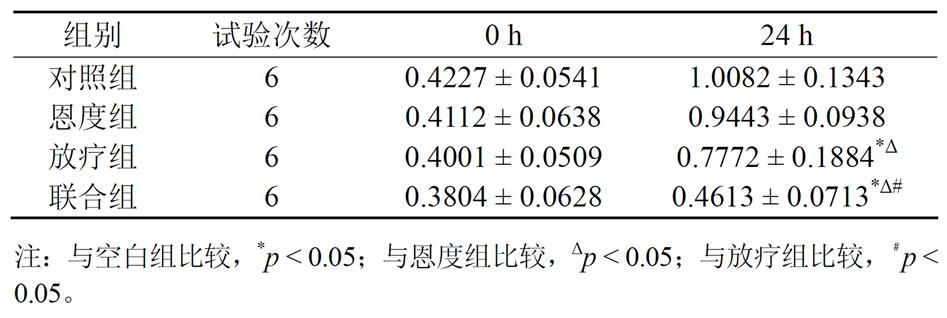
Table 1. Absorbance values of lung cancer A549 cells of different treatment groups at different time
表1. 不同处理组肺癌A549细胞不同时间点的吸光度值(OD值)
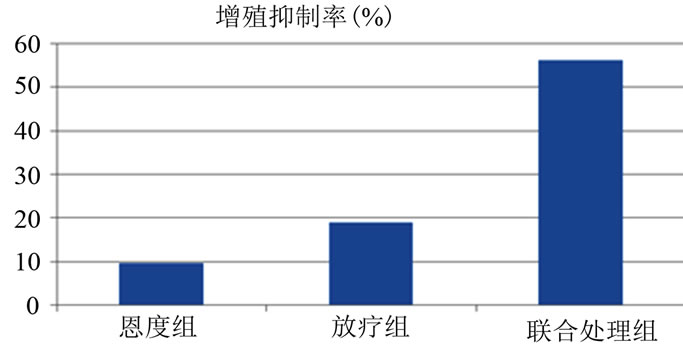
Figure 1. Growth inhibition rate of lung cancer A549 cells of different treatment groups in 24 h
图1. 不同处理组肺癌A549细胞24 h的生长抑制率
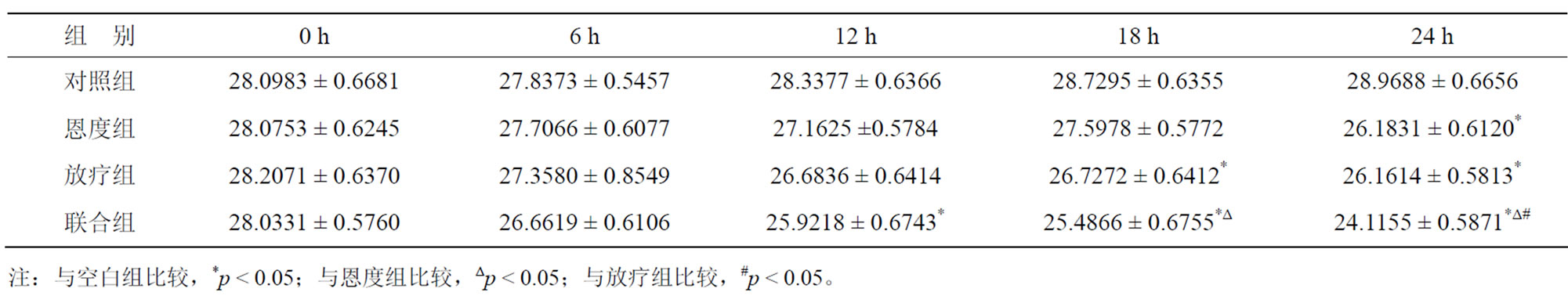
Table 2. The HIF-1α protein expression of different treatment groups at different time
表2. 各处理组不同时间点HIF-1α蛋白的表达量比较(ng/L)
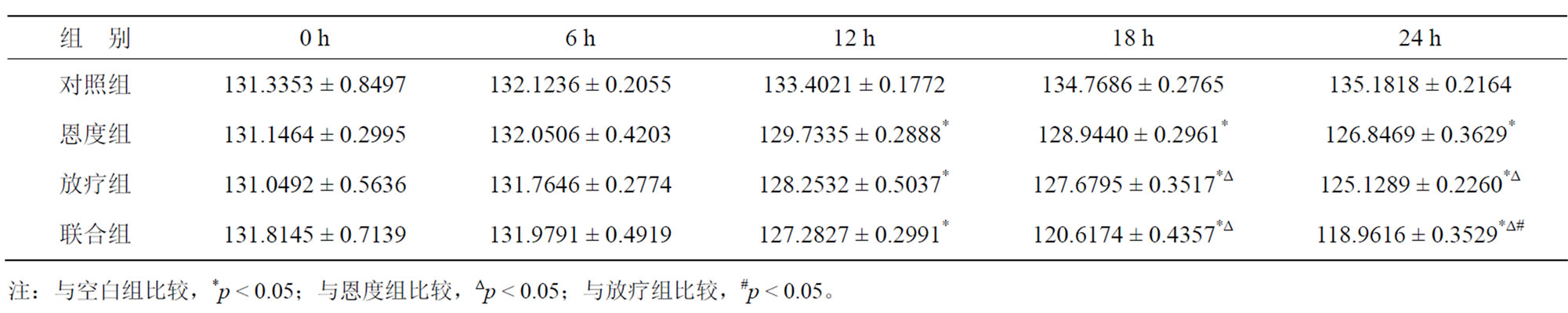
Table 3. The TGF-β1 protein expression of different treatment groups at different time
表3. 各处理组不同时间点TGF-β1蛋白表达情况(ng/L)
 (a)
(a)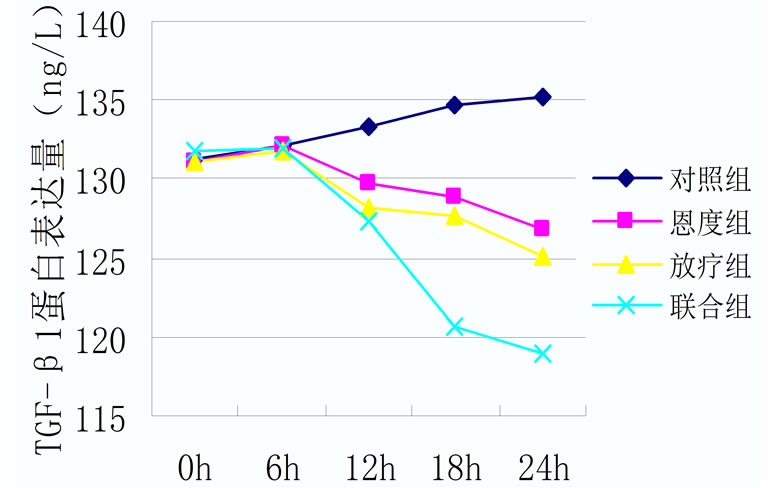 (b)
(b)
Figure 2. (a) HIF-1α protein expression of different treatment groups; (b) TGF-β1 protein expression of different treatment groups
图2. (a) 各组HIF-1α蛋白表达情况;(b) 各组TGF-β1蛋白表达情况
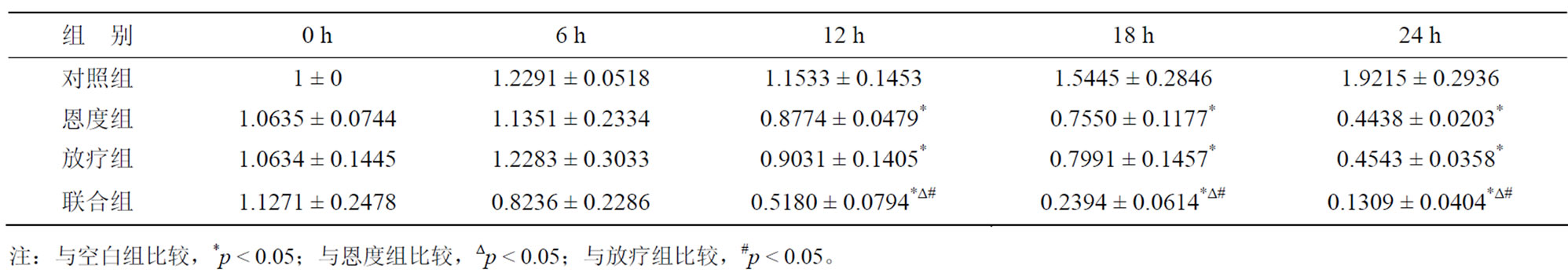
Table 4. The HIF-1α mRNA amplification multiples of different treatment groups at different time
表4. 各处理组不同时间点HIF-1α mRNA的表达量比较

Table 5. The TGF-β1 mRNA amplification multiples of different treatment groups at different time
表5. 各处理组不同时间点TGF-β1 mRNA相对表达情况
 (a)
(a) (b)
(b)
Figure 3. (a) The HIF-1α mRNA amplification multiples of different treatment groups; (b) The TGF-β1 mRNA amplification multiples of different treatment groups
图3. (a) 各处理组HIF-1α mRNA的扩增倍数;(b) 各处理组TGF-β1 mRNA的扩增倍数
皮细胞增殖有抑制作用,具有独特的抗内皮细胞作用[5]。本研究中细胞增殖实验结果表明,恩度组细胞增殖情况也受到抑制,说明重组人血管内皮抑素恩度也具有一定程度的抗肿瘤作用。研究表明,恩度可以通过诱导白血病细胞HL-60及NB4的凋亡来抑制其增殖[6]。在宫颈癌裸鼠模型中,恩度也可抑制肿瘤细胞的增殖及血管生成[7]。这些与我们的结论一致,说明恩度与放疗联合应用,对肿瘤细胞具有抑制增殖的作用。
转化生长因子-β1(Transforming Growth Factor-β1)是一种多功能调节多肽,在各种组织及细胞内广泛存在,它的生物学功能表现在以下几方面[8]:1) 细胞转化和分化;2) 细胞增殖;3) 血管生成;4) 免疫抑制;5) 细胞外基质形成;6) 肿瘤发生、发展及转移等。TGF-β1可直接作用于血管内皮细胞,促进血管生成,TGF-β1作用于人类真皮层微血管内皮细胞(MVEC),使MVEC易于在真皮层基质胶中移动并形成毛细血管样形态,从而产生强烈的促进血管生成作用,实时荧光定量-PCR发现,TGF-β1通过SMAD2/3和FAK信号通路上调尿激酶型纤溶酶原激活物受体(uPAR)及纤溶酶原激活酶抑制剂-1(PAI-1)的表达,用TGF-β1特异性抗体阻滞后,TGF-β1所引起的促血管生成作用则减弱[9];TGF-β1还可作用于促血管生成因子,促进肿瘤血管生成,Chae等的实验[10]表明,前列腺癌细胞可过量分泌TGF-β1,通过Smad3通路及Smad结合元素2、乏氧反应元素与VEGF启动子结合,刺激VEGF启动子来诱导VEGF的表达。TGF-β1还通过其配体–受体、Smads蛋白及靶基因信号通路作用于基质金属蛋白酶及其他蛋白酶,使细胞外基质降解,易于血管内皮细胞的迁移,从而形成新生血管。已有研究表明[11],恩度联合放疗可以显著抑制A549细胞VEGF的表达,间接说明VEGF表达量的降低跟TGF-β1的表达降低有关。
乏氧诱导因子-1(HIF-1)是乏氧状态下,对细胞的增殖与血管生成过程起着重要调控作用的细胞因子。在实体瘤中,无论是乏氧环境还是富氧环境下,HIF- 1α通常都呈现出过量表达的情况。这种过量表达在肿瘤细胞恶性度增加、耐药性、辐射耐受等的形成过程中起重要作用[12]。因此,可以通过抑制HIF-1α的过量表达来控制或抑制肿瘤的血管生成、浸润转移等特性来提高临床疗效。
本实验结果表明,恩度联合放疗在短期内可以显著降低HIF-1α蛋白及mRNA的蓄积,恩度组及放疗组HIF-1α蛋白及mRNA的表达随时间表现出下降趋势。放疗及恩度均可抑制肿瘤HIF-1α的表达,放疗可以通过直接杀灭肿瘤细胞进而减少分泌细胞因子的细胞数来降低HIF-1α的表达。在体内情况下,由于肿瘤微环境中处于乏氧状态,经过放疗后,其组织内HIF-1α的表达量会有不同程度的升高,这一现象的产生与乏氧有关,而在体外实验中,细胞培养于富氧状态下,放射线可通过氧增敏效应来加大对肿瘤细胞的遗传物质的破坏,进而影响肿瘤细胞的增殖,从而从源头上减少了HIF-1α的表达。
TGF-β1与HIF-1α在肿瘤血管生成、血管重塑及侵袭转移中发挥着重要作用。肿瘤组织中新生血管主要是通过VEGF及其信号通路来介导实现的,VEGF在乏氧状况下主要由HIF-1α诱导表达,除了HIF-1α之外,TGF-β1也可以通过其信号通路中的smad3/smad4增强血管生成因子VEGF基因及蛋白的表达,并且这种促进作用在乏氧情况下表现的更为突出[13]。已有研究表明,TGF-β1与HIF-1α在肿瘤血管生成过程中可以通过TGFβ1/PHD2/HIF-1α/VEGF通路来促进血管生成[14]。
综上所述,恩度联合放疗可以抑制肺腺癌A549细胞增殖及TGF-β1、HIF-1α的表达,恩度可能通过下调TGF-β1、HIF-1α的表达进而发挥放疗增敏作用,为临床应用恩度联合放疗提供了理论依据。
参考文献 (References)
[1] M. Kamrava, M. B. Bernstein, K. Camphausen, et al. Combining radiation, immunotherapy, and antiangiogenesis agents in the management of cancer: The three musketeers or just another quixotic combination? Molecular Biosystems, 2009, 5(11): 1262- 1270.
[2] J. Folkman. Antiangiogenesis in cancer therapy—Endostatin and its mechanisms of action. Experimental Cell Research, 2006, 312(5): 594-607.
[3] 林丽彬, 林建银. 内皮抑素及其抗血管生成作用[J]. 福建医科大学学报, 2007, 41(2): 189-190.
[4] 王金万, 孙燕, 刘永煜等. 重组人血管内皮抑素联合NP方案治疗晚期NSCLC随机、双盲、对照、多中心Ⅲ期临床研究[J]. 中国肺癌杂志, 2005, 8(4): 283-290.
[5] Z. Y. You, Y. Zhao, F. Liu, et al. The radiosensitization effects of Endostar on human lung squamous cancer cells H-520. Cancer Cell International, 2010, 10: 17.
[6] R. Feng, X. J. Huang. Preliminary study on the anti-leukemia effect of recombinant human endostatin. National Medical Journal of China, 2010, 31(7): 461-465.
[7] Y. T. Jia, Z. X. Li, M. Liu, et al. Endostar reduces the growth and metastasis by inhibiting angiogenesis and lymphangiogenesis in nude mouse models of human cervical cancer. National Medical Journal of China, 2009, 31(4): 254-257.
[8] C. H. Heldin, M. Landström and A. Moustakas. Mechanism of TGF-beta signaling to growth arrest, apoptosis, and epithelialmesenchymal transition. Current Opinion in Cell Biology, 2009, 21(2): 166-176.
[9] S. Serratì, F. Margheri, M. Pucci, et al. TGF-beta1 antagonistic peptides inhibit TGF beta1-dependent angiogenesis. Biochemical Pharmacology, 2009, 77(5): 813-825.
[10] K. S. Chae, M. J. Kang, J. H. Lee, et al. Opposite functions of HIF-α isoforms in VEGF induction by TGF-β1 under non-hypoxic conditions. Oncogene, 2010 (Epub ahead of print).
[11] L. Zhang, W. Ge, K. Hu, Y. Zhang, et al. Endostar down-regulates HIF-1 and VEGF expression and enhances the radioresponse to human lung adenocarcinoma cancer cells. Molecular Biology Reports, 2012, 39(1): 89-95.
[12] G. L. Semenza. Defining the role of hypoxia-inducible factor 1 in cancer biology and therapeutics. Oncogene, 2010, 29(5): 625- 634.
[13] S. Kitamura, Y. Maeshima, T. Sugaya, et al. Transforming growth factor-1 induces vascular endothelial growth factor expression in murine proximal tubular epithelial cells. Nephron Experimental, 2003, 95: 79-86.
[14] H. H. Lin, C. W. Tsai, F. P. Chou, et al. Andrographolide downregulates hypoxia-inducible factor-1α in human non-small cell lung cancer A549 cells. Toxicology and Applied Pharmacology, 2011, 250(3): 336-345.
NOTES
*资助信息:国家自然科学基金资助项目(编号:30970860/C100801)。
#通讯作者。