Botanical Research
Vol.06 No.02(2017), Article ID:19905,6
pages
10.12677/BR.2017.62005
Construction of Recombinant Plasmid of Defense-Related Gene THI2.1 Promoter and GUS Gene in Arabidopsis thaliana
Nan Rong1*, Wei Cai1*, Zhou Zhou1, Chunmei Ren1,2#
1College of Bioscience and Biotechnology, Hunan Agricultural University, Changsha Hunan
2Crop Gene Engineering Key Laboratory of Hunan Province, Changsha Hunan

Received: Feb. 25th, 2017; accepted: Mar. 14th, 2017; published: Mar. 17th, 2017

ABSTRACT
THI2.1 gene is an important gene in plant defense systems; the thionins encoded can effectively enhance plants disease resistance and help plants resist the spread of external pathogens. Analysis of the expression pattern of this gene in plants will help us to further understand the regulation of this gene. In our study, a fusion expression vector of THI2.1 gene promoter and GUS marker gene was constructed and transformed into Arabidopsis thaliana. Our results provide the material basis for further study on the expression pattern of THI2.1 gene in Arabidopsis thaliana. The result as follows: 1) The fusion vector of THI2.1 gene promoter and GUS marker gene was constructed successfully. 2) The reconstructive vector was transferred into Arabidopsis thaliana and the trans- genic plants were screened successfully.
Keywords:Vector Construction, THI2.1 Gene, Promoter
拟南芥防御相关基因THI2.1启动子与GUS重组载体的构建与转化
荣 楠1*,蔡薇1*,周 舟1,任春梅1,2#
1湖南农业大学生物科学技术学院,湖南 长沙
2作物基因工程湖南省重点实验室,湖南 长沙

收稿日期:2017年2月25日;录用日期:2017年3月14日;发布日期:2017年3月17日

摘 要
THI2.1基因是植物防御系统中的一个重要基因,其编码的硫菫蛋白能有效的提升植物的抗病性,帮助植物抵御外界病原物的侵染。分析该基因在植物体内的表达模式有利于进一步了解该基因的表达调控。本试验对拟南芥THI2.1基因启动子与带GUS标记基因的载体进行重组构建,并将重组载体转入拟南芥,为后续研究该基因的表达模式提供材料。结果如下:1) 成功的构建了拟南芥THI2.1基因启动子与GUS基因的重组载体。2) 成功的将拟南芥THI2.1基因启动子与GUS基因重组载体转入拟南芥植株,并筛选到了转基因植株。
关键词 :载体构建,THI2.1基因,启动子

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
在自然界中,植物经常会受到各种病原物(如,病原真菌、细菌和病毒)的侵害。虽然植物不像动物具有特定的免疫系统来抵抗病原物的侵害,但植物在长期的进化中形成了多种防御体系来抵制病原物的侵袭 [1] [2] [3] [4] [5] 。THI2.1基因作为植物防御体系中的重要基因,一直受到人们的广泛研究。
THI2.1基因属于植物防御系统中病原相关蛋白基因家族中PR-13 (硫菫蛋白家族),其编码的硫菫蛋白在植物防御系统中扮演着重要的作用,当植物受到病原物感染时,THI2.1基因会大量的诱导表达并产生大量的硫菫蛋白来提升植物的抗病性。Epple, P等人的研究发现THI2.1基因对F. oxysporum f. sp. matthiolae病原物有着明显的抗性 [6] 。而chan等人通过将拟南芥的THI2.1基因转入易感病的番茄中,发现转入拟南芥THI2.1基因的番茄植株抗病性明显增强 [7] 。
GUS染色是生物学上常用的一种实验方法。利用该方法可观察到外源基因在特定器官、组织,甚至单个细胞内的表达情况 [8] [9] [10] [11] [12] 。目前将GUS基因作为显色基因来研究目的基因的表达情况得到了广泛的应用。本研究对拟南芥THI2.1基因启动子与带GUS标记基因的载体进行重组构建,并将重组载体转入拟南芥,为后续研究该基因的表达模式提供材料。
2. 材料与方法
2.1. 实验材料
拟南芥(Arabidopsis thaliana)野生型Col-0,大肠杆菌(Escherichia coli) DH5α,根癌农杆菌(Agro bacterium tumefactions) GV3101,载体pCAMBIA1301等都由作物基因工程湖南省重点实验室植物信号传导课题组保存。
2.2. 植株培养条件
将拟南芥种子置于消毒液(20% bleach + 0.1% Triton100)中浸泡10~15 min,于超净工作台上用无菌水冲洗4~5遍,适当密度的播撒在MS固体培养基上,置于黑暗处4℃春化3 d,转入光照培养室22℃长日照(16 h光照/8 h黑暗)培养。长至7 d时,将其转入营养土(东北黑土与蛭石的体积比为1:1)中,盖上透明塑料薄盖1~2 d。
2.3. 载体的构建
2.3.1. 引物的设计及THI2.1启动子片段克隆
在TAIR网上查询拟南芥THI2.1基因选取上游启动子区域序列,用在线软件Plantcare对其进行启动子元件分析。利用Primer Premier 5.0引物设计软件设计1对扩增引物THI-F/THI-R,在引物5’端分别加上PstⅠ和NcoⅠ酶切位点,扩增引物序列为:
THI-F:TGCACTGCAGCCCCTTTCTTTGACTA
THI-R: GTACCCATGGCTACTTGAACTTGTGCC
根据预测退火温度,选取56℃、58℃、60℃进行PCR扩增,确定引物最适温度为58℃。用SDS法提取拟南芥总DNA,以此为模板,用引物THI-F/THI-R进行PCR扩增,琼脂糖凝胶电泳后回收目的片段并纯化。
2.3.2. 重组载体的构建
对目的片段和pCAMBIA1301载体用PstⅠ和NcoⅠ限制性内切酶在37℃下过夜双酶切,将得到的目的片段和目的载体进行回收。用T4连接酶将THI2.1基因启动子连接至pCAMBIA1301载体的预期位点。通过热激法将重组载体转化至大肠杆菌DH5α“见图1”,挑取阳性克隆进行菌落PCR鉴定,结果正确的送上海铂尚公司测序。
2.4. 重组载体的遗传转化
挑选测序正确的重组质粒,通过电击法转化到根癌农杆菌GV3101中,将转化液置于含有卡那霉素(50 mg/L)、庆大霉素(100 mg/L)、利福平(50 mg/L)的YEB固体培养基上28℃黑暗过夜培养,再挑取阳性菌进行扩大培养。采用浸花法转化拟南芥Col-0野生型。收获T0代种子播种于含有潮霉素(25 mg/L)的MS固体培养基上,长日照培养2周后将抗性植株移栽至营养土(东北黑土与蛭石的体积比为1:1)中正常生长。

Figure1. Flow chart of pTHI2.1::GUS recombinant vector
图1. pTHI2.1::GUS重组载体构建流程图
3. 结果与分析
3.1. THI2.1启动子的克隆
利用Plantcare对THI2.1基因上游约1600 bp启动子序列进行分析,其中包含了大量核心启动子元件TATA-box、CAAT-box,以及部分与生物胁迫相关的顺式调控原件。以拟南芥基因组DNA为模板,通过引物THI-F/THI-R扩增出一段大小为约1800 bp的目的片段“见图2”,与预期大小相符。
3.2. pTHI2.1::GUS重组载体的构建
用T4连接酶将酶切后的目的片段连接到带有报告基因GUS的pCAMBIA1301载体上,通过热激法将pTHI2.1::GUS重组载体转化至大肠杆菌DH5α。为了验证载体的正确性,挑选阳性菌进行菌落PCR检测“见图3”,并对PCR结果正确的进行PstⅠ和NcoⅠ双酶切“见图4”。结果显示:目的片段与预期结果相符,表明pTHI2.1::GUS重组载体构建成功。检测正确的阳性菌送测序,测序结果经比对得出:目的片段大小正确,无移码突变现象,连接处与预期位置相符。
3.3. pTHI2.1::GUS重组载体的遗传转化
将成功转入农杆菌的重组载体,通过浸花法转化拟南芥Col-0野生型。收获T0代种子播种于含有潮霉素(25 mg/L)的MS固体培养基上,因潮霉素对拟南芥幼苗具有抑制作用,长日照培养2周后我们可观察到:成功转入重组载体的拟南芥幼苗能正常生长并长出真叶,转化失败的拟南芥幼苗无法正常长出真叶“见图5(a)”;而未进行转化的拟南芥Col-0野生型在含潮霉素的MS固体培养基上也无法正常长出真叶“见图5(a)”。
 M为Marker(5K)Line 1为未加DNA模板的对照组Line 2-4为THI2.1启动子片段
M为Marker(5K)Line 1为未加DNA模板的对照组Line 2-4为THI2.1启动子片段
Figure 2. PCR result of THI2.1 promoter
图2. THI2.1基因启动子PCR扩增结果
 M为Marker(5K)Line 1-6为菌落PCR
M为Marker(5K)Line 1-6为菌落PCR
Figure 3. PCR result of recombinant colonies
图3. 菌落PCR结果
 M为Marker(15K) Line1-4为重组载体双酶切 Line 5为未酶切载体
M为Marker(15K) Line1-4为重组载体双酶切 Line 5为未酶切载体
Figure 4. Restriction enzyme digestion of pTHI2.1::GUS recombinant vector
图4. pTHI2.1::GUS重组载体的双酶切
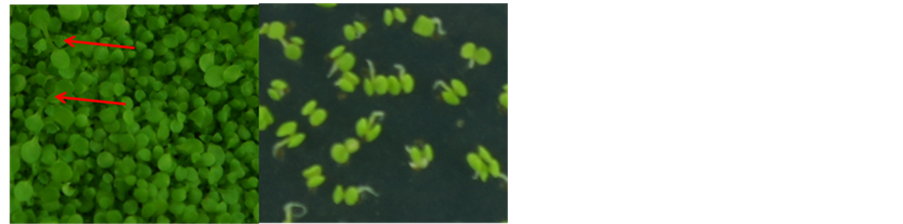 (a) (b)(a) 箭头所指为转基因阳性植株 (b) 为未转基因野生型植株
(a) (b)(a) 箭头所指为转基因阳性植株 (b) 为未转基因野生型植株
Figure 5. The phenotype of transgenic plants on MS
图5. 转基因植株在培养基上表型
4. 讨论
植物基因的克隆技术是生命科学研究的重要组成部分,是现代生命科学技术中最核心的内容 [13] 。启动子作为基因工程中表达载体的一个重要组成部分,它的选择与应用决定了目的基因在时间和空间上的表达的不同。
本研究所选择表达载体为pCAMBIA1301,此载体为常用载体,上面有较多较为常用的限制性内切酶以及筛选基因,更重要的是带有GUS报告基因。GUS染色是生物学上常用的一种实验方法,利用该方法可观察到外源基因在特定的器官和组织中的表达情况,GUS基因作为显色基因来研究目的基因的表达情况得到了广泛的应用。
在自然界中,植物经常会受到各种病原物(如,病原真菌、细菌和病毒)的侵害。虽然植物并不像动物具有特定的免疫系统来抵抗病原物的侵害,但植物在长期的进化中形成了多种防御体系来抵制病原物的侵袭 [1] [2] [3] [4] [5] 。THI2.1基因作为植物防御体系中的重要基因,本研究已成功构建THI2.1基因启动子与GUS重组载体,并通过浸花法转化至拟南芥野生型内得到转基因植株,下一步通过GUS染色,研究THI2.1基因在拟南芥中表达模式。
5. 结论
本研究成功构建了THI2.1基因启动子与GUS重组载体,为进一步研究THI2.1基因在植物体内的表达打下基础。
基金项目
国家级大学生研究性学习和创新性实验计划项目(G)SCX1604。
文章引用
荣楠,蔡薇,周舟,任春梅. 拟南芥防御相关基因THI2.1启动子与GUS重组载体的构建与转化
Construction of Recombinant Plasmid of Defense-Related Gene THI2.1 Promoter and GUS Gene in Arabidopsis thaliana[J]. 植物学研究, 2017, 06(02): 25-30. http://dx.doi.org/10.12677/BR.2017.62005
参考文献 (References)
- 1. 王金生. 植物抗病性分子机制[J]. 植物病理学报, 1995, 25(4): 289-295.
- 2. 何晨阳, 王金生. 植物防卫反应基因的类型、表达、调控和应用[J]. 生物工程进展, 1994, 14 (4): 46-49.
- 3. 古瑜, 贾占温, 孙德岭, 等. 植物抗病机制的研究进展[J]. 天津农业科学, 2008, 14(4): 45-48.
- 4. 王忠华, 贾育林, 夏英武. 植物抗病分子机制研究进展[J]. 植物学通报, 2004, 21(5): 521-530.
- 5. 王友红, 张鹏飞, 陈建群. 植物抗病基因及其作用机理[J]. 植物学通报, 2005, 22(1): 92-99.
- 6. Petra, E., Alberto, V., Klaus, A. and Holger, B. (1998) Differential Induction of the Arabidopsis thaliana thi2.1 Gene by Fusarium oxysporum f. sp. Matthiolae. MPMI, 11, 523-529. https://doi.org/10.1094/MPMI.1998.11.6.523
- 7. Chan, Y.L., Prasad, V., Sanjaya, et al. (2005) Transgenic Tomato Plants Expressing an Arabidopsis thionin (thi2.1) Driven by Fruit-Inactive Promoter Battle against Phytopathogenic Attack. Planta, 221, 386-393. https://doi.org/10.1007/s00425-004-1459-3
- 8. 卢丽丽. 基因枪法导入GUS基因诱导小麦条锈菌毒性突变的研究[D]: [硕士学位论文]. 咸阳: 西北农林科技大学, 2008.
- 9. 吴刚, 崔海瑞, 舒庆尧, 叶恭银, 夏英武. GUS组织化学染色法——一种快速筛选抗二化螟转Bt cry1Ab基因水稻的方法[J]. 浙江大学学报: 农业与生命科学版, 2000, 26(2): 141-143.
- 10. 沈岚. 报告基因gus在快速筛选转抗虫基因水稻中的应用[J]. 宁波农业科技, 1999(4): 2-5.
- 11. 朱英, 蔡秀玲, 王宗阳. 用无启动子的GUS报告基因捕获水稻基因启动子[J]. 植物生理与分子生物学报, 2003, 29(4): 289-294.
- 12. 王爱民, 陈石燕, 沈革志, 王新其, 鞠丹花, 等. Ac/Ds(GUS)结构介导的水稻启动子捕获系统的建立[J]. 植物生理与分子生物学学报, 2005, 31(6): 575-580.
- 13. 陈儒钢, 巩振辉, 逯明辉, 等. 植物基因克隆技术的发展与展望[J]. 长江蔬菜: 学术版, 2009(20): 13-18.
*并列第一作者。
#通讯作者。